文档内容
必修第一册 第四章 第一节 原子结构与元素周期表 测试题
榆次一中 李金虎
一、选择题(每小题只有一个正确选项,每小题4分,共40分)
1. 美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数118,中子数为175的超重元
素。该元素原子核内中子数与核外电子数之差是( )
A.47 B.57 C.61 D.293
2. 著名化学家徐光宪(画面正中),因为在稀土萃取领域取得的卓越成就被誉为“稀土界的袁隆
平”。稀土元素是指镧系元素,加上钪和钇两种元素。下列说法正确的是( )
A.稀土元素一共有16种元素
B.稀土元素为主族元素
C.稀土元素全部是金属元素
D.某些稀土元素在地壳中的含量可能高于铝
3. 2015年4月,于敏获颁“影响世界华人终身成就奖”。“钚-239”是“于敏型”氢弹的重要
原料。下列说法正确的是( )
A.239Pu原子的原子核中含有239个质子
B.238Pu、239Pu和241Pu属于不同的核素
C.238Pu与238U在元素周期表中的位置相同
D.239Pu衰变成235U属于化学变化
4. 2020年4月,我国自主设计,被称为“人造太阳”的“东方超环”核聚变实验装置取得重大突
破,该核聚变的基础原料是海水中提取的氘和氚。下列叙述错误的是( )
A.氘原子的相对原子质量约为2
B.氚原子内中子数和核外电子数之差为1
C.氘原子和氚原子互为同位素
D.海水中的HO与DO互为同素异形体
2 2
5. 中国计量科学研究院研制的NIM5铯原子喷泉钟,2 000万年不差一秒,目前成为国际计量局
认可的基准钟之一,参与国际标准时间修正。下列关于Cs的说法错误的是( )
A.137Cs和133Cs互为同位素
B.单质Cs与水反应非常缓慢
C.137Cs比133Cs多4个中子
D.137Cs最外层只有1个电子
6. 2019年1月3日上午10时26分,嫦娥四号探测器实现人类探测器首次月背软着陆。月背探测
1
学科网(北京)股份有限公司器用的是同位素温差发动机,使用的放射性同位素有Sr(锶)、Pu(钚)、Po(钋)。通过衰变产生能
量发电。下列有关同位素的说法中正确的是( )
A.位于周期表中同一周期同一族的不同的核素,一定互为同位素
B.氧有三种核素16O、17O、18O,所以自然界中的氧气分子共有6种
C.同位素是指质子数相同中子数不同的微粒间的互称
D.温差发动机使用时没有发生化学变化
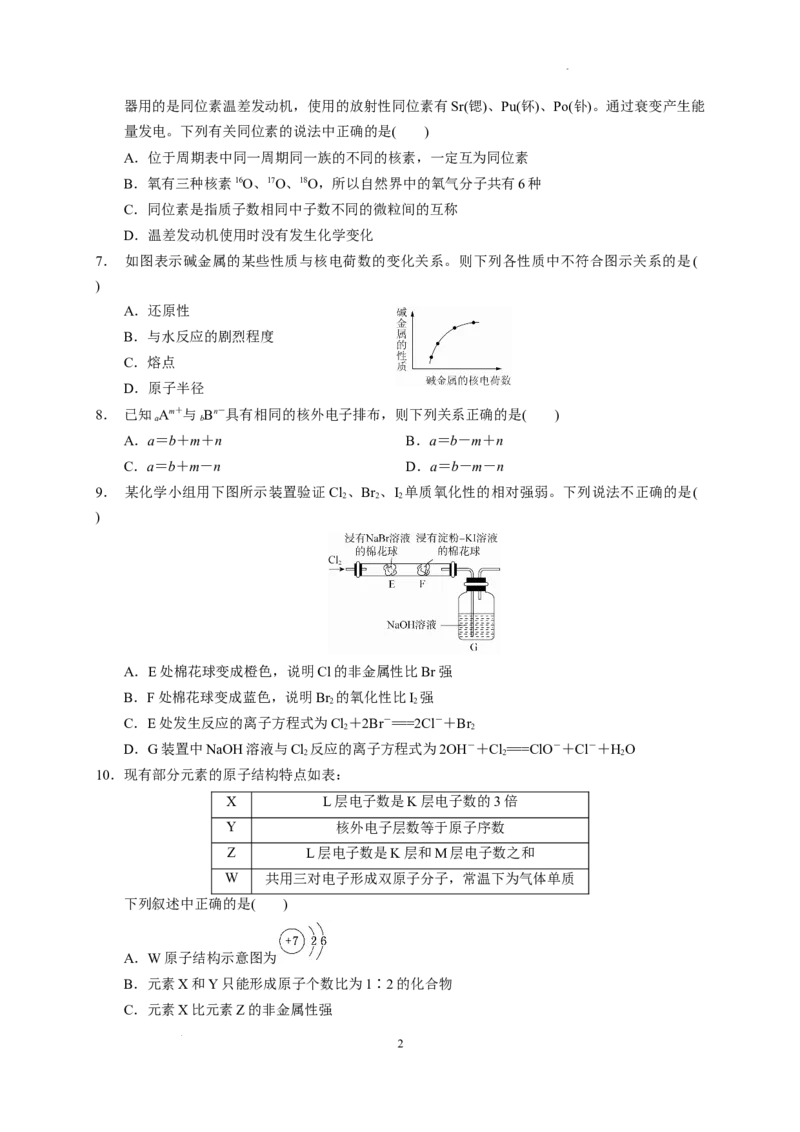
7. 如图表示碱金属的某些性质与核电荷数的变化关系。则下列各性质中不符合图示关系的是(
)
A.还原性
B.与水反应的剧烈程度
C.熔点
D.原子半径
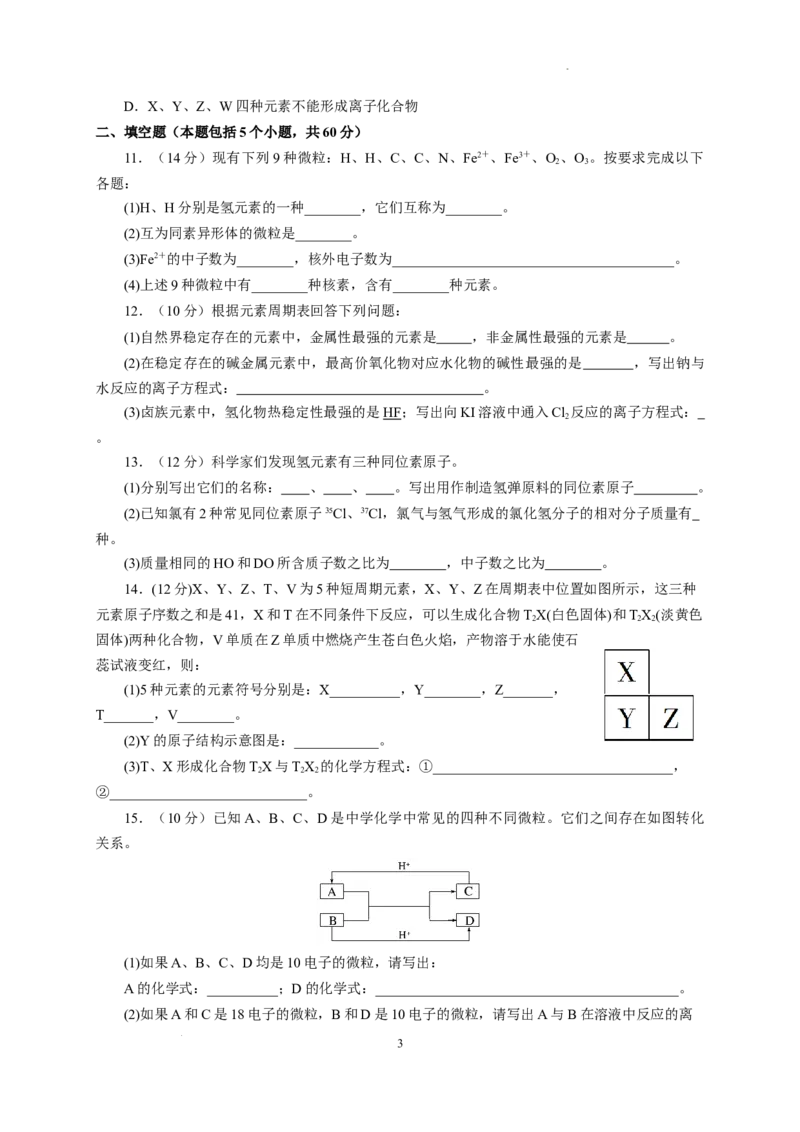
8. 已知 Am+与 Bn-具有相同的核外电子排布,则下列关系正确的是( )
a b
A.a=b+m+n B.a=b-m+n
C.a=b+m-n D.a=b-m-n
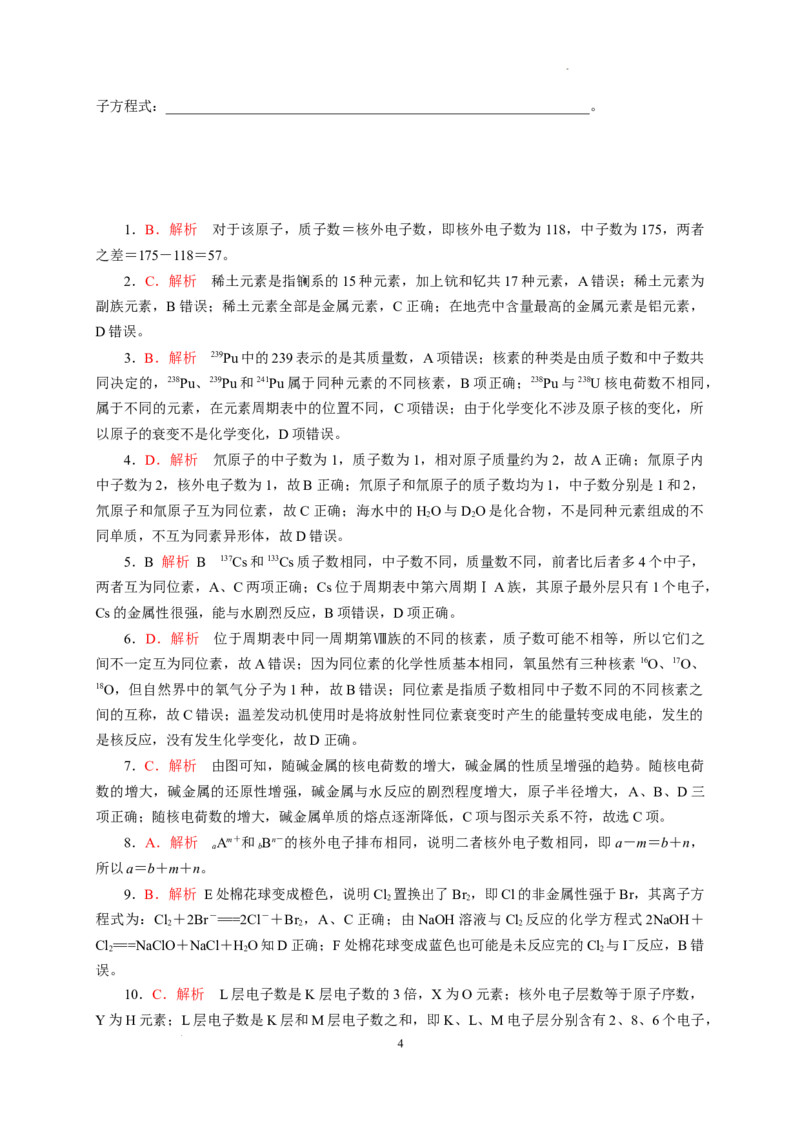
9. 某化学小组用下图所示装置验证Cl 、Br 、I 单质氧化性的相对强弱。下列说法不正确的是(
2 2 2
)
A.E处棉花球变成橙色,说明Cl的非金属性比Br强
B.F处棉花球变成蓝色,说明Br 的氧化性比I 强
2 2
C.E处发生反应的离子方程式为Cl+2Br-===2Cl-+Br
2 2
D.G装置中NaOH溶液与Cl 反应的离子方程式为2OH-+Cl===ClO-+Cl-+HO
2 2 2
10.现有部分元素的原子结构特点如表:
X L层电子数是K层电子数的3倍
Y 核外电子层数等于原子序数
Z L层电子数是K层和M层电子数之和
W 共用三对电子形成双原子分子,常温下为气体单质
下列叙述中正确的是( )
A.W原子结构示意图为
B.元素X和Y只能形成原子个数比为1∶2的化合物
C.元素X比元素Z的非金属性强
2
学科网(北京)股份有限公司D.X、Y、Z、W四种元素不能形成离子化合物
二、填空题(本题包括5个小题,共60分)
11.(14分)现有下列9种微粒:H、H、C、C、N、Fe2+、Fe3+、O 、O 。按要求完成以下
2 3
各题:
(1)H、H分别是氢元素的一种________,它们互称为________。
(2)互为同素异形体的微粒是________。
(3)Fe2+的中子数为________,核外电子数为________________________________________。
(4)上述9种微粒中有________种核素,含有________种元素。
12.(10分)根据元素周期表回答下列问题:
(1)自然界稳定存在的元素中,金属性最强的元素是 ,非金属性最强的元素是 。
(2)在稳定存在的碱金属元素中,最高价氧化物对应水化物的碱性最强的是 ,写出钠与
水反应的离子方程式: 。
(3)卤族元素中,氢化物热稳定性最强的是HF;写出向KI溶液中通入Cl 反应的离子方程式:
2
。
13.(12分)科学家们发现氢元素有三种同位素原子。
(1)分别写出它们的名称: 、 、 。写出用作制造氢弹原料的同位素原子 。
(2)已知氯有2种常见同位素原子35Cl、37Cl,氯气与氢气形成的氯化氢分子的相对分子质量有
种。
(3)质量相同的HO和DO所含质子数之比为 ,中子数之比为 。
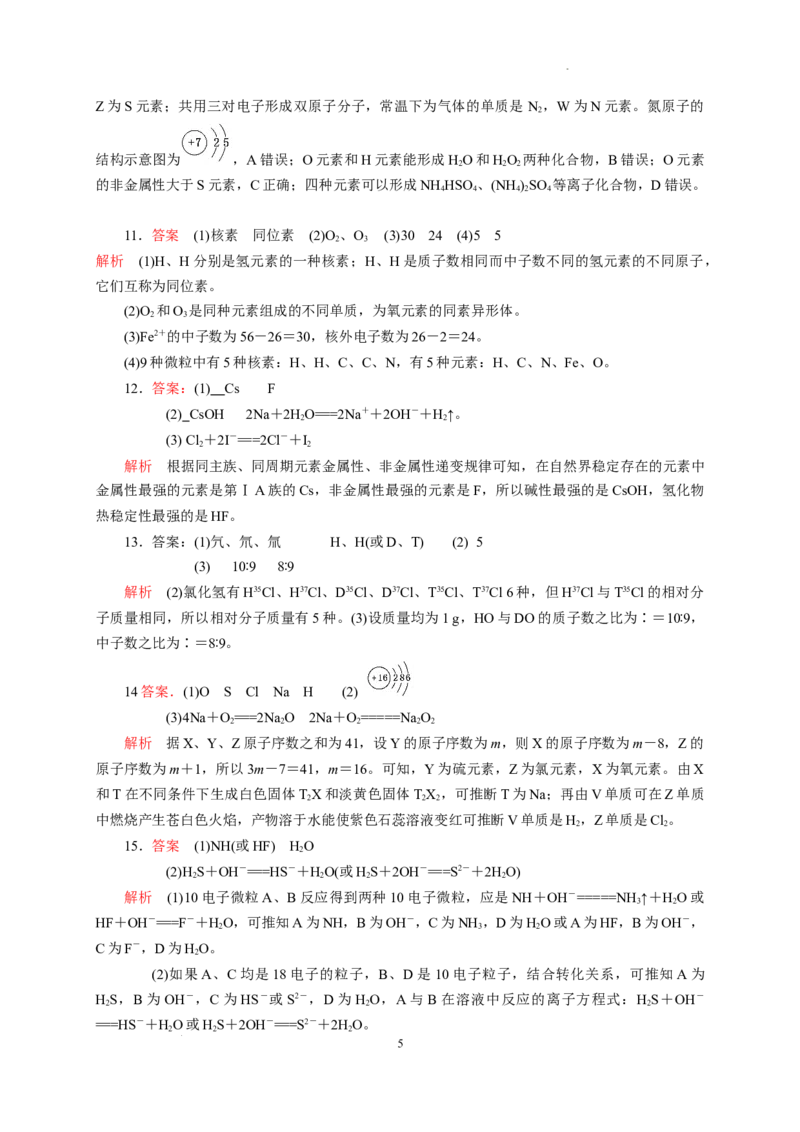
14.(12分)X、Y、Z、T、V为5种短周期元素,X、Y、Z在周期表中位置如图所示,这三种
元素原子序数之和是41,X和T在不同条件下反应,可以生成化合物TX(白色固体)和TX(淡黄色
2 2 2
固体)两种化合物,V单质在Z单质中燃烧产生苍白色火焰,产物溶于水能使石
蕊试液变红,则:
(1)5种元素的元素符号分别是:X__________,Y________,Z_______,
T_______,V________。
(2)Y的原子结构示意图是:____________。
(3)T、X形成化合物TX与TX 的化学方程式:①__________________________________,
2 2 2
②____________________________。
15.(10分)已知A、B、C、D是中学化学中常见的四种不同微粒。它们之间存在如图转化
关系。
(1)如果A、B、C、D均是10电子的微粒,请写出:
A的化学式:__________;D的化学式:___________________________________________。
(2)如果A和C是18电子的微粒,B和D是10电子的微粒,请写出A与B在溶液中反应的离
3
学科网(北京)股份有限公司子方程式:____________________________________________________________。
1.B.解析 对于该原子,质子数=核外电子数,即核外电子数为118,中子数为175,两者
之差=175-118=57。
2.C.解析 稀土元素是指镧系的15种元素,加上钪和钇共17种元素,A错误;稀土元素为
副族元素,B错误;稀土元素全部是金属元素,C正确;在地壳中含量最高的金属元素是铝元素,
D错误。
3.B.解析 239Pu中的239表示的是其质量数,A项错误;核素的种类是由质子数和中子数共
同决定的,238Pu、239Pu和241Pu属于同种元素的不同核素,B项正确;238Pu与238U核电荷数不相同,
属于不同的元素,在元素周期表中的位置不同,C项错误;由于化学变化不涉及原子核的变化,所
以原子的衰变不是化学变化,D项错误。
4.D.解析 氘原子的中子数为1,质子数为1,相对原子质量约为2,故A正确;氚原子内
中子数为2,核外电子数为1,故B正确;氘原子和氚原子的质子数均为1,中子数分别是1和2,
氘原子和氚原子互为同位素,故C正确;海水中的HO与DO是化合物,不是同种元素组成的不
2 2
同单质,不互为同素异形体,故D错误。
5.B 解析 B 137Cs和133Cs质子数相同,中子数不同,质量数不同,前者比后者多4个中子,
两者互为同位素,A、C两项正确;Cs位于周期表中第六周期ⅠA族,其原子最外层只有1个电子,
Cs的金属性很强,能与水剧烈反应,B项错误,D项正确。
6.D.解析 位于周期表中同一周期第Ⅷ族的不同的核素,质子数可能不相等,所以它们之
间不一定互为同位素,故A错误;因为同位素的化学性质基本相同,氧虽然有三种核素16O、17O、
18O,但自然界中的氧气分子为1种,故B错误;同位素是指质子数相同中子数不同的不同核素之
间的互称,故C错误;温差发动机使用时是将放射性同位素衰变时产生的能量转变成电能,发生的
是核反应,没有发生化学变化,故D正确。
7.C.解析 由图可知,随碱金属的核电荷数的增大,碱金属的性质呈增强的趋势。随核电荷
数的增大,碱金属的还原性增强,碱金属与水反应的剧烈程度增大,原子半径增大,A、B、D三
项正确;随核电荷数的增大,碱金属单质的熔点逐渐降低,C项与图示关系不符,故选C项。
8.A.解析 Am+和 Bn-的核外电子排布相同,说明二者核外电子数相同,即a-m=b+n,
a b
所以a=b+m+n。
9.B.解析 E处棉花球变成橙色,说明Cl 置换出了Br ,即Cl的非金属性强于Br,其离子方
2 2
程式为:Cl +2Br-===2Cl-+Br ,A、C正确;由NaOH溶液与Cl 反应的化学方程式2NaOH+
2 2 2
Cl===NaClO+NaCl+HO知D正确;F处棉花球变成蓝色也可能是未反应完的Cl 与I-反应,B错
2 2 2
误。
10.C.解析 L层电子数是K层电子数的3倍,X为O元素;核外电子层数等于原子序数,
Y为H元素;L层电子数是K层和M层电子数之和,即K、L、M电子层分别含有2、8、6个电子,
4
学科网(北京)股份有限公司Z为S元素;共用三对电子形成双原子分子,常温下为气体的单质是 N ,W为N元素。氮原子的
2
结构示意图为 ,A错误;O元素和H元素能形成HO和HO 两种化合物,B错误;O元素
2 2 2
的非金属性大于S元素,C正确;四种元素可以形成NH HSO 、(NH )SO 等离子化合物,D错误。
4 4 4 2 4
11.答案 (1)核素 同位素 (2)O 、O (3)30 24 (4)5 5
2 3
解析 (1)H、H分别是氢元素的一种核素;H、H是质子数相同而中子数不同的氢元素的不同原子,
它们互称为同位素。
(2)O 和O 是同种元素组成的不同单质,为氧元素的同素异形体。
2 3
(3)Fe2+的中子数为56-26=30,核外电子数为26-2=24。
(4)9种微粒中有5种核素:H、H、C、C、N,有5种元素:H、C、N、Fe、O。
12.答案:(1) Cs F
(2) CsOH 2Na+2HO===2Na++2OH-+H↑。
2 2
(3) Cl +2I-===2Cl-+I
2 2
解析 根据同主族、同周期元素金属性、非金属性递变规律可知,在自然界稳定存在的元素中
金属性最强的元素是第ⅠA族的Cs,非金属性最强的元素是F,所以碱性最强的是CsOH,氢化物
热稳定性最强的是HF。
13.答案:(1)氕、氘、氚 H、H(或D、T) (2) 5
(3) 10∶9 8∶9
解析 (2)氯化氢有H35Cl、H37Cl、D35Cl、D37Cl、T35Cl、T37Cl 6种,但H37Cl与T35Cl的相对分
子质量相同,所以相对分子质量有5种。(3)设质量均为1 g,HO与DO的质子数之比为∶=10∶9,
中子数之比为∶=8∶9。
14答案.(1)O S Cl Na H (2)
(3)4Na+O===2Na O 2Na+O=====NaO
2 2 2 2 2
解析 据X、Y、Z原子序数之和为41,设Y的原子序数为m,则X的原子序数为m-8,Z的
原子序数为m+1,所以3m-7=41,m=16。可知,Y为硫元素,Z为氯元素,X为氧元素。由X
和T在不同条件下生成白色固体TX和淡黄色固体TX ,可推断T为Na;再由V单质可在Z单质
2 2 2
中燃烧产生苍白色火焰,产物溶于水能使紫色石蕊溶液变红可推断V单质是H,Z单质是Cl。
2 2
15.答案 (1)NH(或HF) HO
2
(2)H S+OH-===HS-+HO(或HS+2OH-===S2-+2HO)
2 2 2 2
解析 (1)10电子微粒A、B反应得到两种10电子微粒,应是NH+OH-=====NH ↑+HO或
3 2
HF+OH-===F-+HO,可推知A为NH,B为OH-,C为NH ,D为HO或A为HF,B为OH-,
2 3 2
C为F-,D为HO。
2
(2)如果A、C均是18电子的粒子,B、D是10电子粒子,结合转化关系,可推知A为
HS,B为OH-,C为HS-或S2-,D为HO,A与B在溶液中反应的离子方程式:HS+OH-
2 2 2
===HS-+HO或HS+2OH-===S2-+2HO。
2 2 2
5
学科网(北京)股份有限公司6
学科网(北京)股份有限公司