文档内容
高一化学考试
本试卷满分100分,考试用时75分钟。
注意事项:
1. 答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2. 回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改
动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在
本试卷上无效。
3. 考试结束后,将本试卷和答题卡一并交回。
4. 本试卷主要考试内容:人教版必修第一册。
5. 可能用到的相对原子质量: 1 12 14 16 23 24 35.5
一、选择题:本题共10小题,每小题3分,共30分。在每小题给出的四个选项中,只有一
项是符合题目要求的。
1. 下列家庭常用物质的主要材料,不属于金属材料的是
A. 炒菜用铁锅 B. 香樟砧板 C. 锰钢防盗门 D. 微波炉用锡箔纸
【答案】B
【解析】
【详解】A.铁锅为金属材料,不符合题意;
B.香樟砧板不是金属材料,符合题意;
C.锰钢为金属材料,不符合题意;
D.锡箔时金属材料,不符合题意;
故选B。
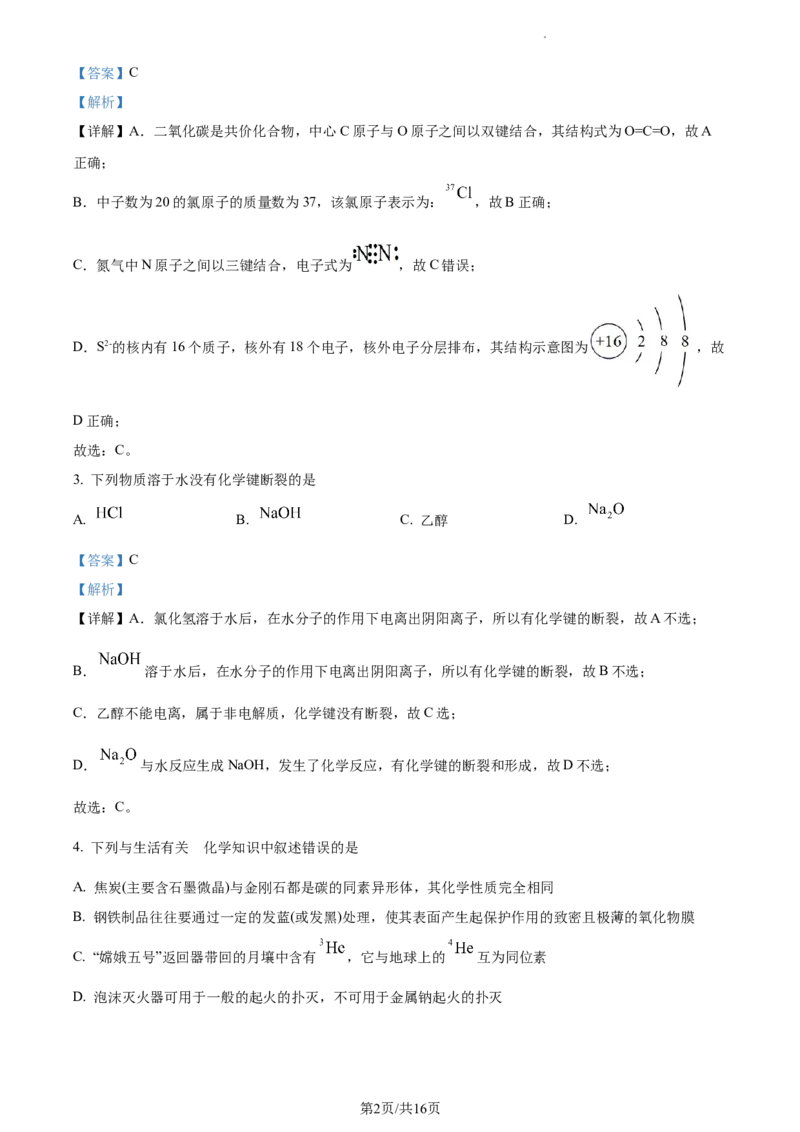
2. 下列有关化学用语表示错误的是
A. 的结构式:
B. 中子数为20的氯原子:
C. 的电子式:
D. 的结构示意图:
第1页/共16页
学科网(北京)股份有限公司【答案】C
【解析】
【详解】A.二氧化碳是共价化合物,中心C原子与O原子之间以双键结合,其结构式为O=C=O,故A
正确;
B.中子数为20的氯原子的质量数为37,该氯原子表示为: ,故B正确;
C.氮气中N原子之间以三键结合,电子式为 ,故C错误;
D.S2-的核内有16个质子,核外有18个电子,核外电子分层排布,其结构示意图为 ,故
D正确;
故选:C。
3. 下列物质溶于水没有化学键断裂的是
A. B. C. 乙醇 D.
【答案】C
【解析】
【详解】A.氯化氢溶于水后,在水分子的作用下电离出阴阳离子,所以有化学键的断裂,故A不选;
B. 溶于水后,在水分子的作用下电离出阴阳离子,所以有化学键的断裂,故B不选;
C.乙醇不能电离,属于非电解质,化学键没有断裂,故C选;
D. 与水反应生成NaOH,发生了化学反应,有化学键的断裂和形成,故D不选;
故选:C。
的
4. 下列与生活有关 化学知识中叙述错误的是
A. 焦炭(主要含石墨微晶)与金刚石都是碳的同素异形体,其化学性质完全相同
B. 钢铁制品往往要通过一定的发蓝(或发黑)处理,使其表面产生起保护作用的致密且极薄的氧化物膜
C. “嫦娥五号”返回器带回的月壤中含有 ,它与地球上的 互为同位素
D. 泡沫灭火器可用于一般的起火的扑灭,不可用于金属钠起火的扑灭
第2页/共16页
学科网(北京)股份有限公司【答案】A
【解析】
【详解】A.焦炭(主要含石墨微晶)与金刚石都是碳的同素异形体,同素异形体由于结构不同,即原子排列
不同,彼此间物理性质有差异;但由于是同种元素形成的单质,所以化学性质相似,选项A错误;
B.钢铁制品往往要通过一定的发蓝(或发黑)处理,使其表面产生起保护作用的致密且极薄的氧化物膜,从
而起到保护作用,防止腐蚀,选项B正确;
C. 与 为具有相同质子数和不同中子数的氦的两种核素,互为同位素,选项C正确;
D.泡沫灭火器不可以扑救金属钠火灾,因为水会加剧钠反应,选项D正确;
答案选A。
5. 元素周期表中某区域的一些元素多用于制造催化剂和耐高温、耐腐蚀的合金,该区域是
A. 稀有气体元素区域
.
B 过渡元素区域
C. 右上方的非金属元素区域
D. 金属元素和非金属元素分界线附近的元素区域
【答案】B
【解析】
【详解】元素周期表中位置相近的元素性质相似,因此人们可以在元素周期表中一定的区域内研究合成有
特定性质的新物质。如在金属和非金属的分界线附近寻找半导体材料(如锗、硅、硒等),在过渡元素中寻
找优良的催化剂和耐高温、耐腐蚀的合金材料(如制造火箭、飞机的钛、钼等元素)。答案选B。
6. 根据元素在元素周期表中的位置,下列判断错误的是
A. 酸性: B. 碱性:
C. 非金属性: D. 稳定性:
【答案】A
【解析】
【详解】A.根据同一主族,从上至下,非金属性逐渐减弱,则非金属性为 ,最高价氧化物对应水
化物的酸性为 ,故A错误;
B.金属性K<Mg,故最高价氧化物对应水化物的碱性为 ,故B正确;
第3页/共16页
学科网(北京)股份有限公司C.同一主族,从上至下,非金属性逐渐减弱,则非金属性为 ,故C正确;
D.非金属性F>O,故最简单气态氢化物的热稳定性为HF>HO,故D正确;
2
故选:A。
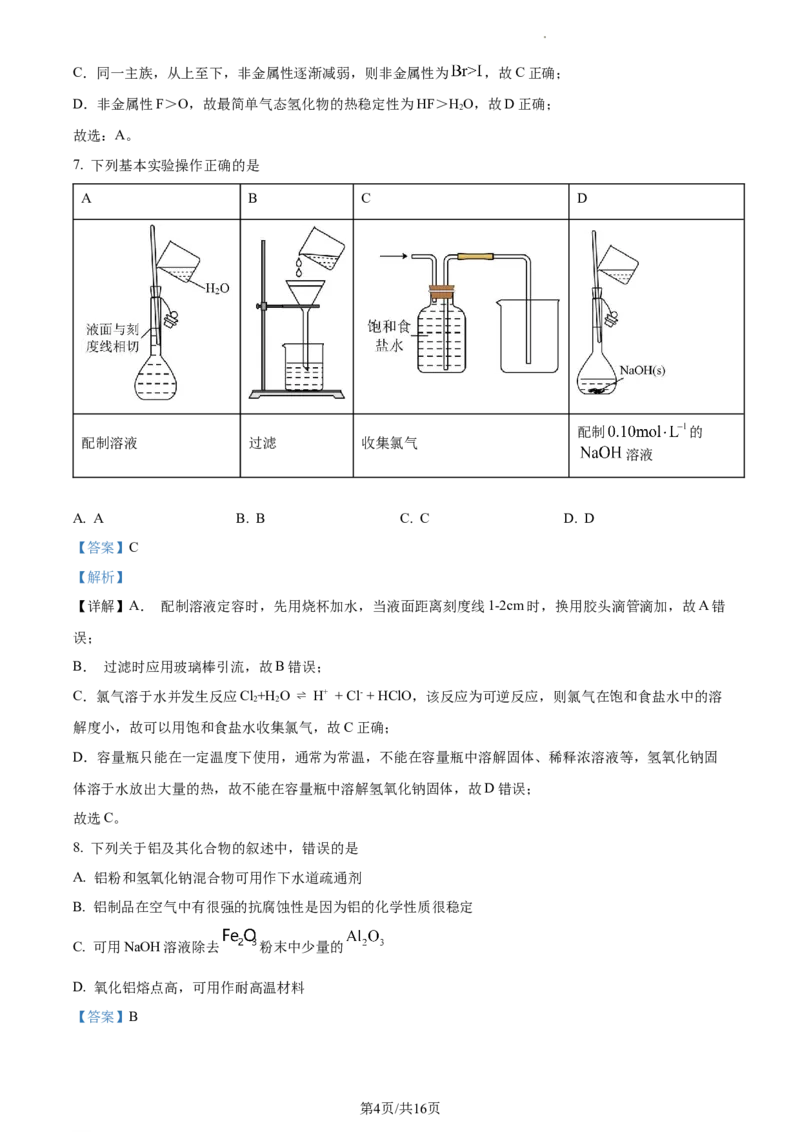
7. 下列基本实验操作正确的是
A B C D
配制 的
配制溶液 过滤 收集氯气
溶液
A. A B. B C. C D. D
【答案】C
【解析】
【详解】A. 配制溶液定容时,先用烧杯加水,当液面距离刻度线1-2cm时,换用胶头滴管滴加,故A错
误;
B. 过滤时应用玻璃棒引流,故B错误;
C.氯气溶于水并发生反应Cl+H O ⇌ H+ + Cl- + HClO,该反应为可逆反应,则氯气在饱和食盐水中的溶
2 2
解度小,故可以用饱和食盐水收集氯气,故C正确;
D.容量瓶只能在一定温度下使用,通常为常温,不能在容量瓶中溶解固体、稀释浓溶液等,氢氧化钠固
体溶于水放出大量的热,故不能在容量瓶中溶解氢氧化钠固体,故D错误;
故选C。
8. 下列关于铝及其化合物的叙述中,错误的是
A. 铝粉和氢氧化钠混合物可用作下水道疏通剂
B. 铝制品在空气中有很强的抗腐蚀性是因为铝的化学性质很稳定
C. 可用NaOH溶液除去 粉末中少量的
D. 氧化铝熔点高,可用作耐高温材料
【答案】B
第4页/共16页
学科网(北京)股份有限公司【解析】
【详解】A.铝和氢氧化钠遇水反应放出大量的热,加快氢氧化钠对毛发等淤积物的腐蚀,同时产生氢气
增加管道内的气压,利于疏通,所以铝粉和氢氧化钠混合物可用作下水道疏通剂,故A正确;
B.铝制品在空气中有很强的抗腐蚀性是因为铝在空气中形成了致密的氧化膜,故B错误;
C. 和NaOH溶液反应生成可溶性偏铝酸钠,所以可用NaOH溶液除去 粉末中少量的 ,
故C正确;
D.具有高熔点的物质可以用作耐高温材料,氧化铝熔点高,可用作耐高温材料,故D正确;
选B。
9. 下列事实不能说明元素的金属性或非金属性的相对强弱的是
选项 事实 推论
A 与氢气反应, 比 剧烈 非金属性:F>Cl
B NaOH的碱性强于 的 金属性:Na>Mg
C 酸性: 非金属性:Cl>C
D 热稳定性: 非金属性:N>C
A. A B. B C. C D. D
【答案】C
【解析】
【详解】A.根据与氢气化合的难易程度可判断元素非金属性强弱,故A不符合题意;
B.根据最高价氧化物对应的水化物碱性强弱可判断元素金属性强弱,故B不符合题意;
C.应该根据最高价氧化物对应的水化物酸性强弱来判断元素非金属性强弱,HCl不是Cl的最高价含氧酸,
所以不能直接比较非金属性,故C符合题意;
D.气态氢化物越稳定,元素非金属性越强,故D不符合题意。
综上所述,答案为C。
10. 下列除杂试剂选用正确且除杂过程中不涉及氧化还原反应的是
选项 物质(括号内为杂质) 除杂试剂
A Fe(Al) NaOH溶液
B ( ) 稀硫酸
第5页/共16页
学科网(北京)股份有限公司C NaCl溶液( ) NaOH溶液、稀盐酸
D 溶液( ) Cu粉
A. A B. B C. C D. D
【答案】C
【解析】
【详解】A.Al能与氢氧化钠溶液反应生成偏铝酸钠溶液和氢气,涉及氧化还原反应,过滤可得到Fe,故
A不符合题意;
B.稀硫酸和碳酸钙反应生成硫酸钙,也为难溶于水的物质,故不能除杂,应该直接加水溶解过滤即可除
杂,B不符合题意;
C.氯化镁溶液和氢氧化钠溶液反应生成氢氧化镁沉淀和氯化钠,过滤所得的氢氧化镁沉淀,可溶于盐酸,
两个反应均为复分解反应、属于非氧化还原反应,提纯方法正确,故C符合题意;
D.FeCl 可与Fe粉反应生成FeCl 溶液,涉及氧化还原反应,D不符合题意;
3 3
答案选C。
二、选择题:本题共4小题,每小题4分,共16分。在每小题给出的四个选项中,有一个或
两个选项符合题目要求。全部选对的得4分,选对但不全的得2分,有选错的得0分。
11. 设 为阿伏加德罗常数的值,下列说法正确的是
A. 中含有的原子总数为3
B. 与足量 或 反应生成 或 ,均失去2 个电子
C. 常温下, 的 溶液中含有的 数为2
D. 与 盐酸反应生成的 的分子数为2
【答案】AB
【解析】
【详解】A.20gDO中含有的原子总数为 ×3×N mol-1=3N ,故A正确;
2 A A
B.氧化镁和氮化镁中镁元素都为+2价,则1mol镁与足量氧气或氮气反应时,失去电子的数目均为
1mol×2×N mol-1=2N ,故B正确;
A A
第6页/共16页
学科网(北京)股份有限公司C.缺溶液的体积,无法计算1mol/L碳酸钠溶液中碳酸钠的物质的量和含有钠离子的个数,故C错误;
D.理论上1mol二氧化锰能与4mol盐酸共热反应生成1mol氯气,反应时浓盐酸会变为稀盐酸,稀盐酸与
二氧化锰共热不反应,则1mol二氧化锰能与1L4mol/L盐酸共热反应生成氯气的物质的量小于1mol,故D
错误;
故选AB。
12. 下列关于离子方程式的评价不合理的是
选
化学反应及其离子方程式 评价
项
错误,
溶液与足量的 溶液反应: 在强
A
碱性条件下会
反应生成
已知氧化性 ,向 溶液中通入少量氯气:
B 正确
稀盐酸除去含 的水垢:
C 正确
错误,钠的活
D 向 溶液中加入一小粒钠块: 泼性很强,会
优先与水反应
A. A B. B C. C D. D
【答案】B
【解析】
【详解】A. 溶液与足量的 溶液反应应该生成偏氯酸钾,故A正确;
B.若向 溶液中通入少量氯气发生反应 ,根据氧化性 ,Br 会氧
2
化Fe2+,故向 溶液中通入少量氯气应该先与Fe2+反应,故B错误;
C.盐酸酸性强于碳酸,故发生反应 ,且符合离子方程式的书写规则,
故C正确;
D.钠与盐反应,应该钠先与水反应,生成的氢氧化钠再与盐反应,故D正确;
故选B。
第7页/共16页
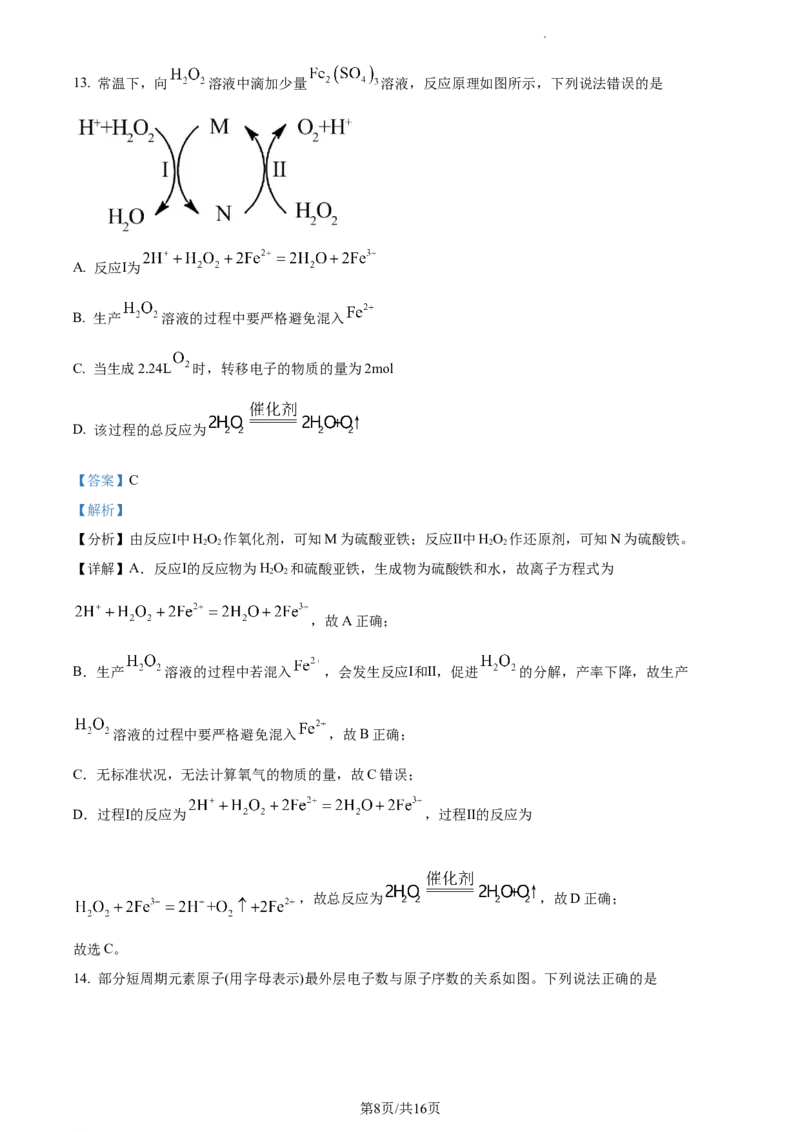
学科网(北京)股份有限公司13. 常温下,向 溶液中滴加少量 溶液,反应原理如图所示,下列说法错误的是
A. 反应Ⅰ为
B. 生产 溶液的过程中要严格避免混入
C. 当生成2.24L 时,转移电子的物质的量为2mol
D. 该过程的总反应为
【答案】C
【解析】
【分析】由反应Ⅰ中HO 作氧化剂,可知M为硫酸亚铁;反应Ⅱ中HO 作还原剂,可知N为硫酸铁。
2 2 2 2
【详解】A.反应Ⅰ的反应物为HO 和硫酸亚铁,生成物为硫酸铁和水,故离子方程式为
2 2
,故A正确;
B.生产 溶液的过程中若混入 ,会发生反应Ⅰ和Ⅱ,促进 的分解,产率下降,故生产
溶液的过程中要严格避免混入 ,故B正确;
C.无标准状况,无法计算氧气的物质的量,故C错误;
D.过程Ⅰ的反应为 ,过程Ⅱ的反应为
,故总反应为 ,故D正确;
故选C。
14. 部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系如图。下列说法正确的是
第8页/共16页
学科网(北京)股份有限公司A. 仅由 与 形成的常见化合物中只含有共价键
B. 与 形成的化合物中不可能含有共价键
C. 非金属性:
D. 原子半径:
【答案】AD
【解析】
【分析】根据元素周期律,推出:X为N,Y为O,W为Cl,R为S,Z为Na。
【详解】A.S与O都是非金属元素,S与O形成的常见化合物只含有共价键,A正确;
B.Na与O形成NaO和NaO,NaO中只含离子键,NaO 含有离子键和非极性共价键,故B错误;
2 2 2 2 2 2
C.同周期元素非金属性从左到右逐渐增强,则NCl>N>O,D
正确。
三、非选择题:本题共4小题,共54分。
15. “化学-我们的生活,我们的未来”,学习化学应该明白“从生活中来,到生活中去”的道理。请回答下列
问题:
(1)云、雾属于胶体,鉴别胶体和溶液的方法是_______,胶体和溶液的本质区别是_______。
(2)钠的焰色试验的焰色为_______色,该色的光射程远,透雾力强,据此原理制作的高压钠灯广泛应用
于道路和广场的照明。焰色试验属于_______(填“物理”或“化学”)变化。过氧化钠是一种淡黄色的固体,可
作漂白剂和呼吸面具中的供氧剂,写出过氧化钠和二氧化碳反应的化学方程式,并用双线桥法表示电子转
移的方向和数目:_______。
(3)将新鲜的有色花瓣放入干燥的氯气中,可观察到的现象是_______,原因是_______。
(4)漂白粉暴露在空气中易变质,若向暴露在空气中的漂白粉中加入浓盐酸,可能收集到的气体除了挥
发的HCl和水蒸气外,还可能有_______(填化学式)。
【答案】(1) ①. 丁达尔效应 ②. 分散质粒子直径大小不同
第9页/共16页
学科网(北京)股份有限公司(2) ①. 黄 ②. 物理 ③.
(3) ①. 有色花瓣变成无色 ②. 氯气和水反应生成了盐酸和次氯酸,次氯酸具有漂白性
(4) 、
【解析】
【小问1详解】
云、雾分散质微粒直径在1~100nm之间,属于胶体分散系,具有丁达尔效应,鉴别胶体和溶液的方法是
丁达尔效应;
胶体和溶液的本质区别是分散质粒子直径大小不同;
【小问2详解】
钠的焰色试验的焰色为黄色;焰色试验属于物理变化;
过氧化钠是一种淡黄色的固体,可作漂白剂和呼吸面具中的供氧剂,过氧化钠和二氧化碳反应生成碳酸钠
和氧气,氧元素由-1价变为0价和-2价,用双线桥法表示电子转移的方向和数目为:
;
【小问3详解】
将新鲜的有色花瓣放入干燥的氯气中,氯气和水反应生成了盐酸和次氯酸,次氯酸具有漂白性,可观察到
的现象是有色花瓣变成无色;
【小问4详解】
漂白粉暴露在空气中易变质,变质则会生成碳酸钙,故若向暴露在空气中的漂白粉中加入浓盐酸,可能收
集到的气体除了挥发的HCl和水蒸气外,还可能有 、 。
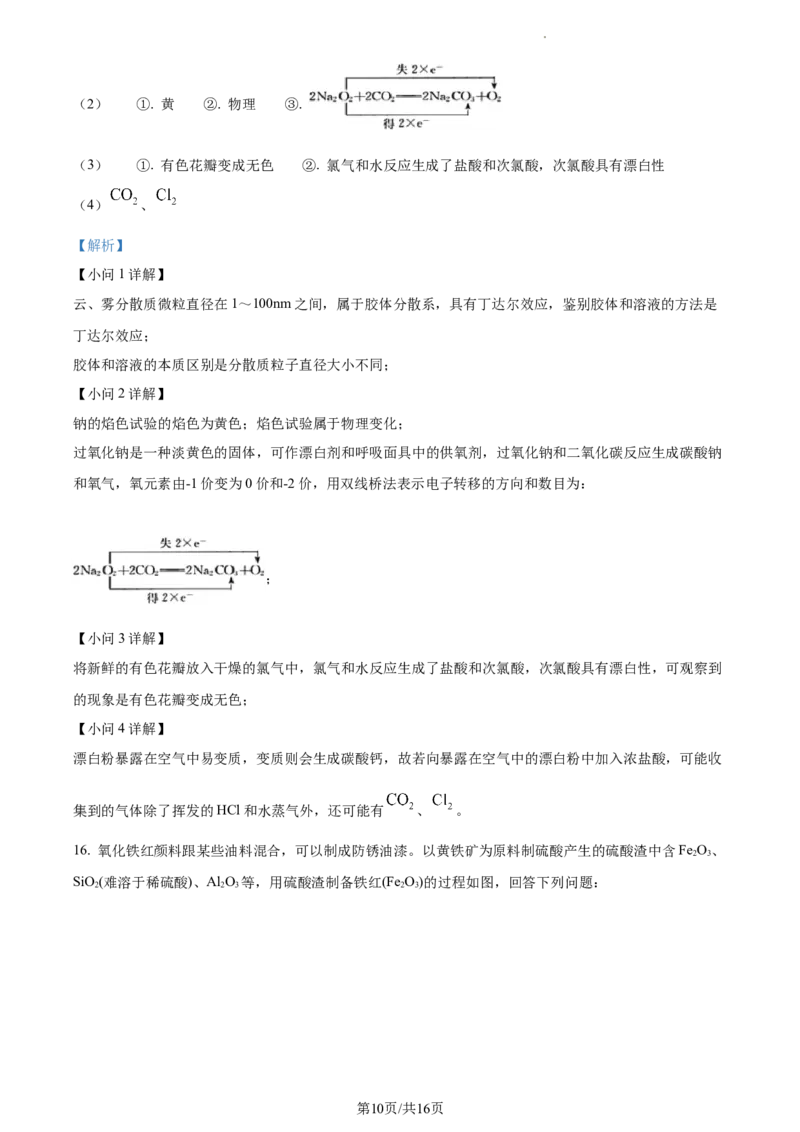
16. 氧化铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe O、
2 3
SiO(难溶于稀硫酸)、Al O 等,用硫酸渣制备铁红(Fe O)的过程如图,回答下列问题:
2 2 3 2 3
第10页/共16页
学科网(北京)股份有限公司(1)“酸溶”过程中,加入过量的稀硫酸充分反应,反应后溶液中含有的金属阳离子除了 还有
___________(填离子符号),写出Fe O 与稀硫酸反应的离子方程式:___________。
2 3
(2)“还原”过程中加入FeS 粉的目的是将溶液中的Fe3+还原为Fe2+,而FeS 自身被氧化为HSO ,该反应
2 2 2 4
中氧化剂和还原剂的物质的量之比为___________。
(3)“滤渣A”是SiO,SiO 是一种常见的酸性氧化物,与CO 类似,都可与强碱反应,写出SiO 与NaOH
2 2 2 2
溶液反应的化学方程式:___________。
(4)“氧化”时,可观察到的实验现象为___________。若加入的NaOH溶液过量,则“滤液B”中的溶质除
了NaOH外,还含有___________;若加入的NaOH溶液不足,则制得的铁红中含有的杂质为
___________(填化学式)。
【答案】(1) ①. Al3+ ②.
(2)14:1 (3)
(4) ①. 有白色沉淀生成,迅速转化为灰绿色,最终变为红褐色 ②. 、 ③.
【解析】
【分析】硫酸渣中含Fe O、SiO、Al O 等,稀硫酸溶解主要除去不与酸反应的SiO,加入FeS 将溶液中
2 3 2 2 3 2 2
的Fe3+还原为Fe2+,再加氢氧化钠和空气,调节溶液的pH主要是使三价铁离子沉淀,而铝离子等不沉淀,
最后洗涤、烘干、研磨使氢氧化铁分解生成氧化铁,从而得到铁红。
【小问1详解】
硫酸渣中含Fe O、SiO、Al O 等,“酸溶”过程中,加入过量的稀硫酸充分反应,反应后溶液中含有的金
2 3 2 2 3
属阳离子除了 还有 ; 与稀硫酸反应生成硫酸铁和水,反应的离子方程式为
第11页/共16页
学科网(北京)股份有限公司;故答案为: ; ;
【小问2详解】
“还原”过程中加入 粉的目的是将溶液中的 还原为 ,而 自身被氧化为 ,则发生
反应的离子方程式为14 + =15 +2 +16H+,该反应中氧化剂 和还原剂 的物质的
量之比为14:1;故答案为:14:1;
【小问3详解】
与NaOH溶液反应生成硅酸钠和水,反应的化学方程式为: ;故
答案为: ;
【小问4详解】
“氧化”时,是加入氢氧化钠溶液和氧气,亚铁离子被沉淀然后沉淀再被氧化,可观察到的实验现象为有白
色沉淀生成,迅速转化为灰绿色,最终变为红褐色,若加入的NaOH溶液过量,NaOH溶液会与氢氧化铝
沉淀反应生成偏铝酸钠等,则“滤液B”中的溶质除了NaOH外,还含有 、 ;若加入的
NaOH溶液不足,则部分氢氧化铝没有转化为偏铝酸钠而留在沉淀中,制得的铁红中可能含有的杂质为
,故答案为:有白色沉淀生成,迅速转化为灰绿色,最终变为红褐色; 、 ;
。
17. X、Y、Z、W、R五种元素的性质或结构信息如表,根据表中的信息回答下列问题:
元素 X Y Z W R
性质或结 是原子半径 常见单质为空气中 是海水中质量分 原子核内有 原子核外有3个电子
构信息 最小的元素 的主要成分之一 数最大的元素 11个质子 层,常见单质为气体
(1)写出元素R在元素周期表中的位置:_______。
(2)由X、Z、R三种元素形成的化合物XRZ的结构式为_______;化合物WR的电子式为_______。
的
(3)Y、Z 最简单氢化物中较稳定的是_______(填化学式),判断依据是_______。由Y和Z组成且Y和
Z的质量之比为7:4的化合物的分子式是_______。
第12页/共16页
学科网(北京)股份有限公司(4)写出少量X的单质在盛满R的单质的集气瓶中燃烧的现象:_______,燃烧片刻后取出燃烧管,迅速
将集气瓶倒扣在过量的烧碱溶液中,可能产生的现象是_______,所得溶液中存在的溶质除了过量的NaOH
外,还含有的是_______(填化学式)。
【答案】(1)第三周期第ⅦA族
(2) ①. H-O-Cl ②.
(3) ①. ②. 非金属性越强,最简单氢化物越稳定 ③.
的
(4) ①. 有苍白色 火焰 ②. 集气瓶内颜色消失,液面上升 ③. NaCl、NaClO
【解析】
【分析】X为是原子半径最小的元素,故X为H;Z是海水中质量分数最大的元素,故Z为O;Y的常见
单质为空气中的主要成分之一,故Y为N;W的原子核内有11个质子,则W为Na;R的原子核外有3个
电子层,常见单质为气体,则R为Cl。
【小问1详解】
Cl为17号元素,位于周期表的第三周期第ⅦA族。
【小问2详解】
H、O、Cl形成的HClO的结构简式为H-O-Cl;NaCl为离子化合物,电子式为 。
【小问3详解】
HO、NH 中较稳定的为HO,依据为非金属性越强,最简单氢化物越稳定。Y和Z的质量之比为7:4的
2 3 2
化合物为 。
【小问4详解】
氢气在氯气中燃烧有苍白色火焰;燃烧生成了氯化氢,还有过量的氯气,故将集气瓶倒扣在过量的烧碱溶
液中,集气瓶内黄绿色消失,液面上升;溶质除了氢氧化钠,还有氯气和氢氧化钠生成的NaCl、NaClO。
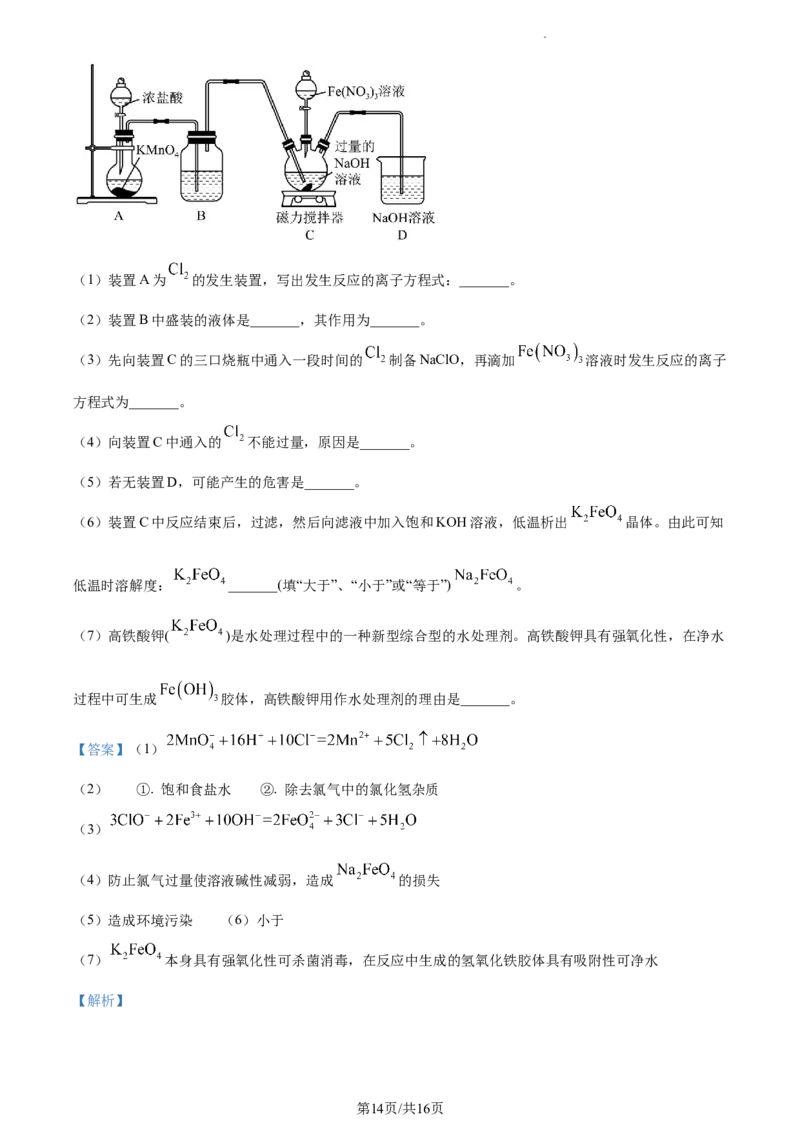
18. 高铁酸钾( )为暗紫色固体,是一种高效多功能的新型非氯绿色消毒剂,易溶于水,在KOH浓
溶液中溶解度较低,在酸性或中性溶液中不稳定,在碱性溶液中较稳定且碱性越强越稳定。某实验小组设
计如图装置制备 ,根据所学知识回答下列问题:
第13页/共16页
学科网(北京)股份有限公司(1)装置A为 的发生装置,写出发生反应的离子方程式:_______。
(2)装置B中盛装的液体是_______,其作用为_______。
(3)先向装置C的三口烧瓶中通入一段时间的 制备NaClO,再滴加 溶液时发生反应的离子
方程式为_______。
(4)向装置C中通入的 不能过量,原因是_______。
(5)若无装置D,可能产生的危害是_______。
(6)装置C中反应结束后,过滤,然后向滤液中加入饱和KOH溶液,低温析出 晶体。由此可知
低温时溶解度: _______(填“大于”、“小于”或“等于”) 。
(7)高铁酸钾( )是水处理过程中的一种新型综合型的水处理剂。高铁酸钾具有强氧化性,在净水
过程中可生成 胶体,高铁酸钾用作水处理剂的理由是_______。
【答案】(1)
(2) ①. 饱和食盐水 ②. 除去氯气中的氯化氢杂质
(3)
(4)防止氯气过量使溶液碱性减弱,造成 的损失
(5)造成环境污染 (6)小于
(7) 本身具有强氧化性可杀菌消毒,在反应中生成的氢氧化铁胶体具有吸附性可净水
【解析】
第14页/共16页
学科网(北京)股份有限公司【分析】本实验利用氯气制备 ,装置A用于制备氯气,将制得的氯气通过装置B用于吸收除去
其中混有的少量HCl,随后将纯净的氯气通入到装置C中用于反应生成高铁酸钠,最后利用D装置吸收没
有反应的尾气。
【小问1详解】
装置A为 的发生装置,利用高锰酸钾与浓盐酸反应生成氯化锰、氯化钾、氯气和水,发生反应的离子
方程式为: ;
【小问2详解】
氯化氢极易溶于水,也能溶于饱和食盐水中,装置B中盛装的液体是饱和食盐水,其作用为除去氯气中的
氯化氢杂质;
【小问3详解】
先向装置C的三口烧瓶中通入一段时间的 制备NaClO,再滴加 溶液时发生反应生成高铁酸
钠、氯化钠和水,反应的离子方程式为 ;
【小问4详解】
向装置C中通入的 不能过量,防止氯气过量使溶液碱性减弱,造成 的损失;
【小问5详解】
若无装置D,则过量的氯气直接排放到空气中,可能产生的危害是造成环境污染;
【小问6详解】
装置C中反应结束后,过滤,然后向滤液中加入饱和KOH溶液,因为低温时溶解度: 小于
,所以低温析出 晶体;
【小问7详解】
高铁酸钾( )是水处理过程中的一种新型综合型的水处理剂。高铁酸钾具有强氧化性,在净水过程
中可生成 胶体, 本身具有强氧化性可杀菌消毒,在反应中生成的氢氧化铁胶体具有吸
附性可净水。
第15页/共16页
学科网(北京)股份有限公司第16页/共16页
学科网(北京)股份有限公司