文档内容
高一上学期期末质量检测
化学试卷
本试卷满分100分,考试用时75分钟
相对原子质量:H 1 C 12 O 16 Cl 35.5 Fe 56 Cu 64
一、选择题:本题共15小题,每小题3分,共45分,在每小题给出的四个选项中,只有一
项符合题目要求。
1. 下列叙述错误的是
A. 氧化铁常用作红色油漆的颜料
B. 常温下可用铁或铝制容器盛装浓硫酸
C. 过氧化钠可用于呼吸面具的氧气的来源
D. 金属钠着火时,可立即用沾水的毛巾覆盖
【答案】D
【解析】
【详解】A.氧化铁是红棕色粉末,常用作红色油漆的颜料,故A正确;
B.铁、铝在冷的浓硫酸中钝化,阻碍反应的继续进行,所以常温下可用铁或铝制容器盛装浓硫酸,故B
正确;
C.过氧化钠能与人呼吸出的二氧化碳和水蒸气反应生成氧气,所以可用于呼吸面具的氧气的来源,故C
正确;
D.金属钠能与水反应生成可燃的气体,所以金属钠着火时不能用沾水的毛巾覆盖,应用沙土覆盖,否则
会发生意外事故,故D错误;
故选D。
2. 下列各组物质,按化合物、单质、混合物顺序排列的是
A. 碱石灰、生铁、盐酸 B. 冰水混合物、白磷、漂粉精
C. 石灰石,液态氧、碘酒 D. 食用醋、氮气、
【答案】B
【解析】
【详解】A.碱石灰是混合物,不属于化合物,生铁是混合物,不属于单质,故A错误;
B.冰水混合物是由水形成的纯净物,水是化合物,白磷是非金属单质,漂粉精是氯化钙和次氯酸钙形成
的混合物,故B正确;
第1页/共15页
学科网(北京)股份有限公司的
C.石灰石是主要成分为碳酸钙 混合物,不属于化合物,故C错误;
D.食用醋是含有乙酸的混合物,不属于化合物,十水碳酸钠是含有结晶水的盐,属于纯净物,故D错误;
故选B。
3. 下列叙述正确的是
A. O 的摩尔体积约为22.4L
2
B. 1molCO 的质量为44g/mol
2
C. 不同物质的摩尔质量必定不相等
D. 50mL溶液中,2mol/LNaCl溶液和1mol/LCaCl 溶液中的c(Cl-)相等
2
【答案】D
【解析】
【详解】A.温度压强不知,不能确定气体摩尔体积,且气体摩尔体积的单位为L/mol,故A不符合题意;
B.二氧化碳的摩尔质量是44g/mol,质量的单位是g,1molCO 的质量为44g,故B不符合题意;
2
C.不同物质的摩尔质量可以相等,如NO和CHO摩尔质量都为30g/mol,NO和CO 摩尔质量都为
2 2 2
44g/mol,故C不符合题意;
D.50mL溶液中,2mol/L NaCl溶液中氯离子浓度为c(Cl-)=2mol/L,1mol/LCaCl 溶液中的
2
c(Cl-)=1mol/L×2=2mol/L,两溶液中c(Cl-)相等,故D符合题意;
答案选D。
4. 下列叙述中正确的是
A. 时, 的醋酸溶液比等浓度的醋酸钠溶液的导电能力弱
B. 在水溶液中的电离方程式为
C. 的水溶液不易导电,故 是弱电解质
D. 溶于水后能导电,故 为电解质
【答案】A
【解析】
【详解】A.醋酸是弱酸,在溶液中部分电离,醋酸钠是强电解质,在溶液中完全电离,所以25℃时,
0.1mol/L的醋酸溶液中离子浓度小于等浓度的醋酸钠溶液,导电能力弱于等浓度的醋酸钠溶液,故A正确;
B.碳酸氢钠在水溶液中完全电离出钠离子和碳酸氢根离子,电离方程式为 ,故B
错误;
第2页/共15页
学科网(北京)股份有限公司C.难溶于水的硫酸钡在溶液中完全电离出钡离子和硫酸根离子,属于强电解质,故C错误;
D.氨气不能电离出自由移动的离子,属于非电解质,故D错误;
故选A。
5. 下列试剂中,不能用于鉴别Fe2+和Fe3+的是
A. NaOH溶液 B. 稀硫酸
C. KSCN溶液 D. 酸性KMnO 溶液
4
【答案】B
【解析】
【详解】A.可以鉴别,与氢氧化钠溶液反应得到的沉淀的颜色不同,得到Fe(OH) 显白色,再变绿色,
2
最后变红褐色,得到Fe(OH) 的直接显红褐色的,A正确;
3
B.无法鉴别,二者都不与稀硫酸反应,B错误;
C.可以鉴别,KSCN溶液只和Fe3+反应变成血红色,C正确;
D.亚铁离子可以使酸性KMnO 溶液褪色,铁离子不可以,可以鉴别,D正确;
4
答案选B。
6. 下列物质不具有漂白性的是( )
A. 次氯酸钙 B. “84”消毒液 C. 氯气 D. 新制氯水
【答案】C
【解析】
的
【详解】A.次氯酸钙具有强氧化性,可生成具有漂白性 次氯酸,ClO-+H O HClO+OH-,故A不选;
2
⇌
B.84消毒液的有效成分为NaClO,可生成具有漂白性的HClO,故B不选;
C.干燥的氯气不具有漂白性,故C选;
D.新制氯水中含有次氯酸,具有强氧化性,能够氧化有机色素,具有漂白性,故D不选;
故选C。
【点睛】理解氯及其化合物中次氯酸具有漂白性是解题的关键。本题的易错点为C,要注意氯气没有漂白
性。
7. 元素在周期表中的位置取决于该元素原子的( )
A. 相对原子质量和核外电子数
B. 电子层数和最外层电子数
C. 相对原子质量和最外层电子数
D. 电子层数和次外层电子数
【答案】B
【解析】
第3页/共15页
学科网(北京)股份有限公司【详解】对主族元素而言,其电子层数就是该元素在元素周期表中的周期序数;其最外层上的电子数就是
该元素在周期表中的族序数,由该元素在周期表中的周期和族决定元素的位置,答案选B。
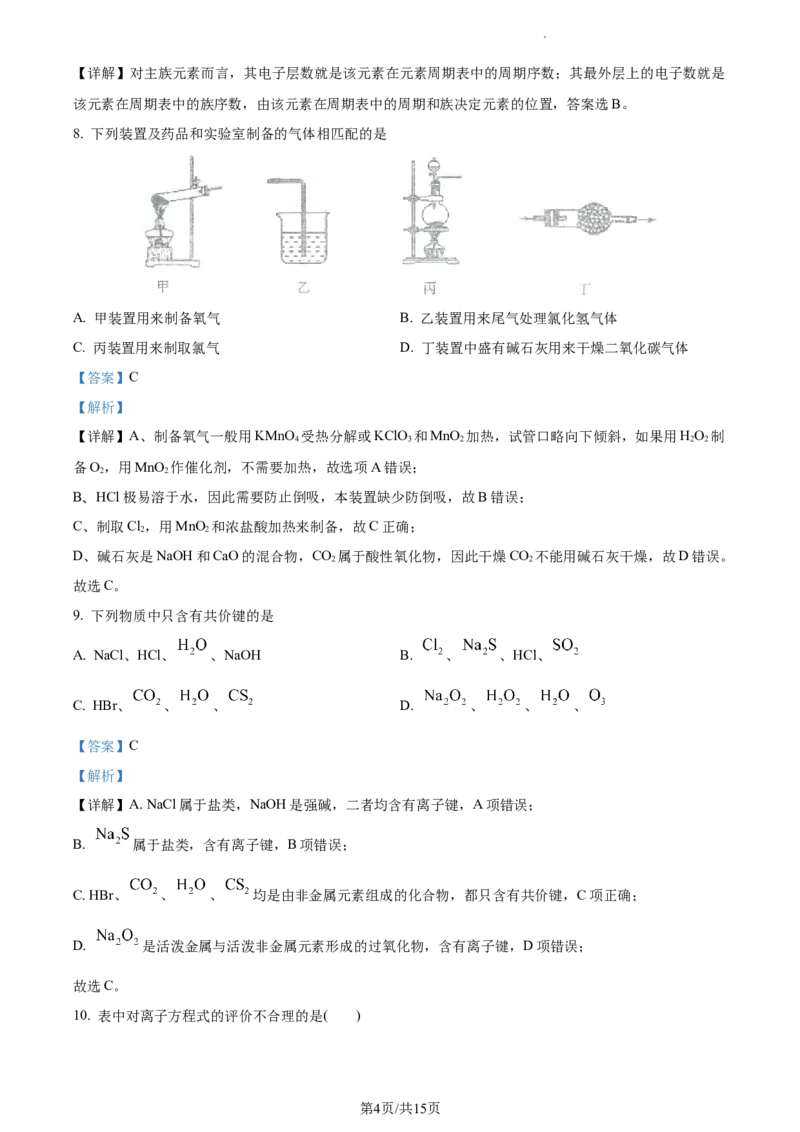
8. 下列装置及药品和实验室制备的气体相匹配的是
A. 甲装置用来制备氧气 B. 乙装置用来尾气处理氯化氢气体
C. 丙装置用来制取氯气 D. 丁装置中盛有碱石灰用来干燥二氧化碳气体
【答案】C
【解析】
【详解】A、制备氧气一般用KMnO 受热分解或KClO 和MnO 加热,试管口略向下倾斜,如果用HO 制
4 3 2 2 2
备O,用MnO 作催化剂,不需要加热,故选项A错误;
2 2
B、HCl极易溶于水,因此需要防止倒吸,本装置缺少防倒吸,故B错误;
C、制取Cl,用MnO 和浓盐酸加热来制备,故C正确;
2 2
D、碱石灰是NaOH和CaO的混合物,CO 属于酸性氧化物,因此干燥CO 不能用碱石灰干燥,故D错误。
2 2
故选C。
9. 下列物质中只含有共价键的是
A. NaCl、HCl、 、NaOH B. 、 、HCl、
C. HBr、 、 、 D. 、 、 、
【答案】C
【解析】
【详解】A. NaCl属于盐类,NaOH是强碱,二者均含有离子键,A项错误;
B. 属于盐类,含有离子键,B项错误;
C. HBr、 、 、 均是由非金属元素组成的化合物,都只含有共价键,C项正确;
D. 是活泼金属与活泼非金属元素形成的过氧化物,含有离子键,D项错误;
故选C。
10. 表中对离子方程式的评价不合理的是( )
第4页/共15页
学科网(北京)股份有限公司选项 化学反应及其离子方程式 评价
足量的CO 与澄清石灰水反应:CO+ 错误,足量的CO 与澄清石灰水反应的
A 2 2 2
Ca2++2OH-=CaCO ↓+HO 产物为Ca(HCO ) 和HO
3 2 3 2 2
向碳酸钙上滴加稀盐酸:2H++
B 错误,碳酸钙不应该写成 形式
=CO ↑+HO
2 2
向硫酸铵溶液中加入氢氧化钡溶液:Ba2
C 正确
++ = BaSO↓
4
铁粉与稀硫酸反应:2Fe+6H+=2Fe3++ 错误,H+的氧化性较弱,只能将铁单质
D
3H↑ 氧化为Fe2+
2
A. A B. B C. C D. D
【答案】C
【解析】
【详解】A.足量的CO 与澄清石灰水反应生成可溶性的碳酸氢钙,发生反应的离子反应方程式为 CO+
2 2
OH-=HCO-,评价合理,选项A正确;
3
B.碳酸钙不溶于水,向碳酸钙上滴加稀盐酸发生的离子反应方程式为2H++CaCO =CO ↑+HO+Ca2+,评
3 2 2
价合理,选项B正确;
C.向硫酸铵溶液中加入氢氧化钡溶液,反应生成硫酸钡沉淀和一水合氨,正确的离子反应为2OH-+2NH+
4
+Ba2++SO2-═BaSO ↓+2NH•H O,该评价不合理,选项C错误;
4 4 3 2
D.H+的氧化性较弱,只能将铁单质氧化为Fe2+,正确的离子方程式为:Fe+2H+=Fe2++H ↑,该评价合理,
2
选项D正确;
答案选C。
11. 用98%的浓硫酸配制1.0mol·L-1的稀硫酸时,下列操作会导致溶液浓度偏高的是
A. 用量筒量取浓硫酸时,俯视量筒读数量取
B. 在烧杯中溶解时,有少量液体溅出
C. 使用容量瓶时,容量瓶内残留有少量水分
D. 定容时俯视容量瓶刻度线
【答案】D
【解析】
【详解】A.用量筒量取浓硫酸时俯视量筒读数,用量筒量取液体时,俯视读数,使所读液体的体积偏小,
使配制的溶液浓度偏小,故A错误;
B.在烧杯中溶解时,有少量液体溅出,导致溶质的物质的量偏小,溶液浓度偏低,故B错误;
C.使用容量瓶时,容量瓶内残留有少量水分,对溶液浓度无影响,因为只要定容时正确,至于水是原来就
第5页/共15页
学科网(北京)股份有限公司有的还是后来加入的,对浓度无影响,故C错误;
D.定容时俯视容量瓶刻度线,导致溶液体积偏小,溶液浓度偏高,故D正确。
故选D。
【点睛】根据C =n /V可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n 和溶液的体积V
B B B
引起的。误差分析时,关键要看配制过程中引起n 和V怎样的变化。在配制一定物质的量浓度溶液时,若
B
n 比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n 比理论值大,或V比理论值小时,
B B
都会使所配溶液浓度偏大。
12. 如图所示实验装置,烧瓶内充满氯气,底部有一层细沙(不参与反应),玻璃导管下口b处塞有一小块钠。从
a口伸入一根细铁丝把钠块捅下去,再用滴管从a口滴下一滴水,恰好落在钠块上,立即剧烈反应。下列对此实
验的说法中,不正确的是
A. 所充氯气应用向上排空气法收集
B. 反应中,烧瓶内产生大量白色烟雾
C. 玻璃导管只起到定位加入钠和水的作用
D. 烧瓶中Cl,可能参与四个氧化还原反应
2
【答案】C
【解析】
【详解】A、氯气的密度比空气的密度大,通常条件不与氧气等反应,故选择向上排空气法收集,故 A正
确;
B、钠与水反应放出大量的热使钠与氯气反应生成氯化钠固体颗粒,有HCl生成,与水蒸气结合,故为白
色烟雾,故B正确;
C、反应导致气体的物质的量减小,玻璃导管可以平衡烧瓶内外压强,防止发生危险,故C错误;
D、滴加水,钠与水反应生成氢氧化钠和氢气,氯气可以与钠反应、氯气与水反应、氯气与氢氧化钠反应、
氯气与氢气反应,都属于氧化还原反应,故D正确;
故选C。
13. 短周期主族元素X、Y、Z、W、R的原子序数依次增大,其中前四种元素原子的最外层电子数之和为
14。X与其他元素不在同一周期,Z是短周期中金属性最强的元素,Y 与W在同一主族。下列说法不正确
的是
第6页/共15页
学科网(北京)股份有限公司A. 原子半径:XW
C. 最高价氧化物对应水化物的酸性:WO2—> Na+
(3) ①. NaO、NaO ②. ③. 离子键、共价键
2 2 2
(4) ①. Cl ②. bd
【解析】
【分析】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W与Y同族,且Y的原子序数是W的
2倍,则W为O元素、Y为S元素;Z的原子序数最大,故Z为Cl元素;X的原子核外电子层数是其最外
层电子数的3倍,则X为Na元素。
【小问1详解】
氧元素位于元素周期表中的位置为第二周期VIA族,故答案为:第二周期VIA族;
【小问2详解】
电子层结构相同的离子,核电荷数越大,离子半径越小,同主族元素,从上到下离子半径依次增大,则氧
离子、硫离子和钠离子的离子半径的大小顺序为S2—>O2—> Na+,故答案为:S2—>O2—> Na+;
【小问3详解】
钠元素和氧元素可以形成离子化合物氧化钠和过氧化钠,摩尔质量大的过氧化钠中含有离子键和共价键,
电子式为 ,故答案为:NaO、NaO; ;离子键、共价键;
2 2 2
【小问4详解】
同周期元素,从左到右元素的非金属性减弱,则硫元素非金属性弱于硫元素;
a.常温时非金属元素单质的物理性质与非金属性强弱无关,不能说明非金属性强弱,故错误;
b.元素的非金属性越强,简单气态氢化物越稳定,氯化氢的稳定性强于硫化氢说明氯元素的非金属性强
于硫元素,故正确;
c.元素的非金属性越强,最高价氧化物对应水化物的酸性越强,但氧化物对应水化物的酸性与非金属性
强弱无关,如硫酸为强酸,而次氯酸为弱酸,故错误;
d.单质的氧化性越强,其对应还原产物的简单离子的还原性越弱,所以硫离子的还原性强于氯离子说明
氯气的氧化性强于硫,氯元素的非金属性强于硫元素,故正确;
故选bd。
第12页/共15页
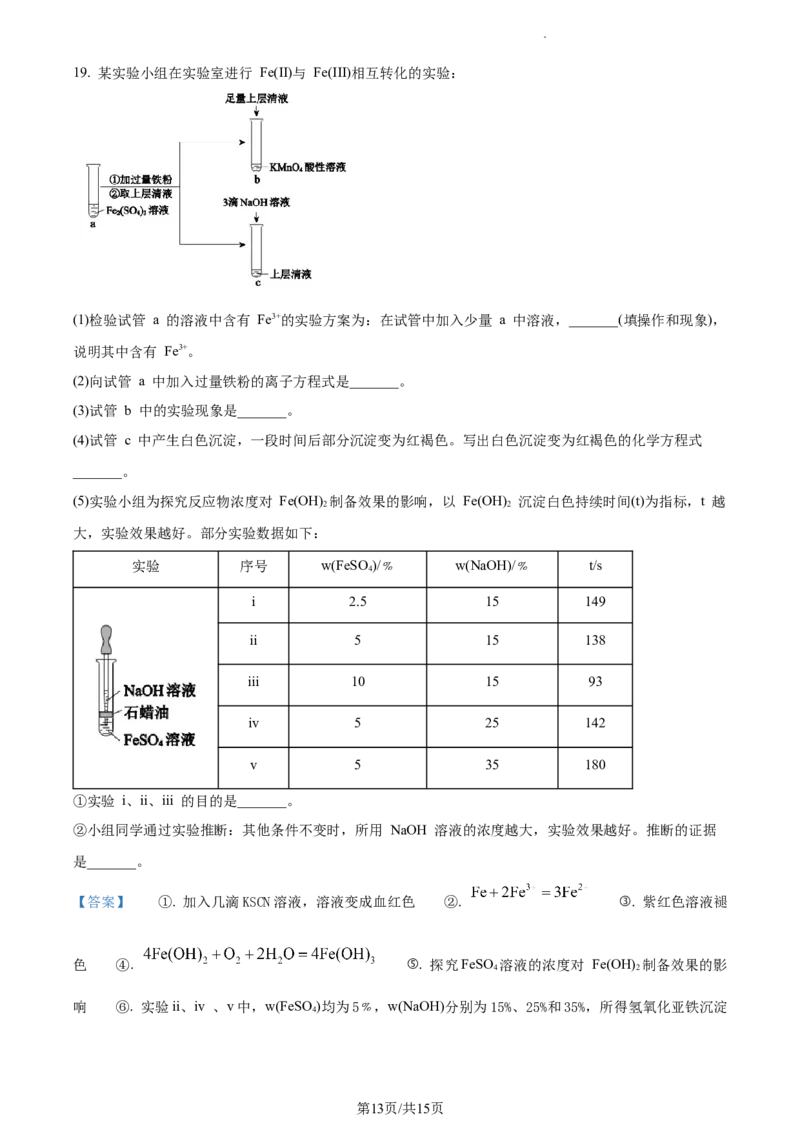
学科网(北京)股份有限公司19. 某实验小组在实验室进行 Fe(II)与 Fe(III)相互转化的实验:
(1)检验试管 a 的溶液中含有 Fe3+的实验方案为:在试管中加入少量 a 中溶液,_______(填操作和现象),
说明其中含有 Fe3+。
(2)向试管 a 中加入过量铁粉的离子方程式是_______。
(3)试管 b 中的实验现象是_______。
(4)试管 c 中产生白色沉淀,一段时间后部分沉淀变为红褐色。写出白色沉淀变为红褐色的化学方程式
_______。
(5)实验小组为探究反应物浓度对 Fe(OH) 制备效果的影响,以 Fe(OH) 沉淀白色持续时间(t)为指标,t 越
2 2
大,实验效果越好。部分实验数据如下:
实验 序号 w(FeSO )/﹪ w(NaOH)/﹪ t/s
4
i 2.5 15 149
ii 5 15 138
iii 10 15 93
iv 5 25 142
v 5 35 180
①实验 i、ii、iii 的目的是_______。
②小组同学通过实验推断:其他条件不变时,所用 NaOH 溶液的浓度越大,实验效果越好。推断的证据
是_______。
【答案】 ①. 加入几滴KSCN溶液,溶液变成血红色 ②. ③. 紫红色溶液褪
色 ④. ⑤. 探究FeSO 溶液的浓度对 Fe(OH) 制备效果的影
4 2
响 ⑥. 实验ii、iv 、v中,w(FeSO )均为5﹪,w(NaOH)分别为15%、25%和35%,所得氢氧化亚铁沉淀
4
第13页/共15页
学科网(北京)股份有限公司白色持续时间分别为138s、142s和180s,说明其他条件不变时,所用 NaOH 溶液的浓度越大,实验效果
越好。
【解析】
【详解】(1)检验试管 a 的溶液中含有 Fe3+的实验方案为:在试管中加入少量 a 中溶液,加入几滴KSCN
溶液,溶液变成血红色,说明其中含有 Fe3+。
是
(2)向试管 a 中加入过量铁粉,铁与Fe3+反应生成Fe2+,离子方程式 。
(3)试管 b 中,足量的硫酸亚铁溶液和酸性高锰酸钾溶液发生氧化还原反应,生成硫酸铁、硫酸锰和水,
酸性高锰酸钾溶液完全消耗,则实验现象是紫红色溶液褪色。
(4)试管 c 中硫酸亚铁溶液和氢氧化钠溶液反应产生白色沉淀氢氧化亚铁,一段时间后部分沉淀变为红褐
色的氢氧化铁沉淀。白色沉淀变为红褐色的化学方程式为 。
(5)①实验 i、ii、iii中,w(NaOH)均为15﹪,w(FeSO )不同,则目的是探究FeSO 溶液的浓度对 Fe(OH)
4 4 2
制备效果的影响;
②小组同学通过实验推断:其他条件不变时,所用 NaOH 溶液的浓度越大,实验效果越好。推断的证据
是:实验ii、iv 、v中,w(FeSO )均为5﹪,w(NaOH)分别为15%、25%和35%,所得氢氧化亚铁沉淀白色持
4
续时间分别为138s、142s和180s,说明其他条件不变时,所用 NaOH 溶液的浓度越大,实验效果越好。
第14页/共15页
学科网(北京)股份有限公司第15页/共15页
学科网(北京)股份有限公司