文档内容
决胜新高考——2024 届高三年级大联考
化 学
注 意 事 项
考生在答题前请认真阅读本注意事项及各题答题要求
1.本试卷共6页。满分为100分,考试时间为75分钟。考试结束后,请将答题卡交回。
2.答题前,请您务必将自己的姓名、学校、考试号等用书写黑色字迹的0.5毫米签字笔填写在答
题卡上规定的位置。
3.请认真核对监考员在答题卡上所粘贴的条形码上的姓名、准考证号与本人是否相符。
4.作答选择题,必须用2B铅笔将答题卡上对应选项的方框涂满、涂黑;如需改动,请用橡皮擦干
净后,再选涂其他答案。作答非选择题,必须用0.5 毫米黑色墨水的签字笔在答题卡上的指定
位置作答,在其他位置作答一律无效。
5.如需作图,必须用2B铅笔绘、写清楚,线条、符号等须加黑、加粗。
可能用到的相对原子质量:H 1 C 12 N 14 O 16
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
....
1.2024年政府工作报告中的新质生产力涉及新材料产业。下列材料不属于新型无机非金属材料的是
...
A.重组蛋白 B.碳纳米材料 C.单晶硅 D.石英光导纤维
2.侯氏制碱法原理为NH +CO +NaCl+H O=NH Cl+NaHCO ↓。下列说法正确的是
3 2 2 4 3
A.基态碳原子价电子排布式:1s22s22p2 B.H O为极性分子
2
H
C.NH
4
Cl的电子式:[H N H]+Cl- D.NaHCO
3
为共价晶体
H
3.臭氧(O )在[Fe(H O) ]2+催化下能将烟气中的 SO 、NOx分别氧化为 SO2-和 NO-。下列关于
3 2 6 2 4 3
N、O、S、Fe 元素及其化合物的说法正确的是
A.原子半径:N>O>S B.第一电离能:I (N)>I (O)>I (S)
1 1 1
C.标准大气压下沸点:H S>H O>NH D.1 mol [Fe(H O) ]2+含有σ键数目为12 mol
2 2 3 2 6
4.N H ·H O是一种重要的精细化工原料,易溶于水,沸点较低,具有强还原性,其制备原理为
2 4 2
2NH +NaClO=N H ·H O+NaCl。下列实验装置和操作不能达到实验目的的是
3 2 4 2 ..
氨水
NH
3
NaClO
HO
2 溶液
甲 乙 丙 丁
A.用甲装置制备NH B.用乙装置制备氨水
3
C.用丙装置制备N H ·H O D.用丁装置提纯N H ·H O
2 4 2 2 4 2
决胜新高考——2024届高三年级大联考(化学) 第1页(共6页)
{{##{{QQQQAABBSQQQQSQ8xgggiwiAgAJIaJAACAZB4hqCBAUQl00CAACqAQGsQIEkjBJACCoECxKQoCGHAuAAARALsyAIAFIBBiBIAF=A}#B}AA=}#}阅读下列资料,完成5~7题:
碳元素被誉为“生命的核心元素”。
e-
e-
电极A 电极B 电极C 电极D
OH- NH H NH 2 4 2 2 4
O 2 N 2 H 2 O N 2
甲 乙
决胜新高考——2024届高三年级大联考(化学) 第2页(共6页)
12C
6
、 13C
6
和14C是碳元素3种常见的核素,由于碳原子通过单键、
6
双键、三键等形式成键,形成了数目繁多的有机物。CO 是常见的含碳化合物,近年来由于温室效应
2
日益加剧,科学家提出了很多利用 CO 制取有机物的新手段。CO 不仅可以和 H 反应生成 CH OH,
2 2 2 3
还可以在电解条件下生成C H 、HCOOH、CH 、尿素[CO(NH ) ]等多种物质。
2 4 4 2 2
5.下列说法正确的是
A. 12C
6
O
2
、 13C
6
O
2
和14CO 属于同素异形体
6 2
B.HCOOH分子中的化学健均为极性共价键
C.CO 转化为有机物一定发生了还原反应
2
D.C H 、HCOOH、CH 中碳原子的杂化轨道类型相同
2 4 4
6.下列化学反应表示不正确的是
...
A.由HCO-生成CH 的电极反应式为HCO-+8e-+8H+=CH ↑+2H O
3 4 3 4 2
B.NH 和CO 反应生成尿素:2NH +CO =CO(NH ) +H O
3 2 3 2 2 2 2
C.载人航天器内,用LiOH固体吸收过量CO :LiOH+CO =LiHCO
2 2 3
D.CH 与CO 重整制氢:CH +CO
4 2 4 2
催 化 剂
2CO+2H
2
7.下列物质结构与性质或物质性质与用途具有对应关系的是
A.CO 是非极性分子,可作为制冷剂
2
B.CH 的空间结构是正四面体,可用作燃料
4
C.CO 具有氧化性,可制备尿素
2
D.HCOOH由于H-O键电子云密度比H CO 小,所以酸性更强
2 3
8.抗氧化剂香豆酰缬氨酸乙酯(Z)可由下列反应制得
下列说法不正确的是
...
A.该反应是取代反应 B.1 mol X 最多可以消耗 4 mol H
2
C.1 mol Z 最多可以消耗 3 mol NaOH D.Z分子存在2个手性碳原子
9.利用CoP催化剂可实现肼氧化辅助制氢,下列有关叙述正确的是
A.图中甲池是电解池,乙池是原电池
B.电极C附近溶液pH下降
C.制得1 mol H 的同时可制得1 mol N 2 2
D.该装置可实现N H 循环制氢
2 4
{{##{{QQQQAABBSQQQQSQ8xgggiwiAgAJIaJAACAZB4hqCBAUQl00CAACqAQGsQIEkjBJACCoECxKQoCGHAuAAARALsyAIAFIBBiBIAF=A}#B}AA=}#}题13图
决胜新高考——2024届高三年级大联考(化学) 第3页(共6页)
lom/量的质物
33
2 2
1100
.5.0
.5 .0
.5.0.5.0
3 0
A
B
C
0 4 0 0
D
5 0温 0
度
(5 0 5
E
6 0 0
/
,1 .3 5
7
)
0 0
10.烟气中的SO 可以在催化剂作用下被CH 还原为S:CH (g)+2SO (g)=2S(g)+CO (g)+2H O(g),
2 4 4 2 2 2
下列说法正确的是
c 2 (S)·c (CO )
A.该反应的ΔS<0 B.该反应的平衡常数 K = 2
c (CH
4
)·c 2 (SO
2
)
C.反应每生成1 mol S,消耗22.4 LSO D.适当升高温度能提高催化剂的活性
2
11.室温下,下列实验探究方案能达到探究目的的是
选项 探究方案 探究目的
A 向盛有KMnO 溶液的试管中通入SO ,观察溶液颜色变化 SO 具有漂白性
4 2 2
向盛有5 mL 0.005 mol·L-1FeCl 溶液的试管中加入5 mL 0.015 mol·L-1 反应物浓度影响
3
B
KSCN溶液,再加入少量铁粉,振荡,观察溶液颜色变化 化学平衡
C 向乙醇中滴加少量酸性KMnO 溶液,振荡,观察溶液颜色变化 乙醇具有氧化性
4
在 CaCO 中加入浓醋酸,并将反应后的气体直接通入苯酚钠溶液中,
3
D 酸性:碳酸>苯酚
观察现象
12.草酸亚铁(FeC O )是生产磷酸铁锂电池的原料,实验室可通过如下反应制取:
2 4
已知室温时:Ka (H C O )=5.6×10-2、Ka (H C O )=1.5×10-4、 K (FeC O )=2.1×10-7。
1 2 2 4 2 2 2 4 sp 2 4
下列说法正确的是
A.酸化、溶解后的溶液中存在:2c(Fe2+)+c(NH+)=2c(SO2-)
4 4
B.室温下,0.1 mol·L-1 NaHC O 溶液中存在:c(C O2-)<c(H C O )
2 4 2 4 2 2 4
C.向稀硫酸酸化的KMnO 溶液中滴加Na C O 溶液至溶液褪色,反应的离子方程式为:
4 2 2 4
5C O2-+2MnO-+8H O=10CO ↑+2Mn2++16OH-
2 4 4 2 2
D.室温时反应Fe2++H C O =FeC O ↓+2H+的平衡常数K=40
2 2 4 2 4
13.二氧化碳加氢制甲烷过程中的主要反应为
I CO (g)+4H (g)=CH (g)+2H O(g) ΔH<0
2 2 4 2
II CO (g)+H (g)=CO(g)+H O(g) ΔH>0
2 2 2
在密闭容器中,1.01×105 Pa、n (CO )=1 mol、n (H )=4 mol时,平衡后反应体系中各物质
起始 2 起始 2
的物质的量随温度的变化如题13图所示。
n (CH ) CH 的选择性可表示为 生成 4 ×100%。 4 n (CO ) 反应 2
下列说法不正确的是
...
A.CH 的物质的量的曲线为B 4
B.CO的平衡选择性随着温度的升高而增加
C.在505℃,反应Ⅱ的平衡常数K=0.16
D.CO 平衡转化率随温度的上升先下降后上升
2
{{##{{QQQQAABBSQQQQSQ8xgggiwiAgAJIaJAACAZB4hqCBAUQl00CAACqAQGsQIEkjBJACCoECxKQoCGHAuAAARALsyAIAFIBBiBIAF=A}#B}AA=}#}题14图
决胜新高考——2024届高三年级大联考(化学) 第4页(共6页)
Lm/积体H
2
0 .2 5 m o
2
时
l·L
.5 m
间
-
o
/m
1
l·L
in
- 1
二、非选择题:共4题,共61分。
14.(15分)硼氢化钠(NaBH )是一种理想的储氢材料。
4
(1)NaBH 的制备
4
碱性条件下,电解偏硼酸钠(NaBO )溶液可制备NaBH 。总反应式为
2 4
NaBO +2H O=NaBH +2O ↑ 已知:电负性B<H。
2 2 4 2
①写出阴极的电极反应式: ▲ 。
②研究表面上述反应为间接还原反应,包括2步反应,请描述出这2步反应的合理假设: ▲ 。
(2)NaBH 的性质
4
常温下,NaBH 在水溶液中将发生水解反应生成H ,NaBH 的半衰期(NaBH 水解掉一半所耗
4 2 4 4
费的时间,用t 表示)与溶液pH、温度(T)的关系如下:lg t =pH-(0.034 T-1.92)。
1/2 1/2
①写出NaBH 在水溶液发生水解反应的化学方程式: ▲ 。
4
②给出保存NaBH 水溶液的2点建议: ▲ 。
4
(3)NaBH 的运用
4
第四周期过渡金属及其化合物是催化NaBH 水解产氢的良好催化剂。
4
①Ag-铁基纳米颗粒催化剂可催化硼氢化钠水解制氢。相同条件下,控制 NaBH 浓度相等,
4
改变其中稳定剂NaOH的浓度,测得NaOH浓度对催化活性的影响如题14图所示。NaOH浓
度相对过大催化活性下降的原因可能是 ▲ 。
②相同条件下,FeSO 、CoCl 、NiCl 催化NaBH 水解制氢性能对比如下:
4 2 2 4
FeSO CoCl NiCl 4 2 2
金属d电子数 6 7 8
反应活化能/ kJ·mol-1 52.01 46.33 58.70
产氢速率 最慢 最快 较慢
根据表格,写出你所得到的结论: ▲ 。
15.(15分)化合物F用于治疗甲癣,其合成路线如下:
Cl Cl
O N NH
Cl
F 1) CH 3 CH 2 MgBr HO F 浓H 2 SO 4 F N
2) H+,
NaH,
D
F F F
A B C
N
H 2 O 2 ,H 2 SO 4 N F
F
E
N
N
HN N
HO F
LiClO
4
F
F
N
{{##{{QQQQAABBSQQQQSQ8xgggiwiAgAJIaJAACAZB4hqCBAUQl00CAACqAQGsQIEkjBJACCoECxKQoCGHAuAAARALsyAIAFIBBiBIAF=A}#B}AA=}#}(1)B分子中碳原子的杂化轨道类型为 ▲ 。
(2)D的结构简式为 ▲ 。
(3)写出同时满足下列条件的A的一种同分异构体的结构简式: ▲ 。
分子中含有3种不同化学环境的氢原子;能发生银镜反应;分子中含有一个手性碳原子。
(4)E→F的副产物与F互为同分异构体,写出该副产物的结构简式: ▲ 。
(5)已知:①
题16图
决胜新高考——2024届高三年级大联考(化学) 第5页(共6页)
C H C l2
H +
C H O
;②
O O
N a O H
O
。
写出以CH MgBr和
3
C
C
H
H
3
3
为原料制备
O
C H
3
的合成路线流程图(无机试剂和有机溶剂
任用,合成路线流程图示例见本题题干)。
16.(16分)硫酸羟胺[(NH OH) SO ]是一种重要的化工原料,呈白色粉末状,可溶于水。一种利用氨
3 2 4
法烟气脱硫中生成的亚硫酸氢铵制备环己酮肟的过程如下:
S O
2
N H
4
N O
反
2
N
应
H
4
H S O
3
浓 缩
X
肟 化 反 应
O
( N
分
H
离
)
4 2
S O
4
N O H
已知:①环己酮( O )和羟胺(NH OH)反应生成环己酮肟(
2
N O H )称为肟化反应;
②环己酮肟能溶于水,难溶于(NH ) SO 浓溶液。
4 2 4
(1)“反应”中生成(NH OH) SO ,若n(SO )∶n(NH HSO )=1∶1,写出该反应的离子方程式
3 2 4 2 4 3
▲ 。
(2)浓缩的目的有:①防止在后续蒸发浓缩制硫酸铵时耗能过多;② ▲ ;③ ▲ 。
(3)“肟化反应”中还需通入气体X,写出X的化学式: ▲ 。
(4)“分离”的操作名称为: ▲ 。
(5)环己酮肟在酸性条件下水解可实现脱肟。实验小组利用
题 16 图装置进行环己酮肟的脱肟并制备硫酸羟胺。补充
完整制取硫酸羟胺的实验方案:在三颈烧瓶中分别加入一
定量环己酮肟、蒸馏水和硫酸, ▲ ,萃取相经气相色
谱分析环己酮肟的转化率较高后, ▲ ,即可得到硫酸
羟胺粗品。(实验中需要使用的试剂、仪器:甲苯、Ba(OH)
2
溶液、蒸馏水、pH计)
控
硫
温
酸
水 浴
磁 力 加 热 搅 拌
冷
器
凝 管
三
水
颈 烧 瓶
{{##{{QQQQAABBSQQQQSQ8xgggiwiAgAJIaJAACAZB4hqCBAUQl00CAACqAQGsQIEkjBJACCoECxKQoCGHAuAAARALsyAIAFIBBiBIAF=A}#B}AA=}#}题17图-1
决胜新高考——2024届高三年级大联考(化学) 第6页(共6页)
N电极
(C
N
i
) E
2
熔 融 盐
N
:
H N 3
3 N
3 N
、 L iC l
H 3
、 K C l C sC l
H 2
N电极
(W
i
E )
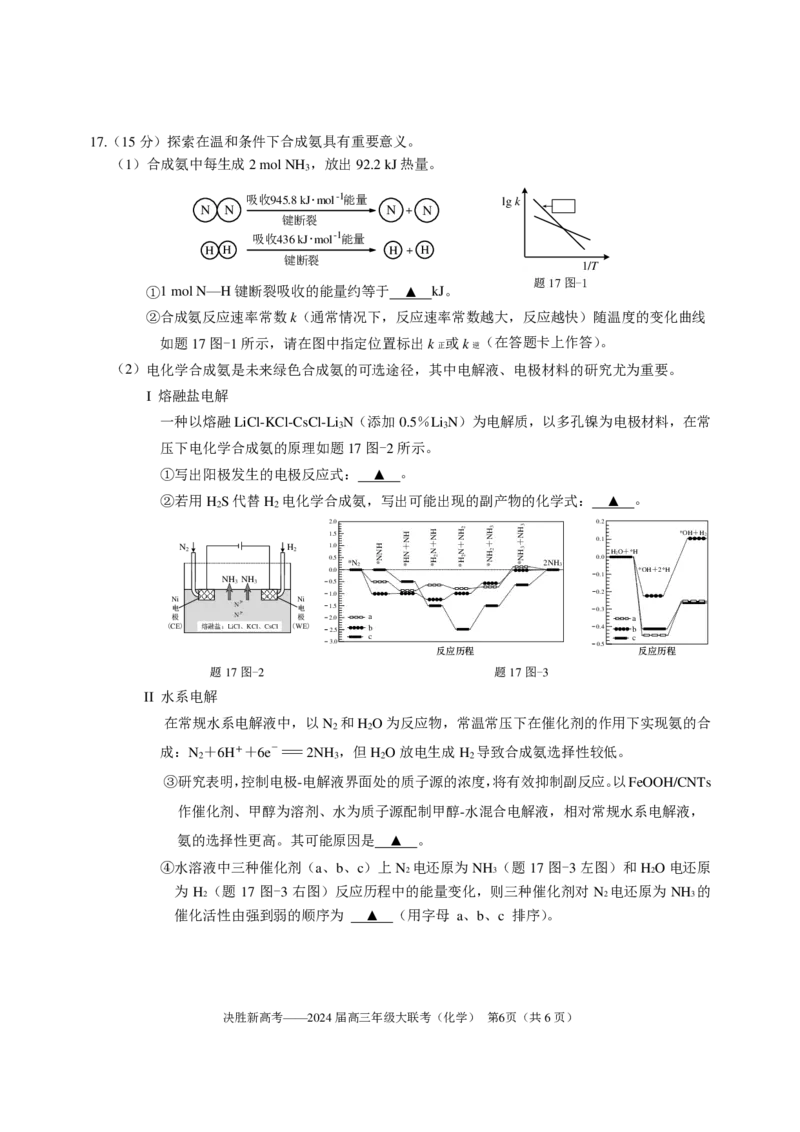
17.(15分)探索在温和条件下合成氨具有重要意义。
(1)合成氨中每生成2 mol NH
3
,放出92.2 kJ热量。
吸收945.8 kJ· mol - 1 能量 lg k
N N N + N
键断裂
吸收436 kJ· mol - 1 能量
H H H + H
键断裂
1/T
①1 mol N—H键断裂吸收的能量约等于 ▲ kJ。
②合成氨反应速率常数k(通常情况下,反应速率常数越大,反应越快)随温度的变化曲线
如题17图-1所示,请在图中指定位置标出k 或k (在答题卡上作答)。
正 逆
(2)电化学合成氨是未来绿色合成氨的可选途径,其中电解液、电极材料的研究尤为重要。
I 熔融盐电解
一种以熔融LiCl-KCl-CsCl-Li N(添加0.5%Li N)为电解质,以多孔镍为电极材料,在常
3 3
压下电化学合成氨的原理如题17图-2所示。
①写出阳极发生的电极反应式: ▲ 。
②若用H S代替H 电化学合成氨,写出可能出现的副产物的化学式: ▲ 。
2 2
2.0 0.2
1 1 0 0 . . . . 5 0 0 5 *N2 H N N * + H N N H * + H N N H * 2 + H N N H * 2 2 + H N H N * 3 2 + H N H N * 3 3 2NH3 0 0. . 0 1 H2O+*H *OH+2*H *OH+H2
0.1 0.5
1.0 0.2
1.5 0.3
2.0 a a
2.5 b 0.4 b
c c
3.0 0.5
反应历程 反应历程
题17图-2 题17图-3
II 水系电解
在常规水系电解液中,以N 和H O为反应物,常温常压下在催化剂的作用下实现氨的合
2 2
成:N +6H++6e-=2NH ,但H O放电生成H 导致合成氨选择性较低。
2 3 2 2
③研究表明,控制电极-电解液界面处的质子源的浓度,将有效抑制副反应。以FeOOH/CNTs
作催化剂、甲醇为溶剂、水为质子源配制甲醇-水混合电解液,相对常规水系电解液,
氨的选择性更高。其可能原因是 ▲ 。
④水溶液中三种催化剂(a、b、c)上N 电还原为 NH (题 17 图-3左图)和HO 电还原
2 3 2
为 H (题 17 图-3 右图)反应历程中的能量变化,则三种催化剂对 N 电还原为 NH 的
2 2 3
催化活性由强到弱的顺序为 ▲ (用字母 a、b、c 排序)。
{{##{{QQQQAABBSQQQQSQ8xgggiwiAgAJIaJAACAZB4hqCBAUQl00CAACqAQGsQIEkjBJACCoECxKQoCGHAuAAARALsyAIAFIBBiBIAF=A}#B}AA=}#}决胜新高考——2024 届高三年级大联考
化学参考答案及评分建议
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
....
题号 1 2 3 4 5 6 7
答案 A B B C B A D
题号 8 9 10 11 12 13
答案 D C D B D C
二、非选择题:共4题,共61分。
14.
(1)① BO-+6H O+8e-=BH-+8OH-(2分)
2 2 4
② 第1步:H O在阴极电解产生H ;第2步:生成的H 再与BO-反应生成BH-(3分)
2 2 2 2 4
(2)① NaBH +2H O=NaBO +4H ↑(2分)
4 2 2 2
② 低温、强碱性溶液 (2分)
(3)① OH-占据了催化剂的表面,减少活性位点与NaBH 的接触,导致放氢速率减慢(3分)
4
② 催化活性与金属的d电子数有关;产氢速率与反应活化能之间没有必然联系 (3分)
(本题共 15 分)
15.
(1)sp2,sp3(2分)
(2)
高三化学(答案) 第1页(共2页)
F
F
(2分)
Cl
F C CHO
(3) (3分)
F
(4) (3分)
F
F
{{##{{QQQQAABBSQQQQSQ8xgggiwiAgAJIaJAACAZB4hqCBAUQl00CAACqAQGsQIEkjBJACCoECxKQoCGHAuAAARALsyAIAFIBBiBIAF=A}#B}AA=}#}(5)
OH
CH 3 Cl 2 CHCl 2 H+ CHO 1) CH 3 MgBr CHCH 3
CH 3 CHCl 2 CHO 2) H+, CHCH
3
OH
O
O
O 2 CCH 3 NaOH
Cu, CCH
3
CH
O 3
(5分)
(本题共 15 分)
16.
(1)NO-+HSO-+SO +2H O=NH OH++2SO2-+ H+(3分)
2 3 2 2 3 4
(2)增大后续肟化反应的速率 减少环己酮肟在后续稀硫酸铵溶液中的溶解损失(各2分)
(3)NH (2分)
3
(4)过滤(2分)
(5)加热,充分反应,用甲苯萃取反应液
萃余水相转移至烧杯中,加Ba(OH) 溶液,同时用pH计测量萃余水相的pH,直至约为7.0
2
后,过滤,用蒸馏水洗涤,将洗涤液与滤液合并,蒸发、浓缩、结晶 (5分)
(本题共 16 分)
17.
(1)① 391 (2分)
② k
逆
(2分)
(2)① 2N3-+3H
2
-6e-=2NH
3
(3分)
② NiS(或NiS 、S)(2分)
2
③ 甲醇分子的供质子能力比水分子差(甲基为推电子基,削弱了羟基的极性),使电极-电
解液界面处的质子源浓度减小抑制了副反应;甲醇-水分子间的氢键作用阻碍了水分子解
离过程,也抑制了副反应 (3分)
④ b a c (3分)
(本题共 15 分)
注:合理答案均参照给分!
高三化学(答案) 第2页(共2页)
{{##{{QQQQAABBSQQQQSQ8xgggiwiAgAJIaJAACAZB4hqCBAUQl00CAACqAQGsQIEkjBJACCoECxKQoCGHAuAAARALsyAIAFIBBiBIAF=A}#B}AA=}#}