文档内容
余姚中学 2024 学年第一学期质量检测高二化学试卷
命题:潘爱萍 审题:俞印坤
本试题卷分选择题和非选择题两部分,满分 100分,考试时间 90分钟。
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Mg:24 Al:27 Ca:40 Cl:35.5 Fe:56 Cu:64
一、单选题:本大题共25小题,共50分。
.下列属于强电解质的是
1 ( )
A
2.
.
下
HF
列水溶液因水解呈酸性
B.
的
是
4 C. 2 D. ( )3
A.HCOONa B.NaHSO C.AlCl D.NaHCO
4 3 3
3.下列化学反应属于放热反应的是
①浓硫酸的稀释 ②工业合成氨 ③NaHCO 溶液中加盐酸 ④氢氧化钡晶体与氯化铵混合
3
⑤ 溶于水 ⑥ 在高温条件下与 的反应 ⑦酸碱中和反应
②⑤⑥⑦ ②⑥⑦ ①②③⑤⑦ 全部
CaO Al 2 3
.下列有关金属的腐蚀和防护说法正确的是
A. B. C. D.
当镀锡铁皮的镀层破损时,减慢铁的腐蚀速率
4
外加电源阴极保护法常用于海堤钢闸门防腐,被保护的钢铁设备作为阳极
A.
铜铁交接处,在潮湿的空气中直接发生反应: ,继而形成铁锈
B.
石油管道常常通过连接一块锌块以达到防腐的作用 − 3+
C. −3 =
.下列溶液一定呈中性的是
D.
的溶液 纯水
5
使石蕊试液呈紫色的溶液 酸与+碱恰好−完6全反应生成正盐的溶液
A. =7 B. ( )= 10 /
. ⇌ 在不同情况下测得反应速率,其中反应速率最快的是
C. D.
6 ( )+3 ( ) 2 ( )+2 ( )
A. ( )=0.7 /( ⋅min) B. ( )=1.2 /( ⋅min)
7.下列说法正确的是
C. ( )=0.9 /( ⋅min) D. ( )=0.02 /( ⋅ )
A.已知 , ,则
B.中和热
2
的
(
测
)+
定
实
(
验
)
中
=
,
2
氢
(
氧
)
化
钠
1
分
<
批
0
加
入
2
,
(
反
)+
应
更
(
充
)=
分
,
2
测
(
定
)
的
中
2 <
和
0
热数值
误
1
差
<
更
小
2
C.已知: 的燃烧热为 ,则 时:
4 890.3 / 101 4( )+2 2( )= 2( )+2 2 ( ) =−
D. 、 下,将 和 置于密闭容器中充分反应生成 ,放热 ,则其
890.3 /
催化剂
热化50学0℃方程3式0 为 0.5 2 1.5 2 3( ) 19.3
高温高压
8.氨广泛应用于 化2工( 、)+化3肥 、2( 制)药⇌等领2域 , 3一( 种) 新 型=制−备38氨.6的 方/ 法 如下。下列说法正确的是
A.反应③为放热反应
B. 是该反应的催化剂
C.图中生成目标产物 的反应②为氧化还原反应
D.若生成 物质的量
为
3
,理论上消耗 为
3 2 2 22.4
第 页,共 页
1 89.下列事实或操作与不能用勒夏特列原理解释的是
新制的氯水在光照条件下颜色变浅 二氧化碳难溶于饱和碳酸氢钠溶液
、 平衡混合气体加压后颜色变深 实验室制取乙酸乙酯时,不断将乙酸乙酯蒸出
A. B.
.设 是阿伏加德罗常数的值,下列说法中正确的是
C. 2 2 4 D.
由 的 和氨水混合形成中性溶液中,含有 数目为
10
已知某温度下 , 的 溶液中 数目+为
A.1L 0.1 / 4 4 0.1
电解 −13 溶液,转移的电子数最多−为
B. =10 =12 NaOH 0.1
可水解形成−1 胶体粒子数目为
C. 200 0.5 ⋅ 3 0.1
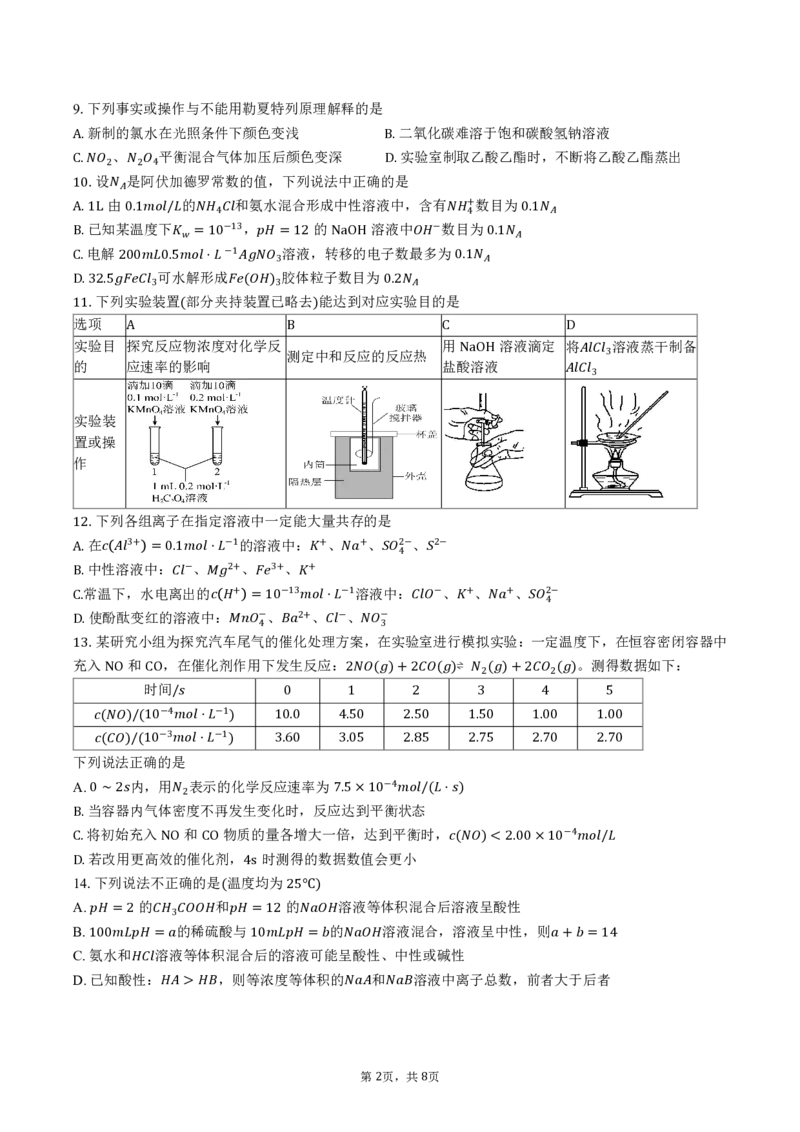
.下列实验装置 部分夹持装置已略去 能达到对应实验目的是
D.32.5 3 ( )3 0.2
选项
11 ( )
实验目 探究反应物浓度对化学反 用 溶液滴定 将 溶液蒸干制备
A B测定中和反应的反应热 C D
的 应速率的影响 盐酸溶液
NaOH 3
3
实验装
置或操
作
.下列各组离子在指定溶液中一定能大量共存的是
在 的溶液中: 、 、 、
12
中性溶3液+中: 、 −1、 、 + + 2− 2−
A. =0.1 ⋅ 4
常温下,水电离出− 的 2+ 3+ + 溶液中: 、 、 、
B.
使酚酞变红的溶液中:+ 、−13 、 −、1 − + + 2−
C. =10 ⋅ 4
.某研究小组为探究汽车尾气−的催化2+处理方−案,在−实验室进行模拟实验:一定温度下,在恒容密闭容器中
D. 4 3
充入 和 ,在催化剂作用下发生反应: ⇌ 。测得数据如下:
13
时间
NO CO 2 ( )+2 ( ) 2( )+2 2( )
/ 0 1 2 3 4 5
−4 −1
( )/(10 ⋅ ) 10.0 4.50 2.50 1.50 1.00 1.00
下列说法正确的−3是 −1
( )/(10 ⋅ ) 3.60 3.05 2.85 2.75 2.70 2.70
A. 内,用 表示的化学反应速率为
当容器内气体密度不再发生变化时,反应达到平衡−4状态
0∼2 2 7.5×10 /( ⋅ )
将初始充入 和 物质的量各增大一倍,达到平衡时,
B.
若改用更高效的催化剂, 时测得的数据数值会更小 −4
C. NO CO ( )<2.00×10 /
14.下列说法不正确的是 温度均为
D. 4s
A. 的 和 的 溶液等体积混合后溶液呈酸性
( 25℃)
B. =2 3 的 稀 硫 酸 与 =12 的 溶液混合,溶液呈中性,则
C.氨水和 溶液等体积混合后的溶液可能呈酸性、中性或碱性
100 = 10 = + =14
D.已知酸性: ,则等浓度等体积的 和 溶液中离子总数,前者大于后者
>
第 页,共 页
2 8.下列说法正确的是
增大反应物浓度,可增大活化分子百分数,从而使单位时间有效碰撞次数增多
15
通过改变条件使可逆反应正向移动,反应物的转化率一定增大
A.
对于气体反应,其他条件不变,增大压强反应速率加快,与活化分子百分数无关
B.
可逆反应,若总键能:反应物 生成物,则升高温度不利于提高反应物的平衡转化率
C.
.下列离子方程式书写正确的是
D. >
氯水呈酸性: ⇌
16
与 溶液反应的离子方+程式−: −
A. 2+ 2 2 + +
溶液水解: ⇌ − − −
B. +2 = + + 2
工业上用 溶液除− 铁锈的原因2−: + ⇌
C.NaHS + 2 + 3
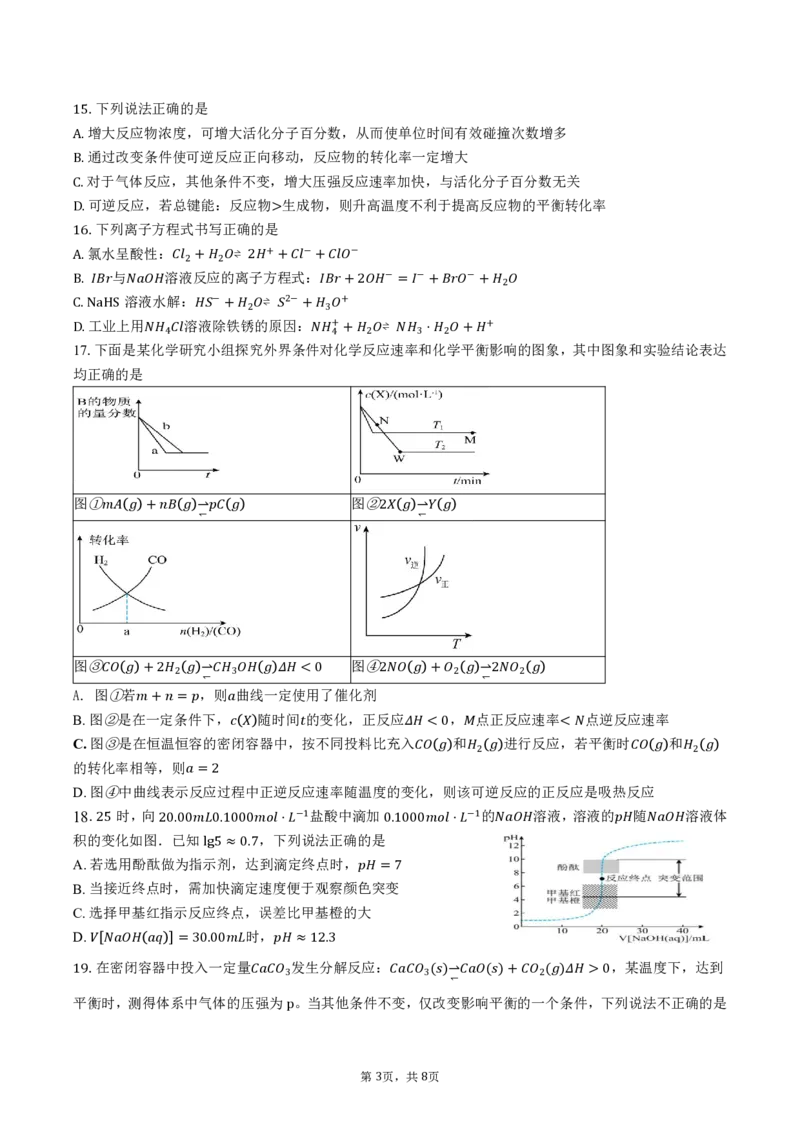
D 17 . .下面是某 化 学 4 研 究小组探究外界条件 对 4 +化 + 学 反 2 应速 率 3 和 ⋅ 化 2 学 平 + 衡 +影响的图象,其中图象和实验结论表达
均正确的是
图① 图②
+ ⇀↽ 2 ⇀↽
图③ 图④
A. 图 ① 若 +2 2 ,⇀↽ 则 3曲 线 一定 使<用0了催化剂2 + 2 ⇀↽2 2
B.图②是在一定条件下, 随时间 的变化,正反应 , 点正反应速率 点逆反应速率
+ =
C.图③是在恒温恒容的密闭容器中,按不同投料比充入 和 进行反应,若平衡时 和
<0 <
的转化率相等,则
2 2
D.图④中曲线表示反应过程中正逆反应速率随温度的变化,则该可逆反应的正反应是吸热反应
=2
18. 时,向 盐酸中滴加 的 溶液,溶液的 随 溶液体
积的变化如图.已知 ,下列−说1 法正确的是 −1
25 20.00 0.1000 ⋅ 0.1000 ⋅
A.若选用酚酞做为指示剂,达到滴定终点时,
lg5≈0.7
B.当接近终点时,需加快滴定速度便于观察颜色突变
=7
C.选择甲基红指示反应终点,误差比甲基橙的大
D. 时,
. 在 密 闭 容 器 中=投3入0.一00定 量 发≈生12分.3解反应: ,某温度下,达到
1平9衡时,测得体系中气体的压 强 为 3 。当其他条件不 变 , 仅 3(改 )变⇀↽ 影 响 (平 )衡+的 一 2(个 条) 件 ,>下0列说法不正确的是
p
第 页,共 页
3 8维持恒压 ,往密闭容器内充入少量 ,最终容器内 的质量为
扩大容器体积,重新达到平衡时 的压强一定小于
A. p He 3 0
升高温度,活化分子百分率增大,正反应速率增大,逆反应速率也增大
B. 2 p
当 的质量不再变化时,表明该反应重新达到了化学平衡状态
C.
D 20 . .短 周 期 3 主族元素 、 、 、 的原子序数依次增大。在如图所示的物质转化关系中, 、 、 、 分别
是元素 、 、 、 的气体单质, 和 均为有色气体, 的水溶液呈碱性。常温下, 溶液与
溶液的 均为 。下列说法不正确的是 −1
0.1 ·
A. 、 的−1最高价氧化物对应的水化物均为强酸
0.1 · 1
B.元素的非金属性: ,原子半径:
C. 和 恰好反应后的固体产物溶于水后,其溶液中水的电离程度增大
> > < <
D. 的 电子式可表示为
21. 次氯酸 和亚氯酸 是两种常见的弱酸,常温时 的 , 的
。现将 和体积都相同的次氯酸溶液和亚氯酸溶液分别加蒸馏水稀释, −随11溶液体积的变化如
( ) ( 2) =4.7×10 2 =
图所示。−下2 列叙述正确的是
1.1×10
A.曲线Ⅰ为次氯酸稀释时 变化曲线
B.取 点的两种酸溶液,中和相同体积、相同浓度的 溶液,消耗亚氯
酸的体积较小
C. 点溶液中水的电离程度比 点溶液中水的电离程度小
D. 从 点到 点,溶液中 保持不变 代表 或
−
( )
22.某 兴趣小 组用数字实 验( 系)⋅统 ( 测 − 定)一定浓度( 溶 液 的 与 温2)度的关系,得到如图所示曲线。下列说
法正确的是
2 3
A. 点阴离子总数最多
B. 点溶液去油污效果最好
C. 点 的水解程度最小
D. 温度 升 2 高 , 3 水的电离程度先增大后减小
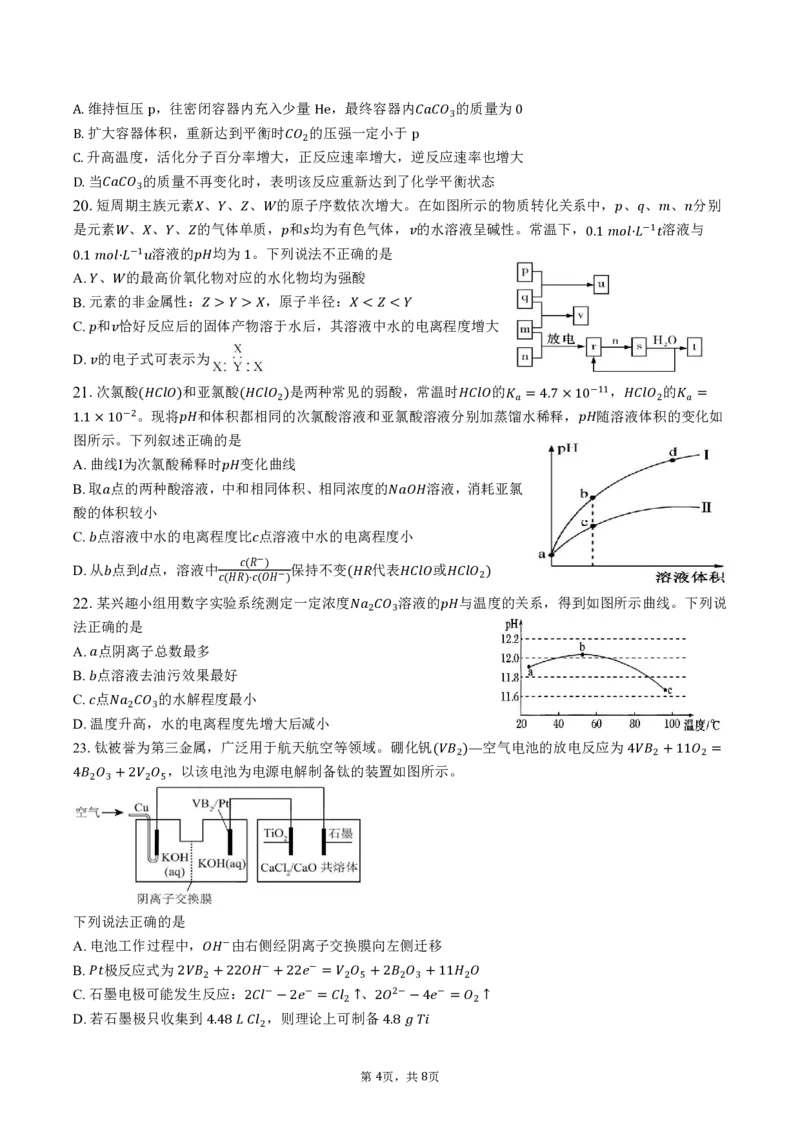
23.钛被誉为第三金属,广泛用于航天航空等领域。硼化钒 空气电池的放电反应为
,以该电池为电源电解制备钛的装置如图所示。
( 2)— 4 2+11 2 =
4 2 3+2 2 5
下列说法正确的是
A.电池工作过程中, 由右侧经阴离子交换膜向左侧迁移
B. 极反应式为 −
C. 石 墨电极可能发 2 生 反 2+ 应 2 : 2 − +22 − = 2 5 、 +2 2 3+11 2
D.若石墨极只收集到
2
−,
−
则
2
理
−论
=
上
可
2
制
↑
备
2
2−
− 4
−
= 2 ↑
4.48 2 4.8
第 页,共 页
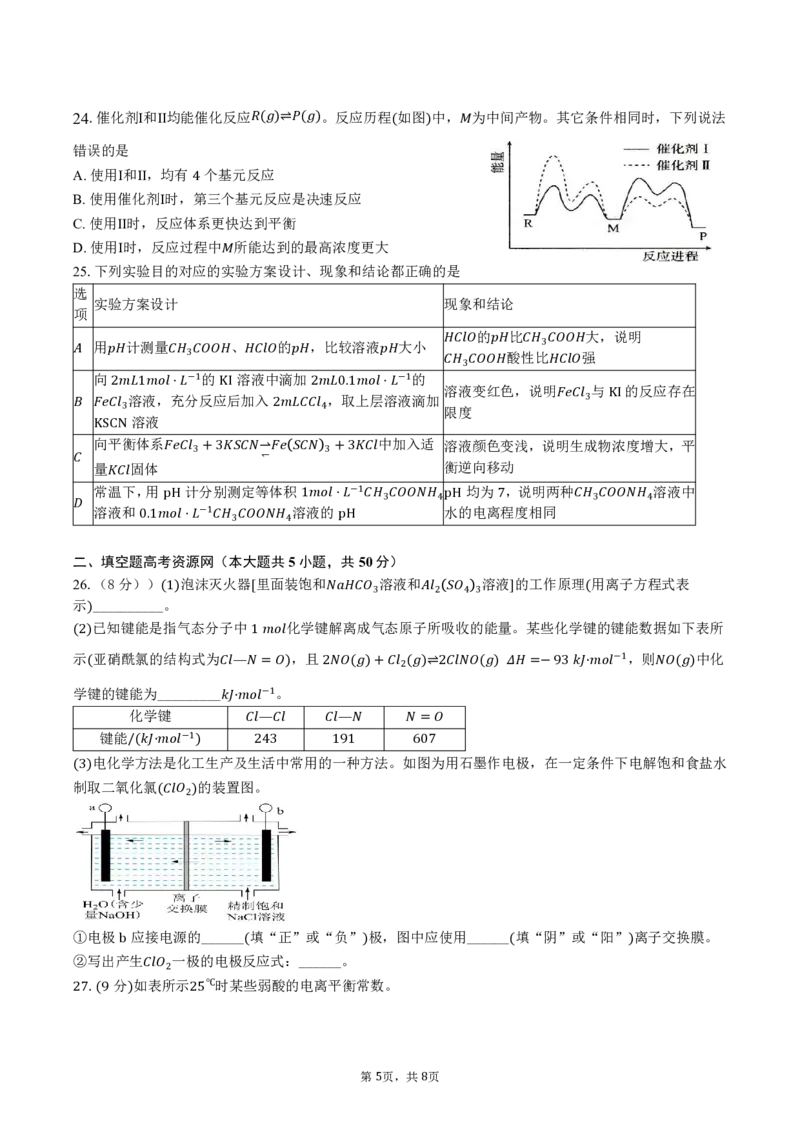
4 824.催化剂Ⅰ和Ⅱ均能催化反应 。反应历程 如图 中, 为中间产物。其它条件相同时,下列说法
错误的是 ( )⇌ ( ) ( )
A.使用Ⅰ和Ⅱ,均有 个基元反应
B.使用催化剂Ⅰ时,第三个基元反应是决速反应
4
C.使用Ⅱ时,反应体系更快达到平衡
D.使用Ⅰ时,反应过程中 所能达到的最高浓度更大
25.下列实验目的对应的实验方案设计、现象和结论都正确的是
选
实验方案设计 现象和结论
项
的 比 大,说明
用 计测量 、 的 ,比较溶液 大小
酸性比 强
3
向 3 的 溶 液 中 滴 加 的
溶 液3 变 红 色,说明 与 的反应存在
溶液,充分−1反应后加入 ,取上层溶液−1滴加
2 1 ⋅ KI 2 0.1 ⋅ 限度
溶液 3 KI
3 2 4
向平衡体系 中加入适 溶液颜色变浅,说明生成物浓度增大,平
KSCN
量 固体 3+3 ⇀↽ 3+3 衡逆向移动
常温下,用 计分别测定等体积 均为 ,说明两种 溶液中
溶液和 溶液的 −1 水的电离程度相同
pH 1 ⋅ 3 4pH 7 3 4
−1
0.1 ⋅ 3 4 pH
二、填空题高考资源网(本大题共5小题,共50分)
26.(8分)) 泡沫灭火器 里面装饱和 溶液和 溶液 的工作原理 用离子方程式表
示 __________。
(1) [ 3 2 4 3 ] (
已知键能是指气态分子中 化学键解离成气态原子所吸收的能量。某些化学键的键能数据如下表所
)
(示2)亚硝酰氯的结构式为 1 ,且 ,则 中化
−1
学键( 的键能为_________ — = 。) 2 ( )+ 2( )⇌2 ( ) =−93 · ( )
化学键 −1
·
键能
— — =
电化学方法是化−1工生产及生活中常用的一种方法。如图为用石墨作电极,在一定条件下电解饱和食盐水
/( · ) 243 191 607
制取二氧化氯 的装置图。
(3)
( 2)
①电极 应接电源的______ 填“正”或“负” 极,图中应使用______ 填“阴”或“阳” 离子交换膜。
②写出产生 一极的电极反应式:______。
b ( ) ( )
. 分 如表所示 时某些弱酸的电离平衡常数。
2
℃
27 (9 ) 25
第 页,共 页
5 8化学
式
2 3 2 2 4 3 3 3
−7 −2 −2
1 =4.5×10 1 =5.4×10 −5 1 =1×10
写出碳酸钠溶液中−1滴1 加少量草酸的离子−5方 程 式=:1._7_5_×__1_0。 −7
2 =4.7×10 2 =5.4×10 2 =2.6×10
常温下,稀 溶液加水稀释过程中,下列数据变大的是______。
(1)
(2) 3
+ −
+ + −
A. 时 ., 有 3 . ⋅ . + 的一组醋酸、醋酸钠混合溶液,当溶液 时,
℃ − ______ −1 。
(3)25 3 + 3 =0.1 ⋅ =3
亚+磷酸 + 为二元−弱酸,则 溶液显_______−_1___性 填“酸”“碱”或“中” ,同温、同浓
+ − + 3 = ⋅
度的 、 、 、 四种溶液, 由大到小的顺序______________。
(4) 3 3 2 3 ( )
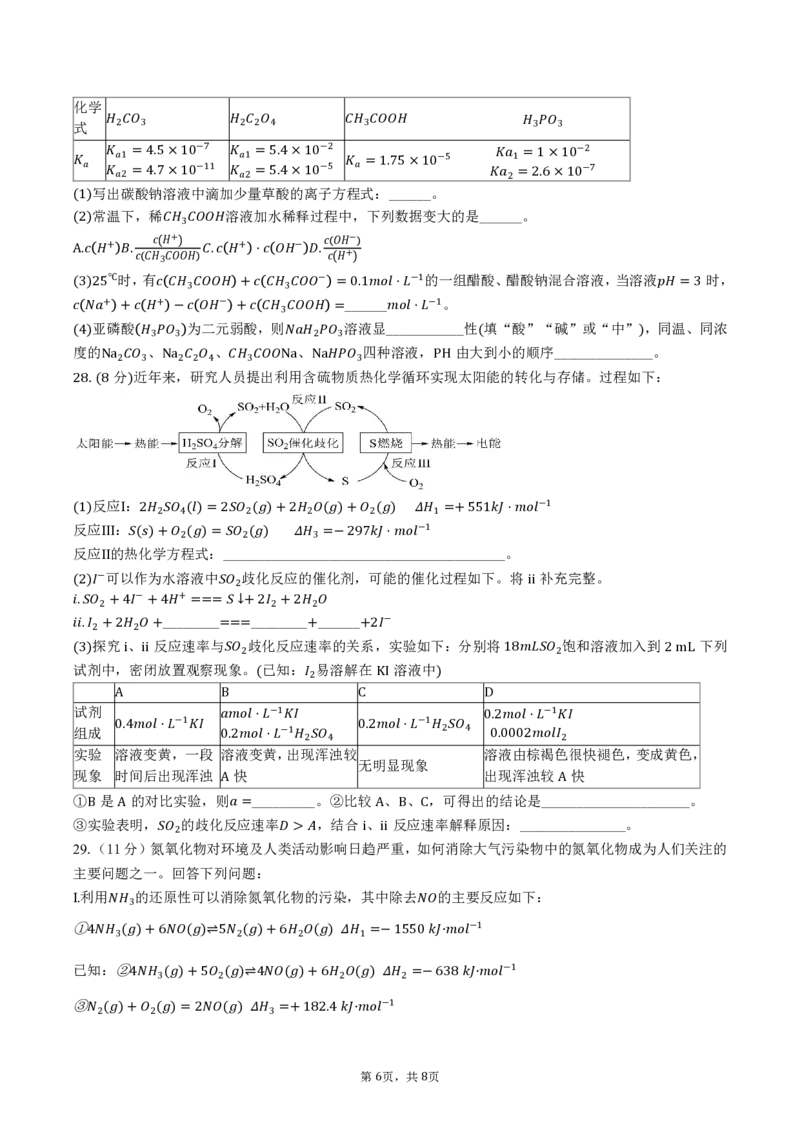
. 分 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
Na2 3 Na2 2 4 3 Na Na 3 PH
28 (8 )
反应Ⅰ:
(
反
1)
应Ⅲ:
2 2 4( )=2 2( )+2 2 ( )+ 2( ) 1 =+551 ⋅
−1
反应Ⅱ的热
(
化
)
学
+
方
程
2(
式
)
:
=
_
_
_
2
_
(
_
_
)
_____
_
_
3
__
=
_
−
__
2
_
9
_
7
_
__
_
⋅
_
_
_
_−_1___________。
可以作为水溶液中 歧化反应的催化剂,可能的催化过程如下。将 补充完整。
−
(2) 2 ii
− ___+_____ ________ ______
. 2+4 +4 === ↓+2 2+2 2
探究 、 反应速率与 歧化反应速率的关系,−实验如下:分别将 饱和溶液加入到 下列
. 2+2 2 + === + +2
试剂中,密闭放置观察现象。 已知: 易溶解在 溶液中
(3) i ii 2 18 2 2mL
( 2 KI )
试剂
A B C D
组成 −1 −1
−1 ⋅ −1 0.2 ⋅
实验 0溶.4液 变 黄⋅ ,一 段 溶液变黄,−出1 现浑浊较0.2 ⋅ 2 4 溶液由棕褐色很快褪色,变成黄色,
0.2 ⋅ 2 4 无明显现象 0.0002 2
现象 时间后出现浑浊 快 出现浑浊较 快
① 是 的对比实验,则 _________。②比较 、 、 ,可得出的结论是_____________________。
A A
③实验表明, 的歧化反应速率 ,结合 、 反应速率解释原因:_______________。
B A = A B C
29.(11分)氮
氧
2
化物对环境及人类
活
>
动
影响日趋
i
严
ii
重,如何消除大气污染物中的氮氧化物成为人们关注的
主要问题之一。回答下列问题:
Ⅰ利用 的还原性可以消除氮氧化物的污染,其中除去 的主要反应如下:
①. 3
−1
4 3( )+6 ( )⇌5 2( )+6 2 ( ) 1 =−1550 ·
已知:②
−1
③ 4 3( )+5 2( )⇌4 ( )+6 2 ( ) 2 =−638 ·
−1
2( )+ 2( )=2 ( ) 3 =+182.4 ·
第 页,共 页
6 8反应①自发进行的条件_________ 填“高温自发”、“低温自发”、“任意温度自发”或“任意温度不
自发” 。
(1) (
温度为 时,在恒容密闭容器中按照 充入反应物,发生上述反应①,下列能
)
判断该反应达到平衡状态的是____________ 填字母 。
(2) 400 ( 3): ( )=2:3
A.混合气体的压强不再发生变化 混合气体的密度保持不变
( )
C.混合气体的平均摩尔质量保持不变 . 和 之比保持不变
.
实验测得反应① ( , 3) ( ) 、 为速率常数,只与温度有
正 正 逆 逆 正 逆
4 6 5 6
(3) = · ( 3)· ( ) = · ( 2)· ( 2 )(
关 。达到平衡后,仅升高温度, 增大的倍数____________ 填“ ”“ ”或“ ” 增大的倍数。
正 逆
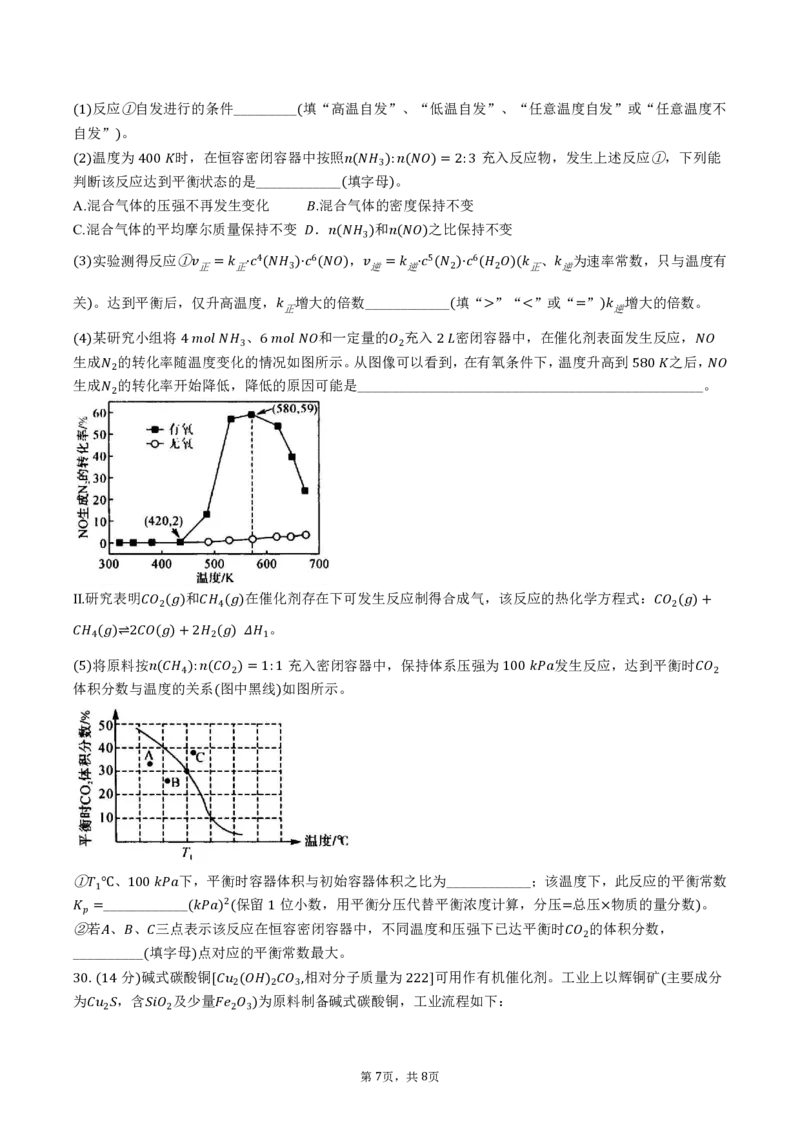
)某研究小组将 、 和一定量的 充入 (密闭容>器中<,在催化=剂表) 面发生反应,
(
生
4)
成 的转化率随
4
温
度
变
化
3
的情
6
况
如
图
所示。从图像
可
2
以看
2
到
,在有氧条件下,温度升高到 之后
,
生成 的转化率开始降低,降低的原因可能是_________________________________________________。
2 580
2
Ⅱ研究表明 和 在催化剂存在下可发生反应制得合成气,该反应的热化学方程式:
. 2( ) 4( ) 。 2( )+
4 将( 原)⇌料2按 ( )+2 2( ) 1 充入密闭容器中,保持体系压强为 发生反应,达到平衡时
体积分数与温度的关系 图中黑线 如图所示。
(5) ( 4): ( 2)=1:1 100 2
( )
① 、 下,平衡时容器体积与初始容器体积之比为____________;该温度下,此反应的平衡常数
____________ 保留 位小数,用平衡分压代替平衡浓度计算,分压 总压 物质的量分数 。
1℃ 100
②若 、 、 三点表示该2反应在恒容密闭容器中,不同温度和压强下已达平衡时 的体积分数,
= ( ) ( 1 = × )
__________ 填字母 点对应的平衡常数最大。
2
. 分 碱式碳酸铜 相对分子质量为 可用作有机催化剂。工业上以辉铜矿 主要成分
( )
为 ,含 及少量 为原料制备碱式碳酸铜,工业流程如下:
30 (14 ) [ 2( )2 3, 222] (
2 2 2 3)
第 页,共 页
7 8金属离子从开始形成氢氧化物沉淀,到沉淀时溶液的 如下表:
金属离子
pH
开始沉淀 2+ 3+ 2+
完全沉淀
pH 7.5 2.7 5.9
“浸取”时能提高辉铜矿 浸取率的措施有____________________ 填 条 。
pH 9.5 3.7 6.9
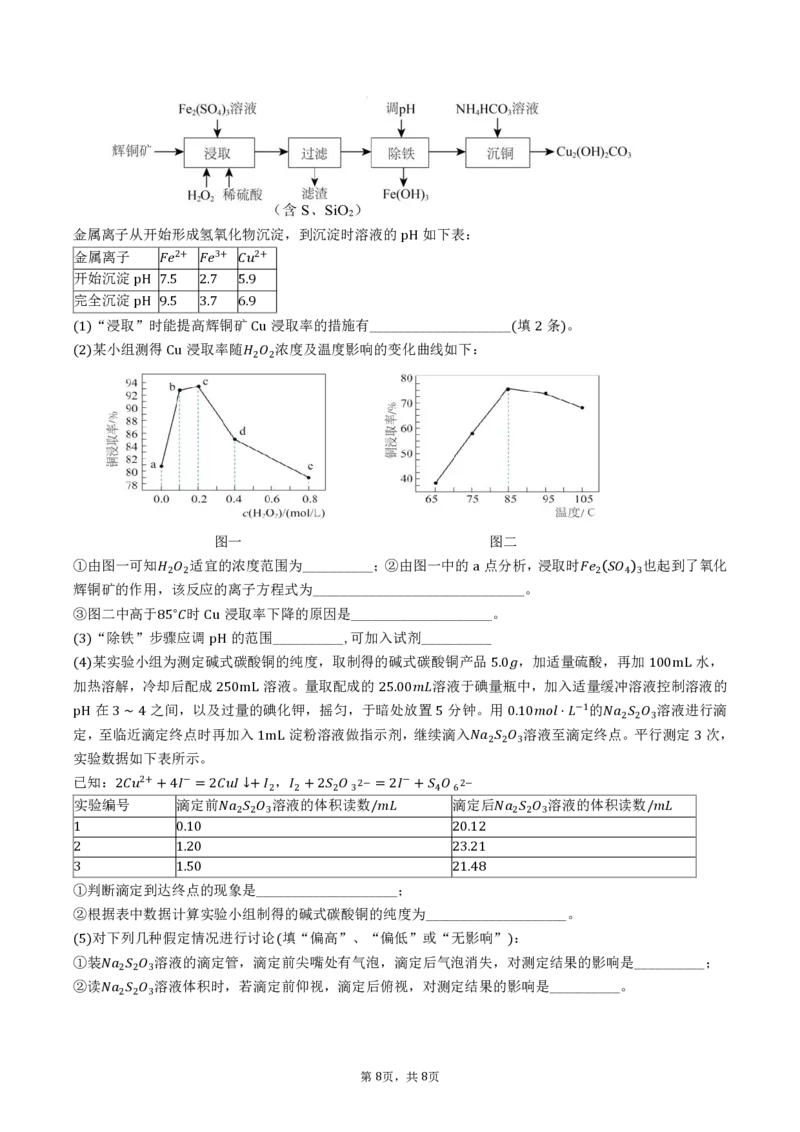
某小组测得 浸取率随 浓度及温度影响的变化曲线如下:
(1) Cu ( 2 )
(2) Cu 2 2
图一 图二
①由图一可知 适宜的浓度范围为__________;②由图一中的 点分析,浸取时 也起到了氧化
辉铜矿的作用,该反应的离子方程式为______________________________。
2 2 a 2 4 3
③图二中高于 时 浸取率下降的原因是____________________。
“除铁”步骤∘应调 的范围__________,可加入试剂__________
85 Cu
某实验小组为测定碱式碳酸铜的纯度,取制得的碱式碳酸铜产品 ,加适量硫酸,再加 水,
(3) pH
加热溶解,冷却后配成 溶液。量取配成的 溶液于碘量瓶中,加入适量缓冲溶液控制溶液的
(4) 5.0 100mL
在 之间,以及过量的碘化钾,摇匀,于暗处放置 分钟。用 的 溶液进行滴
250mL 25.00
定,至临近滴定终点时再加入 淀粉溶液做指示剂,继续滴入 溶液至滴−定1 终点。平行测定 次,
pH 3∼4 5 0.10 ⋅ 2 2 3
实验数据如下表所示。
1mL 2 2 3 3
已知: ,
实验编号 2+ 滴−定前 溶液的体积读数2− − 滴2−定后 溶液的体积读数
2 +4 =2 ↓+ 2 2+2 2 3 =2 + 4 6
2 2 3 / 2 2 3 /
1 0.10 20.12
2 1.20 23.21
①判断滴定到达终点的现象是____________________;
3 1.50 21.48
②根据表中数据计算实验小组制得的碱式碳酸铜的纯度为____________________。
对下列几种假定情况进行讨论 填“偏高”、“偏低”或“无影响” :
①装 溶液的滴定管,滴定前尖嘴处有气泡,滴定后气泡消失,对测定结果的影响是__________;
(5) ( )
②读 溶液体积时,若滴定前仰视,滴定后俯视,对测定结果的影响是__________。
2 2 3
2 2 3
第 页,共 页
8 8