文档内容
南充高中高 2023 级第三学期第二次月考
5.25℃时,V
1
LpH=m的HCl溶液和V
2
LpH=n的NaOH溶液恰好完全中和,若m+n=13,则
V :V 为
1 2
化 学 试 题 A.1:1 B.1:2 C.1:10 D.10:1
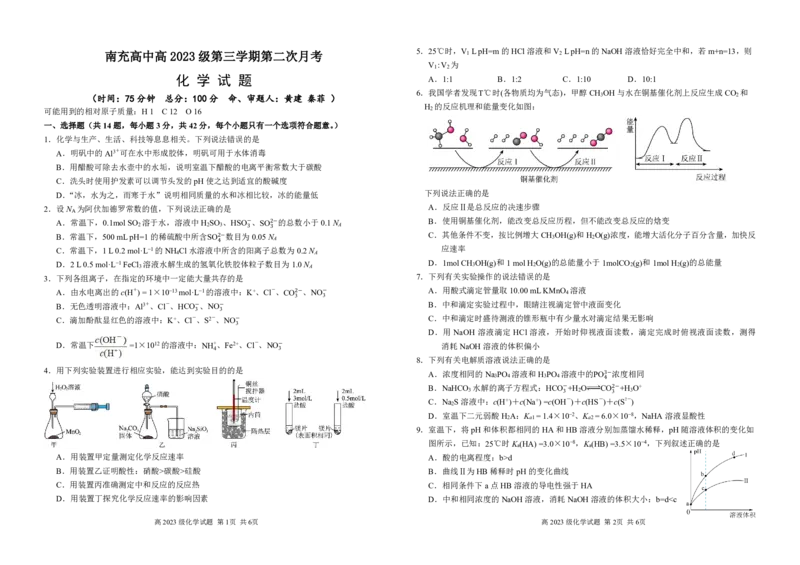
6.我国学者发现T℃时(各物质均为气态),甲醇CH OH与水在铜基催化剂上反应生成CO 和
(时间:75 分钟 总分:100分 命、审题人:黄建 秦菲 ) 3 2
H 的反应机理和能量变化如图:
可能用到的相对原子质量:H1 C12 O16 2
一、选择题(共14题,每小题3分,共42分,每个小题只有一个选项符合题意。)
1.化学与生产、生活、科技等息息相关。下列说法错误的是
A.明矾中的Al3+可在水中形成胶体,明矾可用于水体消毒
B.用醋酸可除去水壶中的水垢,说明室温下醋酸的电离平衡常数大于碳酸
C.洗头时使用护发素可以调节头发的pH使之达到适宜的酸碱度
D.“冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量低 下列说法正确的是
2.设N 为阿伏加德罗常数的值,下列说法正确的是 A.反应Ⅱ是总反应的决速步骤
A
A.常温下,0.1molSO 溶于水,溶液中H SO 、HSO 、SO 的总数小于0.1N B.使用铜基催化剂,能改变总反应历程,但不能改变总反应的焓变
2 2 3 A
B.常温下,500mLpH=1的稀硫酸中所含SO 数目为 3 − 0.05N3 2− A C.其他条件不变,按比例增大CH 3 OH(g)和H 2 O(g)浓度,能增大活化分子百分含量,加快反
C.常温下,1L0.2mol·L−1的NH Cl水溶液中2−所含的阳离子总数为0.2N 应速率
4 4 A
D.2L0.5mol·L−1FeCl 3 溶液水解生成的氢氧化铁胶体粒子数目为1.0N A D.1molCH 3 OH(g)和1molH 2 O(g)的总能量小于1molCO 2 (g)和1molH 2 (g)的总能量
3.下列各组离子,在指定的环境中一定能大量共存的是 7.下列有关实验操作的说法错误的是
A.由水电离出的c(H+)=1×10−13mol·L−1的溶液中:K+、Cl-、CO 、NO A.用酸式滴定管量取10.00mLKMnO 4 溶液
3 3
B.无色透明溶液中:Al3+、Cl-、HCO 、NO 2− − B.中和滴定实验过程中,眼睛注视滴定管中液面变化
3 3
C.滴加酚酞显红色的溶液中:K+、Cl-−、S2-、−
NO
C.中和滴定时盛待测液的锥形瓶中有少量水对滴定结果无影响
3
− D.用NaOH 溶液滴定HCl 溶液,开始时仰视液面读数,滴定完成时俯视液面读数,测得
D.常温下 =1×1012的溶液中:NH +、Fe2+、Cl-、NO 消耗NaOH溶液的体积偏小
4 3
−
8.下列有关电解质溶液说法正确的是
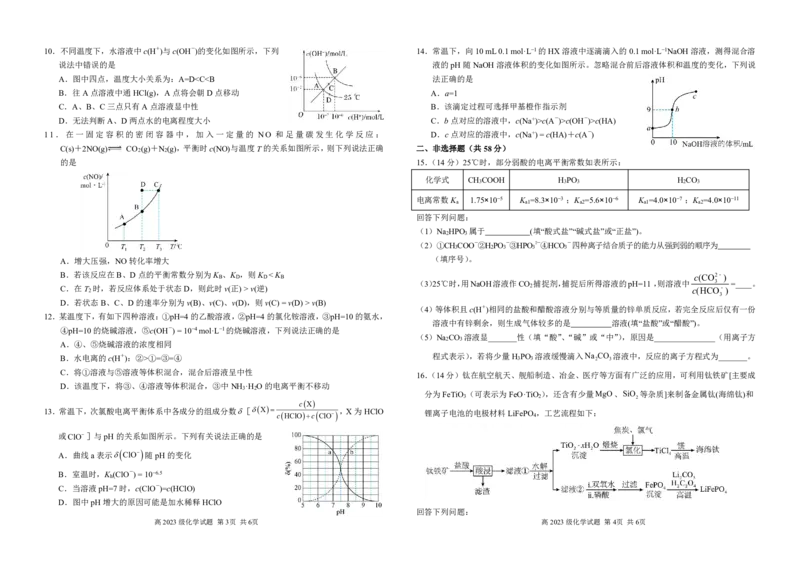
4.用下列实验装置进行相应实验,能达到实验目的的是
A.浓度相同的Na PO 溶液和H PO 溶液中的PO 浓度相同
3 4 3 4
B.NaHCO
3
水解的离子方程式:HCO
3
+H
2
O C4 3 O −
3
+H
3
O+
C.Na S溶液中:c(H+)+c(Na+)=c(OH −- )+c(HS - )+2 c − (S2-)
2
D.室温下二元弱酸H A:K =1.4×10−2、K =6.0×10−8,NaHA溶液显酸性
2 a1 a2
9.室温下,将pH和体积都相同的HA和HB溶液分别加蒸馏水稀释,pH随溶液体积的变化如
图所示,已知:25℃时K (HA)=3.0×10−8,K (HB)=3.5×10−4,下列叙述正确的是
a a
A.用装置甲定量测定化学反应速率 A.酸的电离程度:b>d
B.用装置乙证明酸性:硝酸>碳酸>硅酸 B.曲线Ⅱ为HB稀释时pH的变化曲线
C.用装置丙准确测定中和反应的反应热 C.相同条件下a点HB溶液的导电性强于HA
D.用装置丁探究化学反应速率的影响因素 D.中和相同浓度的NaOH溶液,消耗NaOH溶液的体积大小:b=dc(A-)>c(OH-)>c(HA)
11.在一固定容积的密闭容器中,加入一定量的 NO 和足量碳发生化学反应: D.c点对应的溶液中,c(Na+)=c(HA)+c(A-)
C(s)+2NO(g) CO (g)+N (g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确 二、非选择题(共58分)
2 2
的是 15.(14分)25℃时,部分弱酸的电离平衡常数如表所示:
化学式 CH COOH H PO H CO
3 3 3 2 3
电离常数K 1.75×10−5 K =8.3×10−3 ;K =5.6×10−6 K =4.0×10−7 ;K =4.0×10−11
a a1 a2 a1 a2
回答下列问题:
(1)Na HPO 属于 (填“酸式盐”“碱式盐”或“正盐”)。
2 3
(2)①CHCOO-②HPO-③HPO2-④HCO-四种离子结合质子的能力从强到弱的顺序为
3 2 3 3 3
A.增大压强,NO转化率增大 (填序号)。
B.若该反应在B、D点的平衡常数分别为K B 、K D ,则K D v(逆) 2 c(HCO-)
3
D.若状态B、C、D的速率分别为v(B)、v(C)、v(D),则v(C)=v(D)>v(B)
(4)等体积且c(H+)相同的盐酸和醋酸溶液分别与等质量的锌单质反应,若完全反应后仅有一份
12.某温度下,有如下四种溶液:①pH=4的乙酸溶液,②pH=4的氯化铵溶液,③pH=10的氨水,
溶液中有锌剩余,则生成气体较多的是 溶液(填“盐酸”或“醋酸”)。
④pH=10的烧碱溶液,⑤c(OH-)=10−4mol·L−1的烧碱溶液,下列说法正确的是
(5)Na CO 溶液显_______性(填“酸”、“碱”或“中”),原因是_______________(用离子方
2 3
A.④、⑤烧碱溶液的浓度相同
B.水电离的c(H+):②>①=③=④ 程式表示),若将少量H
3
PO
3
溶液缓慢滴入Na
2
CO
3
溶液中,反应的离子方程式为_______。
C.将①溶液与⑤溶液等体积混合,混合后溶液呈中性
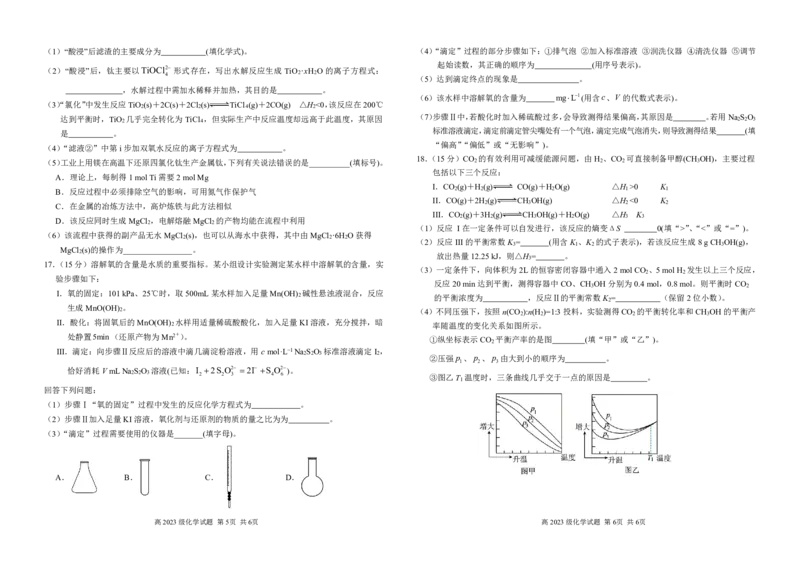
16.(14分)钛在航空航天、舰船制造、冶金、医疗等方面有广泛的应用,可利用钛铁矿[主要成
D.该温度下,将③、④溶液等体积混合,③中NH ·H O的电离平衡不移动
3 2
分为FeTiO (可表示为FeO·TiO ),还含有少量MgO、SiO 等杂质]来制备金属钛(海绵钛)和
3 2 2
cX
13.常温下,次氯酸电离平衡体系中各成分的组成分数[X
cHClOc ClO ,X为HClO 锂离子电池的电极材料LiFePO 4 ,工艺流程如下:
或ClO]与pH的关系如图所示。下列有关说法正确的是
A.曲线a表示
ClO
随pH的变化
B.室温时,K (ClO-)=10−6.5
h
C.当溶液pH=7时,c(ClO-)=c(HClO)
D.图中pH增大的原因可能是加水稀释HClO
回答下列问题:
高2023级化学试题 第3页 共6页 高2023级化学试题 第4页 共6页(1)“酸浸”后滤渣的主要成分为 (填化学式)。 (4)“滴定”过程的部分步骤如下:①排气泡 ②加入标准溶液 ③润洗仪器 ④清洗仪器 ⑤调节
起始读数,其正确的顺序为 (用序号表示)。
(2)“酸浸”后,钛主要以TiOCl2形式存在,写出水解反应生成TiO ·xH O 的离子方程式:
4 2 2
(5)达到滴定终点的现象是 。
,水解过程中需加水稀释并加热,其目的是 。
(6)该水样中溶解氧的含量为 mgL1(用含c、V 的代数式表示)。
(3)“氯化”中发生反应TiO (s)+2C(s)+2Cl (s) TiCl (g)+2CO(g) △H <0,该反应在200℃
2 2 4 2
达到平衡时,TiO 2 几乎完全转化为TiCl 4 ,但实际生产中反应温度却远高于此温度,其原因 (7)步骤Ⅱ中,若酸化时加入稀硫酸过多,会导致测得结果偏高,其原因是 。若用Na 2 S 2 O 3
是 。
标准溶液滴定,滴定前滴定管尖嘴处有一个气泡,滴定完成气泡消失,则导致测得结果 (填
(4)“滤液②”中第i步加双氧水反应的离子方程式为 。
“偏高”“偏低”或“无影响”)。
18.(15分)CO 的有效利用可减缓能源问题,由H 、CO 可直接制备甲醇(CH OH),主要过程
(5)工业上用镁在高温下还原四氯化钛生产金属钛,下列有关说法错误的是__________(填标号)。 2 2 2 3
包括以下三个反应:
A.理论上,每制得1molTi需要2molMg
I.CO (g)+H (g) CO(g)+H O(g) △H >0 K
B.反应过程中必须排除空气的影响,可用氮气作保护气 2 2 2 1 1
II.CO(g)+2H (g) CH OH(g) △H <0 K
C.在金属的冶炼方法中,高炉炼铁与此方法相似 2 3 2 2
III.CO (g)+3H (g) CH OH(g)+H O(g) △H K
2 2 3 2 3 3
D.该反应同时生成MgCl ,电解熔融MgCl 的产物均能在流程中利用
2 2
(1)反应 I在一定条件可以自发进行,该反应的熵变ΔS 0(填“>”、“<”或“=”)。
(6)该流程中获得的副产品无水MgCl (s),也可以从海水中获得,其中由MgCl ·6H O获得
2 2 2
(2)反应III的平衡常数K = (用含K 、K 的式子表示),若该反应生成8gCH OH(g),
3 1 2 3
MgCl (s)的操作为_________________。
2
放出热量12.25kJ,则△H = 。
3
17.(15分)溶解氧的含量是水质的重要指标。某小组设计实验测定某水样中溶解氧的含量,实
(3)一定条件下,向体积为2L的恒容密闭容器中通入2molCO 、5molH 发生以上三个反应,
2 2
验步骤如下:
反应20min达到平衡,测得容器中CO、CH OH分别为0.4mol,0.8mol。则平衡时CO
3 2
I.氧的固定:101kPa、25℃时,取500mL某水样加入足量Mn(OH) 碱性悬浊液混合,反应
2 的平衡浓度为 ,反应Ⅱ的平衡常数K = (保留2位小数)。
2
生成MnO(OH) 。
2 (4)不同压强下,按照n(CO ):n(H )=1:3投料,实验测得CO 的平衡转化率和CH OH的平衡产
2 2 2 3
II.酸化:将固氧后的MnO(OH)
2
水样用适量稀硫酸酸化,加入足量KI溶液,充分搅拌,暗
率随温度的变化关系如图所示。
处静置5min(还原产物为Mn2+)。
①纵坐标表示CO 平衡产率的是图 (填“甲”或“乙”)。
2
III.滴定:向步骤Ⅱ反应后的溶液中滴几滴淀粉溶液,用 cmol·L−1Na S O 标准溶液滴定I ,
2 2 3 2
②压强 p 、 p 、p 由大到小的顺序为 。
1 2 3
恰好消耗VmLNa S O 溶液(已知:I 2S O2 2I S O2 )。
2 2 3 2 2 3 4 6 ③图乙T 温度时,三条曲线几乎交于一点的原因是 。
1
回答下列问题:
(1)步骤Ⅰ“氧的固定”过程中发生的反应化学方程式为 。
(2)步骤Ⅱ加入足量KI溶液,氧化剂与还原剂的物质的量之比为为 。
(3)“滴定”过程需要使用的仪器是_______(填字母)。
A. B. C. D.
高2023级化学试题 第5页 共6页 高2023级化学试题 第6页 共6页