文档内容
长春外国语学校 2023-2024 学年度第一学期 NH +Al3++2SO +2Ba2++4OH-=2BaSO ↓+Al(OH) ↓+NH•H O;故B正确;
4 3 3 2
高三年级期中考试化学试题答案解析 C.二氧化硫过量,反应生成硫酸钙、盐酸和硫酸;向Ca(ClO) 溶液中通入过量的SO
2 2
一、单选题(每题3分)
气体,离子方程式:2HO+Ca2++2ClO-+2SO═CaSO ↓+2Cl-+4H++ ,故C错误;
2 2 4
1.D
【详解】A.Cl 溶于适量水中Cl+H O H++Cl-+HClO,71g Cl 的物质的量为1mol,有 D.铁离子能够氧化碘离子,向氢氧化铁中滴加氢碘酸溶液,离子方程式为:
2 2 2 2
Cl、HClO、ClO-微粒总数为N ,所以⇌溶液中Cl 和ClO-微粒总数小于N ,A错误; 2Fe(OH) +2I-+6H+═2Fe2++I +6H O,故D错误。
2 A 2 A 3 2 2
B.1L1mol/LH O 溶液发生分解反应时2HO=2H O+O↑,转移的电子数目为N ,B错 答案选B。
2 2 2 2 2 2 A
误; 4.C
C.标准状况下,CCl 为液体,无法根据体积进行计算,C错误; 【详解】A.检验尿液中的葡萄糖需要用新制氢氧化铜悬浊液,硫酸铜溶液、氢氧化钠
4
D.NaS和NaO 的相对分子质量均为78g/mol,7.8gNa S和NaO 的物质的量为 溶液可以制成新制氢氧化铜悬浊液,A正确;
2 2 2 2 2 2
0.1mol,且NaS含有2个钠离子和一个硫离子,NaO 中含有2个钠离子和一个过氧根 B.浓硝酸能与蛋白质发生化学反应,可以用来检验蛋白质,B正确;
2 2 2
离子,均为3个离子,因此7.8gNa S和NaO 含有的离子总数为0.3N ,D正确;
2 2 2 A C.淀粉溶液只能检验I,不能检验 ,C错误;
2
故选D。
D.乙醇可以还原重铬酸钾使其变色,D正确;
2.D
故选C。
【详解】A.苏打饼干的制作原料含有小苏打,A正确;
5.B
B.碳酸氢钠药片可用于治疗胃酸过多,B正确;
【详解】A.石油裂化是指在一定的条件下,将相对分子质量较大、沸点较高的烃断裂
C.港珠澳大桥桥梁采用先进的抗腐蚀方法,钢铁桥梁被腐蚀是氧化还原反应,C正确;
为相对分子质量较小、沸点较低的烃的过程,属于化学反应,A不符合题意;
D.抗击“新型冠状病毒”过程中用到的“84”消毒液的有效成分是次氯酸钠,D不正确;
B.蛋白质盐析是物理变化,B符合题意;
故选D。
C.煤的干馏是煤化工的重要过程之一。指煤在隔绝空气条件下加热、分解,生成焦炭、
3.B
煤焦油、粗苯、煤气等产物的过程,煤的干馏是属于化学变化,C不符合题意;
【详解】A.向硫代硫酸钠溶液中通入足量Cl,硫代硫酸钠和Cl 发生氧化还原反应,
2 2
D.植物油皂化是指植物油脂与碱作用而成肥皂(高碳数脂肪酸盐)和甘油的反应,D不
氯气是氧化剂氯元素得电子被还原为Cl-,硫代硫酸钠是还原剂,S元素失电子被氧化为
符合题意;
,离子方程式为: +4Cl+5H O═2 +8Cl-+10H+,故A错误; 故选B。
2 2
6.A
B.NH Al(SO ) 与Ba(OH) 的物质的量之比为1:2,铝离子先与氢氧根离子反应生成氢
4 4 2 2
【详解】A.玻璃搅拌器是为了加快反应速率,使反应尽快完成,减少热量的损失,减
氧化铝沉淀,剩余的氢氧根离子恰好与铵根离子结合生成一水合氨;离子方程式为:
少实验误差,故A正确;
B.温度计水银球应浸入溶液中但不能与内筒底部接触;故B错误;
化学试题 第15页 (共66页) 化学试题 第16页 (共66页)
学科网(北京)股份有限公司C.盐酸是强酸,醋酸是弱酸,醋酸电离吸热,测得 不同;故C错误;
D.根据生成硫化亚铁17.6g(即0.2mol)时,放出19.12k热量,可知生成1 mol 时放
D.在测定中和反应反应热的实验中,不需要滴定管、天平,故D错误。
出95.6kJ的热量,所以硫粉与铁粉反应的热化学方程式为
答案选A。
7.B
,D项正确;
【详解】A.制备乙酸乙酯时应该先加乙醇、后加浓硫酸,不断搅拌振荡,冷却后加乙
答案选D。
酸,可提高乙酸的利用率,故A错误;
9.D
B.SO 可以和碳酸氢钠溶液反应生成CO,除去干燥CO 中混有少量的SO ,可将混合
2 2 2 2
气体依次通过盛有足量饱和NaHCO 3 溶液、浓硫酸的洗气瓶,故B正确; 【详解】A.由题意知配离子为 ,配离子CN-,NO不显电性,因此中
C.检验FeSO 溶液未完全变质,应该用酸性高锰酸钾溶液检验亚铁离子的存在,故C
4
错误;
心离子为 ,故A错误;
D .常温下Fe遇浓硝酸发生钝化,而Cu可以和浓硝酸发生氧化还原反应,由操作和现
B.配体为CN-和NO,配位数6,故B错误;
象不能比较两者活泼性,故D错误;
C.氢键不是化学键,故C错误;
故选:B。
D.NO的配位原子为N,提供一个孤电子对与中心离子 形成1个配位键(σ键),故
8.D
【详解】A.稀 和NaOH发生中和反应,放出热量,则 D正确。
综上所述,答案为D。
10.D
,A项错误;
【详解】A.阳离子中饱和碳原子为 杂化,碳碳双键两端的碳为 杂化,A正确;
B.燃烧热指101kPa时,1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,所以
B.该物质为离子晶体,但是由于阴、阳离子体积较大,离子之间作用力较弱,导致其
,水的分解是氢气燃烧
晶体的熔点较低,B正确;
C.阴阳离子间存在离子键,阴阳离子内部存在共价键,C正确;
的逆过程,所以水分解的热化学方程式为 ,
D.氢原子不符合8电子稳定结构,D错误;
B项错误; 故选D。
11.C
C.燃烧热强调1mol可燃物完全燃烧生成稳定的氧化物,如C→ 、H→ ,而
【详解】A. 中的中心离子为 ,其配位原子为 ,配位数为6,故
中不是 ,C项错误;
A错误;
化学试题 第25页 (共66页) 化学试题 第26页 (共66页)
学科网(北京)股份有限公司C.聚乙酸乙烯酯在碱性环境下的水解生成乙酸钠和聚乙烯醇,乙酸钠和聚乙烯醇都不
B.由 晶胞结构可知, 周围等距离且最近的 有8个,B
参与该合成路线,故C错误;
错误;
D.该有机物的同分异构体中,能和NaHCO 溶液反应的结构中含有-COOH,符合条
3
C. 位于晶胞内部,若把晶胞分为8个相等的小立方体,则 位于左后上的小立方体
件的同分异构体有CH=CHCHCOOH、CHCH=CHCOOH、CH=C(CH )COOH,故D
2 2 3 2 3
错误;
的体心,根据 的原子坐标参数可知, 的原子坐标参数为 ,故C正确; 故选:A。
14.A
D.通过晶胞结构,根据均摊法,一个晶胞含有的 的个数为
【详解】A.该物质的分子式为 ,A正确;
B.分子中含有三种含氧官能团:羟基、醚键、羰基,B错误;
个,含有的 的个数为8个,故每个晶胞中含有4个
C.1mol该物质最多能与8mol 反应,C错误;
的摩尔质量是 ,晶胞体积为 ,则晶胞的 D.苯环上有7种不同化学环境的氢原子,D错误;
故选A。
二、填空题
密度为 ,故D错误。
15.(每空2分)
(1) 1 ab
答案选C。
(2) > 0.2
12.D
(3)SbCl (4)3SbCl +2Sb=5SbCl
3 5 3
【详解】A.布洛芬修饰分子中含有1个手性碳原子,A错误;
B.1mol布洛芬中含有1mol羧基,故可以与 反应生成标况下22.4 L ,B错 【详解】(1)实验1中酸性高锰酸钾是强氧化剂,酸性高锰酸钾溶液遇到过氧化氢紫
色褪去、有大量气泡产生(从反应物价态看,气体只能是氧气),说明过氧化氢被氧化,
误;
过氧化氢体现还原性;
C.布洛芬中手性碳原子为sp3杂化,所有碳原子不可能共平面,C错误;
(2)84消毒液与过氧化氢消毒剂混用,导致消毒能力降低甚至消失,池水变绿,是因
D.在肠道内,布洛芬修饰分子可以水解生成布洛芬,D正确;
为反应生成的氧气促进藻类的疯长,该反应的化学反应方程式为
故选D。
13.A NaClO+H 2 O 2 =NaCl+O 2 ↑+H 2 O,说明氧化性NaClO>H 2 O 2 ;当有0.1molO 2 生成时,转移
【详解】A.根据反应前后原子守恒判断A的结构简式为CHCOOH,故A正确; 电子的物质的量为0.2mol;
3
B.乙炔发生加成反应生成CHCOOCH=CH ,则反应1为加成反应,根据反应前后结构 (3)“浸出“时之,Sb S 在溶液中和SbCl 发生氧化还原反应,生成单质硫和三价氯
3 2 2 3 5
简式知,反应2为加聚反应,故B错误; 化锑,反应的化学方程式为:Sb S+3SbCl =5SbCl +3S,其中Sb从+6价降低到+3价,
2 3 5 3
化学试题 第35页 (共66页) 化学试题 第36页 (共66页)
学科网(北京)股份有限公司则还原产物是SbCl ;
3 (1) NH CO 、SO HCO HCO +Ba2++OH-=H O+BaCO ↓
2 3
(4)“还原”时Sb和SbCl 反应生成SbCl ,反应的化学方程式为
5 3
0.1mol•L-1
3SbCl +2Sb=5SbCl 。
5 3
(2) 6 Ni O
2 3
16.(每空2分)
【分析】已知1L无色待测液,则一定不含Fe3+;待测液和氯化钡溶液反应得到沉淀
(1) CaCO 、CaHPO SiO
3 4 2
(2) CO 过滤
2
A,则溶液中可能含有CO 、SO ,向沉淀中加入稀硝酸生成气体,且有部分沉淀不
(3) Ca(OH) +NaCO=CaCO ↓+2NaOH 蒸发结晶
2 2 3 3
(4) CaCO +2HCl=CaCl +CO↑+HO 100
3 2 2 2
溶解,则溶液中一定存在CO 、SO ,根据离子共存知,溶液中不存在Ca2+、Ba2+;
滤液A中有Ba2+,加入过量的NaOH溶液得到气体B、白色沉淀B,则溶液中一定含有
【分析】方案一中,石灰石焙烧发生反应 ,水浸时,CaO转化
NH ,HCO ,气体B为NH ,白色沉淀B为BaCO ,滤液B中通入氯气,得浅黄绿色
3 3
溶液,溶液中一定没有Br-,滤液B中加入硝酸银、硝酸溶液得到白色沉淀C,C为
为Ca(OH) ,沉钙时发生反应 ,过滤可得到
2 AgCl,说明滤液B中含有Cl-,由于加入氯化钡溶液,不能确定原溶液中是否含有Cl-,以
此解答该题。
CaCO ;方案二中,石灰石与盐酸反应为 ,NaCO
3 2 3
【详解】(1)①由以上分析可知气体B为NH ,可确定待测液中含有的离子是NH ,
3
在沉钙中与CaCl 发生复分解反应得到CaCO 。
2 3
【详解】(1)上述摩擦剂属于盐的是CaCO 、CaHPO ,属于氧化物的是SiO;
3 4 2
故答案为:NH ;
(2)由分析可知,气体A的化学式为CO;操作a的名称为过滤;
2
②待测液和氯化钡溶液反应得到沉淀A,向沉淀中加入稀硝酸生成气体,且有部分沉淀
(3)方案一“沉钙”时是氢氧化钙溶液中加入碳酸钠使其沉淀,生成的碳酸钙和氢氧
化钠,化学方程式为:Ca(OH) +NaCO=CaCO ↓+2NaOH;由NaOH溶液得到NaOH
2 2 3 3
不溶解,则溶液中一定存在CO 、SO ;故答案为:CO 、SO ;
固体的操作为蒸发结晶;
(4)方案二“酸浸”是石灰石与盐酸反应,生成氯化钙、水和CO 2 ,化学方程式为: ③由上述分析可知,白色沉淀B为碳酸钡,是由HCO 、Ba2+、OH-反应生成,则可确
CaCO +2HCl=CaCl +CO↑+HO;气体B为CO,若生成44 g CO,则消耗CaCO 的
3 2 2 2 2 2 3
定待测液中含有的离子是HCO ,反应的离子方程式为:HCO +Ba2++OH-
质量 100 g。
17.(前五个空每空2分,后两空每空3分)
化学试题 第45页 (共66页) 化学试题 第46页 (共66页)
学科网(北京)股份有限公司=H O+BaCO ↓;故答案为:HCO ;HCO +Ba2++OH-=H O+BaCO ↓;
2 3 2 3
m(O)=8.3g-5.9g=2.4g,n(O)= ,则Q中 ,故Q的化
④ B(碳酸钡)的物质的量= ,则n(HCO )=0.1mol,故c(HCO 学式为:Ni O;故答案为:Ni O。
2 3 2 3
【点睛】把握离子之间的反应和现象推断物质为解答的关键,侧重分析与推断能力的考
查,注意电荷守恒及元素化合物知识的应用,进行热重分析时,注意按照失重的一般顺
)=0.1mol/L,E(碳酸钙)的物质的量= ,则n(CO )=0.1mol,c(CO 序:结晶水,非金属氧化物,最后一般得到金属氧化物。
18.(每空2分)
(1)C<O<F
)=0.1mol/L,D(硫酸钡)的物质的量= ,故c(SO )= 0.05mol/L,n(NH
(2)
(3) C HF sp2、sp3 7
)= ,则c(NH )=0.1mol/L,溶液中c(Na+)=0.2mol/L,c(HCO 7 7
(4) π 加成
【详解】(1)由题干有机物结构简式可知,上述有机物涉及的3种第二周期元素即
)=0.1mol/L,c(CO )=0.1mol/L,c(SO )= 0.05mol/L,单位体积为正电
C、O、F,根据同一周期从左往右元素的电负性依次增大可知,其电负性由小到大排序
荷=1×0.1mol/L+1×0.2mol/L=0.3mol/L,单位体积内负电荷=1×0.1mol/L+2×0.1mol/
依次是C<O<F,故答案为:C<O<F;
L+2×0.05mol/L=0.4mol/L,则单位体积为正电荷<单位体积内负电荷,故一定含有K+,
(2)同时连有四个互不相同的原子或原子团的碳原子为手性碳原子,故用“*”标记出
当溶液中没有Cl-,K+离子浓度最小,根据电荷守恒可知,c(K+)最小浓度=0.4mol/
L-0.3mol/L=0.1mol/L,
故答案为:0.1mol•L-1
下图分子中的手性碳原子表示为: ,故答案为: ;
(2)①L→N时失掉全部的结晶水,N时为NiSO ,则n(NiSO )= ,则
4 4
(3)根据题干有机物键线式可知, 的分子式是C HF,其中苯环上碳原子
7 7
n(NiSO •nH O)=0.1mol,M(NiSO •nH O)= ,则n的值= ,
4 2 4 2
的杂化类型为sp2,甲基上的碳原子的杂化类型为sp3,分子中有7个原子(即苯环上的6
故答案为:6;
个碳原子和F原子)参与形成离域键,故答案为:C HF;sp2、sp3;7;
7 7
②到Q时应该为Ni的金属氧化物,根据Ni元素守恒,m(Ni)= =5.9g,
化学试题 第55页 (共66页) 化学试题 第56页 (共66页)
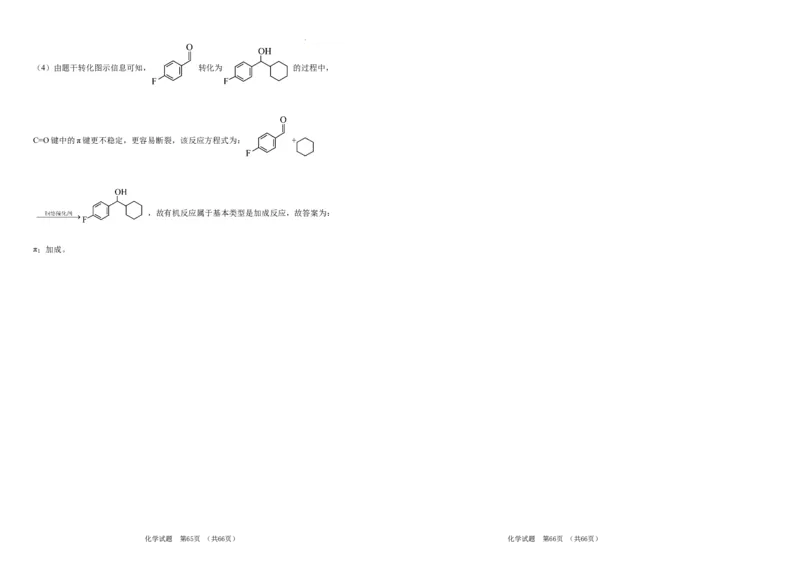
学科网(北京)股份有限公司(4)由题干转化图示信息可知, 转化为 的过程中,
C=O键中的π键更不稳定,更容易断裂,该反应方程式为: +
,故有机反应属于基本类型是加成反应,故答案为:
π;加成。
化学试题 第65页 (共66页) 化学试题 第66页 (共66页)
学科网(北京)股份有限公司