文档内容
威远中学校 2026 届高二下半期考试
化学试题
注意事项:
考试时间共75分钟。试卷共6页,满分100分。
考生作答客观题时,必须使用2B铅笔在答题卡上将所选答案对应的标号涂黑。
考生作答主观题时,须将答案答在答题卡上,在本试题卷、草稿纸上答题无效。考试结束后,将本试题卷
和答题卡一并交回。
可能用到的相对原子质量:N-14 H-1 S-32
一、选择题(本题包括14小题,每小题3分,共42分。每小题只有一个选项符合题意。)
1. 下列关于能层和能级的说法正确的是
A.原子核外每能层最多可容纳的电子数为n2
B.能层序数较大的能级,能量不一定较高
C.同一原子中,1s、2s、3s电子的能量逐渐减小
D.同一原子中,2p、3p、4p能容纳的电子数逐渐增多
2.已知某元素+3价离子的电子排布式为1s22s22p63s23p63d5, 该元素在周期表中的位置及分区分别是
A.第三周期VIII族,p区 B.第三周期VB族,ds 区
C.第四周期VIII族,d区 D.第四周期V族,f区
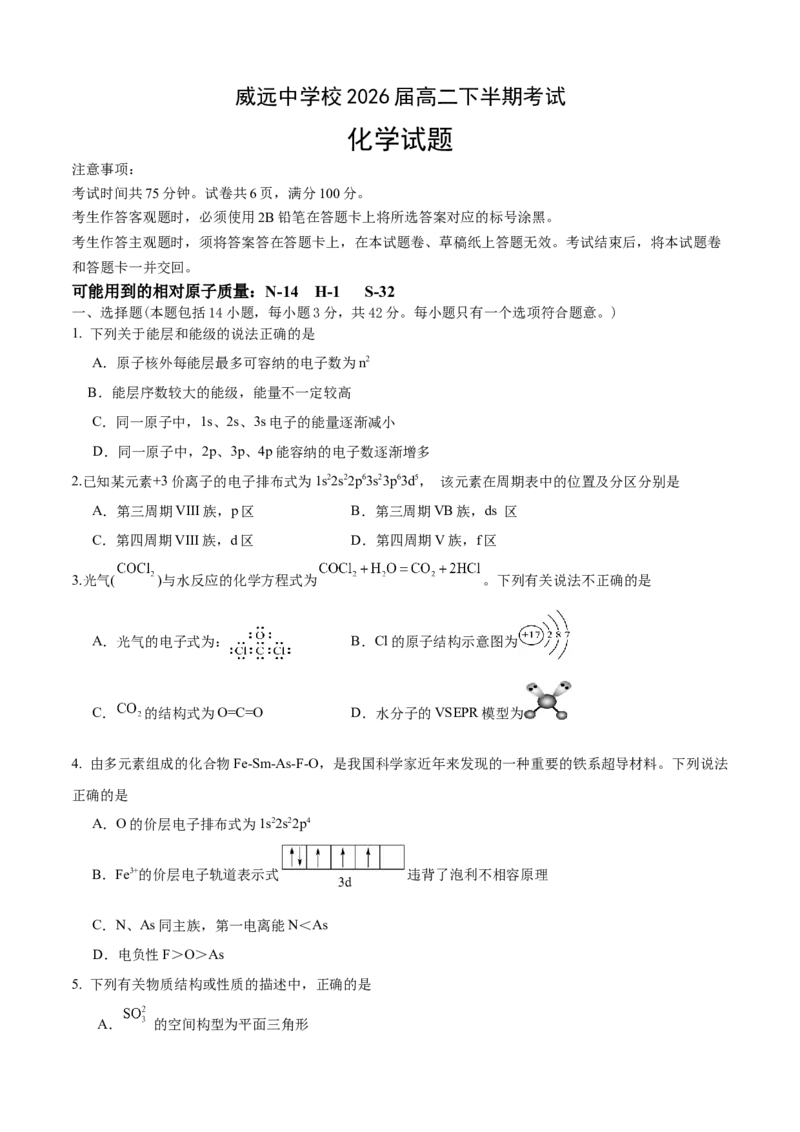
3.光气( )与水反应的化学方程式为 。下列有关说法不正确的是
A.光气的电子式为: B.Cl的原子结构示意图为
C. 的结构式为O=C=O D.水分子的VSEPR模型为
4. 由多元素组成的化合物Fe-Sm-As-F-O,是我国科学家近年来发现的一种重要的铁系超导材料。下列说法
正确的是
A.O的价层电子排布式为1s22s22p4
B.Fe3+的价层电子轨道表示式 违背了泡利不相容原理
C.N、As同主族,第一电离能N<As
D.电负性F>O>As
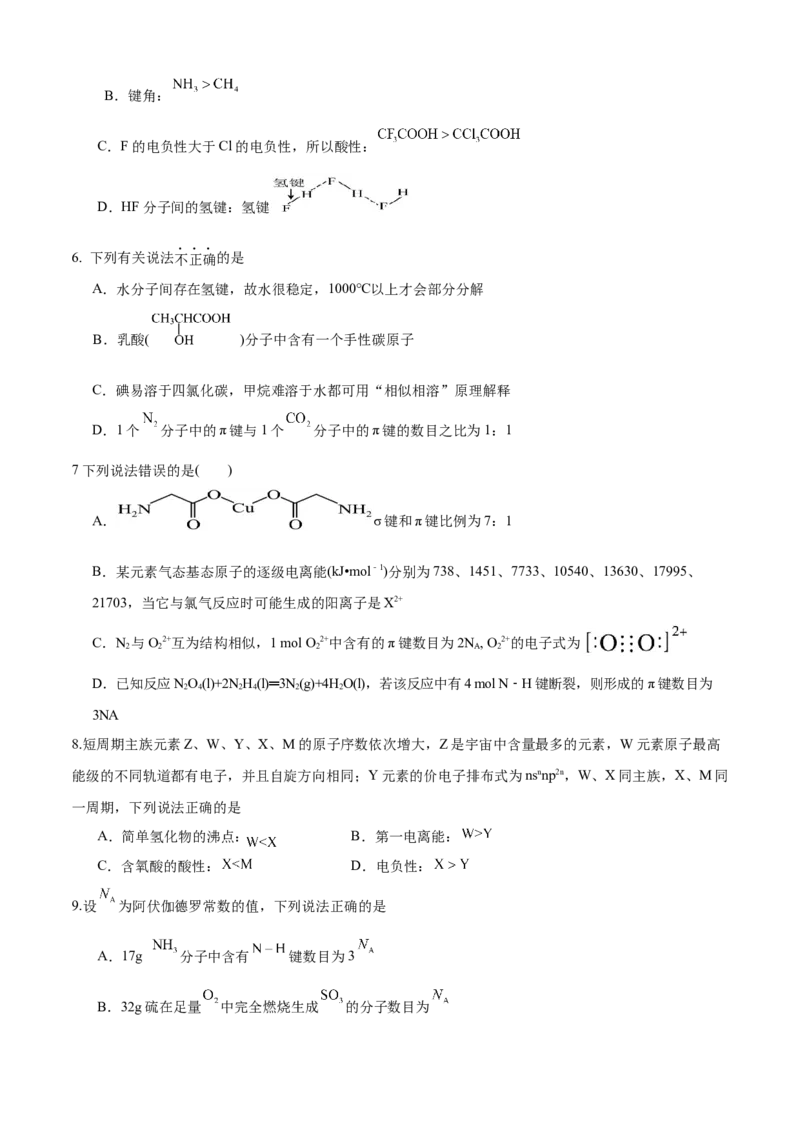
5. 下列有关物质结构或性质的描述中,正确的是
A. 的空间构型为平面三角形B.键角:
C.F的电负性大于Cl的电负性,所以酸性:
D.HF分子间的氢键:氢键
6. 下列有关说法不正确的是
A.水分子间存在氢键,故水很稳定,1000℃以上才会部分分解
B.乳酸( )分子中含有一个手性碳原子
C.碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D.1个 分子中的π键与1个 分子中的π键的数目之比为1:1
7下列说法错误的是( )
A. σ键和π键比例为7:1
B.某元素气态基态原子的逐级电离能(kJ•mol﹣1)分别为738、1451、7733、10540、13630、17995、
21703,当它与氯气反应时可能生成的阳离子是X2+
C.N 与O2+互为结构相似,1 mol O 2+中含有的π键数目为2N , O2+的电子式为
2 2 2 A 2
D.已知反应NO(l)+2N H(l)═3N (g)+4HO(l),若该反应中有4 mol N﹣H键断裂,则形成的π键数目为
2 4 2 4 2 2
3NA
8.短周期主族元素Z、W、Y、X、M的原子序数依次增大,Z是宇宙中含量最多的元素,W元素原子最高
能级的不同轨道都有电子,并且自旋方向相同;Y元素的价电子排布式为nsnnp2n,W、X同主族,X、M同
一周期,下列说法正确的是
A.简单氢化物的沸点: B.第一电离能:
C.含氧酸的酸性: D.电负性:
9.设 为阿伏伽德罗常数的值,下列说法正确的是
A.17g 分子中含有 键数目为3
B.32g硫在足量 中完全燃烧生成 的分子数目为C.标准状况下,22.4L 中含有Cl数目为3
D.1mol 受热或光照分解,转移电子数目为2
10. 下图所示的有机物是合成青蒿素的原料之一。下列有关该有机物的说法错误的是
A.分子式为C H O
6 12 4
B.既能发生取代反应,又能发生加成反应
C.可使酸性KMnO 溶液褪色
4
D.标况下,1mol该有机物与足量金属钠反应放出33.6L氢气
11.下列操作能达到相应实验目的的是
实验目的 操作
向 还原 所得到的产物中加入适量稀盐酸将固体全部溶
A 验证 是否被全部还原为
解后,再滴加 溶液,观察溶液颜色变化
除去 中混有的少量 ,并
B 将混合气体通过盛有足量溴水溶液的洗气瓶,进行洗气
得到纯净且干燥的
C 验证木炭与浓 反应生成 向盛有浓 的烧杯中插入红热的炭,观察现象
D 检验 溶液是否全部变质 取待测液加入到酸性 溶液中,观察现象
12. 下列物质性质与用途对应的离子方程式书写正确的是
A.绿矾处理含 的酸性废水:
B.NaO 与水反应用作潜水艇氧气来源:
2 2
C.HO 氧化海带灰酸性浸出液提取碘:
2 2
D.向NaHSO 溶液中加入足量Ba(OH) 溶液:
4 2
13. Ni可活化 制得 ,其反应历程如图所示:下列关于活化历程的说法正确的是A.总反应的 B.Ni不是该反应的催化剂
C.该反应历程中没有非极性键的断裂和生成 D.总反应的速率由“中间体1→中间体2”决定
14. 常温下,几种弱酸的电离平衡常数如表所示,下列说法正确的是
化学式 HCOOH HCO HCN
2 3
K=1.8×10﹣
电离平衡常数 K =4.3×10﹣7 K =5.6×10﹣11 K=4.9×10﹣10
4 1 2
A.结合H+的能力由大到小:CO >CN﹣>HCO >HCOO﹣
B.等物质的量浓度的 HCOONa溶液和NaCN溶液,pH大小顺序:HCOONa>NaCN
C.加水稀释 HCOOH溶液,其电离平衡常数将减小
D.HCO 溶液和NaCN溶液反应的离子方程式为HCO+2CN﹣=2HCN+CO
2 3 2 3
二、填空题(共4个大题,共58/分)
15.回答下列问题:
(1)二氯化二硫( )是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构如
图所示。
① 的化学键类型为 (填下列序号),它
是 (填“极性”或“非极性”)分子。
a.极性键 b.非极性键 c.极性键和非极性键
② 中硫的化合价为 。
③ 分子中 原子的杂化轨道类型为 。
(2)原子序数小于36的 、 、 、 、J、G六种元素,原子序数依次增大,其中 元素的原子在所有原
子中半径最小, 元素原子核外有三种不同的能级且各个能级所填充的电子数相同, 元素原子最外层电
子数是内层电子数的3倍,J元素原子核外的 能级有两个电子,G元素原子核外有6个未成对电子(用元
素符号或化学式表示)。
①写出G元素的基态原子的价电子排布式 ; 分子中 键与 键数目之比为 。
② 、 、 三种元素第一电离能由大到小的顺序为 (用元素符号表示)。
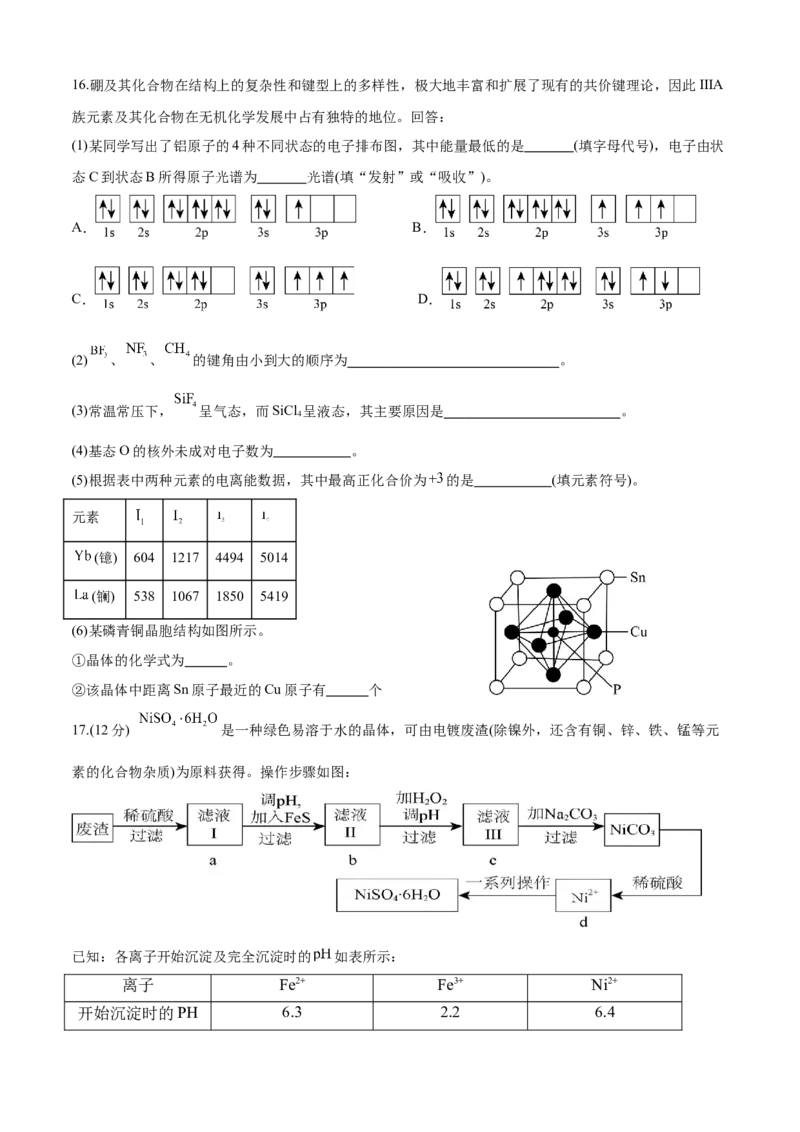
③ 在水中的溶解度较大,可能的原因有 。(写出两个即可)16.硼及其化合物在结构上的复杂性和键型上的多样性,极大地丰富和扩展了现有的共价键理论,因此IIIA
族元素及其化合物在无机化学发展中占有独特的地位。回答:
(1)某同学写出了铝原子的4种不同状态的电子排布图,其中能量最低的是 (填字母代号),电子由状
态C到状态B所得原子光谱为 光谱(填“发射”或“吸收”)。
A. B.
C. D.
(2) 、 、 的键角由小到大的顺序为 。
(3)常温常压下, 呈气态,而SiCl 呈液态,其主要原因是 。
4
(4)基态O的核外未成对电子数为 。
(5)根据表中两种元素的电离能数据,其中最高正化合价为 的是 (填元素符号)。
元素
(镱) 604 1217 4494 5014
(镧) 538 1067 1850 5419
(6)某磷青铜晶胞结构如图所示。
①晶体的化学式为 。
②该晶体中距离Sn原子最近的Cu原子有 个
17.(12分) 是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁、锰等元
素的化合物杂质)为原料获得。操作步骤如图:
已知:各离子开始沉淀及完全沉淀时的 如表所示:
离子 Fe2+ Fe3+ Ni2+
开始沉淀时的PH 6.3 2.2 6.4完全沉淀时的PH 9.7 3.2 8.4
根据要求回答下列问题
(1)向滤液中加入 固体是为了生成更难溶于水的硫化物沉淀而除去 等杂质,则除去 的离
子方程式为 。
(2)调节滤液Ⅱ的 应控制在范围为 。
(3)检验滤液Ⅲ中杂质金属离子是否除尽最合理的试剂是 。
(4)滤液Ⅲ溶质的主要成分是 ,加 过滤后得到 固体,再加适量稀硫酸溶解又生成
,这两步操作的目的是 。
(5)硫酸镍在强碱溶液中用 氧化,可沉淀出能用作镍镉电池正极材料的 。写出该反应的离子
方程式 。
(6)在废水处理中常用HS将Mn2+转化为MnS除去,向含有0.020mol/LMn2+的废水中通入一定量的HS气
2 2
体,调节溶液的PH=a,当c(HS-)=1.0×10-4mol/L时,Mn2+开始沉淀,则 [已知:25℃时,
HS的电离常数K =1.0×10-7,K =7.0×10-15;K =1.4×10-15]
2 a1 a2 sp
18.(16分)党的二十大报告指出,要积极稳妥推进碳达峰、碳中和。二氧化碳的捕集、利用与封存(CCUS)已
成为科学家研究的重要课题。
I.工业上用 和 在一定条件下可以合成乙烯:
已知:①
②
③
(1) (用 、 、 表示)。
(2)恒温恒容下,向密闭容器按投料比 通入原料气,能判断该反应处于平衡状态的是
___________(填标号)。
A.B.混合气体的密度保持不变
C.混合气体的平均相对分子质量保持不变
D. 保持不变
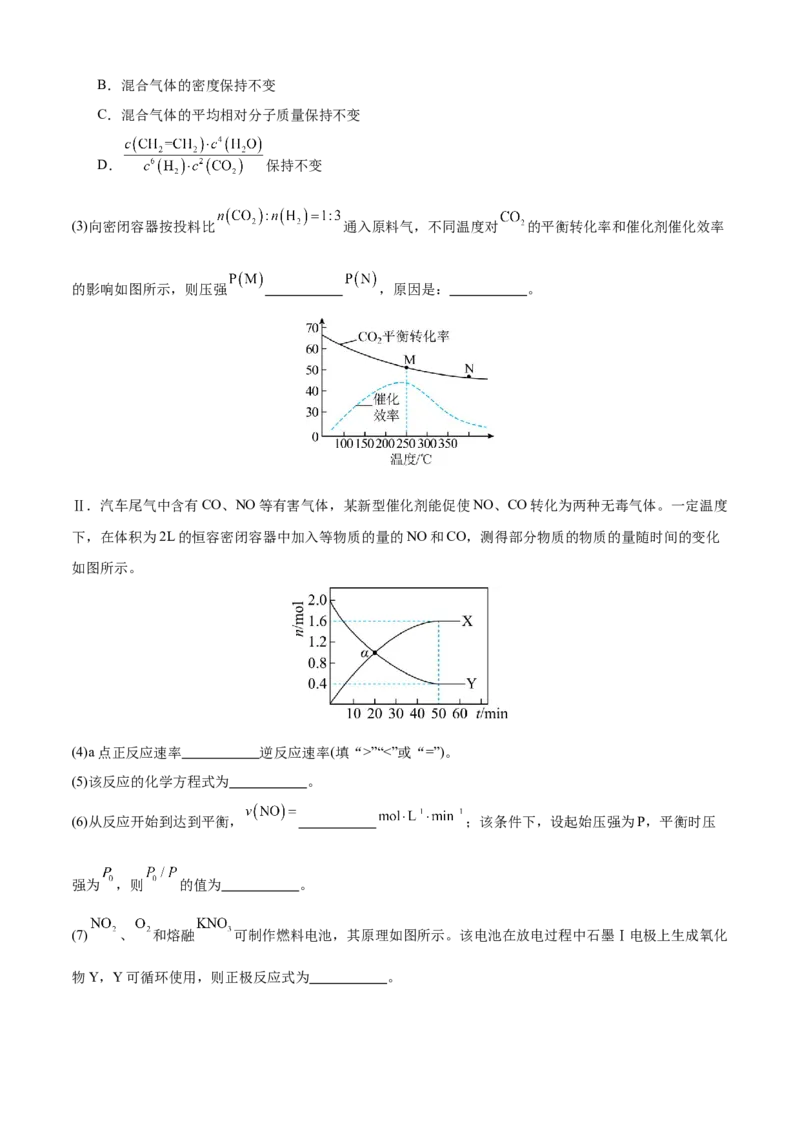
(3)向密闭容器按投料比 通入原料气,不同温度对 的平衡转化率和催化剂催化效率
的影响如图所示,则压强 ,原因是: 。
Ⅱ.汽车尾气中含有CO、NO等有害气体,某新型催化剂能促使NO、CO转化为两种无毒气体。一定温度
下,在体积为2L的恒容密闭容器中加入等物质的量的NO和CO,测得部分物质的物质的量随时间的变化
如图所示。
(4)a点正反应速率 逆反应速率(填“>”“<”或“=”)。
(5)该反应的化学方程式为 。
(6)从反应开始到达到平衡, ;该条件下,设起始压强为P,平衡时压
强为 ,则 的值为 。
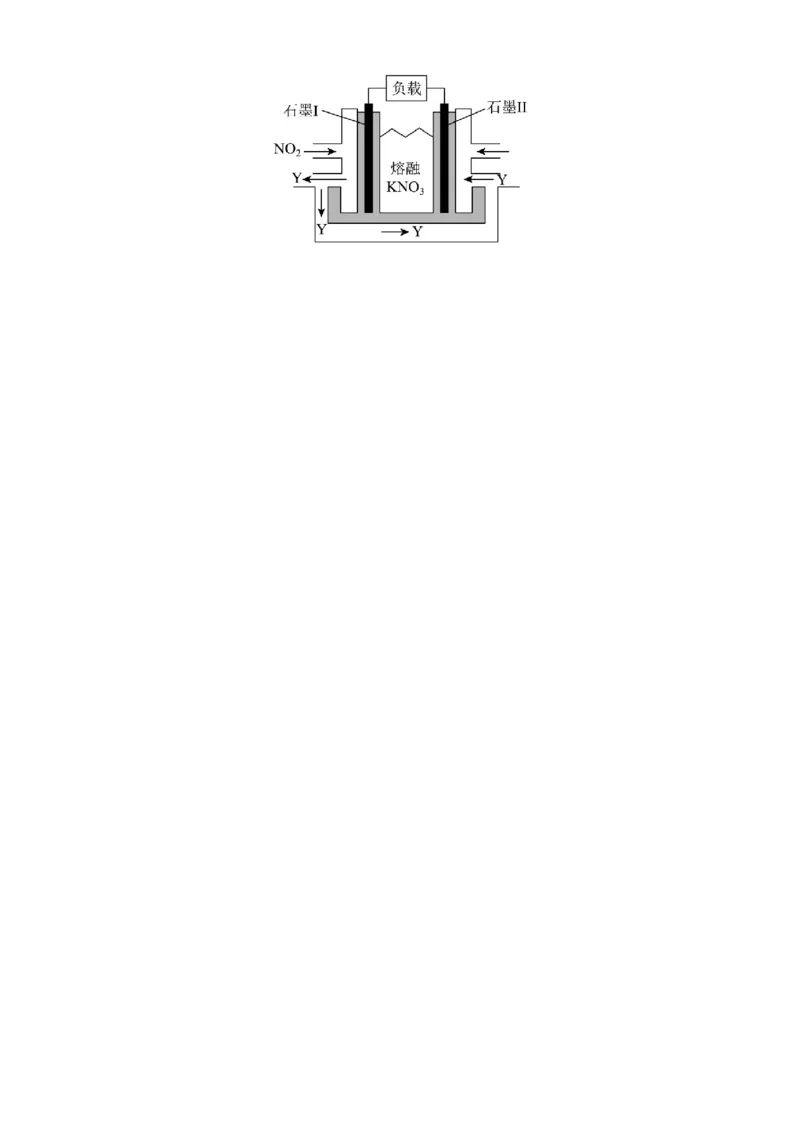
(7) 、 和熔融 可制作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化
物Y,Y可循环使用,则正极反应式为 。威远中学校 2026 届高二下半期考试
化学答案
1-5 BCADC 6-10 AABAB 11-14 DCBA
15.(14分,未标注的各为两分)
(1)①c(1分) 极性(1分) ②+1 ③sp3
(2)①3d54s1 3∶2 ②N>O>C ③NH 能与水反应、NH 与水都是极性分子、NH 与水分子之
3 3 3
间还可以形成氢键(任写两个)
16.(16分)
(1) A 发射
(2)NF