文档内容
台州市 2023 年 11 月选考科目教学质量评估试题
化 学
命题:方钰锭(仙居中学) 刘聪聪(天台中学)
审题:陈晓勇(路桥中学)
本试卷分选择题和非选择题两部分,共8页,满分100分,考试时间90分钟。
考生须知:
l.答题前,请务必将自己的姓名、准考证号用黑色字迹的签字笔或钢笔分别填写在试题
卷和答题纸规定的位置上。
2.答题时,请按照答题纸上“注意事项”的要求,在答题纸相应的位置上规范作答,在本
试题卷上的作答一律无效。
3.非选择题的答案必须使用黑色字迹的签字笔或钢笔写在答题纸上相应区域内,作图
时可先使用2B铅笔,确定后必须使用黑色字迹的签字笔或钢笔描黑。
4.可能用到的相对原子质量:H1 Li7 C12 N14 O16 Mg24 Al27 S32
选择题部分
一、选择题(本大题共16小题,每小题3分,共48分。每小题列出的四个备选项中只有一
个是符合题目要求的,不选、多选、错选均不得分)
1.碳纤维被称为“黑色黄金”、“材料之王”,它属于
A.有机高分子材料 B.无机非金属材料 C.合成纤维 D.金属材料
2.苯甲酸钠是一种重要的盐,下列关于苯甲酸钠说法不.正.确.的是
A.具有抑菌作用,常用作防腐剂
B.属于强电解质
C.可由甲苯被氧化成苯甲酸,苯甲酸再与氢氧化钠反应制得
D.水溶液呈酸性
3.下列化学用语表示不.正.确.的是
A.用电子式表示K S形成:
2
B.基态锗原子的简化电子排布式:[Ar]4s24p2
C.氯仿的球棍模型:
D.聚氯乙烯的结构简式:
4. 物质的性质决定用途,下列两者对应关系正确的是
A.液氨汽化时吸收大量热,可用作制冷剂
B.SO 具有氧化性,葡萄酒中添加SO 起到漂白作用
2 2
C.钾钠合金具有还原性,用于快中子反应堆的热交换剂
D.FeCl 具有氧化性,可用作净水剂
3
第1页 共8页
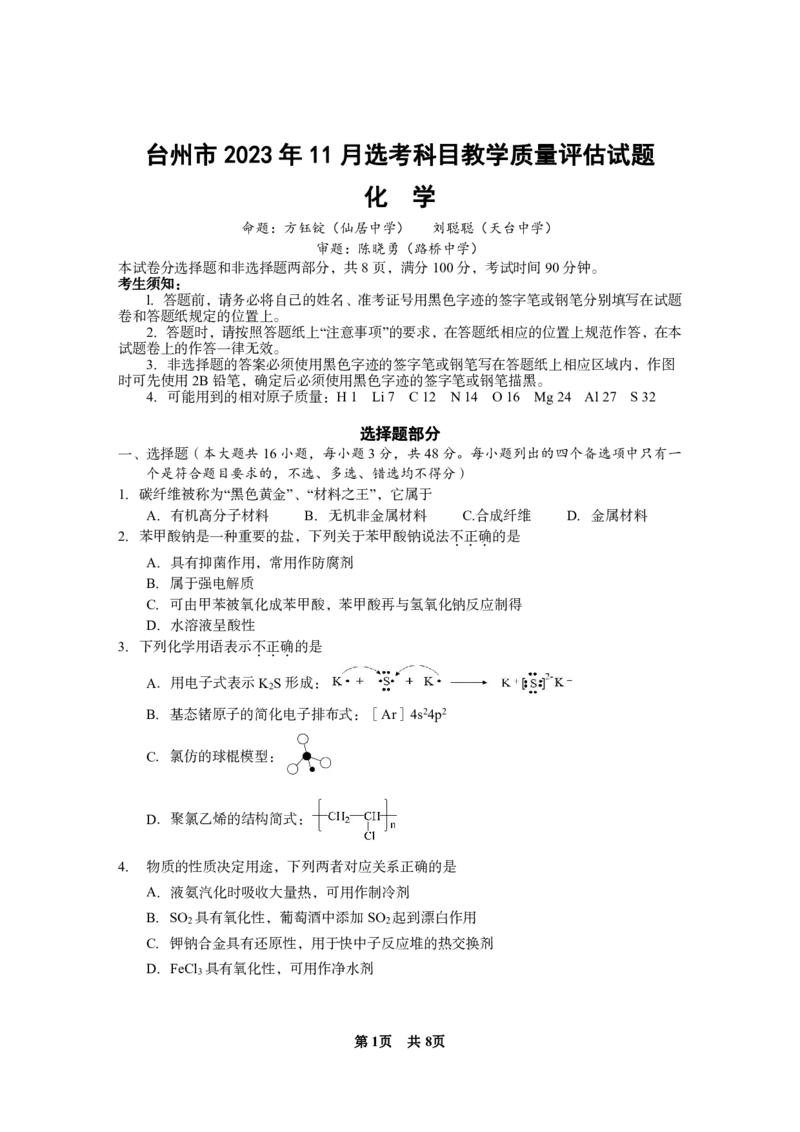
{#{QQABDY4AggAIAAAAAQhCEwVQCkIQkBGCCIoOgAAIoAAAgBFABCA=}#}5.下列说法正确的是
第5题图
A.图①左侧通入潮湿的氯气,检验干燥的氯气是否有漂白性
B.图②由MgCl ·5H O制取无水MgCl 固体
2 2 2
C.图③验证石蜡油热分解产物里是否有不饱和烃
D.图④实验室制备少量NH
3
6.关于反应4Na
2
S
2
O
3
+O
2
+2H
2
SO
4
2Na
2
S
4
O
6
+2H
2
O+2Na
2
SO
4
,下列说法不.正.确.的是
A.Na S O 是氧化产物 B.每生成1molNa S O 时,转移4mol电子
2 4 6 2 4 6
C.Na S O 发生氧化反应 D.氧化剂与还原剂的物质的量之比为1∶4
2 2 3
7.N 为阿伏加德罗常数的值,下列说法正确的是
A
A.标准状况下,60gCH COOH中H+数目为N
3 A
B.72gC 中含有的σ键数目为9N
60 A
C.50mL18mol/L浓硫酸与足量铁加热反应,转移电子数小于0.9N
A
D.由2H和18O组成的水22g,其中所含的中子数为11N
A
8.下列说法不.正.确.的是
A.核磁共振氢谱中不同的氢具有不同的化学位移,且吸收峰面积与氢原子数成正比
B.聚四氟乙烯和脲醛树脂分别是通过加聚反应和缩聚反应形成的有机高分子
C.某有机化合物的相对分子质量为44,则其分子式一定为C H
3 8
D.麦芽糖既能发生水解反应,又能发生银镜反应
9.下列反应的化学方程式或离子方程式不.正.确.的是
A.乙醛与氰化氢发生加成反应:CH CHO+HCN CH CH(OH)CN
3 3
B.单质铜与稀硝酸反应:3Cu+2NO −+8H+ 3Cu2++2NO↑+4H O
3 2
C.苯酚钠溶液中通入少量CO ,2C H O−+H O+CO 2C H OH+CO 2−
2 6 5 2 2 6 5 3
D.Al溶于足量的氢氧化钠溶液:2Al+6H O+2OH− 2[Al(OH) ]−+3H ↑
2 4 2
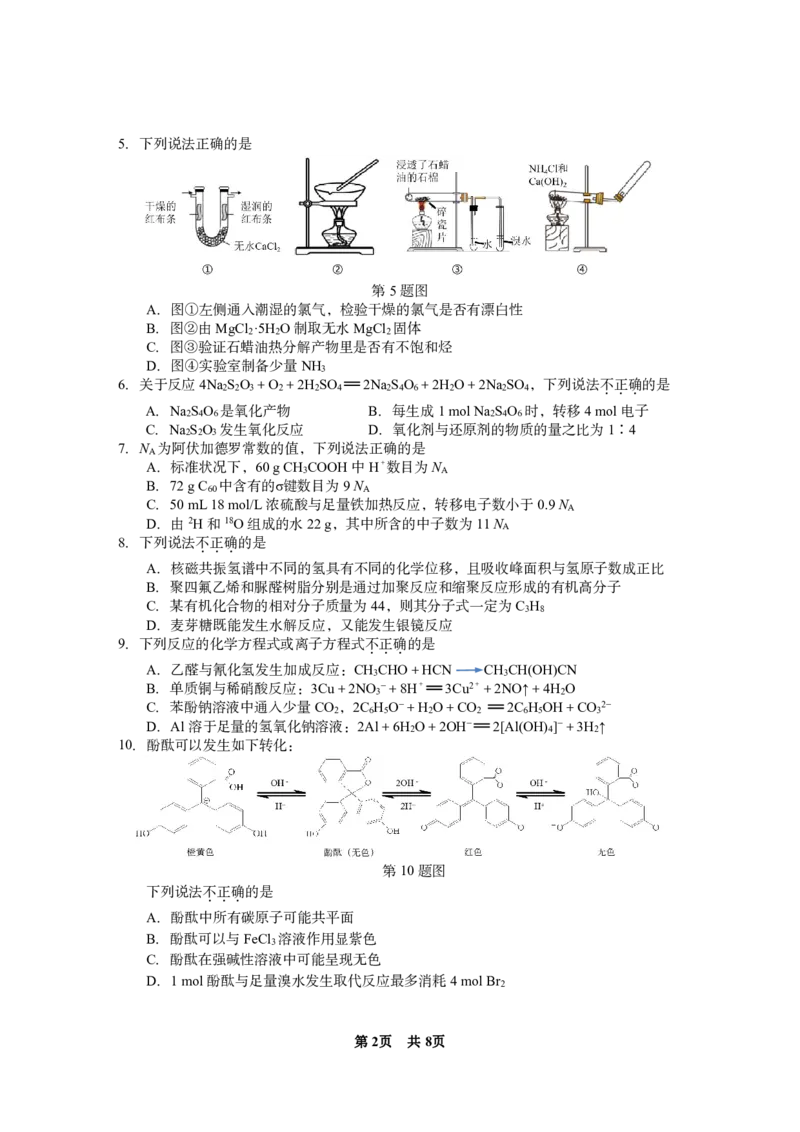
10.酚酞可以发生如下转化:
第10题图
下列说法不.正.确.的是
A.酚酞中所有碳原子可能共平面
B.酚酞可以与FeCl 溶液作用显紫色
3
C.酚酞在强碱性溶液中可能呈现无色
D.1mol酚酞与足量溴水发生取代反应最多消耗4molBr
2
第2页 共8页
{#{QQABDY4AggAIAAAAAQhCEwVQCkIQkBGCCIoOgAAIoAAAgBFABCA=}#}11.X、Y、Z、M、Q五种短周期主族元素,原子序数依次增大,X、Y同主族,Z位于周期
表第13列,M是地壳中含量最多的元素,Q基态原子p轨道上有4个电子。下列说法
不.正.确.的是
A.原子半径大小:Q>M>X
B.分子X 、M 均为非极性分子
2 3
C.气态QM 分子构型为平面正三角形
3
D.金属Y在空气中燃烧生成Y O
2
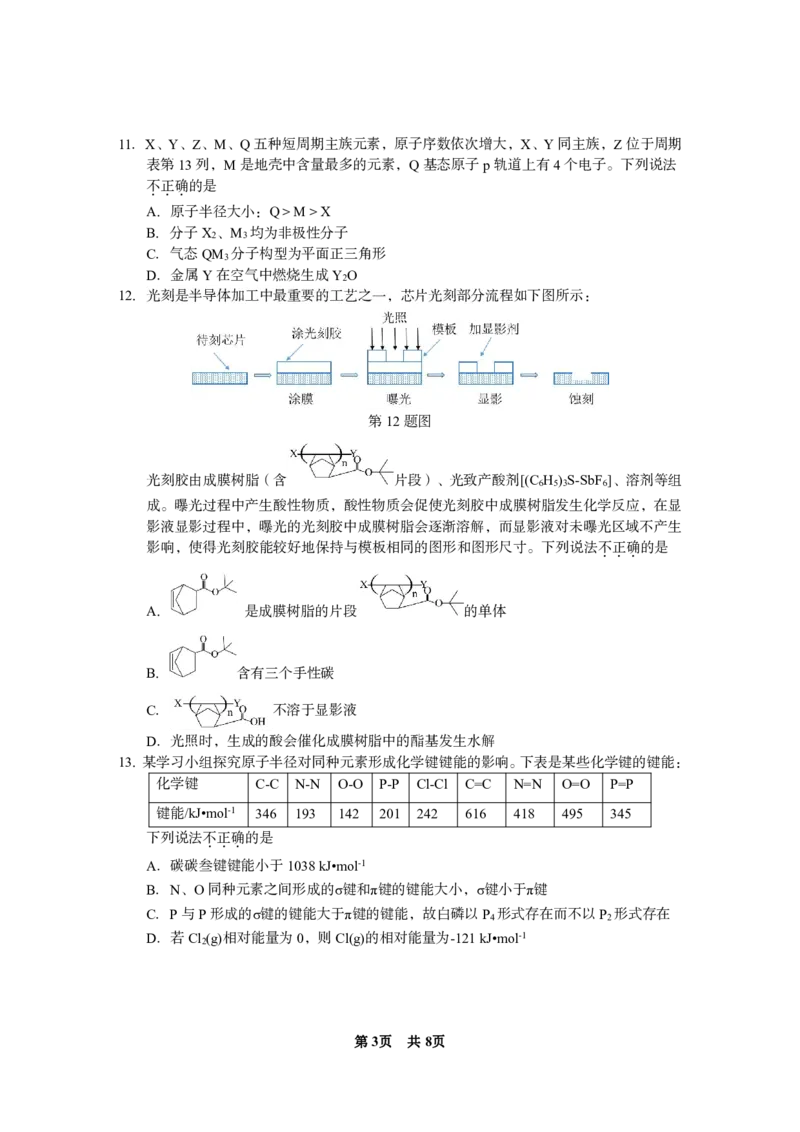
12.光刻是半导体加工中最重要的工艺之一,芯片光刻部分流程如下图所示:
第12题图
光刻胶由成膜树脂(含 片段)、光致产酸剂[(C H ) S-SbF ]、溶剂等组
6 5 3 6
成。曝光过程中产生酸性物质,酸性物质会促使光刻胶中成膜树脂发生化学反应,在显
影液显影过程中,曝光的光刻胶中成膜树脂会逐渐溶解,而显影液对未曝光区域不产生
影响,使得光刻胶能较好地保持与模板相同的图形和图形尺寸。下列说法不.正.确.的是
A. 是成膜树脂的片段 的单体
B. 含有三个手性碳
C. 不溶于显影液
D.光照时,生成的酸会催化成膜树脂中的酯基发生水解
13.某学习小组探究原子半径对同种元素形成化学键键能的影响。下表是某些化学键的键能:
化学键 C-C N-N O-O P-P Cl-Cl C=C N=N O=O P=P
键能/kJ•mol-1 346 193 142 201 242 616 418 495 345
下列说法不.正.确.的是
A.碳碳叁键键能小于1038kJ•mol-1
B.N、O同种元素之间形成的σ键和π键的键能大小,σ键小于π键
C.P与P形成的σ键的键能大于π键的键能,故白磷以P 形式存在而不以P 形式存在
4 2
D.若Cl (g)相对能量为0,则Cl(g)的相对能量为-121kJ•mol-1
2
第3页 共8页
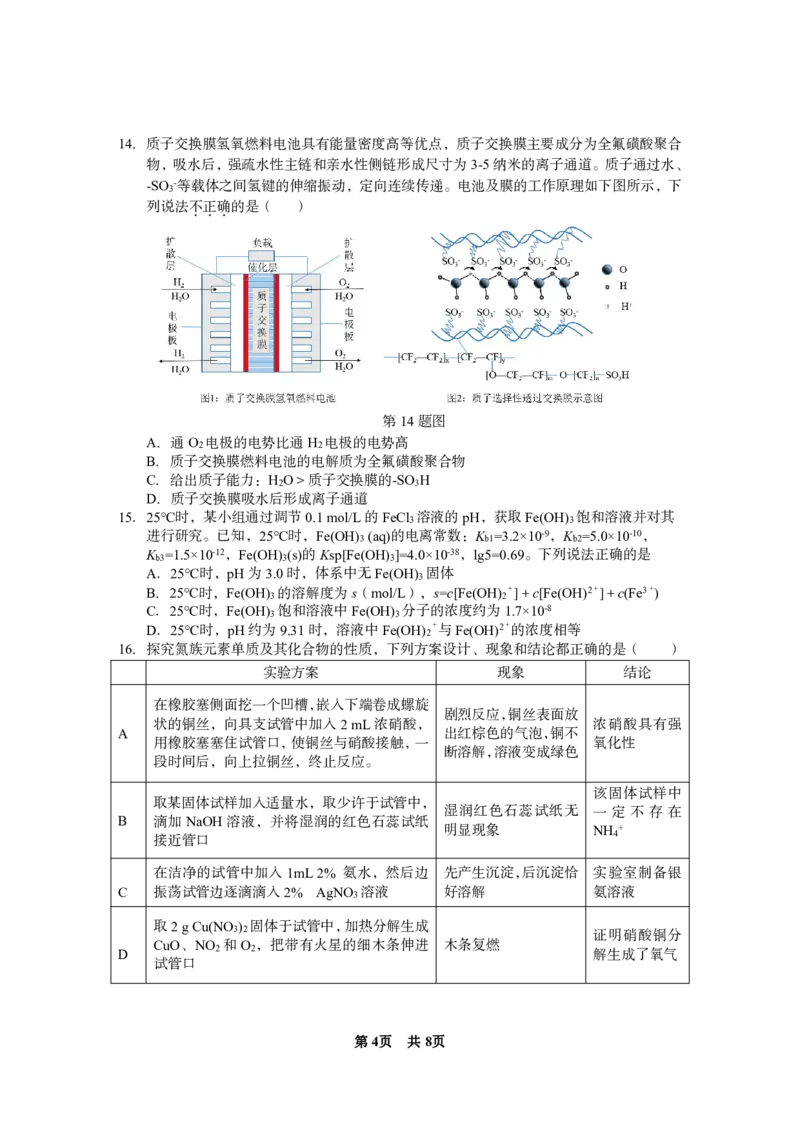
{#{QQABDY4AggAIAAAAAQhCEwVQCkIQkBGCCIoOgAAIoAAAgBFABCA=}#}14.质子交换膜氢氧燃料电池具有能量密度高等优点,质子交换膜主要成分为全氟磺酸聚合
物,吸水后,强疏水性主链和亲水性侧链形成尺寸为3-5纳米的离子通道。质子通过水、
-SO -等载体之间氢键的伸缩振动,定向连续传递。电池及膜的工作原理如下图所示,下
3
列说法不.正.确.的是( )
第14题图
A.通O 电极的电势比通H 电极的电势高
2 2
B.质子交换膜燃料电池的电解质为全氟磺酸聚合物
C.给出质子能力:H O>质子交换膜的-SO H
2 3
D.质子交换膜吸水后形成离子通道
15.25℃时,某小组通过调节0.1mol/L的FeCl 溶液的pH,获取Fe(OH) 饱和溶液并对其
3 3
进行研究。已知,25℃时,Fe(OH) (aq)的电离常数:K =3.2×10-9,K =5.0×10-10,
3 b1 b2
K =1.5×10-12,Fe(OH) (s)的Ksp[Fe(OH) ]=4.0×10-38,lg5=0.69。下列说法正确的是
b3 3 3
A.25℃时,pH为3.0时,体系中无Fe(OH) 固体
3
B.25℃时,Fe(OH) 的溶解度为s(mol/L),s=c[Fe(OH) +]+c[Fe(OH)2+]+c(Fe3+)
3 2
C.25℃时,Fe(OH) 饱和溶液中Fe(OH) 分子的浓度约为1.7×10-8
3 3
D.25℃时,pH约为9.31时,溶液中Fe(OH) +与Fe(OH)2+的浓度相等
2
16.探究氮族元素单质及其化合物的性质,下列方案设计、现象和结论都正确的是( )
实验方案 现象 结论
在橡胶塞侧面挖一个凹槽,嵌入下端卷成螺旋
剧烈反应,铜丝表面放
状的铜丝,向具支试管中加入2mL浓硝酸, 浓硝酸具有强
A 出红棕色的气泡,铜不
用橡胶塞塞住试管口,使铜丝与硝酸接触,一 氧化性
断溶解,溶液变成绿色
段时间后,向上拉铜丝,终止反应。
该固体试样中
取某固体试样加入适量水,取少许于试管中,
湿润红色石蕊试纸无 一 定 不 存 在
B 滴加NaOH 溶液,并将湿润的红色石蕊试纸
明显现象 NH +
接近管口 4
在洁净的试管中加入1mL2% 氨水,然后边 先产生沉淀,后沉淀恰 实验室制备银
C 振荡试管边逐滴滴入2% AgNO 溶液 好溶解 氨溶液
3
取2gCu(NO ) 固体于试管中,加热分解生成
3 2 证明硝酸铜分
CuO、NO 和O ,把带有火星的细木条伸进 木条复燃
D 2 2 解生成了氧气
试管口
第4页 共8页
{#{QQABDY4AggAIAAAAAQhCEwVQCkIQkBGCCIoOgAAIoAAAgBFABCA=}#}非选择题部分
二、非选择题(本大题共5小题,共52分)
17.(10分)Cu是生活中常见的金属元素,在材料、农业、医药等领域具有广泛应用。
回答下列问题:
(1)Al-Zn-Mg-Cu合金具有优异的耐腐蚀性能和高强度,是一种很有发展前景的合金材料。
①基态Zn原子的价电子轨道表示式为 ▲ ,位于周期表的 ▲ 区。
②AlF 的熔点为1090℃,远高于AlCl 的192℃,原因是 ▲ 。
3 3
③下列说法不.正.确.的是 ▲
A.该合金的硬度比其成分金属的大,是因为加入其他金属元素,其内部金属原子有
规则的层状排列被改变
B.第一电离能(I ):I (Mg)I (Cu)
1 1 1 1 1
C.MgCl 熔融时不导电,所以工业上用电解熔融MgO来制取金属镁
2
D.Cu元素的焰色为绿色,与铜原子核外电子跃迁释放能量有关
(2)Mg(BH ) 是一种新型配位氢化物储氢材料,因具有较高的质量储氢密度和体积储氢
4 2
密度而备受关注。
①Mg(BH ) 中各元素的电负性由大到小的排列顺序为 ▲ 。
4 2
②Mg(BH ) 中B原子的杂化方式为 ▲ 。
4 2
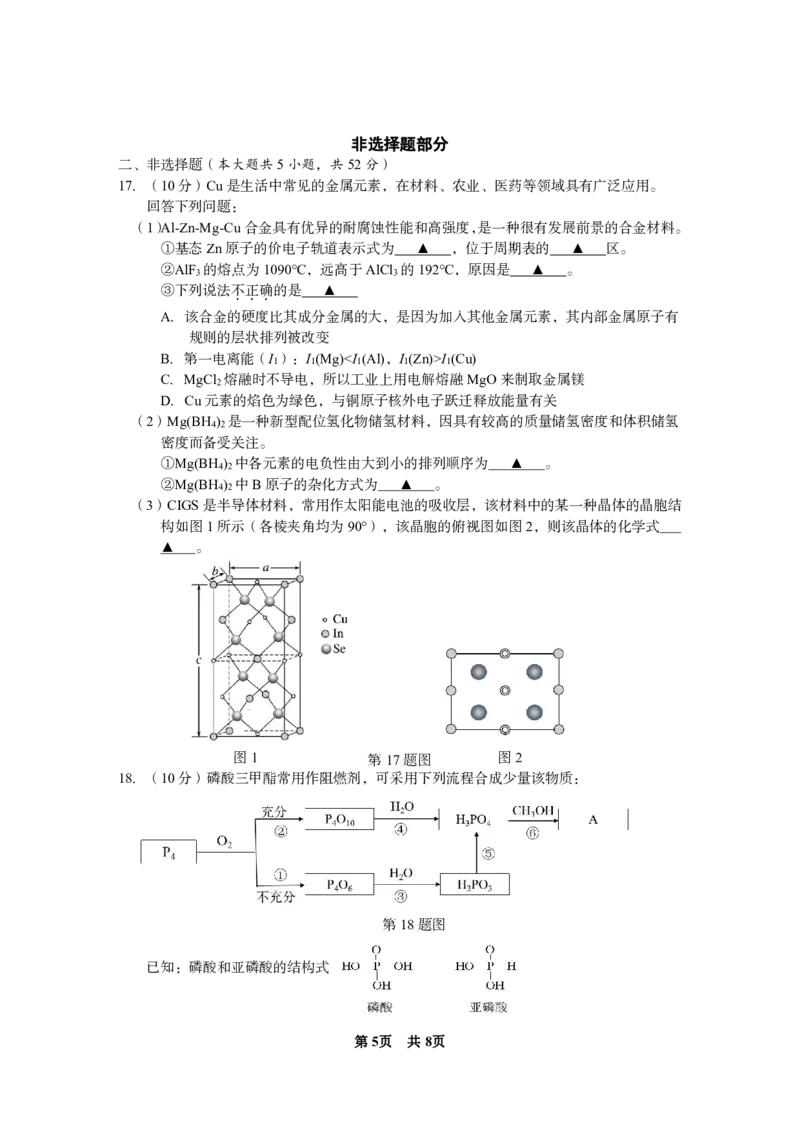
(3)CIGS是半导体材料,常用作太阳能电池的吸收层,该材料中的某一种晶体的晶胞结
构如图1所示(各棱夹角均为90°),该晶胞的俯视图如图2,则该晶体的化学式
▲ 。
图1 第17题图 图2
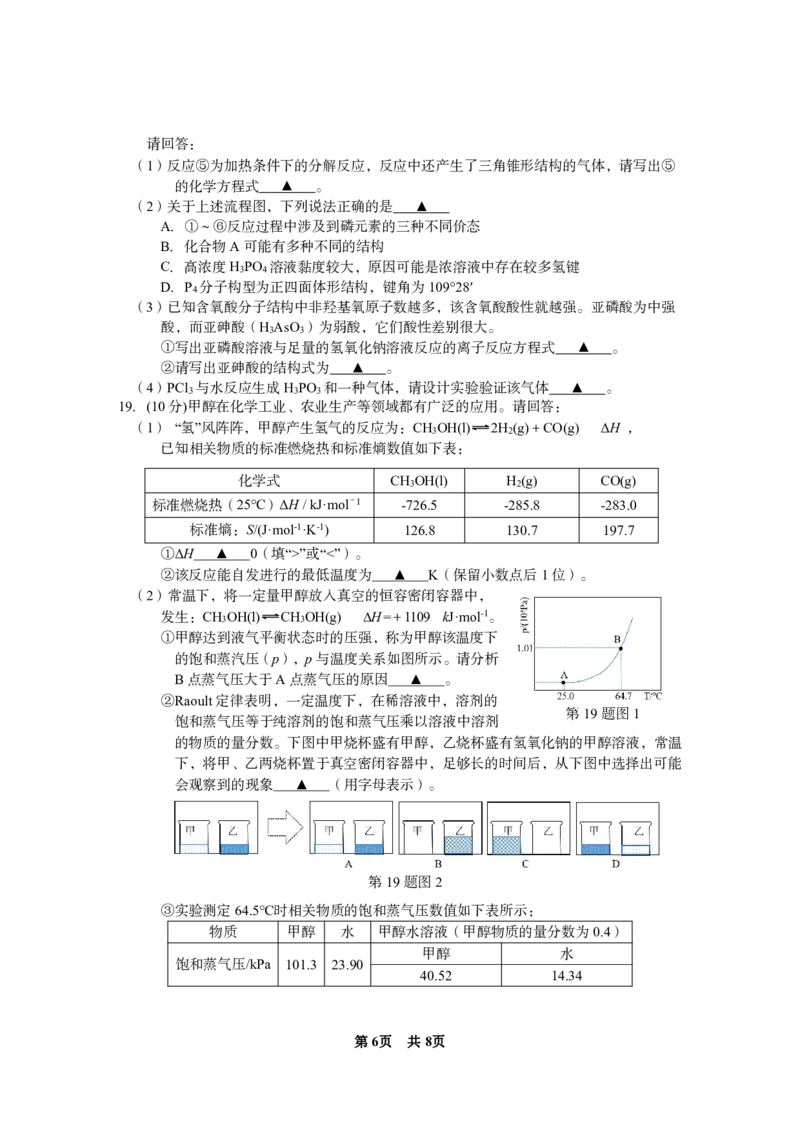
18.(10分)磷酸三甲酯常用作阻燃剂,可采用下列流程合成少量该物质:
第18题图
已知:磷酸和亚磷酸的结构式
第5页 共8页
{#{QQABDY4AggAIAAAAAQhCEwVQCkIQkBGCCIoOgAAIoAAAgBFABCA=}#}请回答:
(1)反应⑤为加热条件下的分解反应,反应中还产生了三角锥形结构的气体,请写出⑤
的化学方程式 ▲ 。
(2)关于上述流程图,下列说法正确的是 ▲
A.①~⑥反应过程中涉及到磷元素的三种不同价态
B.化合物A可能有多种不同的结构
C.高浓度H PO 溶液黏度较大,原因可能是浓溶液中存在较多氢键
3 4
D.P 分子构型为正四面体形结构,键角为109°28′
4
(3)已知含氧酸分子结构中非羟基氧原子数越多,该含氧酸酸性就越强。亚磷酸为中强
酸,而亚砷酸(H AsO )为弱酸,它们酸性差别很大。
3 3
①写出亚磷酸溶液与足量的氢氧化钠溶液反应的离子反应方程式 ▲ 。
②请写出亚砷酸的结构式为 ▲ 。
(4)PCl 与水反应生成H PO 和一种气体,请设计实验验证该气体 ▲ 。
3 3 3
19.(10分)甲醇在化学工业、农业生产等领域都有广泛的应用。请回答:
(1) “氢”风阵阵,甲醇产生氢气的反应为:CH OH(l) 2H (g)+CO(g) ΔH ,
3 2
已知相关物质的标准燃烧热和标准熵数值如下表:
化学式 CH OH(l) H (g) CO(g)
3 2
标准燃烧热(25℃)ΔH/kJ·mol-1 -726.5 -285.8 -283.0
标准熵:S/(J·mol-1·K-1) 126.8 130.7 197.7
①ΔH ▲ 0(填“>”或“<”)。
②该反应能自发进行的最低温度为 ▲ K(保留小数点后1位)。
(2)常温下,将一定量甲醇放入真空的恒容密闭容器中,
发生:CH OH(l) CH OH(g) ∆H=+1109 kJ·mol-1。
3 3
①甲醇达到液气平衡状态时的压强,称为甲醇该温度下
的饱和蒸汽压(p),p与温度关系如图所示。请分析
B点蒸气压大于A点蒸气压的原因 ▲ 。
②Raoult定律表明,一定温度下,在稀溶液中,溶剂的
第19题图1
饱和蒸气压等于纯溶剂的饱和蒸气压乘以溶液中溶剂
的物质的量分数。下图中甲烧杯盛有甲醇,乙烧杯盛有氢氧化钠的甲醇溶液,常温
下,将甲、乙两烧杯置于真空密闭容器中,足够长的时间后,从下图中选择出可能
会观察到的现象 ▲ (用字母表示)。
第19题图2
③实验测定64.5℃时相关物质的饱和蒸气压数值如下表所示:
物质 甲醇 水 甲醇水溶液(甲醇物质的量分数为0.4)
甲醇 水
饱和蒸气压/kPa 101.3 23.90
40.52 14.34
第6页 共8页
{#{QQABDY4AggAIAAAAAQhCEwVQCkIQkBGCCIoOgAAIoAAAgBFABCA=}#}已知溶液上方蒸气的总压p =54.86kPa,p(CH OH)=x(CH OH)p ,p(CH OH)为甲
总 3 3 总 3
醇蒸气分压,x(CH OH)为甲醇和水的蒸气中CH OH的物质的量分数。
3 3
64.5℃时,甲醇水溶液上方饱和蒸气中,甲醇物质的量分数 ▲ 0.4(填“>”、“<”
或“=”),解释采用蒸馏可获得较高浓度甲醇的原因 ▲ 。
(3)工业用甲醇空气氧化法制甲醛,催化剂为铁钼氧化物。
CH OH(g)+1/2O (g) HCHO(g)+H O(g) K=4.35×1029 v=kp(CH OH)p0.5(O )
3 2 2 3 2
该反应分两步完成:
反应I:CH OH(g)+Cat HCHO(g)+Cat +H O(g) K v =k p(CH OH)χ(Cat )
3 ox red 2 1 1 1 3 ox
反应II:1/2O (g)+Cat Cat K v =k p0.5(O )χ(Cat )
2 red ox 2 2 2 2 red
k、k 、k 为速率方程常数,分压p等于其物质的量分数乘以总压,χ(Cat )为氧化态催
1 2 ox
化剂的物质的量分数;χ(Cat )为还原态催化剂的物质的量分数;反应I为决速步。下
red
列说法不.正.确.的是 ▲ 。
A.K=K ×K
1 2
B.用铁钼氧化物来提高反应I的平衡转化率
C.kp(CH OH)p0.5(O )≈k p(CH OH)χ(Cat )
3 2 1 3 ox
D.若O 和CH OH(g)的分压增大相同倍数,O 比CH OH(g)对总反应速率的影响大
2 3 2 3
20.(10分)某研究小组用磷酸和碳酸钠制备NaH PO •2H O,按如下流程开展实验。
2 4 2
已知:常温下NaH PO •2H O为无色晶体,易溶于水,不溶于乙醇,熔点60℃,热至100℃
2 4 2
时失去全部结晶水。磷酸易溶于乙醇。25℃,H PO 的电离常数:K =6.9×10-3,
3 4 a1
K =6.2×10-8,K =4.8×10-13;H CO 的电离常数:K =4.5×10-7,K =4.7×10-11。
a2 a3 2 3 a1 a2
回答下列问题:
(1)步骤II蒸发浓缩时,将溶液转移至 ▲ (填仪器名称)进行加热。
(2)下列说法不.正.确.的是 ▲
A.步骤I,碳酸钠固体宜缓慢分批加入
B.步骤Ⅱ,蒸发浓缩时溶液出现大量晶体时停止加热
C.步骤Ⅲ,洗涤时加入洗涤剂,并用玻璃棒轻轻搅拌
D.步骤Ⅲ,干燥时宜采取真空干燥
(3)步骤I用pH试纸检测溶液的pH=4.2~4.6的具体操作如下,请将操作补充完整:将
广泛pH试纸置于玻璃片上,用玻璃棒蘸取溶液点在试纸中部,与标准比色卡对照、
读数; ▲ 。
(4)一系列操作包括:操作A、洗涤和干燥。
①写出操作A的名称 ▲ 。
②洗涤时,下列洗涤剂最合适的是 ▲ (填序号)。
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液
(5)为测定NaH PO •2H O产品的纯度,可用已知浓度的NaOH标准溶液滴定。已知弱
2 4 2
酸的浓度c和K 值满足c×K 在10-8附近时,才能被准确的滴定,否则不能被滴定。
a a
第7页 共8页
{#{QQABDY4AggAIAAAAAQhCEwVQCkIQkBGCCIoOgAAIoAAAgBFABCA=}#}室温下称取产品试样3.900g溶于水并定容至250mL。取试样溶液25.00mL于锥形
瓶中,用0.1000mol·L-1的NaOH溶液滴定。平行滴定三次,平均消耗NaOH溶液
20.00mL。该产品的纯度为 ▲ %(保留小数点后两位)。
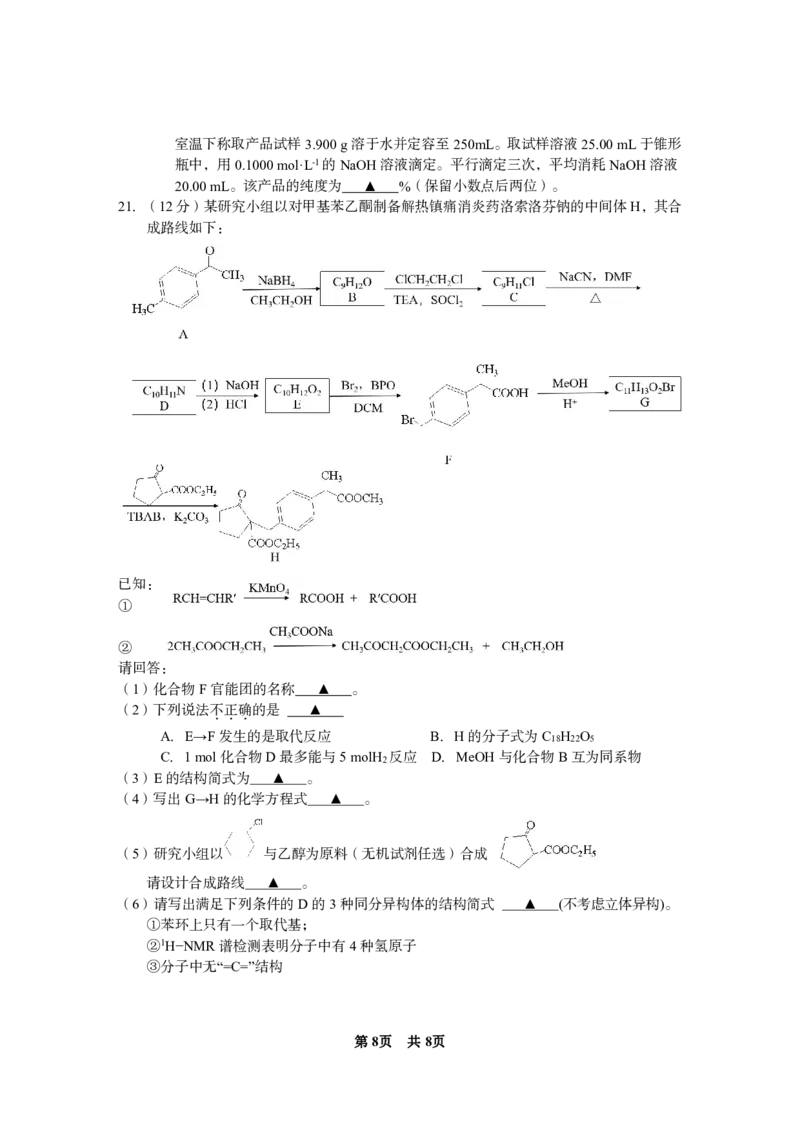
21.(12分)某研究小组以对甲基苯乙酮制备解热镇痛消炎药洛索洛芬钠的中间体H,其合
成路线如下:
已知:
①
②
请回答:
(1)化合物F官能团的名称 ▲ 。
(2)下列说法不.正.确.的是 ▲
A.E→F发生的是取代反应 B.H的分子式为C H O
18 22 5
C.1mol化合物D最多能与5molH 反应 D.MeOH与化合物B互为同系物
2
(3)E的结构简式为 ▲ 。
(4)写出G→H的化学方程式 ▲ 。
(5)研究小组以 与乙醇为原料(无机试剂任选)合成
请设计合成路线 ▲ 。
(6)请写出满足下列条件的D的3种同分异构体的结构简式 ▲ (不考虑立体异构)。
①苯环上只有一个取代基;
②1H−NMR谱检测表明分子中有4种氢原子
③分子中无“=C=”结构
第8页 共8页
{#{QQABDY4AggAIAAAAAQhCEwVQCkIQkBGCCIoOgAAIoAAAgBFABCA=}#}