文档内容
⑤恒容下充入 ⑥升高温度 ⑦将碳粉碎
长春外国语学校 2025-2026 学年第一学期月考考试
A.①②④⑤ B.②⑥⑦ C.③⑥⑦ D.②③⑤⑥
6.如图是第三周期11~17号元素某些性质变化趋势的柱形
高二年级 化学
图,
下列有关说法中正确的是
本试卷共8页。考试结束后,将答题卡交回。 A.y轴表示的可能是第一电离能
注意事项:1.答卷前,考生先将自己的姓名、准考证号码填写清楚,将条形码准确粘贴在考 B.y轴表示的可能是电负性
C.y轴表示的可能是原子半径
生信息条形码粘贴区。
D.y轴表示的可能是形成基态离子转移的电子数
2.答题时请按要求用笔。
7.下列方程式与所给事实不相符的是
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案
A.NaClO、 在强碱性溶液中反应制备 :
无效;在草稿纸、试卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折叠,不要弄破、弄皱,不准使用涂改液、修正带、刮纸 B.灭火时,将泡沫灭火器中的 浓溶液和 浓溶液混合:
刀。
可能用到的相对原子质量:H 1 C 12 O 16 Fe 56
C.将水加热至 ,水的 变小:
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项
D.向氢氧化镁悬浊液中滴入酚酞溶液,溶液变红:
符合题目要求。
1.九三阅兵以“智能化、信息化、无人化”为亮点,全面展示了我国国防科技的最新成就。 8.设 为阿伏加德罗常数的值。下列说法正确的是
下列说法错误的是
A.标准状况下,22.4 L HF所含的分子数目为
A.攻击-11隐形机的吸波涂层:材料为宽频吸波、低反射的纳米金属粉,属于胶体
B.常温下, 溶液中,由水电离出的 数目大于
B.反无人机方队的高功率微波天线罩:材料为耐高温、介电损耗低的氮化铝陶瓷,属于新
型无机非金属材料 C. 的 溶液中含有0.1 个
C.舰载防空方队的激光武器光学窗口与波导:材料为质轻、透光好的聚碳酸酯(PC),属于
D. 含共价键的数目为0.4
有机高分子材料
D.100坦克车体与炮塔部分结构:材料为高强、高韧、高精度的铝合金,属于合金材料
2.2024年5月8日,我国第三艘航空母舰福建舰顺利完成首次海试。舰体表面需要采取有效 9.下列实验方案不能达到探究目的的是
的防锈措施,下列防锈措施中不形成表面钝化膜的是
选项 探究目的 实验方案
A.发蓝处理 B.阳极氧化 C.表面渗镀 D.喷涂油漆
向两支试管中各加入2 mL 0.1 mol/L 溶液,分
3.价电子排布图 ,表示下列哪种微粒
温度对化学反应速率的 别放入盛有冷水和热水的两个烧杯中,再同时分别向
A
影响
两支试管中加入2 mL 0.1 mol/L 溶液,振荡,
A.Mn B.Co C.Fe3+ D.Cu2+
观察现象
4.如表给出的是8种元素的电负性的值,运用表中数据解答下题
在一块除去铁锈的铁片上滴1滴含有酚酞的食盐水,
元素 Na Mg Al Si P S Cl K
B 铁片上发生了吸氧腐蚀
静置2~3 min,溶液边缘出现红色
电负性
能否催化 分 向2 mL 5% 溶液中滴加几滴 溶液,观察
估计钙元素的电负性的取值范围 C
A.小于0.8 B.大于1.2 解 气泡产生情况
C.在0.8与1.2之间 D.在0.8与1.5之间
向5 mL 0.1 mol/L KI溶液中滴加1 mL 0.1 mol/L的
5.在 的反应中,采取下列措施能够使反应速率增大的是 与KI的反应是可
D 溶液,振荡,再滴加1~2滴KSCN溶液,观察
逆反应
①增大容器体积 ②增大 浓度 ③增加碳的量④恒压下充入 现象A.上述组成元素只位于 区、 区
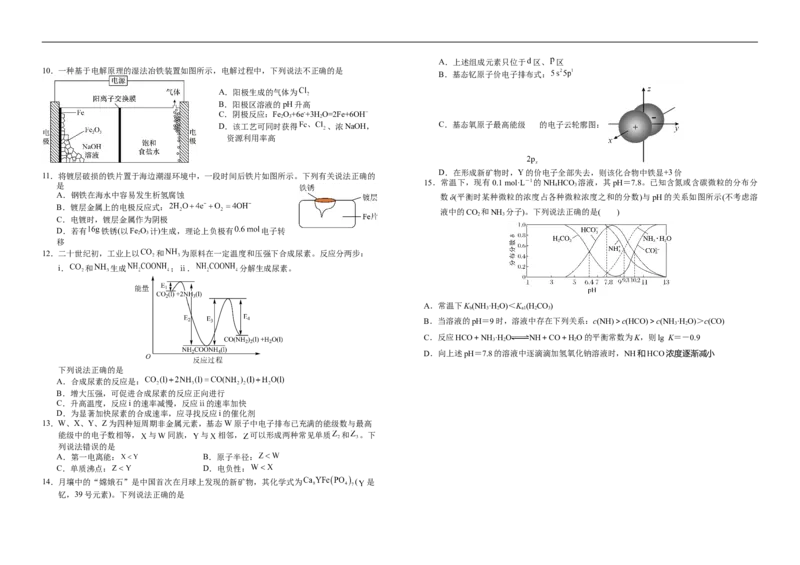
10.一种基于电解原理的湿法冶铁装置如图所示,电解过程中,下列说法不正确的是
B.基态钇原子价电子排布式:
A.阳极生成的气体为
B.阳极区溶液的pH升高
C.阴极反应:Fe O+6e-+3H O=2Fe+6OH−
2 3 2
D.该工艺可同时获得 、浓NaOH, C.基态氧原子最高能级 的电子云轮廓图:
资源利用率高
D.在形成新矿物时,Y的价电子全部失去,则该化合物中铁显+3价
11.将镀层破损的铁片置于海边潮湿环境中,一段时间后铁片如图所示。下列有关说法正确的
15.常温下,现有0.1 mol·L-1的NH HCO 溶液,其pH=7.8。已知含氮或含碳微粒的分布分
是 4 3
A.钢铁在海水中容易发生析氢腐蚀 数δ(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示(不考虑溶
B.镀层金属上的电极反应式:
液中的CO 和NH 分子)。下列说法正确的是( )
2 3
C.电镀时,镀层金属作为阴极
D.若有 铁锈(以Fe O 计)生成,理论上负极有 电子转
2 3
移
12.二十世纪初,工业上以 和 为原料在一定温度和压强下合成尿素。反应分两步:
i. 和 生成 ;ⅱ. 分解生成尿素。
A.常温下K (NH ·H O)<K (H CO)
b 3 2 a1 2 3
B.当溶液的pH=9时,溶液中存在下列关系:c(NH)>c(HCO)>c(NH ·H O)>c(CO)
3 2
C.反应HCO+NH ·H O NH+CO+HO的平衡常数为K,则lg K=-0.9
3 2 2
D.向上述pH=7.8的溶液中逐滴滴加氢氧化钠溶液时,NH和HCO浓度逐渐减小
下列说法正确的是
A.合成尿素的反应是:
B.增大压强,可促进合成尿素的反应正向进行
C.升高温度,反应i的速率减慢,反应ⅱ的速率加快
D.为显著加快尿素的合成速率,应寻找反应i的催化剂
13.W、X、Y、Z为四种短周期非金属元素,基态W原子中电子排布已充满的能级数与最高
能级中的电子数相等, 与 同族, 与 相邻, 可以形成两种常见单质 和 。下
列说法错误的是
A.第一电离能: B.原子半径:
C.单质沸点: D.电负性:
14.月壤中的“嫦娥石”是中国首次在月球上发现的新矿物,其化学式为 ( 是
钇,39号元素)。下列说法正确的是mol·L-1(保留两位小数)时,会产生草酸钙沉淀可能会引起结石。[已知K (CaC O)=4×10-8]
sp 2 4
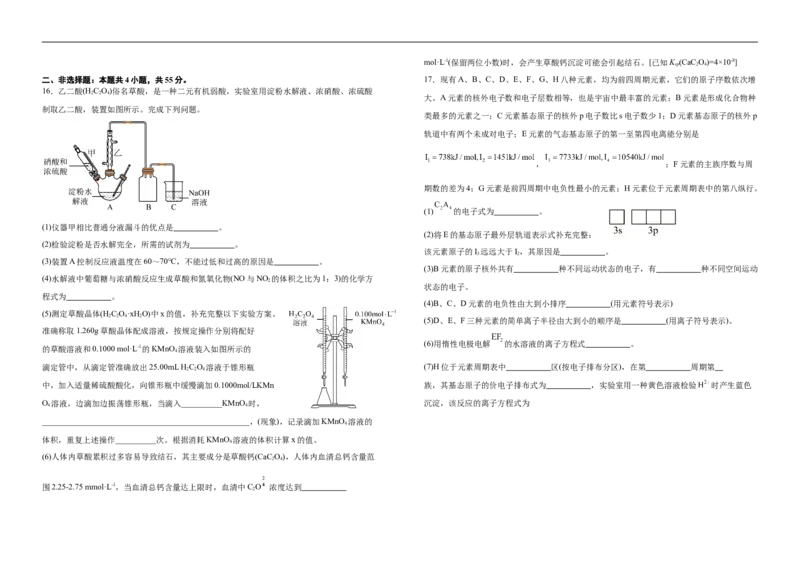
二、非选择题:本题共4小题,共55分。 17.现有A、B、C、D、E、F、G、H八种元素,均为前四周期元素,它们的原子序数依次增
16.乙二酸(H C O)俗名草酸,是一种二元有机弱酸,实验室用淀粉水解液、浓硝酸、浓硫酸
2 2 4
大。A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素;B元素是形成化合物种
制取乙二酸,装置如图所示。完成下列问题。
类最多的元素之一;C元素基态原子的核外p电子数比s电子数少1;D元素基态原子的核外p
轨道中有两个未成对电子;E元素的气态基态原子的第一至第四电离能分别是
, ;F元素的主族序数与周
期数的差为4;G元素是前四周期中电负性最小的元素;H元素位于元素周期表中的第八纵行。
(1) 的电子式为 。
(1)仪器甲相比普通分液漏斗的优点是 。
(2)将E的基态原子最外层轨道表示式补充完整:
(2)检验淀粉是否水解完全,所需的试剂为 。
该元素原子的I 远远大于I,其原因是 。
3 2
(3)装置A控制反应液温度在60~70℃,不能过低和过高的原因是 。
(3)B元素的原子核外共有 种不同运动状态的电子,有 种不同空间运动
(4)水解液中葡萄糖与浓硝酸反应生成草酸和氮氧化物(NO与NO 的体积之比为1:3)的化学方
2
状态的电子。
程式为 。
(4)B、C、D元素的电负性由大到小排序 (用元素符号表示)
(5)测定草酸晶体(H C O·xH O)中x的值,补充完整以下实验方案。
2 2 4 2
(5)D、E、F三种元素的简单离子半径由大到小的顺序是 (用离子符号表示)。
准确称取1.260g草酸晶体配成溶液,按规定操作分别将配好
(6)用惰性电极电解 的水溶液的离子方程式 。
的草酸溶液和0.1000 mol·L-1的KMnO 溶液装入如图所示的
4
滴定管中,从滴定管准确放出25.00mL H C O 溶液于锥形瓶 (7)H位于元素周期表中 区(按电子排布分区),在第 周期第
2 2 4
中,加入适量稀硫酸酸化,向锥形瓶中缓慢滴加0.1000mol/LKMn 族,其基态原子的价电子排布式为 ,实验室用一种黄色溶液检验 时产生蓝色
O 溶液,边滴加边振荡锥形瓶,当滴入__________KMnO 时, 沉淀,该反应的离子方程式为
4 4
___________________________________________________,(现象),记录滴加KMnO 溶液的
4
体积,重复上述操作__________次。根据消耗KMnO 溶液的体积计算x的值。
4
(6)人体内草酸累积过多容易导致结石,其主要成分是草酸钙(CaC O),人体内血清总钙含量范
2 4
围2.25-2.75 mmol·L-1,当血清总钙含量达上限时,血清中C O 浓度达到
2Ⅱ.
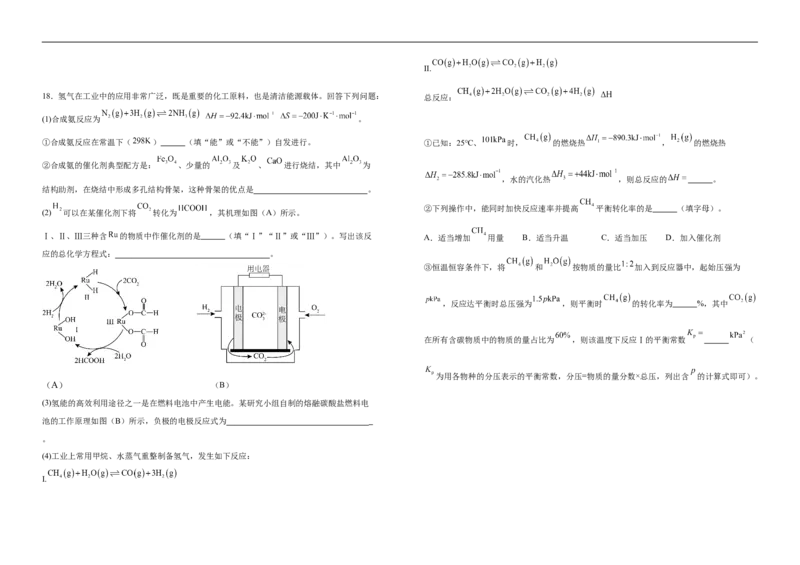
18.氢气在工业中的应用非常广泛,既是重要的化工原料,也是清洁能源载体。回答下列问题: 总反应:
(1)合成氨反应为 。
①合成氨反应在常温下( ) (填“能”或“不能”)自发进行。 ①已知:25℃、 时, 的燃烧热 , 的燃烧热
②合成氨的催化剂典型配方是: 、少量的 及 、 进行烧结,其中 为
,水的汽化热 ,则总反应的 。
结构助剂,在烧结中形成多孔结构骨架,这种骨架的优点是 。
②下列操作中,能同时加快反应速率并提高 平衡转化率的是 (填字母)。
(2) 可以在某催化剂下将 转化为 ,其机理如图(A)所示。
Ⅰ、Ⅱ、Ⅲ三种含 的物质中作催化剂的是 (填“Ⅰ”“Ⅱ”或“Ⅲ”)。写出该反 A.适当增加 用量 B.适当升温 C.适当加压 D.加入催化剂
应的总化学方程式: 。
③恒温恒容条件下,将 和 按物质的量比 加入到反应器中,起始压强为
,反应达平衡时总压强为 ,则平衡时 的转化率为 %,其中
在所有含碳物质中的物质的量占比为 ,则该温度下反应Ⅰ的平衡常数 (
为用各物种的分压表示的平衡常数,分压=物质的量分数×总压,列出含 的计算式即可)。
(A) (B)
(3)氢能的高效利用途径之一是在燃料电池中产生电能。某研究小组自制的熔融碳酸盐燃料电
池的工作原理如图(B)所示,负极的电极反应式为
。
(4)工业上常用甲烷、水蒸气重整制备氢气,发生如下反应:
Ⅰ.B. Co外围电子排布式为3d74s2,故B符合;
2025-2026 学年上学期周测 2 考试
C. Fe3+外围电子排布式为3d5,故C不符;
高二年级 化学学科参考答案
D. Cu2+外围电子排布式为3d9,故D不符;
题号 1 2 3 4 5 6 7 8 9 10
故选B。
答案 A D B C B B A B C B
题号 11 12 13 14 15
答案 B A D C C 4.C
【详解】同一周期从左至右,电负性增大;同一主族从上到下,电负性减小,钙元素的电负性应
1.A
小于Mg的而大于K的,即Ca的电负性的取值范围:0.8