文档内容
… … … …
… … … …
… … … …
○ … ○ …
… … … …
… 2025 年 1 月“八省联考”考前猜想卷
… … … …
学 校
… …
_____
外 … 内 … 化 学
_____
… … … …
____
… … … …
姓 名 (考试时间:75分钟 试卷满分:100分)
… …
_____
○ … ○ … 注意事项:
_____
… … … …
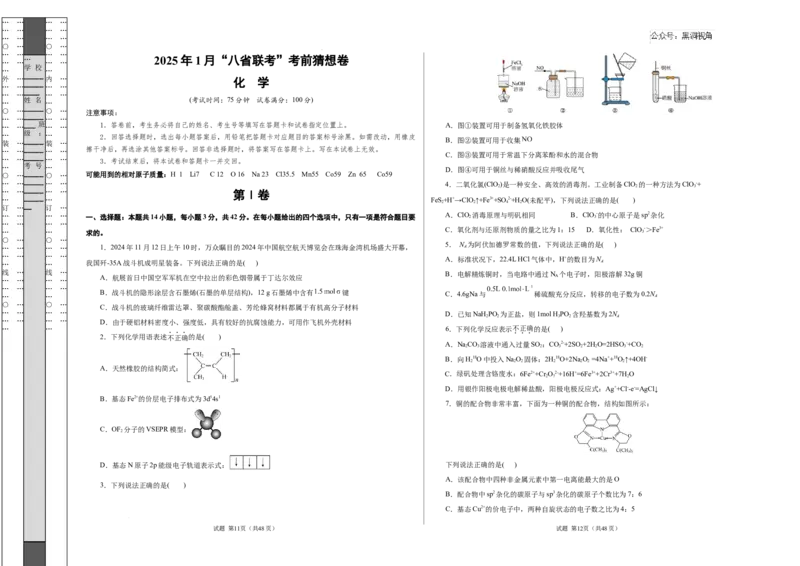
… … ___ 班 … … 1.答卷前,考生务必将自己的姓名、考生号等填写在答题卡和试卷指定位置上。 A.图①装置可用于制备氢氧化铁胶体
级 :
… … 2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。如需改动,用橡皮
_____ B.图②装置可用于收集
装 … 装 …
_____ 擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
… … … …
C.图③装置可用于常温下分离苯酚和水的混合物
… …_____ … … 3.考试结束后,将本试卷和答题卡一并交回。
… 考 号 …
D.图④可用于铜丝与稀硝酸反应并吸收尾气
○ …_____ ○ … 可能用到的相对原子质量:H 1 Li7 C 12 O 16 Na 23 Cl35.5 Mn55 Co59 Zn 65 Co59
… …_____ … … 4.二氧化氯(ClO)是一种安全、高效的消毒剂。工业制备ClO 的一种方法为ClO -+
2 2 3
… …_____ … … 第Ⅰ卷
… _____ … FeS+H+→ClO↑+Fe3++SO2-+H O(未配平),下列说法正确的是( )
2 2 4 2
订 …__ 订 …
… … … … 一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要 A.ClO 2 消毒原理与明矾相同 B.ClO 3 -的中心原子是sp2杂化
… … … …
… … 求的。
C.氧化剂与还原剂物质的量之比为1:15 D.氧化性: ClO
3
->Fe3+
○ … ○ …
5. N 为阿伏加德罗常数的值,下列说法正确的是( )
… … … … 1.2024年11月12日上午10时,万众瞩目的2024年中国航空航天博览会在珠海金湾机场盛大开幕, A
… … … …
A.标准状况下,22.4L HCl气体中,H+的数目为N
… … 我国歼-35A战斗机成明星装备。下列说法正确的是( ) A
线 … 线 … B.电解精炼铜时,当电路中通过N 个电子时,阳极溶解32g铜
A.航展首日中国空军军机在空中拉出的彩色烟带属于丁达尔效应 A
… … … …
… … … …
B.战斗机的隐形涂层含石墨烯(石墨的单层结构),12 g石墨烯中含有 键 C.4.6gNa与 稀硫酸充分反应,转移的电子数为0.2N
… … A
○ … ○ …
C.战斗机的玻璃纤维雷达罩、聚碳酸酯舱盖、芳纶蜂窝材料都属于有机高分子材料
… … … … D.已知NaH PO 为正盐,则1mol HPO 含羟基数为2N
2 2 3 2 A
… … … … D.由于硬铝材料密度小、强度低,具有较好的抗腐蚀能力,可用作飞机外壳材料
… … 6.下列化学反应表示不正确的是( )
2.下列化学用语表述不正确的是( )
A.NaCO 溶液中通入过量SO :CO2-+2SO+2H O=2HSO -+CO
2 3 2 3 2 2 3 2
B.向H18O中投入NaO 固体:2H18O+2Na O =4Na++18O↑+4OH-
2 2 2 2 2 2 2
A.天然橡胶的结构简式:
C.绿矾处理含铬废水:6Fe2++Cr O2-+16H+=6Fe3++2Cr3++7H O
2 7 2
D.用银作阳极电极电解稀盐酸,阳极电极反应式:Ag++Cl--e-=AgCl↓
B.基态Fe2+的价层电子排布式为3d54s1
7.铜的配合物非常丰富,下面为一种铜的配合物,结构如图所示:
C.OF 分子的VSEPR模型:
2
D.基态N原子2p能级电子轨道表示式: 下列说法正确的是( )
A.该配合物中四种非金属元素中第一电离能最大的是O
3.下列说法正确的是( )
B.配合物中sp2杂化的碳原子与sp3杂化的碳原子个数比为7:6
C.基态Cu2+的价电子中,两种自旋状态的电子数之比为4:5
试题 第11页(共48页) 试题 第12页(共48页)
学科网(北京)股份有限公司… … … …
… … … …
… … … …
○ … ○ …
… … … …
… … … …
… …
外 … 内 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
装 … 装 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
订 … 订 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
线 … 线 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
… … … …
… … … …
… … … …
D.除铜外,四种元素形成的单质的晶体类型一定相同
○ … ○ …
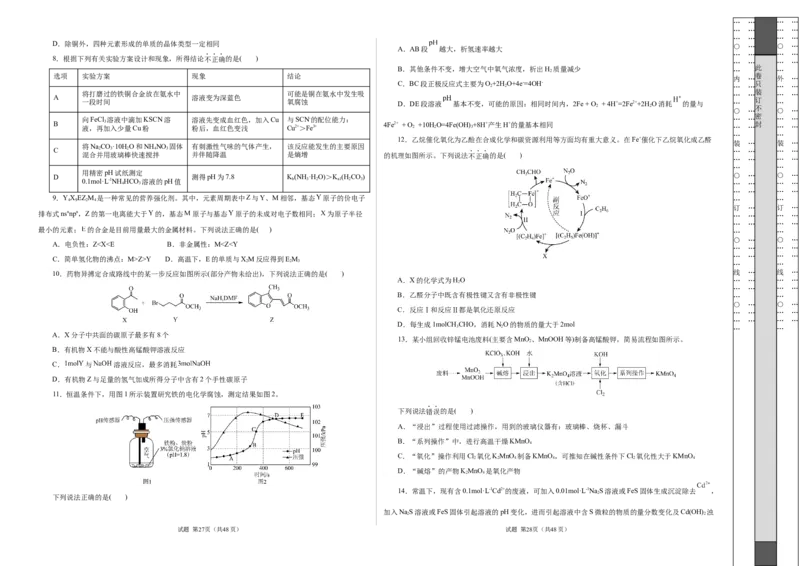
A.AB段 越大,析氢速率越大
… … … …
8.根据下列有关实验方案设计和现象,所得结论不正确的是( )
… … … …
B.其他条件不变,增大空气中氧气浓度,析出H 2 质量减少 … 此 …
选项 实验方案 现象 结论 卷
内 … 外 …
C.BC段正极反应式主要为O+2H O+4e-=4OH- 只
2 2 … … … …
将打磨过的铁铜合金放在氨水中 可能是铜在氨水中发生吸 … … 装 … …
A 溶液变为深蓝色
一段时间 氧腐蚀 D.DE段溶液 基本不变,可能的原因:相同时间内,2Fe + O + 4H+=2Fe2++2H O消耗 的量与 … 订 …
2 2 不
○ … ○ …
密
向FeCl 溶液中滴加KSCN溶 溶液先变成血红色,加入Cu 与SCN-的配位能力: … … … …
B 液,再加 3 入少量Cu粉 粉后,血红色变浅 Cu2+>Fe3+ 4Fe2+ + O 2 +10H 2 O=4Fe(OH) 3 +8H+产生H+的量基本相同 … … 封 … …
… …
12.乙烷催化氧化为乙酫在合成化学和碳资源利用等方面均有重大意义。在Fe+催化下乙烷氧化成乙醛
装 … 装 …
将NaCO·10H O和NH NO 固体 有刺激性气味的气体产生, 该反应能发生的主要原因
C 2 3 2 4 3 … … … …
混合并用玻璃棒快速搅拌 并伴随降温 是熵增 的机理如图所示。下列说法不正确的是( )
… … … …
… …
用精密pH试纸测定
D 测得pH为7.8 K(NH ·H O)>K (H CO) ○ … ○ …
0.1mol·L-1NH 4 HCO 3 溶液的pH值 b 3 2 a1 2 3 … … … …
… … … …
9.Y 4 X 9 EZ 2 M 4 是一种常见的营养强化剂。其中,元素周期表中 与Y、M相邻,基态 原子的价电子 … …
订 … 订 …
排布式nsnnpn,Z的第一电离能大于 的,基态 原子与基态 原子的未成对电子数相同; 为原子半径 … … … …
… … … …
最小的元素; 的合金是目前用量最大的金属材料。下列说法正确的是( ) … …
○ … ○ …
A.电负性:ZZ>Y D.高温下,E的单质与XM反应得到EM
2 2 3 … …
10.药物异搏定合成路线中的某一步反应如图所示(部分产物未给出),下列说法正确的是( ) 线 … 线 …
A.X的化学式为HO … … … …
2
… … … …
B.乙醛分子中既含有极性键又含有非极性键 … …
○ … ○ …
C.反应Ⅰ和反应Ⅱ都是氧化还原反应
… … … …
… … … …
D.每生成1molCH CHO,消耗NO的物质的量大于2mol
3 2 … …
A.X分子中共面的碳原子最多有8个
13.某小组回收锌锰电池废料(主要含MnO 、MnOOH等)制备高锰酸钾,简易流程如图所示。
2
B.有机物X不能与酸性高锰酸钾溶液反应
C. 与 溶液反应,最多消耗
D.有机物Z与足量的氢气加成所得分子中含有2个手性碳原子
11.恒温条件下,用图1所示装置研究铁的电化学腐蚀,测定结果如图2。
下列说法错误的是( )
A.“浸出”过程使用过滤操作,用到的玻璃仪器有:玻璃棒、烧杯、漏斗
B.“系列操作”中,进行高温干燥KMnO
4
C.“氧化”操作利用Cl 氧化KMnO 制备KMnO ,可推知在碱性条件下Cl 氧化性大于KMnO
2 2 4 4 2 4
D.“碱熔”的产物KMnO 是氧化产物
2 4
14.常温下,现有含0.1mol·L-1Cd2+的废液,可加入0.01mol·L-1NaS溶液或FeS固体生成沉淀除去 ,
2
下列说法正确的是( )
加入NaS溶液或FeS固体引起溶液的pH变化,进而引起溶液中含S微粒的物质的量分数变化及Cd(OH) 浊
2 2
试题 第27页(共48页) 试题 第28页(共48页)… … … …
… … … …
… … … …
○ … ○ …
… … … …
… … … …
… …
内 … 外 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
装 … 装 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
订 … 订 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
线 … 线 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
… … … …
… … … …
… … … …
○ … ○ …
… … … …
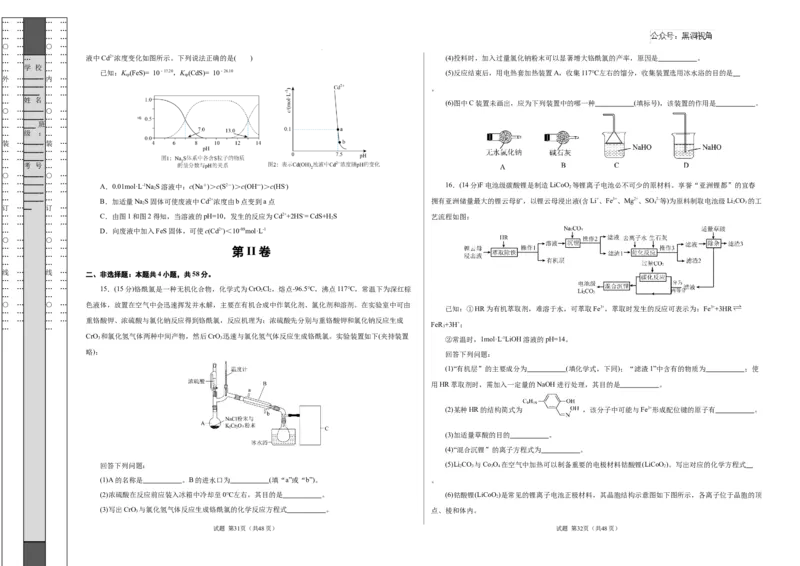
… 液中Cd2+浓度变化如图所示。下列说法正确的是( ) (4)投料时,加入过量氯化钠粉末可以显著增大铬酰氯的产率,原因是 。
… … … …
学 校
… … 已知:K (FeS)= 10-17.20,K (CdS)= 10-26.10 (5)反应结束后,用电热套加热装置A,收集117℃左右的馏分,收集装置选用冰水浴的目的是
_____ sp sp
外 … 内 …
_____
… … … … 。
____
… … … …
姓 名
… … (6)图中C装置未画出,应为下列装置中的哪一种 (填标号),该装置的作用是 。
_____
○ … ○ …
_____
… … … …
___ 班
… … … …
级 :
… …
_____
装 … 装 …
_____
… … … …
… …_____ … …
… 考 号 …
○ …_____ ○ …
… … … … _ _ _ _ _ _ _ _ _ _ … … … … A.0.01mol·L-1Na 2 S溶液中:c(Na+)>c(S2-)>c(OH―)>c(HS-) 16.(14分)F电池级碳酸锂是制造LiCoO 2 等锂离子电池必不可少的原材料。享誉“亚洲锂都”的宜春
… _____ … B.加适量NaS固体可使废液中Cd2+浓度由b点变到a点 拥有亚洲储量最大的锂云母矿,以锂云母浸出液(含Li+、Fe3+、Mg2+、SO 2-等)为原料制取电池级LiCO 的工
订 …__ 订 … 2 4 2 3
… … … … C.由图1和图2得知,当溶液的pH=10,发生的反应为Cd2++2HS-= CdS+HS 艺流程如图:
2
… … … …
… … D.向废液中加入FeS固体,可使c(Cd2+)<10-9.9mol·L-1
○ … ○ …
… … … … 第 II 卷
… … … …
… …
线 … 线 …
二、非选择题:本题共4小题,共58分。
… … … …
… … … … 15.(15分)铬酰氯是一种无机化合物,化学式为CrO Cl,熔点-96.5℃,沸点117℃,常温下为深红棕
2 2
… …
○ … ○ … 色液体,放置在空气中会迅速挥发并水解,主要在有机合成中作氧化剂、氯化剂和溶剂。在实验室中可由
已知:①HR为有机萃取剂,难溶于水,可萃取Fe3+,萃取时发生的反应可表示为:Fe3++3HR
… … … …
… … … … 重铬酸钾、浓硫酸与氯化钠反应得到铬酰氯,反应机理为:浓硫酸先分别与重铬酸钾和氯化钠反应生成
FeR +3H+;
… … 3
CrO 和氯化氢气体两种中间产物,然后CrO 迅速与氯化氢气体反应生成铬酰氯。实验装置如下(夹持装置
3 3 ②常温时,1mol·L-1LiOH溶液的pH=14。
略):
回答下列问题:
(1)“有机层”的主要成分为 (填化学式,下同);“滤渣1”中含有的物质为 ;使
用HR萃取剂时,需加入一定量的NaOH进行处理,其目的是 。
(2)某种HR的结构简式为 ,该分子中可能与Fe3+形成配位键的原子有 。
(3)加适量草酸的目的 。
(4)“混合沉锂”的离子方程式为 。
回答下列问题: (5)Li CO 与Co O 在空气中加热可以制备重要的电极材料钴酸锂(LiCoO )。写出对应的化学方程式
2 3 3 4 2
(1)A的名称是 。B的进水口为 (填“a”或“b”)。 。
(2)浓硫酸在反应前应装入冰箱中冷却至0℃左右,其目的是 。 (6)钴酸锂(LiCoO )是常见的锂离子电池正极材料,其晶胞结构示意图如下图所示,各离子位于晶胞的顶
2
(3)写出CrO 3 与氯化氢气体反应生成铬酰氯的化学反应方程式 。 点、棱和体内。
试题 第31页(共48页) 试题 第32页(共48页)
学科网(北京)股份有限公司… … … …
… … … …
… … … …
○ … ○ …
… … … …
… … … …
… …
外 … 内 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
装 … 装 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
订 … 订 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
线 … 线 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
… … … …
… … … …
… … … …
的量分数)。
○ … ○ …
… … … …
Ⅱ.电解法制氢气。某科研小组设计如图所示电解池,利用CO
2
和H
2
O在碱性电解液中制备水煤气
… … … …
此
… …
(H 2 、CO),产物中H 2 和CO的物质的量之比为1∶1。 内 … 卷 外 …
只
… … … …
(4)电极B是 极,生成水煤气的电极反应式为 。
装
… … … …
订
… …
不
○ … ○ …
密
… … … …
封
… … … …
①基态Co原子核外电子排布式为 。
… …
装 … 装 …
②该晶胞密度为 g·cm-3。(写出计算式,阿伏加德罗常数为N )
A … … … …
… … … …
17.(14分)绿色能源是未来能源发展的方向,积极发展氢能,是实现“碳达峰、碳中和”的重要举措,
… …
可以用以下方法制备氢气。 ○ … ○ …
… … … …
I.甲烷和水蒸气催化制氢气。主要反应如下: 18.(15分)卡龙酸是一种医药中间体,主要用于蛋白酶抑制剂的合成。以下是卡龙酸的一种合成路线 … … … …
… …
i.CH 4 (g)+H 2 O(g) CO(g)+3H 2 (g) H=+206.2kJ•mol-1 (部分试剂和条件省略,不考虑立体异构) 订 … 订 …
… … … …
ii.CO(g)+H 2 O(g) CO 2 (g)+H 2 (g) △H=-41.2kJ•mol-1 … … … …
… …
(1)反应CH
4
(g)+CO
2
(g) 2CO(g)+2H
2
△(g)的△H= kJ•mol-1。
○ … ○ …
… … … …
(2)在容积不变的绝热密闭容器中发生反应i,下列能说明反应达到平衡状态的是 (填标号)。
… … … …
… …
A.气体混合物的密度不再变化 B.CH 消耗速率和H 的生成速率相等
4 2
线 … 线 …
C.CO的浓度保持不变 D.气体平均相对分子质量不再变化 … … … …
… … … …
E.体系的温度不再发生变化 … …
(1)A中碳原子杂化方式为 。
○ … ○ …
(3)恒定压强为P 0 MPa时,将n(CH 4 ):n(H 2 O)=1:3的混合气体投入反应器中发生反应i和ii,平衡时, (2)反应②所需的试剂和条件为 。 … … … …
… … … …
各组分的物质的量分数与温度的关系如图所示。 (3)D的化学名称为 。 … …
(4)反应③的化学方程式为 ,反应类型为 。
(5)G中含有的官能团名称为 。
(6)写出满足下列条件的B的同分异构体的结构简式 。
①能发生银镜反应;②核磁共振氢谱显示有3组峰,峰面积之比为
(7)以乙炔和乙醇为有机原料,合成 的路线如下(反应条件已略去,
无机试剂任选),其中Y的结构简式为 。
①图中表示CO 的物质的量分数与温度的变化曲线是 (填字母)。
2
②结合图中数据,其他条件不变,若要H 的产量最大,最适宜的反应温度是 (填标号)。
2
A.550~600℃ B.650~700℃ C.750~800℃
在其他条件不变的情况下,向体系中加入CaO可明显提高平衡体系中H 的含量,原因是 。
2
③600℃时,反应ii的平衡常数的计算式为K= (K 是以分压表示的平衡常数,分压=总压×物质
p p
试题 第47页(共48页) 试题 第48页(共48页)