文档内容
成都石室中学 2024—2025 学年度上期高 2026 届十月考试
化学试卷
试卷说明:
1.满分100分,考试时间90分钟;
2. 可能用到的相对原子质量:
H-1 C-12 N-14 O-16 Na-23 K-39 S-32 Cl-35.5 Cu-64
I卷(44分)
选择题(共22道小题,单选,每题2分)
1. 下列词语描述中,属于△H<0、△S>0的化学变化的是
A. 春风化雨 B. 滴水成冰 C. 蜡炬成灰 D. 聚沙成塔
2. 在一个密闭容器中发生如下反应:2SO (g) + O(g) 2SO (g),反应过程中某一时刻测得SO 、O、
2 2 3 2 2
SO 的浓度分别为:0.2 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能出现的数据是
3
A.c(SO )=0.4 mol·L-1 B.c(SO )=c(SO )=0.15 mol·L-1
3 2 3
C.c(SO )=0.25 mol·L-1 D.c(SO ) + c(SO )=0.5 mol·L-1
2 2 3
3.足量块状铁与100mL 0.01mol/L的稀硫酸反应,为了加快反应速率而不改变生成H 的量,可以使用的方
2
法有:①滴入几滴硫酸铜溶液②加NaOH固体③将稀硫酸改用98%的浓硫酸④将块状铁改为铁粉
⑤加入NaNO 固体⑥升高温度
3
A.③④⑥ B.①④⑥ C.②③⑤ D.①⑤⑥
4.人体血液里存在HCO/HCO-缓冲体系,可使血液的pH稳定在7.35~7.45,当血液pH低于7.2或高于
2 3 3
7.5时,会发生酸中毒或碱中毒。缓冲体系的作用可用H+(aq)+HCO
3
-(aq)⇌H
2
CO
3
(aq)⇌CO
2
(g)+H
2
O(l)表示。
已知该温度下HCO 的pK =6.1,pK =10.3,下列说法不正确的是
2 3 a1 a2
A.正常人体血液中,c(HCO -)a>b
11.炼油、石化等工业会产生含硫(-2价)废水,可通过催化氧化法进行处理,碱性条件下,催化氧化废水的
机理如图所示。其中MnO 为催化剂,附着在催化剂载体聚苯胺的表面。下列说法错误的是
2
A.转化I中Mn的化合价未发生变化
B.催化氧化过程中有共价键的断裂
C.催化氧化过程的总反应为:O+2HO+2S2-MnO24OH-+2S↓
2 2
D.催化剂使用一段时间后催化效率会下降,原因是生成的S覆盖在催化剂表面或进入催化剂内空位处
12.下列离子方程式与所给事实相符的是
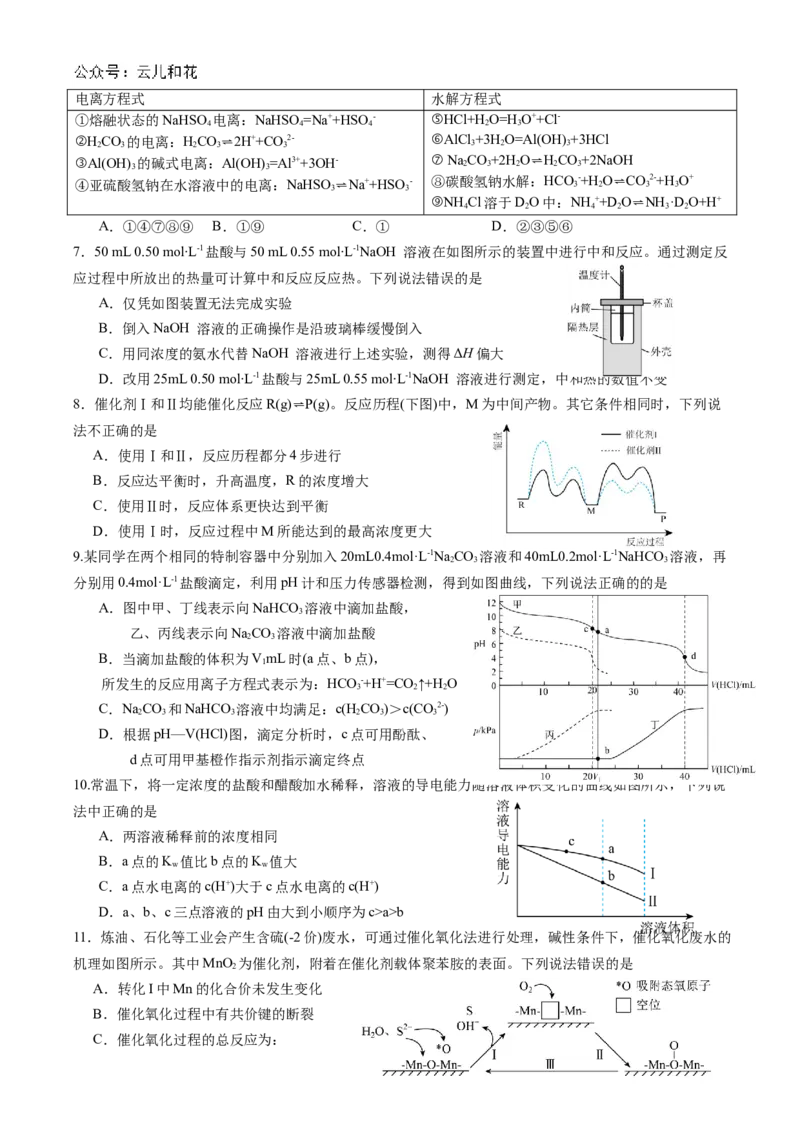
A.往K
2
Cr
2
O
7
溶液中滴加几滴浓NaOH溶液,溶液由橙色变黄:Cr
2
O
7
2-+OH- ⇌2CrO
4
2-+H
2
O
B.往淀粉KI溶液中滴入稀硫酸,溶液变蓝:4I-+4H++O =2I +2H O
2 2 2
C.加热CuCl
2
溶液,溶液由蓝色变为黄绿色:[Cu(H
2
O)
4
]2++4Cl- ⇌[CuCl
4
]2-+4H
2
O
D.草酸使酸性高锰酸钾溶液褪色的总反应为:2MnO -+5C O2-+16H+=2Mn2++10CO ↑+8H O
4 2 4 2 2
13.室温时,取0.1mol·L-1 HCl和0.1mol·L-1 HA(一元酸K=1×10-3)混合溶液20mL,用0.1mol·L-1 NaOH溶
a
液滴定,滴定曲线如图所示。下列说法不正确的是
A.a点时,溶液中c(Cl-)>c(HA)
B.b点时,c(Na+)=c(Cl-)=c(HA)+c(A-)
C.c点时,c(A-)=0.05mol·L-1
D.a→c过程中,水的电离程度逐渐增大
14.下列反应及其自由能与温度的关系如下图所示:
Ⅰ.CO(g)+2H
2
(g)⇌CH
3
OH(g) ΔH
1
=-116kJ·mol-1
Ⅱ.CO(g)+H
2
O(g)⇌CO
2
(g)+H
2
(g) ΔH
2
=-41kJ·mol-1
Ⅲ.CO
2
(g)+3H
2
(g)⇌CH
3
OH(g)+H
2
O(g) ΔH
3
下列说法错误的是
A.反应Ⅱ在T<427K时,能自发进行
B.相同温度下,ΔG(Ⅰ)<ΔG(Ⅱ)的主要原因可能是ΔH>ΔH
1 2
C.ΔH=-75kJ·mol-1
3
D.400K时,平衡常数K(Ⅲ)=K(Ⅰ)/K(Ⅱ)
15.已知2N
2
O(g)⇌2N
2
(g)+O
2
(g)的速率方程为v=k·cn(N
2
O)(k为速率常数,只与温度、催化剂有关)。实验测
得,NO在催化剂X表面反应的变化数据如下,下列说法正确的是
2
t/min 0 10 20 30 40 50 60 70
c(N O)/
2 0.100 0.080 c 0.040 0.020 c c 0
mol·L-1 1 2 3
A.n=0,c>c=c
1 2 3
B.t=10 min时,v(N O)=2.0×10-3mol·L-1 · s-1
2
C.相同条件下,增大NO的浓度或催化剂X的表面积,都能加快反应速率
2
D.保持其他条件不变,若NO起始浓度为0.200 mol·L-1,当浓度减至一半时共耗时100 min
2
16.用0.2500mol/L的盐酸滴定20ml某未知浓度的氢氧化钠溶液实验中,所测数据如表:
下列说法正确的是
实验次数 1 2 3
A.用蒸馏水洗涤后的酸式滴定管即可装入盐酸标准溶液
B.氢氧化钠溶液的浓度为0.3125mol/L 消耗盐酸的体积 25.05 24.95 20.95
C.滴定过程中可以选用石蕊溶液做指示剂
D.若酸式滴定管在滴定前尖端有气泡,而滴定后气泡消失,则氢氧化钠溶液浓度偏低
17.在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g) + Y(g)⇌M(g) + N(g),所得实验数据如下表:起始时物质的量/mol 平衡时物质的量/mol
实验编号 温度/℃
n(X) n(Y) n(M)
① 700 0.40 0.10 0.090
② 800 0.10 0.40 0.080
③ 800 0.20 0.30 a
④ 900 0.10 0.15 b
下列说法正确的是
A.实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min内,平均反应速率υ(N)=1.0×10-2
mol/(L·min)
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡时,X的转化率为60%
D.实验④中,达到平衡时,b>0.060
18.下表是在相同温度下三种酸的一些数据,下列判断正确的是
A.在相同温度下,电离常数:K 1 >K 4 >K 5 酸 HX HY HZ
B.在相同温度下,从HX的数据可以说明:弱电解质 浓度/(mol·L-1) 0.12 0.2 0.9 0.9 0.9
溶液浓度越小,电离度越大,且K>K>K 电离度 0.25 0.2 0.1 0.3 0.5
1 2 3
电离常数 K K K K K
c(H+
)
1 2 3 4 5
C.室温时,若在HZ溶液中加少量盐酸,则 的
c(Z−
)
值不变
D.表格中三种浓度的HX溶液,从左至右c(X-)逐渐增大
19.一定条件下,乙酸酐[(CH CO) O]醇解反应[(CH CO) O+ROH→CH COOR+CH COOH]可进行完全,利
3 2 3 2 3 3
用此反应定量测定有机醇(ROH)中的羟基含量,实验过程中酯的水解可忽略。实验步骤如下:
①配制一定浓度的乙酸酐-苯溶液。
②量取一定体积乙酸酐-苯溶液置于锥形瓶中,加入mgROH样品,充分反应后,加适量水使剩余乙酸酐完
全水解:(CHCO) O+HO→2CH COOH。
3 2 2 3
③加指示剂并用cmol·L-1NaOH-甲醇标准溶液滴定至终点,消耗标准溶液VmL。
1
④在相同条件下,量取相同体积的乙酸酐-苯溶液,只加适量水使乙酸酐完全水解;加指示剂并用
cmol·L-1NaOH-甲醇标准溶液滴定至终点,消耗标准溶液VmL。ROH样品中羟基质量分数计算正确的是
2
A. B.
C. D.
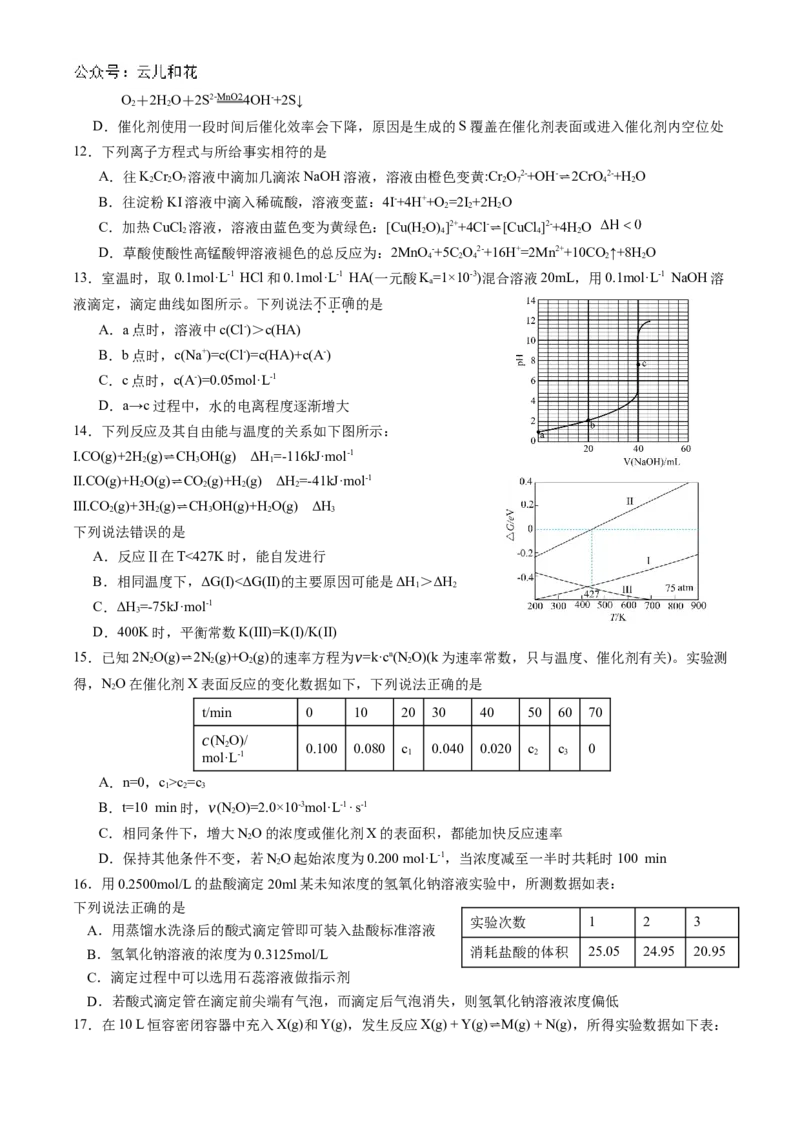
20.下面是某小组探究外界条件对化学反应速率和平衡影响的图象,其中图象和结论表达均正确的是图①mA(g)+nB(g)⇌pC(g) 图②2X(g)⇌Y(g)
A.图①a曲线一定使用了催化剂 B.图②是在一定条件下,c(X)随时间t的变化,正反应
ΔH<0,M点正反应速率小于N点逆反应速率
图③ CO(g)+2H
2
(g)⇌CH
3
OH(g) ΔH<0 图④2NO(g)+O
2
(g)⇌2NO
2
(g)
C.图③是在恒温恒容的密闭容器中,按不同 D.图④中曲线表示一定压强下NO平衡转化率随温度的
投料比充入CO(g)和H(g)进行反应,若平衡 变化,A、B、C三点表示不同温度、压强下NO的平衡转
2
时CO(g)和H(g)的转化率相等,则a=2 化率,压强最大的是B点,化学平衡常数最小的是A点
2
21.在常温下,有关下列溶液的叙述中错误的是
①pH=11的氨水 ②pH=11的氢氧化钾溶液 ③pH=3的醋酸 ④pH=3的硫酸
A.将aL ②与bL ④混合,忽略溶液体积变化,若所得溶液的pH=5,则a:b=199:101
B.将①、②分别加水稀释1000倍后,溶液的pH:①>②
C.向③、④中分别加入醋酸钠晶体后,两种溶液的pH均增大
D.将①、③等体积混合后溶液呈中性,该溶液中:c(NH +)= c(CHCOO-)
4 3
22.二甲醚(CHOCH )催化制备乙醇主要涉及以下两个反应:
3 3
反应I:CO(g)+CH
3
OCH
3
(g)⇌CH
3
COOCH
3
(g) ΔH
1
<0
反应II:CH
3
COOCH
3
(g)+2H
2
(g)⇌CH
3
CH
2
OH(g)+CH
3
OH(g) ΔH
2
<0
在固定CO、CHOCH 、H 的原料比及体系压强不变的条件下,同时发生反应I、II,平衡时部分物质的物
3 3 2
质的量分数随温度的变化如图,下列说法正确的是
A.反应CO(g)+CH
3
OCH
3
(g)+2H
2
(g)⇌CH
3
CH
2
OH(g)+CH
3
OH(g)
一定可以自发进行
B.由如图可知随着温度的升高,H 的平衡转化率先下降后升高
2
C.温度高于600K时,温度对反应I的影响大于对反应II的影响
D.其他条件不变,延长时间或选用对反应II催化性能更好的催
化剂都能提高平衡混合物中乙醇含量
II卷(56分)
填空题(共4道大题)
23.根据所学知识回答下列问题。
Ⅰ.(1)在一定条件下可实现反应CO
2(g)
+H 2(g)⇌CO
(g)
+H
2
O
(g)
ΔH>0,该反应催化原理分两步,第一步为吸热的
慢反应,第二步为放热的快反应。正确的能量变化示意图为 。(选填字母)A. B. C. D.
(2)二甲醚CHOCH 是重要的化工原料,也可用CO和H 制得,总的热化学方程式如下:
3 3 2
2CO(g)+2H
2
(g)⇌CH
3
OCH
3
(g)+H
2
O(g) ΔH=-206.0kJ·mol-1
工业中采用“一步法”,通过复合催化剂使下列甲醇合成和甲醇脱水反应同时进行:
ⅰ.甲醇合成反应:___________
ⅱ.甲醇脱水反应2CH
3
OH(g)⇌CH
3
OCH
3
(g)+H
2
O(g) ΔH=-24.0kJ·mol-1
①写出ⅰ的热化学方程式:___________。
②若起始时向容器中投入2mol CO和4mol H ,测得某时刻上述总反应中放出的热量为51.5kJ,此时CO的
2
转化率为___________。
Ⅱ.现有下列物质:①熔融的NaCl ②稀硫酸 ③液氯 ④冰醋酸 ⑤铜
⑥BaSO ⑦NaHSO
4 4
⑧液氨 ⑨SO ⑩Ca(OH) 固体
2 2
(1) 以上物质中属于弱电解质的是 (填数字序号,下同),属于非电解质的是 。
(2)可以证明醋酸是弱酸的事实是 (填字母序号)。
a.醋酸和水能以任意比例混溶
b.在醋酸水溶液中还含有未电离的醋酸分子
c.醋酸与NaCO 溶液反应放出CO 气体
2 3 2
d.1mol·L-1的醋酸水溶液能使紫色石蕊溶液变红色
e.等体积等pH的醋酸和盐酸分别与足量氢氧化钠溶液反应,醋酸消耗的氢氧化钠更多
(3)某温度时,某酸性溶液pH=5,其中c(OH-)=10-10mol·L-1。将pH=a的Ba(OH) 溶液VL与10-bmol·L-1的
2 1
NaHSO,溶液VL混合(忽略体积变化)。若所得混合溶液呈中性,且a=12,b=1,则V:V=
4 2 1 2
。
24. (1)甲醇-水蒸气重整在工业生产中用途广泛,主要反应为CHOH(g)+H O(g) CO(g)+3H(g) ∆H。
3 2 2 2
已知同时还进行的反应有:Ⅰ. CHOH(g) CO(g)+2H(g) ∆H=+90.8kJ∙mol
3 2 1 ⇌
Ⅱ. CO(g)+HO(g) CO(g)+H(g) ∆H=-41.1kJ∙mol
2 2 2 2 ⇌
则:① CHOH(g)+H O(g) CO(g)+3H(g) ∆H= 。自发进行的条件是 (填字母)。
3 ⇌2 2 2
A.高温 B.低温 C.所有温度 D.所有温度均不自发
⇌
②实际生产中,CHOH与HO投料比常<1,原因是_________。
3 2
③甲醇-水蒸气重整制氢是电动汽车氢氧燃料电池理想的氢源。CO会损坏燃料电池的交换膜。工业生产过
程中会向重整系统中加入适量轻质多孔的生石灰,目的是_____。
(2) 甲烷通常也可通过多种重整方式进行利用,如二氧化碳重整甲烷反应:CH
4
(g)+CO
2
(g)⇌2CO(g)
+2H (g),实验测定该反应的反应速率v =k ∙c(CH)∙c(CO),v =k ∙c2(CO)
2 正 正 4 2 逆 逆
c2(H ),k 、k 分别是正、逆反应速率常数,且只与温度有关。T℃时,向
2 正 逆某恒温恒容密闭容器中充入物质的量浓度均为1mol∙L-1的CH (g)和CO (g),发生重整反应,测得体系中
4 2
CH (g)和CO(g)的物质的量浓度随时间的变化如图所示:
4
v
①B点的坐标为 。 ②反应进行到5min时, 正 = 。
v
逆
(3)我国科学家开发的特殊催化剂用于CO 制备CH=CH ,有利于实现“双碳”目标:
2 2 2
2CO
2
(g)+6H
2
(g)⇌CH
2
=CH
2
(g)+4H
2
O(g) ∆H=-127.8kJ∙mol
过程中可得副产物甲酸: CO
2
(g)+H
2
(g)⇌HCOOH ∆H=-31.4kJ∙mol
①在合适催化剂的作用下,在恒容容器中充入一定量的CO 与H,反应
2 2
进行相同的时间测得体系中HCOOH和C H 的体积分数随温度的变化如
2 4
图所示,则主反应与副反应中活化能较大的反应是 (填“主反应”或“副反应”);600K后,
C H 的体积分数减小的主要原因为 。
2 4
②一定温度下,在容积为1L的恒容密闭容器中充入2mol CO(g)和6mol H(g),同时发生了主反应和副反
2 2
应,达到平衡时CH=CH 的物质的量为0.5mol,H 的物质的量为2.5mol,则该温度下,副反应的平衡常数
2 2 2
K= 。
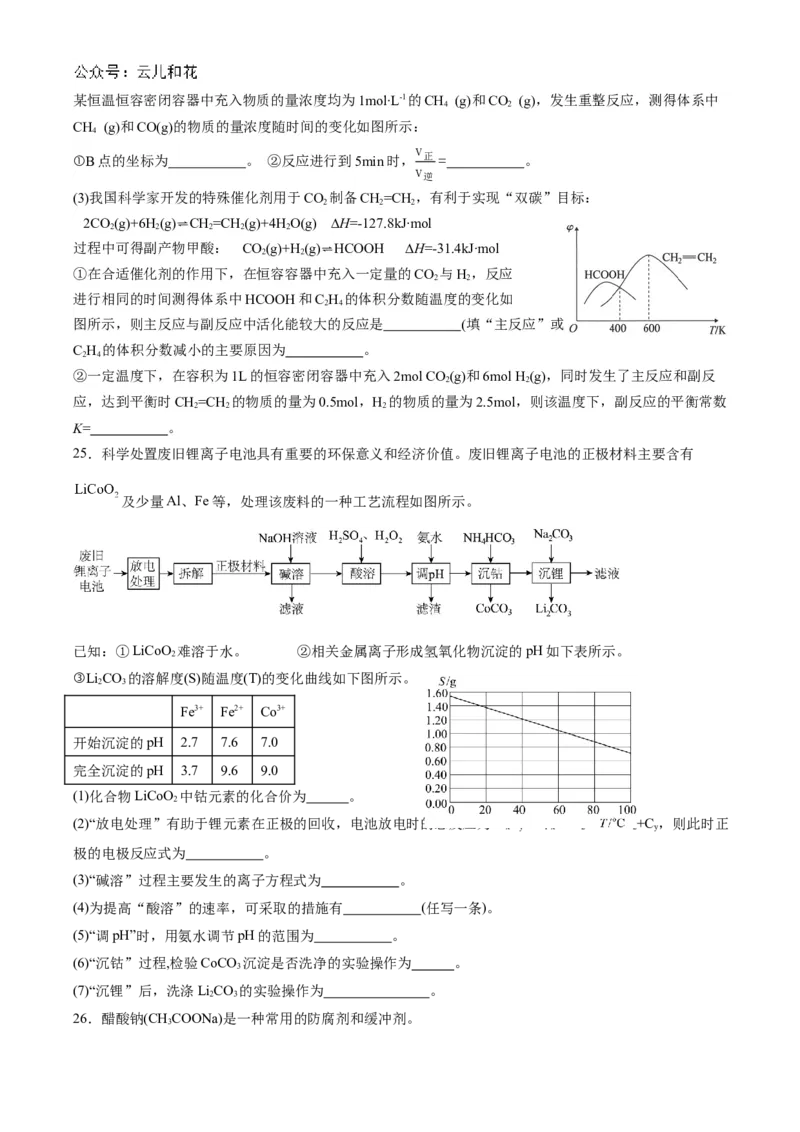
25.科学处置废旧锂离子电池具有重要的环保意义和经济价值。废旧锂离子电池的正极材料主要含有
及少量Al、Fe等,处理该废料的一种工艺流程如图所示。
已知:①LiCoO 难溶于水。 ②相关金属离子形成氢氧化物沉淀的pH如下表所示。
2
③LiCO 的溶解度(S)随温度(T)的变化曲线如下图所示。
2 3
Fe3+ Fe2+ Co3+
开始沉淀的pH 2.7 7.6 7.0
完全沉淀的pH 3.7 9.6 9.0
(1)化合物LiCoO 中钴元素的化合价为 。
2
(2)“放电处理”有助于锂元素在正极的回收,电池放电时的总反应为LiC +Li CoO=LiCoO+C ,则此时正
x y 1-x 2 2 y
极的电极反应式为 。
(3)“碱溶”过程主要发生的离子方程式为 。
(4)为提高“酸溶”的速率,可采取的措施有 (任写一条)。
(5)“调pH”时,用氨水调节pH的范围为 。
(6)“沉钴”过程,检验CoCO 沉淀是否洗净的实验操作为 。
3
(7)“沉锂”后,洗涤LiCO 的实验操作为 。
2 3
26.醋酸钠(CHCOONa)是一种常用的防腐剂和缓冲剂。
3(1)某小组探究外界因素对CHCOONa水解程度的影响。甲同学设计实验方案如下(溶液浓度均为0.10
3
mol/L);
序号 温度 V(CH COONa)/mL V(CH COONH)/mL V(H O)/mL pH
3 3 4 2
1 25℃ 40.0 0 0 A
1
2 25℃ 4.0 0 36.0 A
2
3 25℃ 20.0 10.0 a A
3
4 40℃ 40.0 0 0 A
4
①实验 和 (填序号),探究加水稀释对CHCOONa水解程度的影响;
3
②根据甲同学的实验方案,补充数据:a= 。
③实验测得A>A ,该结果 (填“足以”或“不足以”)证明加入NH +促进了CHCOONa的水
1 3 4 3
解。可根据 (填一种微粒的化学式)的浓度增大进一步说明。
④甲同学预测AA 。实验结果与预测不一致的原因是 。
1 4 1 4
(2)小组通过测定不同温度下CHCOONa的水解常数K 确定温度对CHCOONa水解程度的影响。
3 h 3
查阅资料:K= ,c 为CHCOONa溶液起始浓度。
h 0 3
试剂: CHCOONa溶液、0.1000 mol·L-1盐酸、pH计。
3
实验:测定40℃下CHCOONa水解常数K,完成下表中序号7的实验内容。
3 h
序号 实验 记录的数据
取20.00mL CH COONa溶液,用0.1000 mol·L-1盐酸滴定至终点,测
5 3 消耗盐酸体积为V mL
CHCOONa溶液的浓度
3
6 测40℃时相同CHCOONa溶液的pH b
3
7 c
在 50℃和60℃下重复上述实验。
实验结论:K(60℃)>K(50℃)>K(40℃),温度升高,促进CHCOONa水解。
h h h 3成都石室中学 2024—2025 学年度上期高 2026 届十月考试
化学答案
1-5 CCBAD 6-10CBCDC 11-15ABCBA 16-20BCDAC 21-22AC
23.(14分,每小题2分)
Ⅰ(1)D
(2) ①
②25%
Ⅱ(1) ④ ⑧⑨
(2) be
(3) 100∶1
24.(16分,除(1)中的①外每小题2分)
(1) ①+49.7 kJ∙mol A (各1分)
②增加HO投料可提升甲醇转化率
2
③吸收CO,从而促使CO不断转化为CO,降低H 中的CO含量,以减轻燃料电池的交换膜的损坏
2 2 2
1
(2) (5, ) 4
2
(3)①主反应 正反应为放热反应,600K时反应达平衡,升高温度,平衡逆向移动
② 0.4
25.(14分,每小题2分)
(1)
(2)
(3)
(4)搅拌或适当升温或适当增大硫酸、双氧水的浓度
(5)3.7≤pH<7.0
(6)取最后一次洗涤液加入试管中,用稀盐酸酸化,再滴入BaCl 溶液,若无白色沉淀则洗净,反之,未洗
2
净
(7)用玻璃棒引流向过滤漏斗中加热水浸没沉淀,静待水自然流下,重复操作2~3次即可26.(12分,除①外每小题2分)
(1) ① 1 2 (各1分)
②0
③不足以 CHCOOH
3
④温度升高,CHCOONa的水解程度增大,水的电离程度也增大,二者综合影响导致c(H+)增大,
3
pH减小
(2) 测40℃纯水的pH