文档内容
高二化学 A 卷
满分:100分 考试时间:75分钟
注意事项:
1.答题前,考生先将自己的姓名、准考证号码填写清楚,将条形码准确粘贴在考生信息条形
码粘贴区。
2.选择题必须使用2B铅笔填涂;非选择题必须使用0.5毫米黑色字迹签字笔书写,字体工整、
笔迹清晰。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;在草
稿纸、试卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折叠,不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
可能用到的原子量:H-1 C-12 O-16
一、选择题:本题共 14小题,每小题3分,共42分。在每小题给出的四个选项中只有一项
是符合题目要求的。
1.中华传统文化蕴含着丰富的化学知识,下列诗词描述的变化中,涉及到吸热反应的是( )
A.杨万里的《桑茶坑道中》:晴明风日雨干时,草满花堤水满溪
B.李商隐的《无题》:春蚕到死丝方尽,蜡炬成灰泪始干
C.于谦的《石灰吟》:千锤万凿出深山,烈火焚烧若等闲
D.杜牧的《赤壁》:折戟沉沙铁未销,自将磨洗认前朝
2.下列说法正确的是( )
A.一定条件下,将 和 置于密闭容器中充分反应生成 放出热量 ,其热化学方
程式为
B. 在 同 温 同 压 下 ; , 则
C.根据 ,可知氢气的燃烧热为
D.已知 ,则稀醋酸与稀 溶液反应生成
水,放出热量
3.下列事实不能用化学平衡移动原理解释的是( )
A.工业合成氨,使用450℃高温
B. 的 溶液,升高温度 减小C.红棕色的 气体,加压后颜色先变深后变浅
D.实验室中常用排饱和食盐水的方法收集氯气
4.化学实验操作是进行科学实验的基础。下列使用的仪器和实验操作能达到实验目的的是( )
A.碱式滴定管排 C.测定锌与稀硫酸的反应
B.中和热的测定 D.探究浓度对反应速率的影响
气泡 速率
5.利用下列反应可减少 排放,是实现“双碳”目标的途径之一。
我国学者发现 时,在铜催化剂上二氧化碳加氢的反应机理如下,其中反应Ⅰ为慢反应。
Ⅰ.
Ⅱ.
下列反应进程示意图(各物质均为气态)符合题意的是( )
A. B.
C. D.
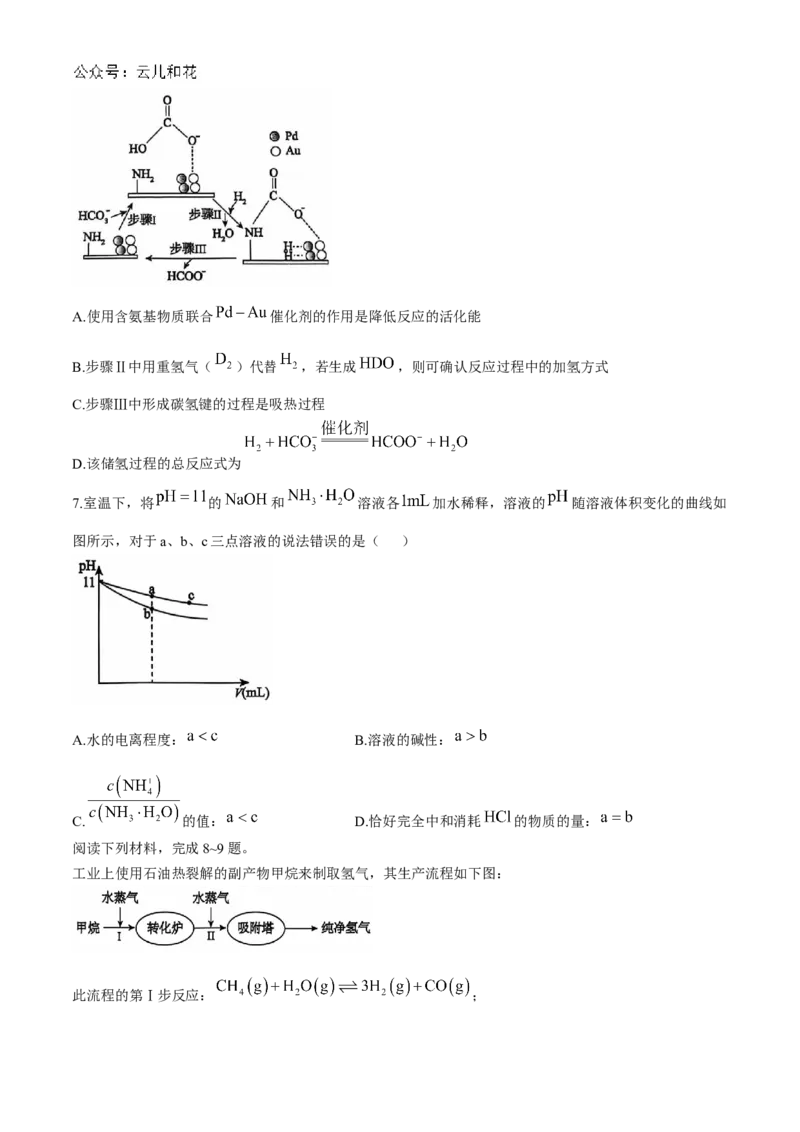
6.氢能是理想清洁能源,氢能产业链包括制氢、储氢和用氢等。一种使用含氨基物质(化学式为
, 是一种碳衍生材料)联合 催化剂储氢,可能机理如图所示。下列说法错误的是
( )A.使用含氨基物质联合 催化剂的作用是降低反应的活化能
B.步骤Ⅱ中用重氢气( )代替 ,若生成 ,则可确认反应过程中的加氢方式
C.步骤Ⅲ中形成碳氢键的过程是吸热过程
D.该储氢过程的总反应式为
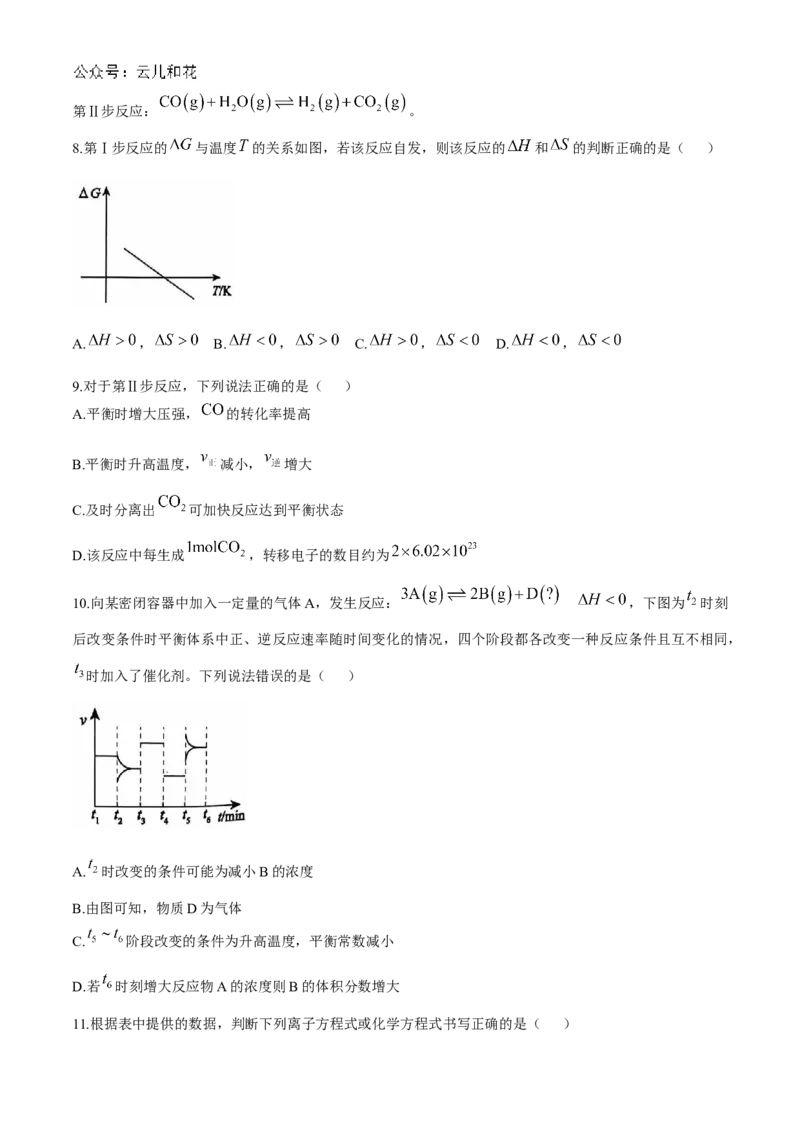
7.室温下,将 的 和 溶液各 加水稀释,溶液的 随溶液体积变化的曲线如
图所示,对于a、b、c三点溶液的说法错误的是( )
A.水的电离程度: B.溶液的碱性:
C. 的值: D.恰好完全中和消耗 的物质的量:
阅读下列材料,完成8~9题。
工业上使用石油热裂解的副产物甲烷来制取氢气,其生产流程如下图:
此流程的第Ⅰ步反应: ;第Ⅱ步反应: 。
8.第Ⅰ步反应的 与温度 的关系如图,若该反应自发,则该反应的 和 的判断正确的是( )
A. , B. , C. , D. ,
9.对于第Ⅱ步反应,下列说法正确的是( )
A.平衡时增大压强, 的转化率提高
B.平衡时升高温度, 减小, 增大
C.及时分离出 可加快反应达到平衡状态
D.该反应中每生成 ,转移电子的数目约为
10.向某密闭容器中加入一定量的气体A,发生反应: ,下图为 时刻
后改变条件时平衡体系中正、逆反应速率随时间变化的情况,四个阶段都各改变一种反应条件且互不相同,
时加入了催化剂。下列说法错误的是( )
A. 时改变的条件可能为减小B的浓度
B.由图可知,物质D为气体
C. 阶段改变的条件为升高温度,平衡常数减小
D.若 时刻增大反应物A的浓度则B的体积分数增大
11.根据表中提供的数据,判断下列离子方程式或化学方程式书写正确的是( )化学式
电离常数
A.向 溶液中通入少量 :
B.向 溶液中通入少量 :
C.向 溶液中通入过量 :
D.向 溶液中滴加少量氯水:
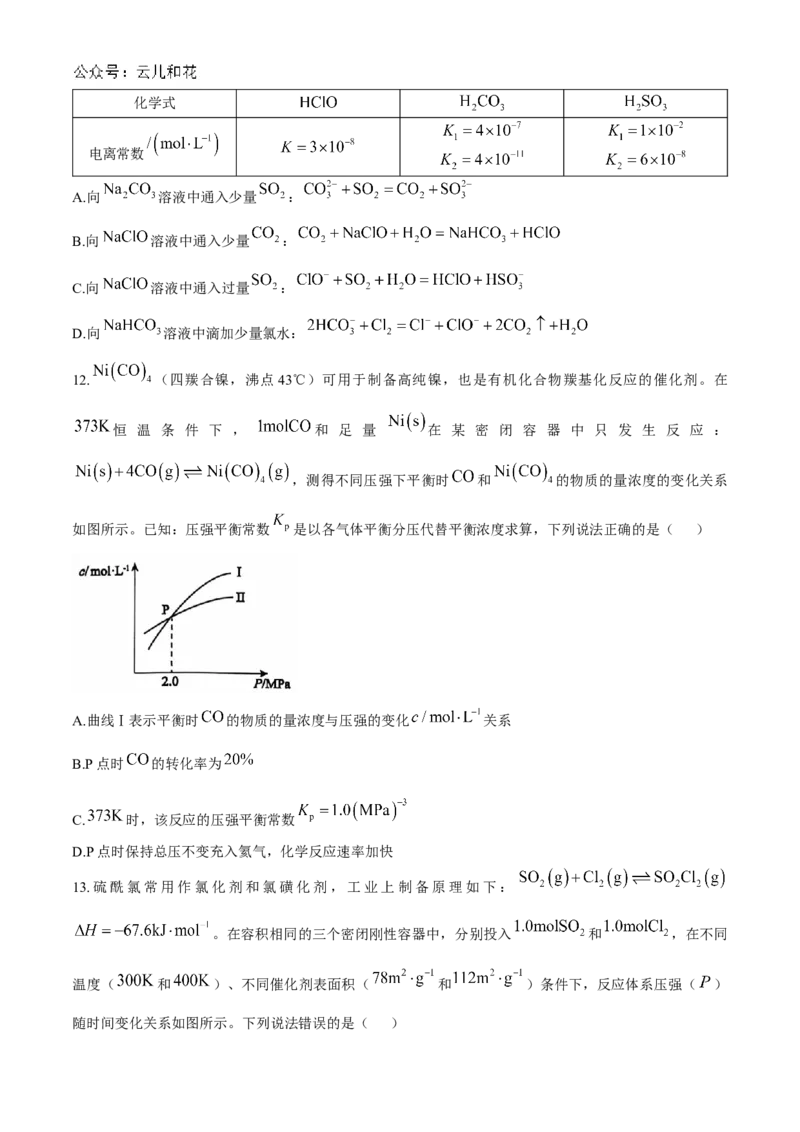
12. (四羰合镍,沸点43℃)可用于制备高纯镍,也是有机化合物羰基化反应的催化剂。在
恒 温 条 件 下 , 和 足 量 在 某 密 闭 容 器 中 只 发 生 反 应 :
,测得不同压强下平衡时 和 的物质的量浓度的变化关系
如图所示。已知:压强平衡常数 是以各气体平衡分压代替平衡浓度求算,下列说法正确的是( )
A.曲线Ⅰ表示平衡时 的物质的量浓度与压强的变化 关系
B.P点时 的转化率为
C. 时,该反应的压强平衡常数
D.P点时保持总压不变充入氦气,化学反应速率加快
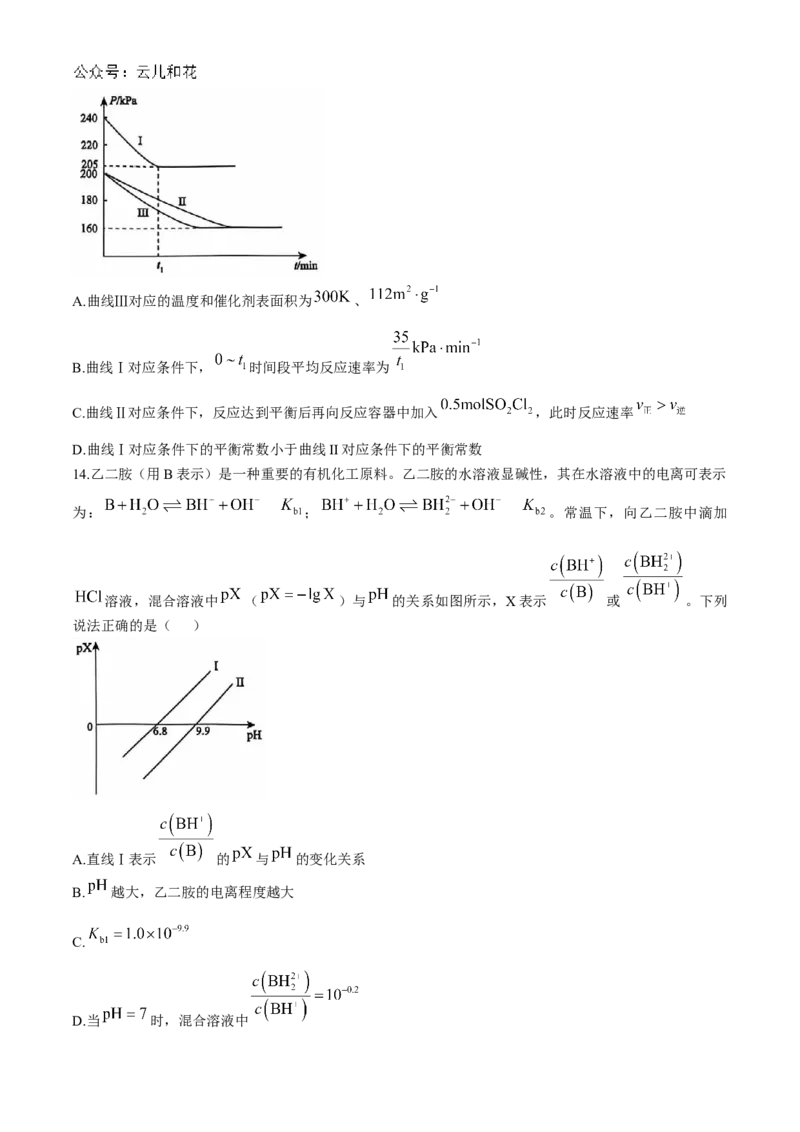
13.硫酰氯常用作氯化剂和氯磺化剂,工业上制备原理如下:
。在容积相同的三个密闭刚性容器中,分别投入 和 ,在不同
温度( 和 )、不同催化剂表面积( 和 )条件下,反应体系压强( )
随时间变化关系如图所示。下列说法错误的是( )A.曲线Ⅲ对应的温度和催化剂表面积为 、
B.曲线Ⅰ对应条件下, 时间段平均反应速率为
C.曲线Ⅱ对应条件下,反应达到平衡后再向反应容器中加入 ,此时反应速率
D.曲线Ⅰ对应条件下的平衡常数小于曲线II对应条件下的平衡常数
14.乙二胺(用B表示)是一种重要的有机化工原料。乙二胺的水溶液显碱性,其在水溶液中的电离可表示
为: ; 。常温下,向乙二胺中滴加
溶液,混合溶液中 ( )与 的关系如图所示,X表示 或 。下列
说法正确的是( )
A.直线Ⅰ表示 的 与 的变化关系
B. 越大,乙二胺的电离程度越大
C.
D.当 时,混合溶液中二、非选择题:共4小题,共58分。
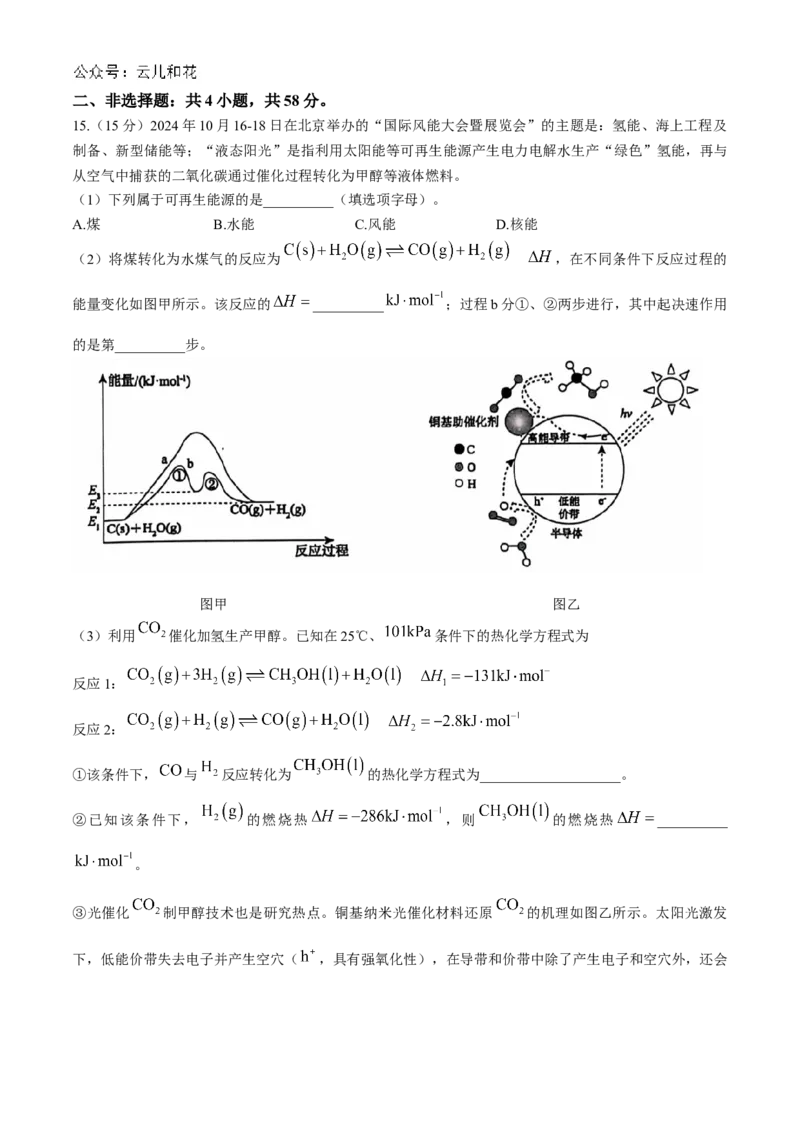
15.(15分)2024年10月16-18日在北京举办的“国际风能大会暨展览会”的主题是:氢能、海上工程及
制备、新型储能等;“液态阳光”是指利用太阳能等可再生能源产生电力电解水生产“绿色”氢能,再与
从空气中捕获的二氧化碳通过催化过程转化为甲醇等液体燃料。
(1)下列属于可再生能源的是__________(填选项字母)。
A.煤 B.水能 C.风能 D.核能
(2)将煤转化为水煤气的反应为 ,在不同条件下反应过程的
能量变化如图甲所示。该反应的 __________ ;过程b分①、②两步进行,其中起决速作用
的是第__________步。
图甲 图乙
(3)利用 催化加氢生产甲醇。已知在25℃、 条件下的热化学方程式为
反应1:
反应2:
①该条件下, 与 反应转化为 的热化学方程式为____________________。
②已知该条件下, 的燃烧热 ,则 的燃烧热 __________
。
③光催化 制甲醇技术也是研究热点。铜基纳米光催化材料还原 的机理如图乙所示。太阳光激发
下,低能价带失去电子并产生空穴( ,具有强氧化性),在导带和价带中除了产生电子和空穴外,还会生成__________(填写微粒符号)参与 的还原再生;光催化 制备甲醇相对于原方法的优点是
____________________。
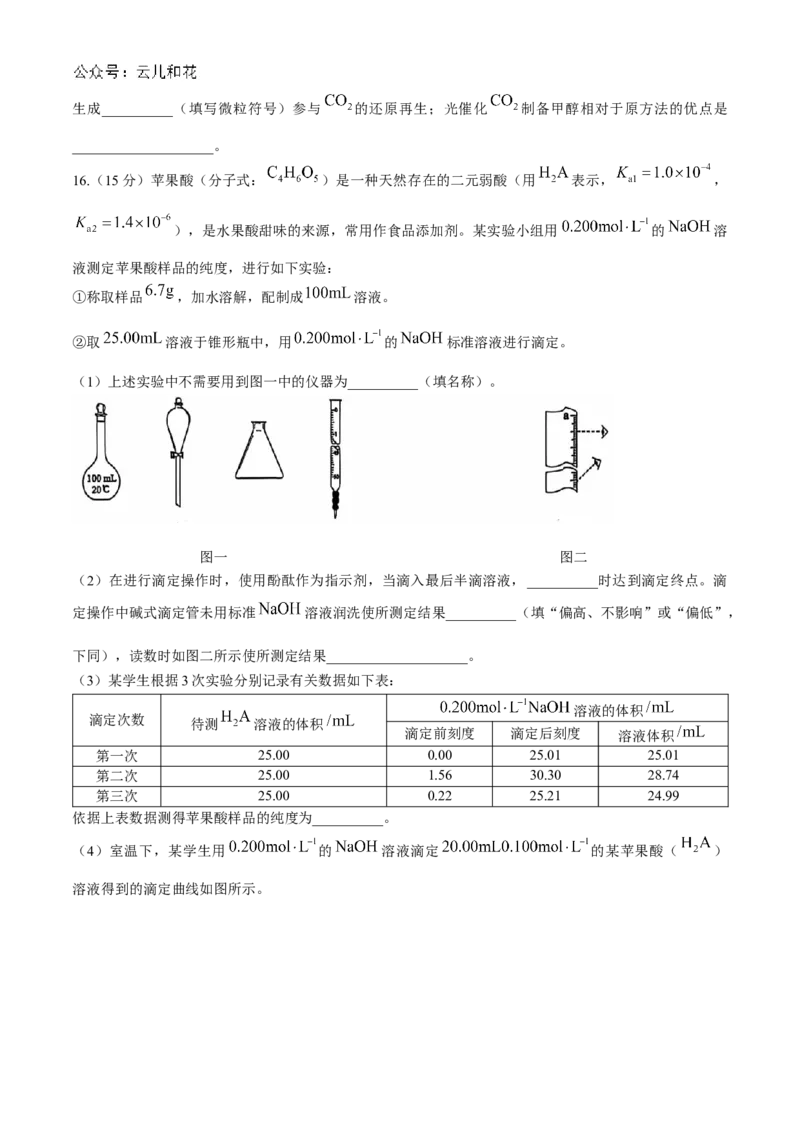
16.(15分)苹果酸(分子式: )是一种天然存在的二元弱酸(用 表示, ,
),是水果酸甜味的来源,常用作食品添加剂。某实验小组用 的 溶
液测定苹果酸样品的纯度,进行如下实验:
①称取样品 ,加水溶解,配制成 溶液。
②取 溶液于锥形瓶中,用 的 标准溶液进行滴定。
(1)上述实验中不需要用到图一中的仪器为__________(填名称)。
图一 图二
(2)在进行滴定操作时,使用酚酞作为指示剂,当滴入最后半滴溶液,__________时达到滴定终点。滴
定操作中碱式滴定管未用标准 溶液润洗使所测定结果__________(填“偏高、不影响”或“偏低”,
下同),读数时如图二所示使所测定结果____________________。
(3)某学生根据3次实验分别记录有关数据如下表:
溶液的体积
滴定次数
待测 溶液的体积
滴定前刻度 滴定后刻度 溶液体积
第一次 25.00 0.00 25.01 25.01
第二次 25.00 1.56 30.30 28.74
第三次 25.00 0.22 25.21 24.99
依据上表数据测得苹果酸样品的纯度为__________。
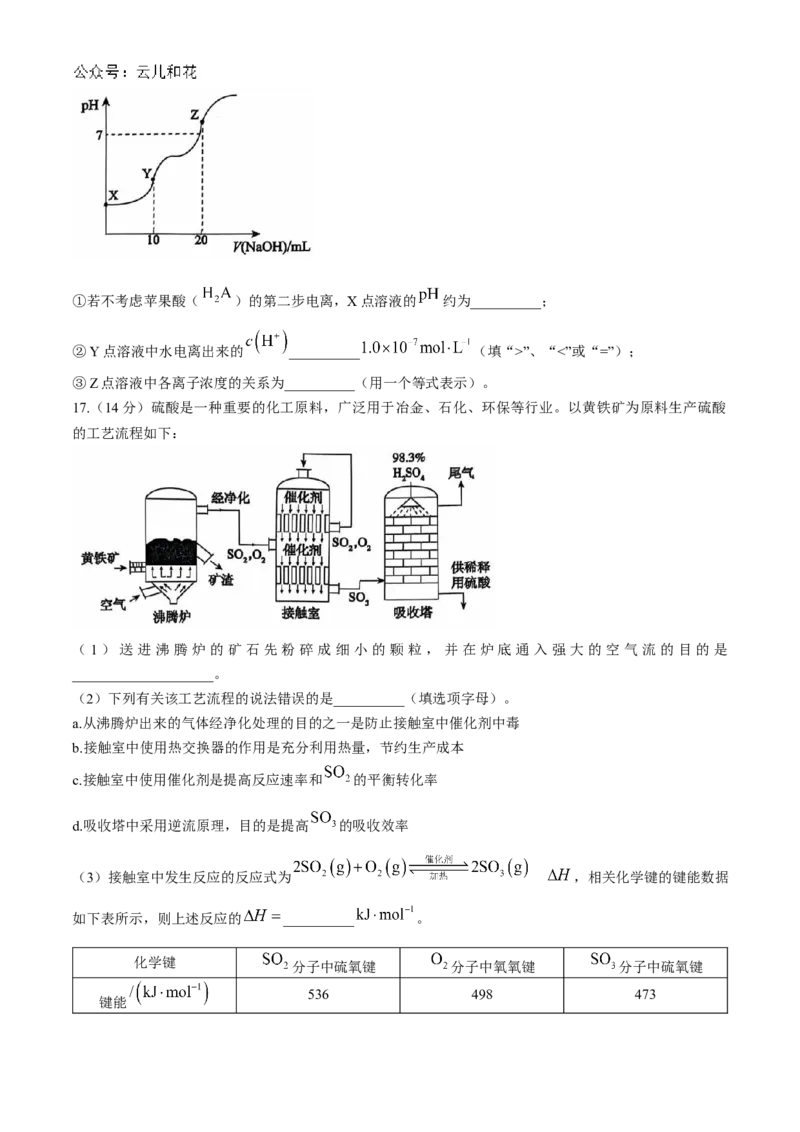
(4)室温下,某学生用 的 溶液滴定 的某苹果酸( )
溶液得到的滴定曲线如图所示。①若不考虑苹果酸( )的第二步电离,X点溶液的 约为__________;
②Y点溶液中水电离出来的 __________ (填“>”、“<”或“=”);
③Z点溶液中各离子浓度的关系为__________(用一个等式表示)。
17.(14分)硫酸是一种重要的化工原料,广泛用于冶金、石化、环保等行业。以黄铁矿为原料生产硫酸
的工艺流程如下:
(1)送进沸腾炉的矿石先粉碎成细小的颗粒,并在炉底通入强大的空气流的目的是
____________________。
(2)下列有关该工艺流程的说法错误的是__________(填选项字母)。
a.从沸腾炉出来的气体经净化处理的目的之一是防止接触室中催化剂中毒
b.接触室中使用热交换器的作用是充分利用热量,节约生产成本
c.接触室中使用催化剂是提高反应速率和 的平衡转化率
d.吸收塔中采用逆流原理,目的是提高 的吸收效率
(3)接触室中发生反应的反应式为 ,相关化学键的键能数据
如下表所示,则上述反应的 __________ 。
化学键
分子中硫氧键 分子中氧氧键 分子中硫氧键
536 498 473
键能(4)温度为 时,在三个起始体积均为 的密闭容器中发生反应: 。
起始物质的量
容器编号 容器类型
平衡时 的物质的量
Ⅰ 恒温恒容 2 1 0 1.8
Ⅱ 恒温恒压 2 1 0
Ⅲ 绝热恒容 0 0 2
①容器Ⅱ中平衡时 的转化率__________容器Ⅰ中平衡时 的转化率(填“大于、小于”或“等于”,
下同);
②容器Ⅱ中的平衡常数__________容器Ⅰ中的平衡常数;
③容器Ⅲ中平衡时 的物质的量: __________1.8。
(5)某温度时,水的离子积为 ,则该温度下将稀释至 的 溶液 与
的 溶液 混合。若所得混合液为中性,则 __________。
18.(14分)“萨巴蒂尔反应”在载人航天器中有着重要应用。通过这个反应,可以将航天器中的二氧化
碳转化为甲烷和水,甲烷可以作为燃料使用,而水可以通过电解生成氧气和氢气,从而实现氧气的再生。
“萨巴蒂尔反应”的原理为:
主反应:
副反应:
(1)对于主反应,若正反应的活化能为 ,则逆反应的活化能 __________
(用含 的代数式表示)。
(2)反应 的平衡常数 __________(用 、 表示)。
(3)恒温条件下,在恒容密闭容器中进行反应: ,达到平衡状
态的标志是__________(填选项字母)。
A. B.混合气体的密度不再改变的状态
C.混合气体的压强不再改变的状态 D.混合气体的平均相对分子质量不再改变的状态
(4)一定条件下,向体积为 的恒容密闭容器中通入 和 发生上述主、副反应,达到
平衡时,容器中 为 , 为 ,此时 的浓度为__________ (用含 、 、 的代数式表示,下同),副反应的平衡常数为__________。
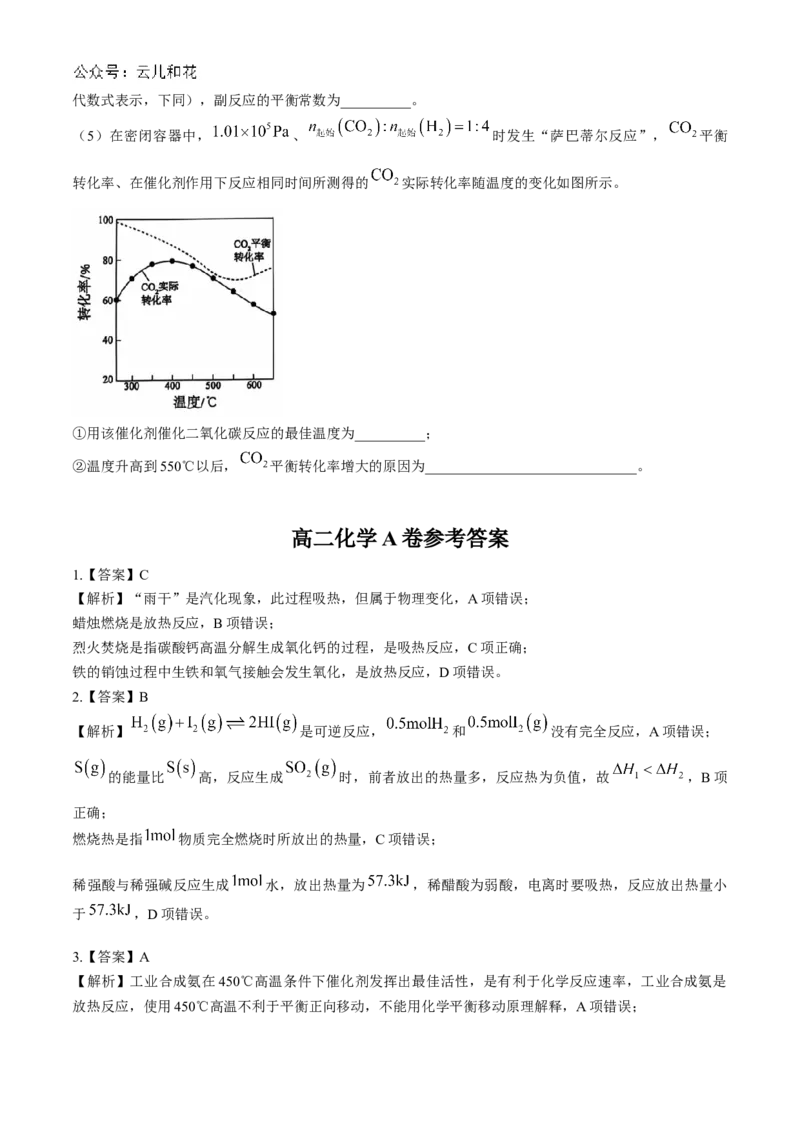
(5)在密闭容器中, 、 时发生“萨巴蒂尔反应”, 平衡
转化率、在催化剂作用下反应相同时间所测得的 实际转化率随温度的变化如图所示。
①用该催化剂催化二氧化碳反应的最佳温度为__________;
②温度升高到550℃以后, 平衡转化率增大的原因为______________________________。
高二化学 A 卷参考答案
1.【答案】C
【解析】“雨干”是汽化现象,此过程吸热,但属于物理变化,A项错误;
蜡烛燃烧是放热反应,B项错误;
烈火焚烧是指碳酸钙高温分解生成氧化钙的过程,是吸热反应,C项正确;
铁的销蚀过程中生铁和氧气接触会发生氧化,是放热反应,D项错误。
2.【答案】B
【解析】 是可逆反应, 和 没有完全反应,A项错误;
的能量比 高,反应生成 时,前者放出的热量多,反应热为负值,故 ,B项
正确;
燃烧热是指 物质完全燃烧时所放出的热量,C项错误;
稀强酸与稀强碱反应生成 水,放出热量为 ,稀醋酸为弱酸,电离时要吸热,反应放出热量小
于 ,D项错误。
3.【答案】A
【解析】工业合成氨在450℃高温条件下催化剂发挥出最佳活性,是有利于化学反应速率,工业合成氨是
放热反应,使用450℃高温不利于平衡正向移动,不能用化学平衡移动原理解释,A项错误;的电离是吸热反应,升温平衡正向移动,氢离子浓度增大, 减小,B项正确;
是气体分子数减小的反应,红棕色的 气体,加压后颜色先变深后变浅,利用了化学
平衡移动原理,C项正确;
氯化钠在溶液中完全电离,所以饱和食盐水中含有大量的氯离子,氯气溶于水的反应是一个可逆反应,
,由于饱和食盐水中含有大量的氯离子,相当于氯气溶于水的反应中增
加了大量的生成物氯离子,根据勒夏特列原理,平衡向逆反应方向移动,氯气溶解量减小,利用了化学平
衡移动原理,D项正确。
4.【答案】A
【解析】碱式滴定管排气泡,将胶管向上倾斜,A项正确;
大小烧杯杯口应相平,B项错误;
缺了秒表,不能测定反应速率,C项错误;
过氧化氢和亚硫酸氢钠反应没有明显的表征,因此该实验不能探究浓度对反应速率的影响,D项错误。
5.【答案】B
【答案】由题可知,反应Ⅰ是吸热反应,反应Ⅱ是放热反应,根据盖斯定律知,总反应
,是放热反应,又已知反应Ⅰ为慢反应,即所需活化能较大,故B项
正确。
6.【答案】C
【解析】催化剂的作用是降低反应的活化能,提高反应速率,A项正确;
步骤Ⅱ中用重氢气( )代替 ,若生成 ,说明氢气中一个氢原子与羟基相连,B项正确;
在化学反应过程中,断裂化学键需吸收能量,形成化学键会释放能量,步骤Ⅲ中形成碳氢键的过程是放热
过程,C项错误;
从图中流程看,该储氢过程的总反应式为 ,D项正确。
7.【答案】D
【解析】a点氢氧根离子浓度大,抑制水的电离,水的电离程度: ,A项正确;
溶液的 : ,则溶液的碱性: ,B项正确;
溶液加水稀释, 的电离平衡常数不变, 减小, 增大,即
,C项正确;
的 和 溶液各 ,溶质的物质的量 大于 ,稀释后溶质的物质的量不变,恰好完全中和,消耗 的物质的量: ,D项错误。
8.【答案】A
【解析】由 可得 ,根据图像可知,由该直线解析式得斜率小于0,纵
截距大于0,即 , 。故结果为 , ,A项正确。
9.【答案】D
【解析】该反应为气体分子数不变的反应,增大压强,平衡不移动,CO的转化率不变,A项错误;
平衡时升高温度,反应物分子的能量都增大,单位体积内的活化分子数目增多, 增大, 增大,B项
错误;
及时分离出 ,虽然可使平衡正向移动,但由于减小了生成物的浓度,所以反应速率减慢,C项错误;
该反应中,C元素由 价升高到 价,所以每生成 ,转移电子的数目约为 ,D
项正确。
10.【答案】D
【解析】 阶段 和 有一速率不变,有一速率减小,应该为容器体积不变,减小某一物质的浓度,
A项正确;
时加入了催化剂, 阶段平衡不移动,说明该反应为气体分子数不变的反应,改变的条件是减小压
强,则D物质为气体,B项正确;
时正、逆反应速率均增大,改变的条件为升高温度,该反应 ,平衡向逆反应方向移动,平衡常
数减小,C项正确;
若 时刻增大反应物A的浓度,相当于增大压强,由于该反应为气体分子数不变的反应,则B的体积分数
不变,D项错误。
11.【答案】B
【解析】根据题目所给数据可知,向 溶液中通入少量 , 过量 应转化为 ,
正确的方程式: ,A项错误;
结合质子的能力 ,向 溶液中通入少量 ,反应生成碳酸氢钠和次氯酸,B项正
确;
向 溶 液 中 通 入 过 量 , 会 与 发 生 氧 化 还 原 反 应 , 正 确 的 方 程 式 :,C项错误;
氯气与水反应生成 和 ,而结合质子的能力 ,所以 的氢离子不会失去,最
终产物中应有 ,正确的方程式: ,D项错误。
12.【答案】C
【解析】该反应的正反应为气体分子数减小的反应,增大压强,平衡正向移动, 的物质的量浓
度增大程度大于 ,结合图像可知曲线Ⅰ表示平衡时 的物质的量浓度与压强的变化关系,A项
错误;
点 和 的物质的量浓度相等,由方程式计算可知, 的转化率为 ,B项错误;
时,温度一定,平衡常数一定,根据 点 和 的物质的量浓度相等,分压也相等,则
; ,C项正确;
点时保持总压不变充入氦气,容器的体积扩大, 和 的物质的量浓度减小,化学反应速率
减慢,D项错误。
13.【答案】C
【解析】催化剂不影响化学平衡,该反应为放热反应,升高温度平衡逆向移动,因此 时体系总压强
应大于 时体系总压强,故Ⅰ对应的温度为 ,Ⅱ、Ⅲ对应的温度为 ,催化剂表面积越大,
反应速率越快,Ⅲ总压强减小的速率大于Ⅱ,说明Ⅲ反应速率更快,Ⅲ对应催化剂表面积为 ,
故曲线Ⅲ对应的温度和催化剂表面积分别为 和 ,A项正确;
曲线Ⅰ对应条件下, 时间段,压强的变化量为 ,平均反应速率为 ,B项正确;
在曲线Ⅱ对应条件下,反应达到平衡后再向反应容器中加入 时, 增大、 不变,故
,C项错误;
曲线Ⅰ对应的温度高于曲线Ⅱ,该反应是放热反应,故曲线Ⅰ对应条件下的平衡常数小,D项正确。
14.【答案】D【解析】当 时, ,即直线与横坐标的交点对应的氢氧根离子浓度表示电离常数,又
已知 , 的 直线与横坐标的交点对应的 大,则 大,故直线Ⅱ表示
的 与 的变化关系,直线Ⅰ表示 的 与 的变化关系,则 ,
,A项错误;
越大, 越大,乙二胺的电离程度越小,B项错误;
,C项错误;
根据 计算可得当 时,混合溶液中 ,D项正确。
15.【答案】(15分,除标记外每空2分)(1)B、C
(2) ①
(3)① (3分)②
③ 条件温和,一般为常温、常压;充分利用太阳能,节约能源(答出一点即可)
【解析】(1)在自然界中可以不断再生的资源,属于可再生能源,主要包括太阳能、风能、水能、生物
质能、地热能和海洋能等,煤和核能是不可再生能源。
(2)反应热为生成物与反应物的能量差, ;过程b中第①步活化能高,反应速
率慢,即起决速作用。
( 3 ) ① 根 据 盖 斯 定 律 , 由 反 应 1 和 反 应 2 可 得 :
。
②根据盖斯定律, ,该反应的反应
热 ,计算可得 。
③结合图知,在低能价带上, 直接转化为 的电极反应式: ,反应生成可参与高能带上的还原再生。光催化 制备甲醇的还原条件温和,一般为常温、常压;充分利用太
阳能,节约能源。
16.【答案】(15分,除标记外每空2分)
(1)分液漏斗(1分)
(2)锥形瓶中溶液由无色变为红色且半分钟不褪色 偏高 偏低
(3)
(4)①2.5②<③
【解析】(1)上述实验中不需要用到图一中的仪器为分液漏斗。
(2)滴定终点的现象是:当滴入最后半滴溶液,锥形瓶中溶液由无色变为红色且半分钟不褪色;滴定操
作中碱式滴定管未用标准 溶液润洗,使标准 溶液的浓度减小,滴定标准 溶液的体积
偏大,所测定结果偏高;读数时如图二所示,初始读数平视,终点读数俯视,读数结果偏小,所测定结果
偏低。
(3)第二次测定结果明显错误,是无效数据,舍去,两次平均值为 ,测得苹果酸样品的纯度为
。
( 4 ) ① 根 据 第 一 步 电 离 常 数 计 算 , ,
, 点溶液的 约为2.5。
② 点溶液呈酸性,是酸抑制了水的电离,水电离出来的 。
③ 点 溶 液 中 含 有 离 子 : 、 、 、 、 , 根 据 电 荷 守 恒 有 :
。
17.【答案】(14分,每空2分)
(1)增大矿石与空气的接触面积,使之充分燃烧(提高原料的利用率)
(2)c
(3)
(4)①大于②等于③大于(5)
【解析】(1)增大矿石与空气的接触面积,使之充分燃烧(提高原料的利用率)
(2)从沸腾炉出来的气体经净化处理的目的之一是防止接触室中催化剂中毒,a项正确;
热交换器在接触室中的作用是把反应时生成的热传递给需要预热的气体,并冷却反应后生成的气体,从而
充分利用热量,降低生产成本,b项正确;
接触室中使用催化剂是提高反应速率,不能提高 的平衡转化率,c项错误;
吸收塔中浓硫酸从上喷下,气体从下往上,采用逆流原理,提高了 的吸收效率,d项正确。
(3)
(4)①容器Ⅰ为恒温恒容,容器Ⅱ为恒温恒压,起始量相同,容器Ⅰ中达到平衡状态时气体压强减小,
容器Ⅱ中随反应进行,气体压强保持恒压,相对于容器Ⅰ,容器Ⅱ相当于增大压强,平衡正向进行,二氧
化硫转化率增大,所以容器Ⅱ中 的转化率大于容器Ⅰ中 的转化率;
②容器Ⅱ和容器Ⅰ温度相同,平衡常数相同;
③容器Ⅲ若为恒温恒容,与容器Ⅰ是等效平衡,达到平衡时 的物质的量应为 ,由于容器Ⅲ中
是逆反应达到的平衡状态,且容器Ⅲ为绝热容器,随反应进行温度降低,相对于容器Ⅰ,相当于降温,平
衡正向进行, 。
(5)该温度时,水的离子积为 , 的 溶液的氢离子浓度为 ,
的 溶 液 的 氢 氧 根 离 子 浓 度 为 , 若 所 得 混 合 液 为 中 性 , 则
,则 。
18.【答案】(14分,每空2分)(1)
(2)
(3)c、d
(4) (或 )
(5)①400℃左右(或400℃)②550℃后以副反应为主(或其它合理答案)
【解析】( 1)根据反应热 与活化能 和 关系为 可知,该反应的。
(2)由盖斯定律可知,主反应-副反应得反应 ,则 。
(3) ,说明正反应速率等于逆反应速率,而 不能说明正反
应速率等于逆反应速率,故a不符合题意;
容器体积始终不变,而反应中气体的质量也不变,则混合气体的密度始终不变,不是平衡状态的标志,故
b不符合题意;
该反应是气体分子数变化的反应,恒温恒容条件下,混合气体的压强不再改变,说明反应达到平衡,故 c
符合题意;
该反应是气体分子数变化的反应,反应过程中气体的物质的量变化,质量不变,摩尔质量改变,即混合气
体的平均相对分子质量改变,混合气体的平均相对分子质量不变的状态,能为平衡标志,故d符合题意。
(4)根据反应方程式计算:
,
则平衡时: 为 , 为 , 为 , 为 ,
为 ,则平衡时 的浓度为 ,副反应的平衡常数为 。
(5)①由图像可知 的实际转化率先升高后降低,在400℃左右时最高,但都未达到平衡转化率,说
明在400℃左右催化剂催化效率最佳,反应速率最快,所以用该催化剂催化二氧化碳反应的最佳温度为
400℃左右。
②主反应是放热反应,副反应是吸热反应,由图像可知 的平衡转化率随着温度的升高先降低后小幅度
地升高,说明550℃前以主反应为主,550℃后以副反应为主。