文档内容
绵阳南山中学集团学校高2022级10月联考
化学试卷
本试卷分为试题卷和答题卡两部分,其中试题卷由选择题和非选择题组成,共 6页;答题卡共2页。
满分100分,考试时间75分钟。
注意事项:
1. 答题前,考生务必将自己的学校、班级、姓名用0.5毫米黑色墨水签字笔填写清楚,同时用2B铅笔
将考号准确填涂在“考号”栏目内。
2. 选择题使用2B铅笔填涂在答题卡对应题目标号的位置上,如需改动,用橡皮擦擦干净后再选涂其它
答案;非选择题用0.5毫米黑色墨水签字笔书写在答题卡的对应框内,超出答题区域书写的答案无效;在
草稿纸、试题卷上答题无效。
3. 考试结束后将答题卡收回。
可能用到的相对原子质量:H—1 N—17 O—16 S—32 Al—27 Cu—64
一、选择题(本题共14小题,每小题3分,共42分。每小题只有一个选项最符合题意)
1. 新材料助力嫦娥六号探月挖“宝”,下列有关说法正确的是
A.“挖宝”所用钻杆由碳化硅增强铝基复合材料制造,碳化硅属于分子晶体
B.制造一同启程的小卫星“思源二号”,采用了特种镁合金与碳纤维,碳纤维属于纤维素
C.登月中,所用北斗系统的导航卫星,其计算机的芯片材料是高纯度二氧化硅
D.月面国旗由超细玄武岩纤维纺织而成,属于无机非金属材料
2. 下列化学用语表达正确的是
A.NH 分子的电子式:∶ ‥ \s\up 0 ()∶HH\s\up 0( B.SO的空间结构:平面三角
3 N H
形
C.HCl的 键的原子轨道重叠图: D. 的命名:2-甲基丁
烯
3. 下列有关离子方程式错误的是
A.向硝酸亚铁溶液中滴加稀硫酸产生无色气体:3Fe+4H++NO = 3Fe+NO↑+2HO
2
B.用NaSO 溶液脱除实验装置中残余Cl:SO2+2Cl+3HO = 2SO2-+4Cl-+6H+
2 2 3 2 2 - 2 2 3
C.K[Fe(CN) ]溶液滴入FeCl 溶液中:K++Fe+Fe(CN)3- = KFe[Fe(CN) ]↓
3 6 2 6 6
D.NaHCO溶液与少量的Ba(OH) 溶液混合:2HCO+Ba2++2OH = BaCO↓+2HO+CO
2 2
4. 工业上用S(分子结构: )与甲烷为原料制备CS,其化学反应为:S+2CH =
8 2 8 4
2CS+4HS,
2 2
设N 为阿伏加德罗常数的值,下列说法正确的是
A
A.CS 中 键和 键数量之比为
2
B.S 中的S原子均为sp杂化
8
C.生成11.2L HS气体(标准状况),断开 键数为N
2 A
D.若该反应转移电子数8N ,则被还原的CH 有1mol
A 4
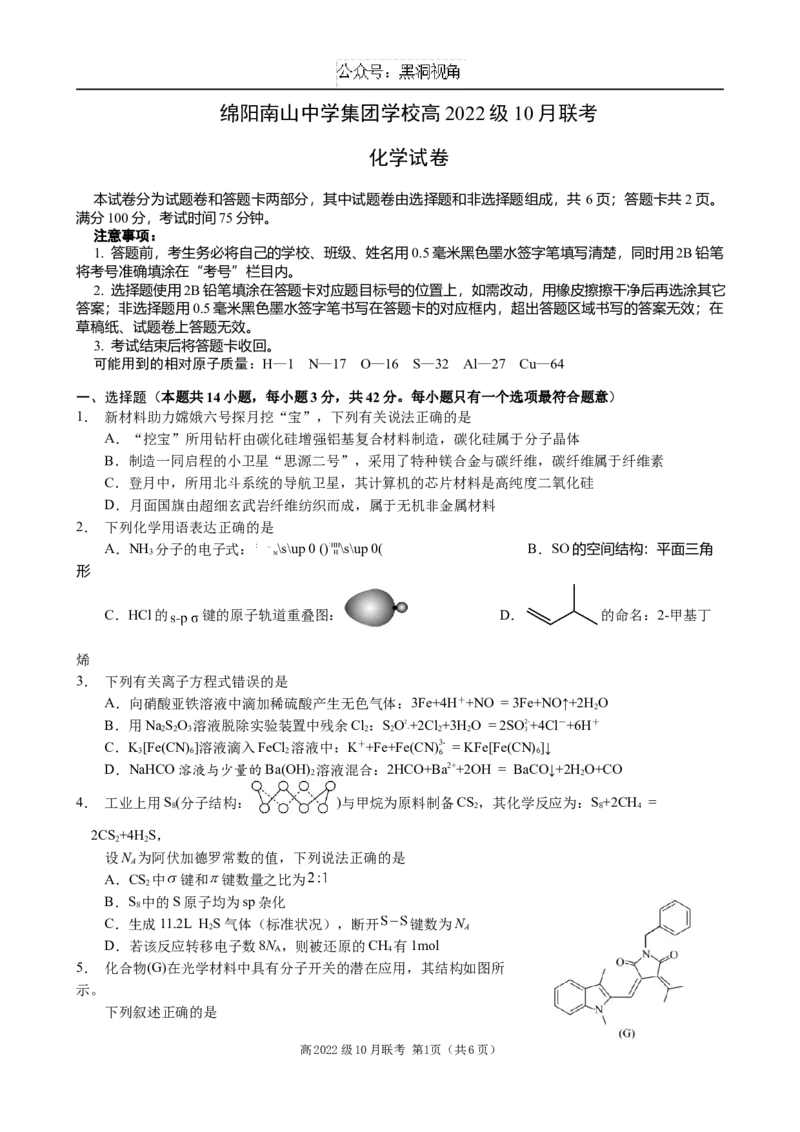
5. 化合物(G)在光学材料中具有分子开关的潜在应用,其结构如图所
示。
下列叙述正确的是
高2022级10月联考 第1页(共6页)A.G不能发生水解反应
B.1mol G与最多能反应11mol H
2
C.G分子不含手性碳原子
D.G分子中苯环上一氯代物有5种
6. 下列实验方法或操作正确且能达到目的的是
实验目的 实验方法或操作
探究温度对化学平衡 把NO 和NO 的混合气体通入两只连通的烧瓶,然后用弹簧夹夹住中间
A 2 2 4
的影响 的乳胶管;将一只烧瓶浸泡在热水中,另一只浸泡在冷水中
探究KI与FeCl 的反 将1mL 0.1mol/L KI溶液与5mL 0.1mol/L FeCl 溶液混合,充分反应后
B 3 3
应存在一定限度 再滴入几滴KSCN溶液
C 证明乙醇与钠反应 取少量医用酒精加入一小粒金属钠产生无色气体
焰色试验检验钾元素
D 用玻璃棒取少量某溶液进行焰色试验并观察现象
的存在
7. 联氨(NH)为二元弱碱,在水中性质与氨相似,可用于处理锅炉水中的溶解氧,防止锅炉被腐
2 4
蚀, 其中一种反应机理如图所示。
下列说法正确的是
A.NH 与水分子可形成氢键 B.Cu2+的价层电子排布式为是3d10
2 4
C.基态原子核外未成对电子数:NO>H
8. 下列实验能达到实验目的的是
A.配制一定物质的量浓度的稀盐酸 B.制备乙炔
玻璃表面皿
C.钠的燃烧 D.测定中和热
9. 室温下,下列各组离子在指定溶液中可能大量共存的是
A.与铝反应能产生H 的溶液:NO、Ba2+ 、Na+、Cl
2
B.在饱和氯水中:Na+、Fe2+、Br、AlO
2
C.在明矾溶液中:NH +、Na+、HCO、NO
4
D.含有大量Fe3+的溶液:Na+、Mg2+、I、SCN
高2022级10月联考 第2页(共6页)10.“光荣属于劳动者,幸福属于劳动者。”下列劳动项目与所述化学知识有关联的是
选项 劳动项目 化学知识
A 水质检测员:用明矾净水 Al(OH) 胶体有杀菌消毒作用
3
化学实验员:新榨苹果汁提取液可 苹果汁中含有氧化性物质,能把FeCl 溶液
B 3
使FeCl 溶液变为浅绿色 中的Cl氧化为Cl
3 2
C 化工工程师:工业合成氨 选择高温条件以提高氨气的产率
D 考古研究员:通过14C测定化石年代 同位素的放射性测半衰期
11.我国运动员在2024年巴黎奥运会上取得了佳绩。下图分子构成的物质可为运动员补充能量。其中
R、W、Z、X、Y为原子序数依次增大的短周期主族元素,Z和Y同族。下列有关叙述中错误的是
A.Z和X的简单氢化物的键角:Z>X
B.分子式为WR X的有机物一定能发生银镜反应
2 4
C.与X同周期且比X第一电离能大的元素有3种
D.Y的最高价氧化物对应的水化物是一种三元中强酸
12. 由γ-羟基丁酸生成γ-丁内酯的反应为:
HOCH CHCHCOOH +H O H<0,在25℃ 时,γ-羟基丁酸水溶液的初始浓度为
2 2 2 2
0.180 mol·L-1,测得γ-丁内酯的浓度随时间变化的数据如图所示:
下列说法错误的是
A.在80~100min内,以γ-丁内酯的浓度变化表示的反应速率为5×10﹣4 mol/(L·min)
B.在25℃时,该反应的平衡常数K=0.363
C.加水降低γ-羟基丁酸的初始浓度,γ-羟基丁酸的平衡转化率不变
D.使用非水溶剂并通过共沸回流移除体系中的水,有助于提高γ-丁内酯的平衡产率
13.单质氟常温下能腐蚀Fe、Ag等金属,但工业上
却可用Cu制容器储存。PtF 是极强的氧化剂,
6
用Xe和PtF 制备六氟合铂氙[XeF]+[Pt F ]-的历
6 2 11
程如图所示,下列叙述错误的是
A.[XeF]+[Pt F ]-固体为离子晶体
2 11
B.上述反应中 的催化剂为F-
C.上述过程中属于氧化还原反应的是②③
高2022级10月联考 第3页(共6页)D.氟单质可用Cu制容器储存的原因是两者不反应
14.一种含Ga、Ni、Co元素的记忆合金的晶体结构可描述为Ga与Ni交替填充在Co构成的立方体体
心, 形成如图所示的结构单元。对于该合金叙述正确的是
A.粒子个数最简比Ga、Ni、Co=1:1:1
B.其立方晶胞的体积为8a3 nm3
C.与Co距离最近且相等的Co有3个
D.Ga、Ni、Co均位于元素周期表的d区
二、非选择题(本题共4小题,共58分)
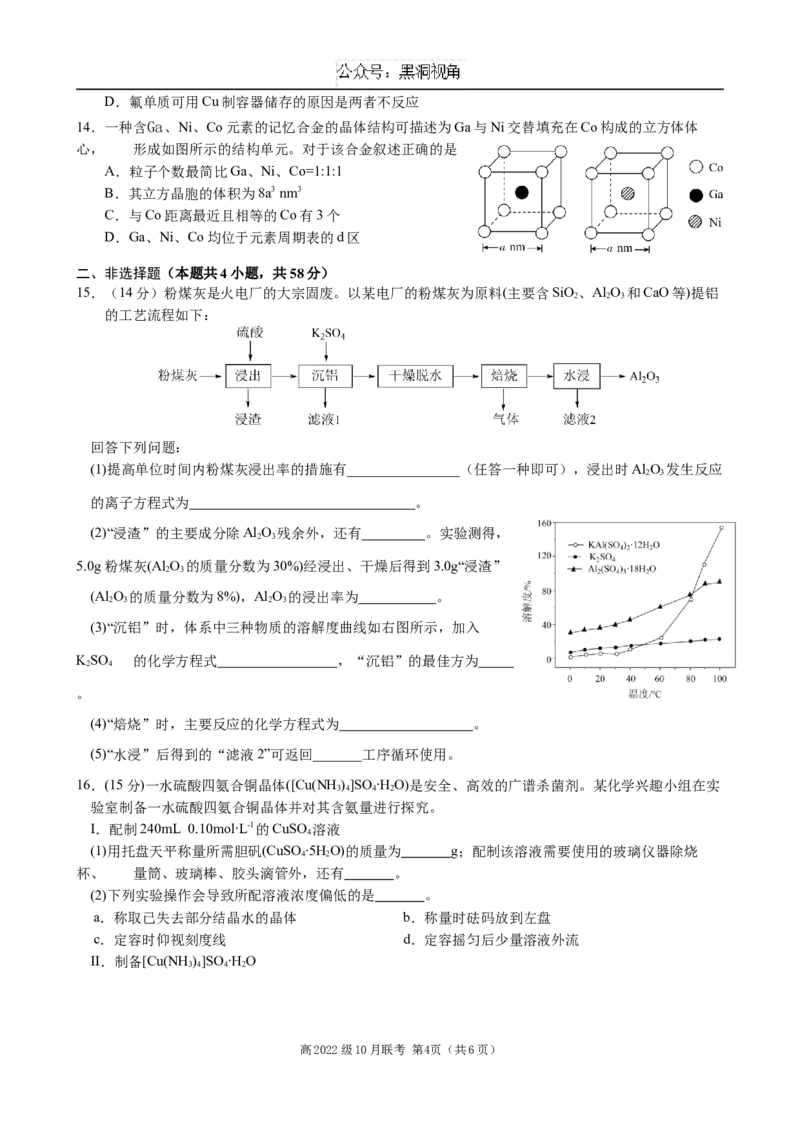
15.(14分)粉煤灰是火电厂的大宗固废。以某电厂的粉煤灰为原料(主要含SiO、Al O 和CaO等)提铝
2 2 3
的工艺流程如下:
回答下列问题:
(1)提高单位时间内粉煤灰浸出率的措施有________________(任答一种即可),浸出时Al O 发生反应
2 3
的离子方程式为 。
(2)“浸渣”的主要成分除Al O 残余外,还有 。实验测得,
2 3
5.0g粉煤灰(Al O 的质量分数为30%)经浸出、干燥后得到3.0g“浸渣”
2 3
(Al O 的质量分数为8%),Al O 的浸出率为 。
2 3 2 3
(3)“沉铝”时,体系中三种物质的溶解度曲线如右图所示,加入
KSO 的化学方程式 ,“沉铝”的最佳方为
2 4
。
(4)“焙烧”时,主要反应的化学方程式为 。
(5)“水浸”后得到的“滤液2”可返回_______工序循环使用。
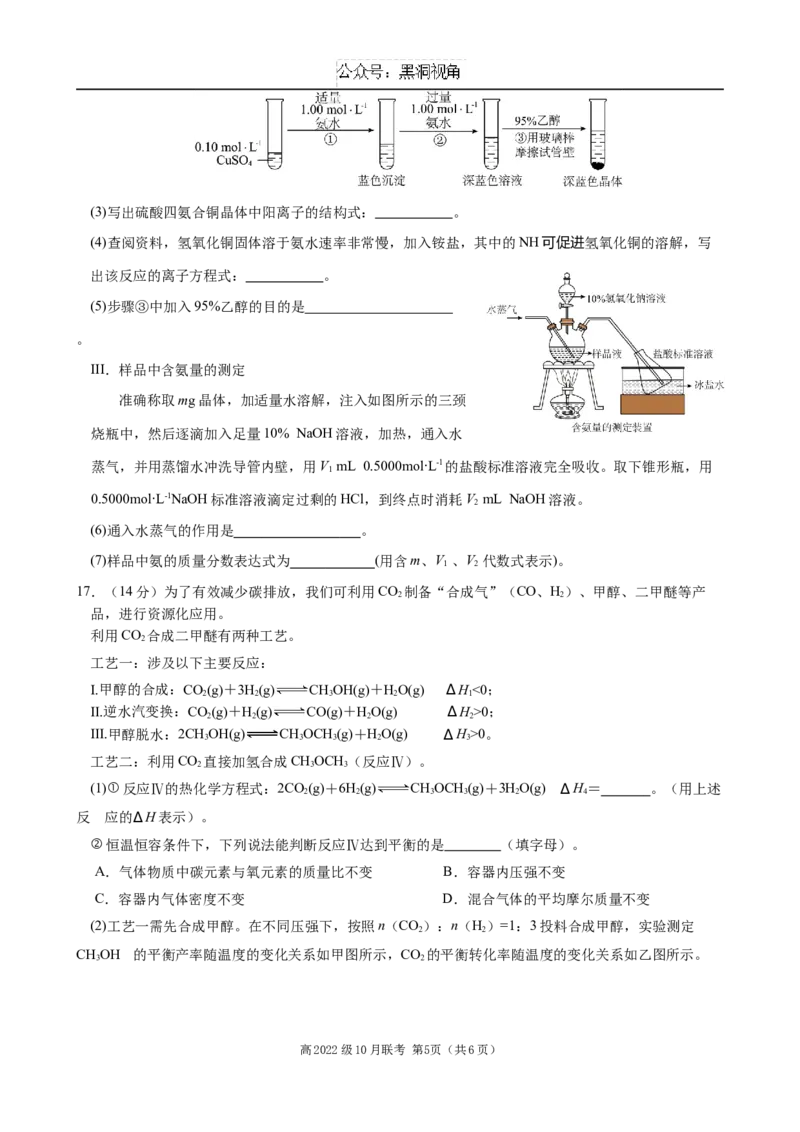
16.(15分)一水硫酸四氨合铜晶体([Cu(NH )]SO ∙HO)是安全、高效的广谱杀菌剂。某化学兴趣小组在实
3 4 4 2
验室制备一水硫酸四氨合铜晶体并对其含氨量进行探究。
I.配制240mL 0.10mol∙L-1的CuSO 溶液
4
(1)用托盘天平称量所需胆矾(CuSO ∙5H O)的质量为 g;配制该溶液需要使用的玻璃仪器除烧
4 2
杯、 量筒、玻璃棒、胶头滴管外,还有 。
(2)下列实验操作会导致所配溶液浓度偏低的是 。
a.称取已失去部分结晶水的晶体 b.称量时砝码放到左盘
c.定容时仰视刻度线 d.定容摇匀后少量溶液外流
II.制备[Cu(NH )]SO ∙HO
3 4 4 2
高2022级10月联考 第4页(共6页)(3)写出硫酸四氨合铜晶体中阳离子的结构式: 。
(4)查阅资料,氢氧化铜固体溶于氨水速率非常慢,加入铵盐,其中的NH可促进氢氧化铜的溶解,写
出该反应的离子方程式: 。
(5)步骤③中加入95%乙醇的目的是
。
III.样品中含氨量的测定
准确称取mg晶体,加适量水溶解,注入如图所示的三颈
烧瓶中,然后逐滴加入足量10% NaOH溶液,加热,通入水
蒸气,并用蒸馏水冲洗导管内壁,用V mL 0.5000mol∙L-1的盐酸标准溶液完全吸收。取下锥形瓶,用
1
0.5000mol∙L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V mL NaOH溶液。
2
(6)通入水蒸气的作用是 。
(7)样品中氨的质量分数表达式为 (用含m、V 、V 代数式表示)。
1 2
17.(14分)为了有效减少碳排放,我们可利用CO 制备“合成气”(CO、H)、甲醇、二甲醚等产
2 2
品,进行资源化应用。
利用CO 合成二甲醚有两种工艺。
2
工艺一:涉及以下主要反应:
Ⅰ.甲醇的合成:CO(g)+3H(g) CHOH(g)+HO(g) ∆H<0;
2 2 3 2 1
Ⅱ.逆水汽变换:CO(g)+H(g) CO(g)+HO(g) ∆H>0;
2 2 2 2
Ⅲ.甲醇脱水:2CH
3
OH(g) CH
3
OCH
3
(g)+H
2
O(g) ∆ H
3
>0。
工艺二:利用CO 直接加氢合成CHOCH(反应Ⅳ)。
2 3 3
(1)①反应Ⅳ的热化学方程式:2CO
2
(g)+6H
2
(g) CH
3
OCH
3
(g)+3H
2
O(g) ∆ H
4
= 。(用上述
反 应的∆ H表示)。
②恒温恒容条件下,下列说法能判断反应Ⅳ达到平衡的是 (填字母)。
A.气体物质中碳元素与氧元素的质量比不变 B.容器内压强不变
C.容器内气体密度不变 D.混合气体的平均摩尔质量不变
(2)工艺一需先合成甲醇。在不同压强下,按照n(CO):n(H)=1:3投料合成甲醇,实验测定
2 2
CHOH 的平衡产率随温度的变化关系如甲图所示,CO 的平衡转化率随温度的变化关系如乙图所示。
3 2
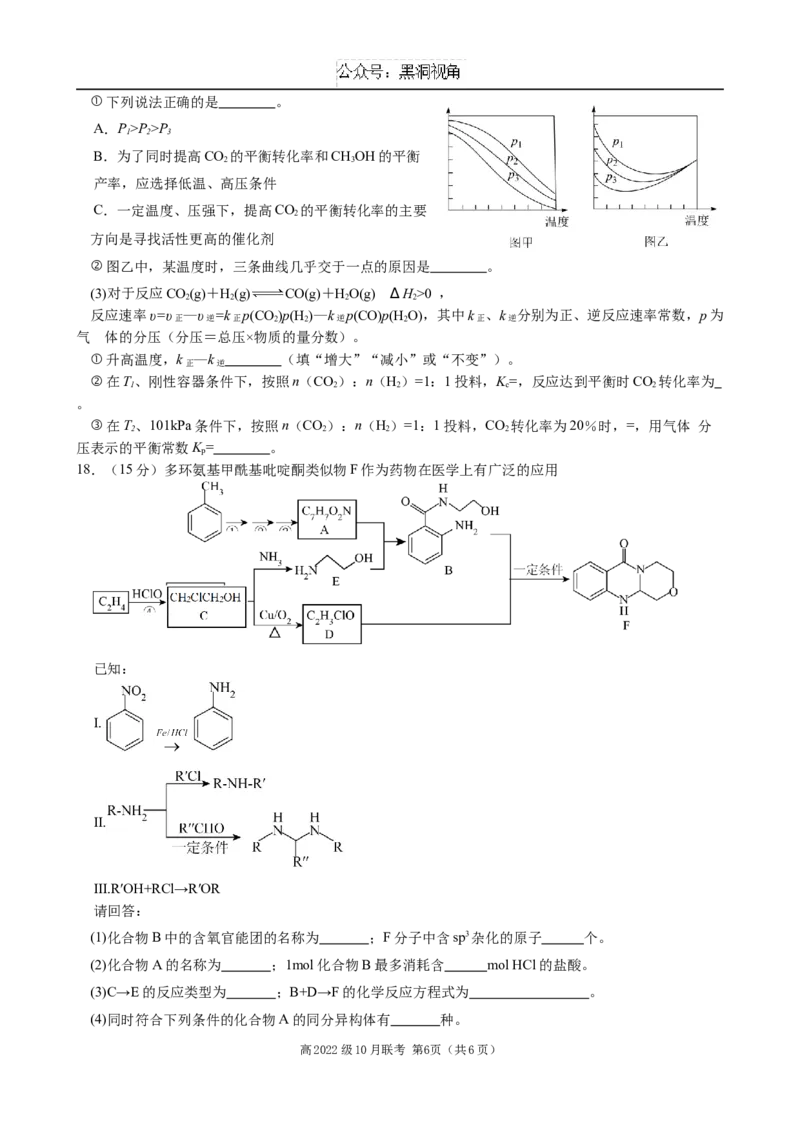
高2022级10月联考 第5页(共6页)①下列说法正确的是 。
A.P>P>P
1 2 3
B.为了同时提高CO 的平衡转化率和CHOH的平衡
2 3
产率,应选择低温、高压条件
C.一定温度、压强下,提高CO 的平衡转化率的主要
2
方向是寻找活性更高的催化剂
②图乙中,某温度时,三条曲线几乎交于一点的原因是 。
(3)对于反应CO(g)+H(g) CO(g)+HO(g) ∆H>0 ,
2 2 2 2
反应速率υ=υ —υ =k p(CO)p(H)—k p(CO)p(HO),其中k 、k 分别为正、逆反应速率常数,p为
正 逆 正 2 2 逆 2 正 逆
气 体的分压(分压=总压×物质的量分数)。
①升高温度,k —k (填“增大”“减小”或“不变”)。
正 逆
②在T、刚性容器条件下,按照n(CO):n(H)=1:1投料,K=,反应达到平衡时CO 转化率为
1 2 2 c 2
。
③在T、101kPa条件下,按照n(CO):n(H)=1:1投料,CO 转化率为20%时,=,用气体 分
2 2 2 2
压表示的平衡常数K = 。
p
18.(15分)多环氨基甲酰基吡啶酮类似物F作为药物在医学上有广泛的应用
已知:
I.
II.
III.R′OH+RCl→R′OR
请回答:
(1)化合物B中的含氧官能团的名称为 ;F分子中含sp3杂化的原子 个。
(2)化合物A的名称为 ;1mol化合物B最多消耗含 mol HCl的盐酸。
(3)C→E的反应类型为 ;B+D→F的化学反应方程式为 。
(4)同时符合下列条件的化合物A的同分异构体有 种。
高2022级10月联考 第6页(共6页)①分子中有苯环和-NH 。 ②能发生银镜反应。 ③能与FeCl 溶液反应而变紫
2 3
(5)设计以 和 为原料合成 的路线(用流程图表示,无机试剂任 选)
。
高2022级10月联考 第7页(共6页)