文档内容
山西省朔州市第九中学高中部 2023-2024 学年
高三上学期期中化学试题
注意事项:
1.答卷前,考生务必用黑色字迹钢笔或签字笔将自己的姓名、准考证号和班级填写在答题卡
上。将条形码横贴在答题卡右上角“条形码粘贴处”。
2.全部答案在答题卡上完成,答在本试题上无效。
3.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需
改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案用0.5mm的黑色笔迹签字
笔写在答题卡上。
4.考试结束后,将本试题和答题卡一并交回。
一、单选题(每题2分,共32分)
1、下列关于能量的说法不合理的是( )
A.能量变化是化学变化的基本特征之一
B.化学反应中的能量变化,通常表现为热量的变化
C.由于石墨制金刚石是吸热反应,故石墨能量比金刚石能量低
D. “嫦娥五号”中砷化镓太阳能电池将化学能直接转化为电能
2、下列实验现象不能用相应的方程式解释的是( )
A.久置的浓硝酸呈黄色:
B.用 溶液做导电实验,灯泡发光:
C.硫酸型酸雨露置于空气中一段时间后溶液酸性增强:
D.喝冰镇碳酸饮料,容易打嗝:
3、金属腐蚀造成了相当大的经济损失和环境污染,因此研究金属的腐蚀与防护意义重
大。下列说法正确的是( )
A.金属腐蚀是指金属单质或合金与其他物质发生化学反应的过程
B.铝的金属活动性比铁强,则铝制品比铁制品更容易锈蚀
C.纯银器表面在空气中主要因电化学腐蚀渐渐变暗
D.钢铁设施采用牺牲阳极法时,需将钢铁连接到直流电源的负极
4、向 溶液中逐渐通入 ,溶液中某些离子的物质的量随 的变化如
图所示。
学科网(北京)股份有限公司下列说法错误的是( )
A. 、 、 、 的还原性依次增强
B.原溶液的物质的量浓度为
C.当 时,溶液中
D.当溶液中 时,反应中共转移0.8mol电子
5、类比是学习化学的重要方法。下列类比正确的是( )
选项 事实 类比
A 过滤时,玻璃棒起到引流作用 结晶时,玻璃棒也起到引流作用
B 干冰升华时破坏了范德华力 碘晶体升华时也只破坏范德华力
甲苯也不能使酸性 溶液褪
C 苯不能使酸性 溶液褪色
色
D 电解熔融的 制备单质镁 电解熔融的 可制备单质铝
A.A B.B C.C D.D
6、黑火药是我国古代四大发明之一,爆炸时的反应为
。下列有关该反应的说法错误的是( )
A.
B. 是氧化剂, 是氧化产物
C.两种气体产物均为非极性分子
D.被2mol 氧化的C的质量是30g
7、设 为阿伏加德罗常数的值。下列说法正确的是( )
A.1mol 分子中含有的共价键数为32
B.足量Na与1mol 反应,转移的电子数一定是4
学科网(北京)股份有限公司C.常温下,1L 溶液中氢离子数为
D.常温常压下,12g石墨烯和12g金刚石含有的碳原子数均为
8、甲、乙、丙、丁四种物质发生如图所示的转化:
(反应条件略去,箭头表示一步转化)。下列不满足转化关系的是( )
选
甲 乙 丙 丁
项
A Al
B HCl
C Si
D
A.A B.B C.C D.D
9、下列物质中属于碱性氧化物的是( )
A. B. C. D.
10、下列有关物质的性质与用途具有对应关系的是( )
A. 溶液呈碱性,可用作生产普通玻璃的原料
B.氧化铝的熔点高,可用于电解铝
C.氢氧化铝具有弱酸性,可用于治疗胃酸过多
D.铁粉具有还原性,可用于食品袋中的抗氧化剂
11、 为短周期主族元素,原子序数依次增大,W是地壳中含量最高的元
素,X的p轨道电子总数比s轨道电子总数多1且p轨道有1个未成对电子,W的最外
层电子数为Y的最外层电子数的三倍, 的最外层电子数成等差数列。下列
叙述错误的是( )
A.元素的第一电离能:
B.元素的电负性 且 分子具有正四面体形结构
C.与氢形成的共价键键能:
D.Y与X形成的化合物为离子化合物
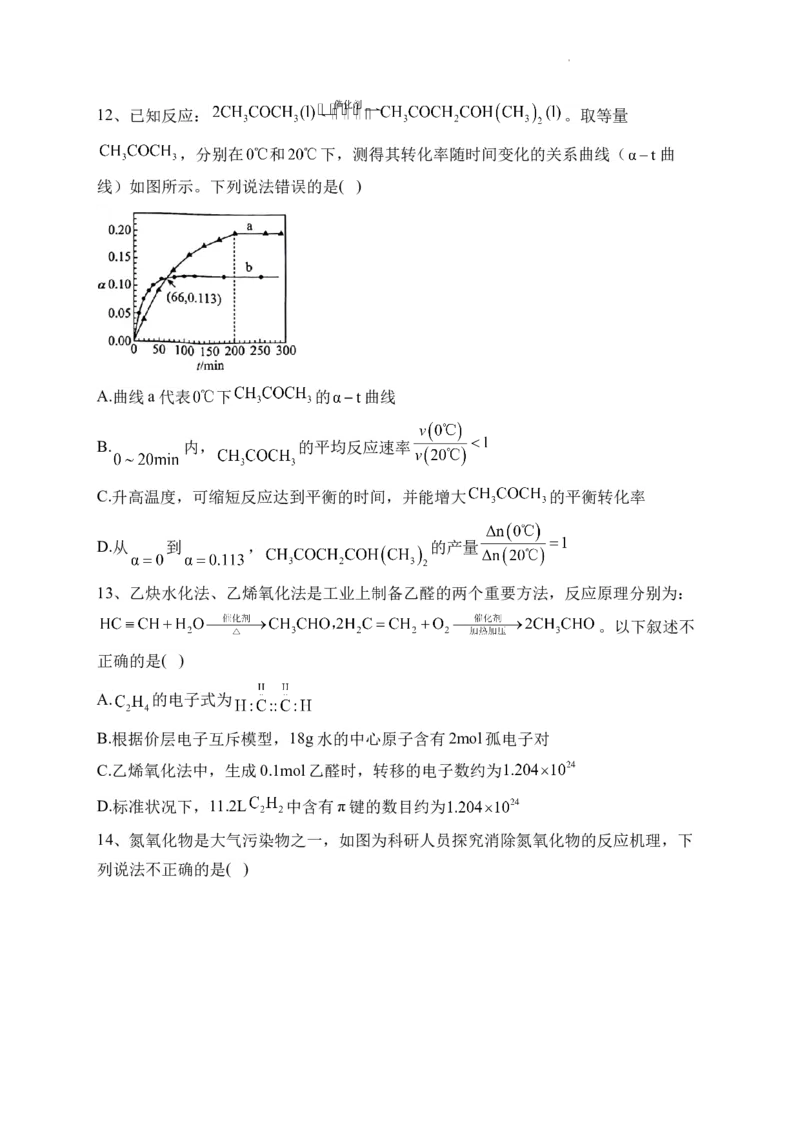
学科网(北京)股份有限公司12、已知反应: 。取等量
,分别在 和 下,测得其转化率随时间变化的关系曲线( 曲
线)如图所示。下列说法错误的是( )
A.曲线a代表 下 的 曲线
B. 内, 的平均反应速率
C.升高温度,可缩短反应达到平衡的时间,并能增大 的平衡转化率
D.从 到 , 的产量
13、乙炔水化法、乙烯氧化法是工业上制备乙醛的两个重要方法,反应原理分别为:
。以下叙述不
正确的是( )
A. 的电子式为
B.根据价层电子互斥模型,18g水的中心原子含有2mol孤电子对
C.乙烯氧化法中,生成0.1mol乙醛时,转移的电子数约为
D.标准状况下,11.2L 中含有π键的数目约为
14、氮氧化物是大气污染物之一,如图为科研人员探究消除氮氧化物的反应机理,下
列说法不正确的是( )
学科网(北京)股份有限公司A.过程I中NO既作氧化剂又作还原剂
B.过程Ⅱ中每生成1mol 时,转移电子的数目约为46.021023
C.过程中涉及的反应均为氧化还原反应
D.整个过程中 +作催化剂
15、下列实验方案中,不能测定出 和 的混合物中 质量分数的
是( )
A.取ag混合物充分加热,质量减少bg
B.取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到bg固体
C.取ag混合物与足量 溶液充分反应,过滤、洗涤、烘干、得到bg固体
D.取ag混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,质量增加bg
16、检验Cr O2 的反应有如下两种途径。下列说法正确的是( )
2 7
A.反应①中 被还原
B.乙醚与 中的铬元素形成共价键,有利于蓝色现象的观察
C.反应②为:
D.反应③中溶液 的pH越小,反应速率越慢
二、填空题
17、锂是最轻的活泼金属,其单质及其化合物有广泛的用途。
学科网(北京)股份有限公司回答下列问题:
(1)在元素周期表中,与 的化学性质最相似的邻族元素是______,该元素基态原
子中,占据最高能级电子的电子云轮廓图形状为______。(4分)
(2) 是一种储氢材料。(4分)
① 与 中第一电离能较小的元素是______。
②离子半径: ______ (填“>”“=”或“<”)。
(3)已知金属锂晶体为FCC(面心立方晶格),面心立方紧密堆积结构示意图如下:
(6分)
①晶胞中锂的配位数为______。
②若锂原子的半径为 ,阿伏加德罗常数的值为 ,则锂晶体密度为______
(列出含有a、 的计算式即可)。
18、有机物X是一种药物合成的中间体,其结构简式为 。X的一种合成路线如
图所示(分离方法和其他产物略)。(10分)
(1)下列关于有机物X的说法错误的是_________(填标号)。
A.属于芳香族化合物
B.分子中所有原子一定在同一平面
C.核磁共振氢谱有4组峰,且峰面积之比为2:2:2:1
D.既能与盐酸反应又能与氢氧化钠溶液反应
(2)步骤Ⅰ的反应条件是_________,步骤Ⅱ的反应类型是_________。
学科网(北京)股份有限公司(3)步骤Ⅲ和Ⅵ在合成有机物X过程中的目的是_________。
(4)步骤Ⅴ的第①步反应的化学方程式为_________。
(5)Z是有机物Y的同分异构体,且满足三个条件:①含有—CONH ;②能与
2
NaHCO 溶液反应产生CO ;③苯环上的一氯取代产物有两种。则Z的结构简式为
3 2
_________。
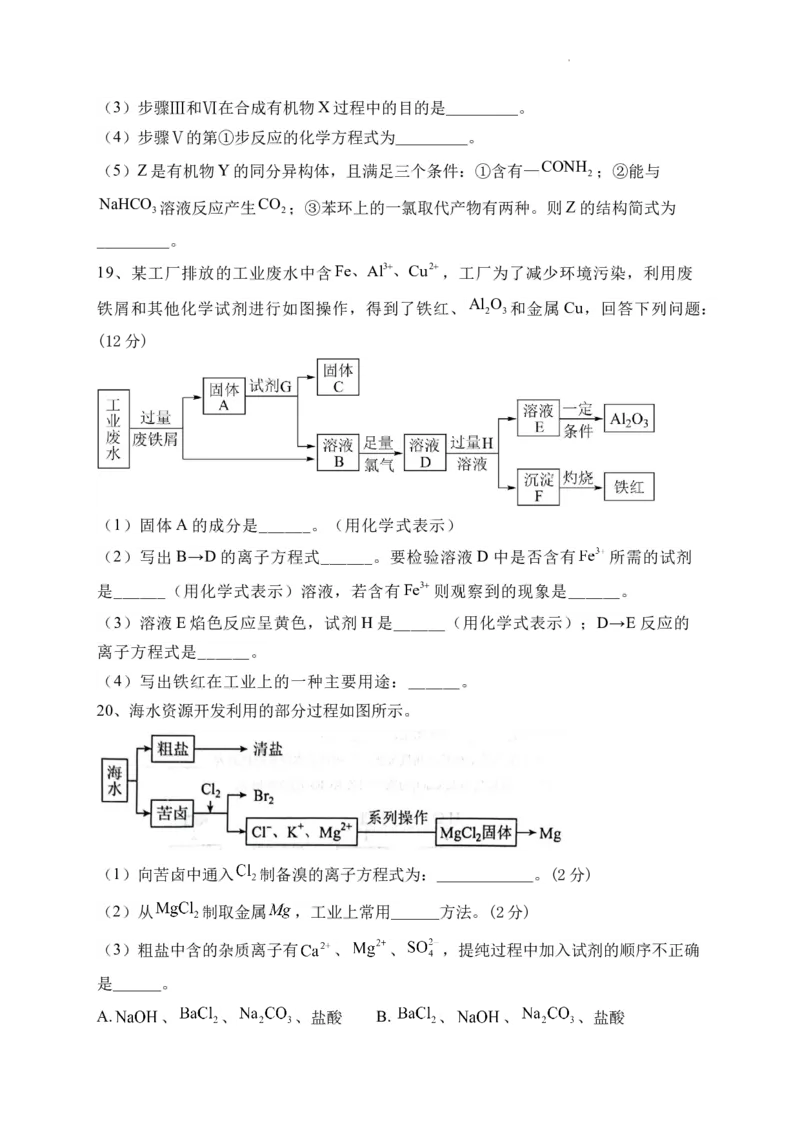
19、某工厂排放的工业废水中含Fe、Al3、Cu2,工厂为了减少环境污染,利用废
铁屑和其他化学试剂进行如图操作,得到了铁红、Al O 和金属Cu,回答下列问题:
2 3
(12分)
(1)固体A的成分是______。(用化学式表示)
(2)写出B→D的离子方程式______。要检验溶液D中是否含有 所需的试剂
是______(用化学式表示)溶液,若含有Fe3则观察到的现象是______。
(3)溶液E焰色反应呈黄色,试剂H是______(用化学式表示);D→E反应的
离子方程式是______。
(4)写出铁红在工业上的一种主要用途:______。
20、海水资源开发利用的部分过程如图所示。
(1)向苦卤中通入 制备溴的离子方程式为:____________。(2分)
(2)从 制取金属 ,工业上常用______方法。(2分)
(3)粗盐中含的杂质离子有 、 、 ,提纯过程中加入试剂的顺序不正确
是______。
A. 、 、 、盐酸 B. 、 、 、盐酸
学科网(北京)股份有限公司C. 、 、 、盐酸 D. 、 、盐酸
实验过程中,请简述验证溶液中的 已沉淀完全的简单操作及现象是____________。
(4分)
(4)加入盐酸的目的是____________。(2分)
(5)从除杂后的氯化钠溶液中获得 固体需要的仪器有铁架台(带铁圈)、酒精
灯和______。(2分)
三、实验题
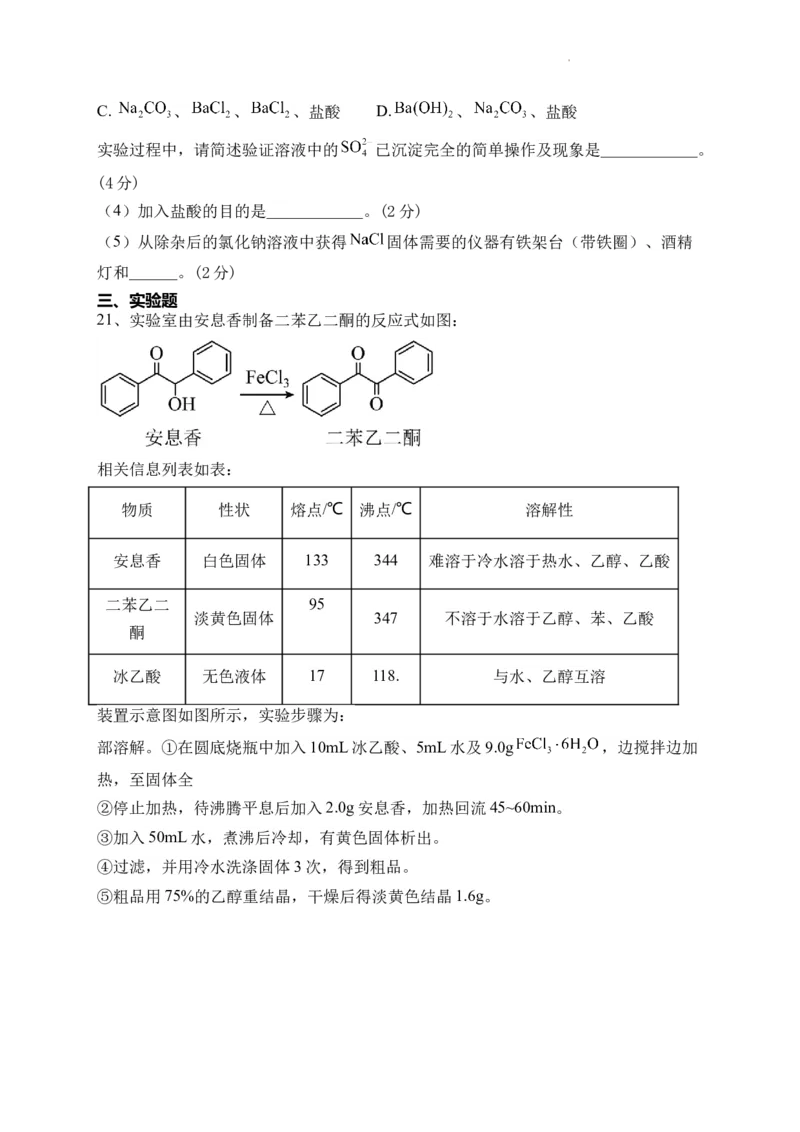
21、实验室由安息香制备二苯乙二酮的反应式如图:
相关信息列表如表:
物质 性状 熔点/℃ 沸点/℃ 溶解性
安息香 白色固体 133 344 难溶于冷水溶于热水、乙醇、乙酸
二苯乙二 95
淡黄色固体 347 不溶于水溶于乙醇、苯、乙酸
酮
冰乙酸 无色液体 17 118. 与水、乙醇互溶
装置示意图如图所示,实验步骤为:
部溶解。①在圆底烧瓶中加入10mL冰乙酸、5mL水及9.0g ,边搅拌边加
热,至固体全
②停止加热,待沸腾平息后加入2.0g安息香,加热回流45~60min。
③加入50mL水,煮沸后冷却,有黄色固体析出。
④过滤,并用冷水洗涤固体3次,得到粗品。
⑤粗品用75%的乙醇重结晶,干燥后得淡黄色结晶1.6g。
学科网(北京)股份有限公司回答下列问题:
(1)实验中加热方式采用油作为热传导介质,该加热方法的优点是_______。(2分)
(2)仪器B的名称是_______;冷却水应从_______(填“a”或“b”)口通入。(4分)
(3)实验步骤②中,安息香必须待沸腾平息后方可加入,其主要目的是_______。(2
分)
(4)在本实验中, 为氧化剂且过量,其还原产物为_______;某同学尝试改进本
实验:采用催化量的 并通入空气制备二苯乙二酮。该方案是否可行_______(填
“是”或“否”),简述判断理由_______。(6分)
(5)本实验步骤①~③在乙酸体系中进行,乙酸除作溶剂外,另一主要作用是
_______。(2分)
(6)若粗品中混有少量未氧化的安息香,可用少量_______洗涤的方法除去 (填标
号)。若要得到更高纯度的产品,可用重结晶的方法进一步提纯。(2分)
a.热水
b.乙酸
c.冷水
d.乙醇
(7)本实验的产率最接近于_______(填标号)。(2分)
a.85%
b.80%
c.75%
d.70%
学科网(北京)股份有限公司参考答案
1、D
2、B
3、A
4、C
5、B
6、B
7、D
8、B
9、C
10、D
11、C
12、C
13、C
14、B
15、D
16、B
17、(1) (或镁);球形
(2)①Li;②<
(3)①12;②
18、(1)B
(2)浓硫酸,加热;还原反应
(3)保护氨基
(4)
学科网(北京)股份有限公司(5) 或
19、 Fe、Cu; ;KSCN;溶液变红色;NaOH;
;红色油漆或涂料等
20、(1)Cl 2Br 2Cl Br
2 2
(2)电解(熔融 )
(3)C待混合液澄清后,取上层清液继续滴加BaCl (或 )溶液无沉淀产生
2
(4)除去过量的OH和
(5)蒸发皿、玻璃棒
21、(1)可以提供更高的加热温度,受热均匀,易于控制温度
(2)①.球形冷凝管;②.a
(3)防暴沸
(4)①. ;②.可行;③.空气可以将还原产物 又氧化为 , 可循环
参与反应
(5)抑制氯化铁水解
(6)a
(7)b
学科网(北京)股份有限公司学科网(北京)股份有限公司