文档内容
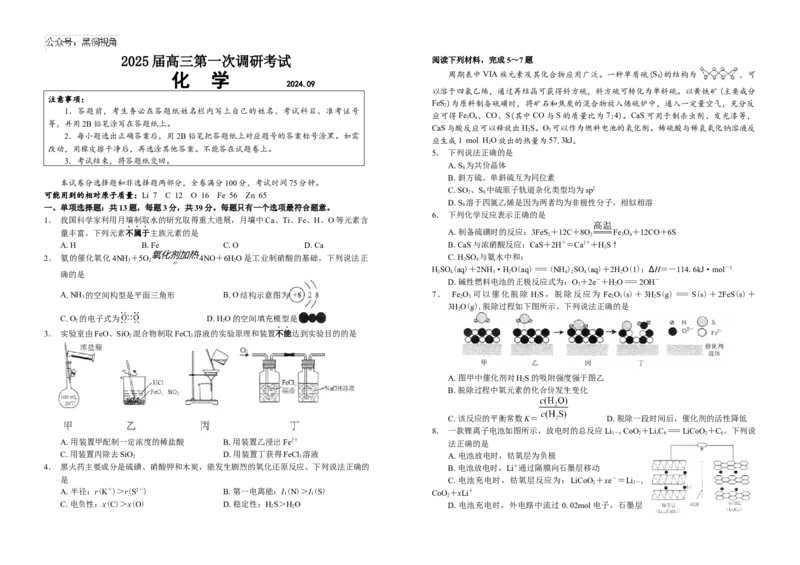
2025 届高三第一次调研考试 阅读下列材料,完成5~7题
化 学 周期表中VIA族元素及其化合物应用广泛。一种单质硫(S)的结构为 ,可
8
2024.09
以溶于四氯乙烯,通过再结晶可获得斜方硫,斜方硫可转化为单斜硫。以黄铁矿(主要成分
注意事项:
FeS)为原料制备硫磺时,将矿石和焦炭的混合物放入炼硫炉中,通入一定量空气,充分反
2
1.答题前,考生务必在答题纸姓名栏内写上自己的姓名、考试科目、准考证号
应可得Fe O 、CO、S(其中CO与S的质量比为7:4)。CaS可用于制杀虫剂、发光漆等,
3 4
等,并用2B铅笔涂写在答题纸上。
CaS与酸反应可以释放出HS。O 可以作为燃料电池的氧化剂。稀硫酸与稀氢氧化钠溶液反
2 2
2.每小题选出正确答案后,用2B铅笔把答题纸上对应题号的答案标号涂黑。如需
应生成1 mol HO放出的热量为57.3kJ。
2
改动,用橡皮擦干净后,再选涂其他答案。不能答在试题卷上。
5. 下列说法正确的是
3.考试结束,将答题纸交回。
A.S 为共价晶体
8
B.斜方硫、单斜硫互为同位素
本试卷分选择题和非选择题两部分,全卷满分100分,考试时间75分钟。
C.SO 、S 中硫原子轨道杂化类型均为sp2
可能用到的相对原子质量:Li 7 C 12 O 16 Fe 56 Zn 65 2 8
D.S 溶于四氯乙烯是因为两者均为非极性分子,相似相溶
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。 8
6. 下列化学反应表示正确的是
1. 我国科学家利用月壤制取水的研究取得重大进展,月壤中Ca、Ti、Fe、H、O等元素含
量丰富。下列元素不属于主族元素的是 A.制备硫磺时的反应:3FeS+12C+8O Fe O+12CO+6S
2 2 3 4
A.H B.Fe C.O D.Ca B.CaS与浓硝酸反应:CaS+2H+=Ca2++HS↑
2
2. 氨的催化氧化4NH
3
+5O
2
氧化剂加热 4NO+6H
2
O是工业制硝酸的基础。下列说法正 C.H
2
SO
4
与氨水中和:
⇇
HSO (aq)+2NH ·HO(aq)=(NH )SO (aq)+2HO(1);∆H=-114.6kJ·mol-1
确的是 2 4 3 2 4 2 4 2
D.碱性燃料电池的正极反应式为:O+2e-+HO=2OH-
2 2
A.NH 的空间构型是平面三角形 B.O结构示意图为 7. Fe O 可以催化脱除 HS,脱除反应为 Fe O(s)+3HS(g)=S(s)+2FeS(s)+
3 2 3 2 2 3 2
3HO(g),脱除过程如下图所示。下列说法正确的是
2
C.O 的电子式为 D.HO的空间填充模型是
2 2
3. 实验室由FeO、SiO 混合物制取FeCl 溶液的实验原理和装置不能达到实验目的的是
2 3
A.图甲中催化剂对HS的吸附强度强于图乙
2
B.脱除过程中氧元素的化合价发生变化
C.该反应的平衡常数K= D.脱除一段时间后,催化剂的活性降低
8. 一款锂离子电池如图所示,放电时的总反应Li CoO+LiC =LiCoO +C 。下列说
1-x 2 x 6 2 6
A.用装置甲配制一定浓度的稀盐酸 B.用装置乙浸出Fe2+ 法正确的是
C.用装置丙除去SiO
2
D.用装置丁获得FeCl
3
溶液 A.电池放电时,钴氧层为负极
4. 黑火药主要成分是硫磺、硝酸钾和木炭,能发生剧烈的氧化还原反应。下列说法正确的 B.电池放电时,Li+通过隔膜向石墨层移动
是 C.电池充电时,钴氧层反应为:LiCoO +xe-=Li
2 1-x
A.半径:r(K+)>r(S2-) B.第一电离能:I 1 (N)>I 1 (S) CoO 2 +xLi+
C.电负性:x(C)>x(O) D.稳定性:H
2
S>H
2
O D.电池充电时,外电路中流过 0.02mol电子,石墨层增重0.14g
A.实验1所在溶液中:c(HSO )>(SO )
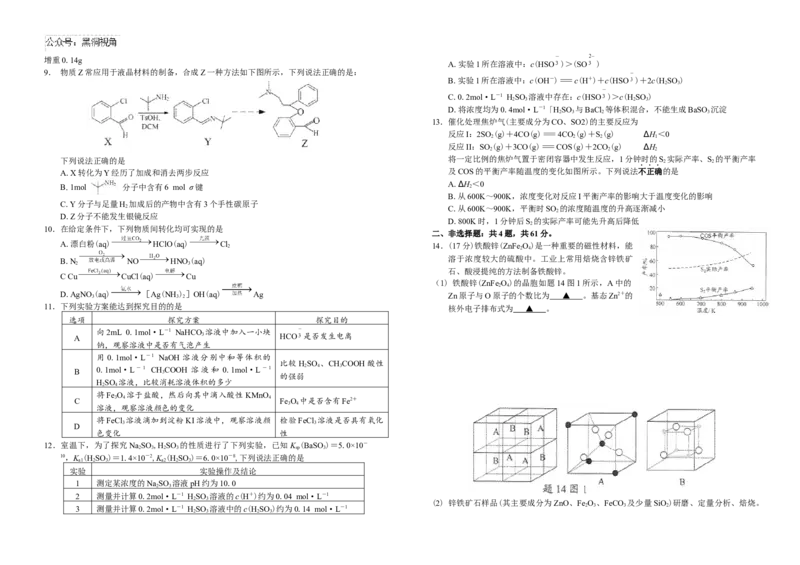
9. 物质Z常应用于液晶材料的制备,合成Z一种方法如下图所示,下列说法正确的是:
B.实验1所在溶液中:c(OH-)=c(H+)+c(HSO )+2c(HSO )
2 3
C.0.2mol·L-1 HSO 溶液中存在:c(HSO )>c(HSO )
2 3 2 3
D.将浓度均为0.4mol·L-1「HSO 与BaCl 等体积混合,不能生成BaSO 沉淀
2 3 2 3
13.催化处理焦炉气(主要成分为CO、SO2)的主要反应为
反应I:2SO (g)+4CO(g)=4CO(g)+S(g) ∆H<0
2 2 2 1
反应II:SO (g)+3CO(g)=COS(g)+2CO(g) ∆H
2 2 2
下列说法正确的是 将一定比例的焦炉气置于密闭容器中发生反应,1分钟时的S 2 实际产率、S 2 的平衡产率
A.X转化为Y经历了加成和消去两步反应 及COS的平衡产率随温度的变化如图所示。下列说法不正确的是
A.∆H<0
B.1mol 分子中含有6 mol σ键 2
B.从600K~900K,浓度变化对反应I平衡产率的影响大于温度变化的影响
C.Y分子与足量H 加成后的产物中含有3个手性碳原子
2 C.从600K~900K,平衡时SO 的浓度随温度的升高逐渐减小
2
D.Z分子不能发生银镜反应
D.800K时,1分钟后S 的实际产率可能先升高后降低
2
10.在给定条件下,下列物质间转化均可实现的是
二、非选择题:共4题,共61分。
A.漂白粉(aq) HClO(aq) Cl 2 14.(17分)铁酸锌(ZnFe 2 O 4 )是一种重要的磁性材料,能
B.N NO HNO(aq) 溶于浓度较大的硫酸中。工业上常用焙烧含锌铁矿
2 3
石、酸浸提纯的方法制备铁酸锌。
C Cu CuCl(aq) Cu
(1) 铁酸锌(ZnFe O)的晶胞如题14图1所示,A中的
2 4
D.AgNO
3
(aq) [Ag(NH
3
)
2
]OH(aq) Ag Zn原子与O原子的个数比为 ▲ 。基态Zn2+的
11.下列实验方案能达到探究目的的是 核外电子排布式为 ▲ 。
选项 探究方案 探究目的
向2mL 0.1mol·L-1 NaHCO 溶液中加入一小块
A 3 HCO 是否发生电离
钠,观察溶液中是否有气泡产生
用 0.1mol·L-1 NaOH 溶液分别中和等体积的
比较HSO 、CHCOOH酸性
B 0.1mol·L-1 CH 3 COOH 溶液和 0.1mol·L-1 2 4 3
的强弱
HSO 溶液,比较消耗溶液体积的多少
2 4
将Fe O 溶于盐酸,然后向其中滴入酸性 KMnO
C 3 4 4 Fe O 中是否含有Fe2+
3 4
溶液,观察溶液颜色的变化
将FeCl 溶液滴加到淀粉KI溶液中,观察溶液颜 检验FeCl 溶液是否具有氧化
3 3
D
色变化 性
12.室温下,为了探究NaSO ,HSO 的性质进行了下列实验,已知K (BaSO)=5.0×10-
2 3 2 3 sp 3
10,K (HSO )=1.4×10-2,K (HSO )=6.0×10-8,下列说法正确的是
a1 2 3 a2 2 3
实验 实验操作及结论
1 测定某浓度的NaSO 溶液pH约为10.0
2 3
2 测量并计算0.2mol·L-1 HSO 溶液的c(H+)约为0.04 mol·L-1
2 3
(2) 锌铁矿石样品(其主要成分为ZnO、Fe O 、FeCO 及少量SiO)研磨、定量分析、焙烧。
3 测量并计算0.2mol·L-1 HSO 溶液中的c(HSO )约为0.14 mol·L-1 2 3 3 2
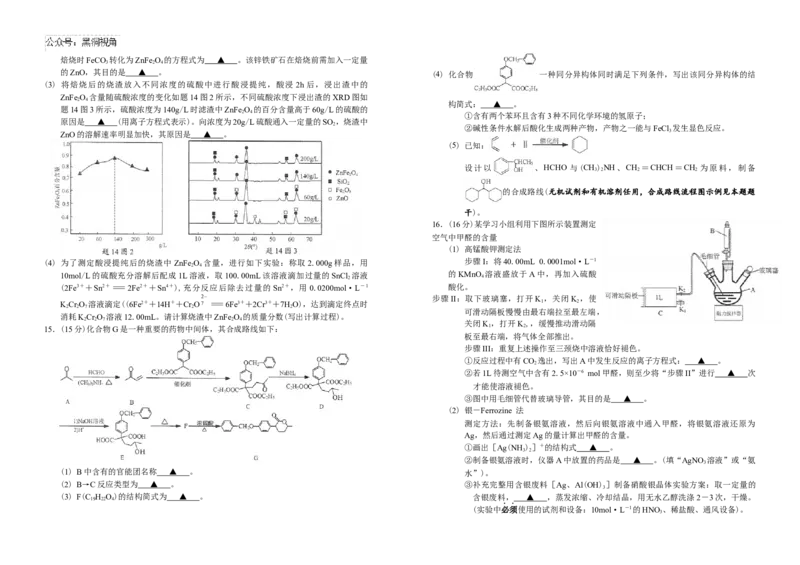
2 3 2 3焙烧时FeCO 转化为ZnFe O 的方程式为 ▲ 。该锌铁矿石在焙烧前需加入一定量
3 2 4
的ZnO,其目的是 ▲ 。 (4) 化合物 一种同分异构体同时满足下列条件,写出该同分异构体的结
(3) 将焙烧后的烧渣放入不同浓度的硫酸中进行酸浸提纯,酸浸 2h 后,浸出渣中的
ZnFe O 含量随硫酸浓度的变化如题14图2所示,不同硫酸浓度下浸出渣的XRD图如
2 4
构简式: ▲ 。
题14图3所示,硫酸浓度为140g/L时滤渣中ZnFe O 的百分含量高于60g/L的硫酸的
2 4
①含有两个苯环且含有3种不同化学环境的氢原子;
原因是 ▲ (用离子方程式表示)。向浓度为20g/L硫酸通入一定量的SO ,烧渣中
2
②碱性条件水解后酸化生成两种产物,产物之一能与FeCl 发生显色反应。
ZnO的溶解速率明显加快,其原因是 ▲ 。 3
(5) 已知:
设计以 、HCHO 与(CH)NH、CH =CHCH=CH 为原料,制备
3 2 2 2
的合成路线(无机试剂和有机溶剂任用,合成路线流程图示例见本题题
干)。
16.(16分)某学习小组利用下图所示装置测定
空气中甲醛的含量
(1) 高锰酸钾测定法
(4) 为了测定酸浸提纯后的烧渣中 ZnFe O 含量,进行如下实验:称取2.000g样品,用 步骤I:将40.00mL 0.0001mol·L-1
2 4
10mol/L的硫酸充分溶解后配成1L溶液,取100.00mL该溶液滴加过量的SnCl
2
溶液 的KMnO
4
溶液盛放于A中,再加入硫酸
(2Fe3++Sn2+=2Fe2++Sn4+),充分反应后除去过量的 Sn2+,用 0.0200mol·L-1 酸化。
步骤II:取下玻璃塞,打开K ,关闭K ,使
KCr O 溶液滴定((6Fe2++14H++Cr O =6Fe3++2Cr3++7HO),达到滴定终点时 1 2
2 2 7 2 2
可滑动隔板慢慢由最右端拉至最左端,
消耗KCr O 溶液12.00mL。请计算烧渣中ZnFe O 的质量分数(写出计算过程)。
2 2 7 2 4
关闭K ,打开K,,缓慢推动滑动隔
15.(15分)化合物G是一种重要的药物中间体,其合成路线如下: 1 2
板至最右端,将气体全部推出。
步骤III:重复上述操作至三颈烧中溶液恰好褪色。
①反应过程中有CO 逸出,写出A中发生反应的离子方程式: ▲ 。
2
②若1L待测空气中含有2.5×10-6 mol甲醛,则至少将“步骤II”进行 ▲ 次
才能使溶液褪色。
③图中用毛细管代替玻璃导管,其目的是 ▲ 。
(2) 银-Ferrozine 法
测定方法:先制备银氨溶液,然后向银氨溶液中通入甲醛,将银氨溶液还原为
Ag,然后通过测定Ag的量计算出甲醛的含量。
①画出[Ag(NH )]+的结构式 ▲ 。
3 2
②制备银氨溶液时,仪器A中放置的药品是 ▲ 。(填“AgNO 溶液”或“氨
3
(1) B中含有的官能团名称 ▲ 。 水”)。
(2) B→C反应类型为 ▲ 。 ③补充完整用含银废料[Ag、Al(OH) ]制备硝酸银晶体实验方案:取一定量的
3
(3) F(C H O)的结构简式为 ▲ 。 含银废料, ▲ ,蒸发浓缩、冷却结晶,用无水乙醇洗涤2-3次,干燥。
19 22 4
(实验中必须使用的试剂和设备:10mol·L-1的HNO、稀盐酸、通风设备)。
317.(13分)NO(主要指NO和NO )是大气主要污染物之一。有效去除大气中的NO,是环 非选择题部分:包括4大题,共61分。
x 2
境保护的重要课题。 14.(1)3:8 (2分) [Ar]3d10 (2分)
(1) ①用水吸收NO 的相关热化学方程式如下:
2 (2)2ZnO+4FeCO+O 2ZnFe O +4CO
3 2 2 4 2
2NO (g)+HO(1)=HNO(aq)+HNO(aq) ∆H=-116.1kJ·mol-1
2 2 3 2
3HNO
2
(aq)=HNO
3
(aq)+2NO(g)+H
2
O(1) ∆H=75.9kJ·mol-1 (条件、配平1分,产物1分) (2分)
反应3NO (g)+HO(1)=2HNO(aq)+NO(g)的∆H= ▲ kJ·mol-1。 使得烧渣中的锌与铁满足一定物质的量之比
2 2 3
②在NO 的水溶液中加入(NH )CO,(NH )CO与溶液中的HNO 反应生成N 和 (写到使烧渣中锌与铁的比例为1:2得2分,写提高原料中铁的转化率或增加
x 2 2 2 2 2 2
CO,,该反应的化学方程式为 ▲ 。 ZnFe O 的产量得1分) (2分)
2 2 4
(2) 氨氮治理-SCR脱硝 (3)Fe
2
O
3
+6H+=2Fe3++3H
2
O (多写其他方程式且该条写对得1分)(3分)
在催化剂作用下,NH
3
将NO,选择性还原为N
2
的过程称为SCR脱硝。用活化后 SO
2
溶于水电离出H+,H+浓度增大(1分);SO
2
与溶液中Fe3+反应产生H+,使得溶
的VO 催化NH 将NO还原为N 的可能反应机理如题17图1所示。催化剂能吸 液中H+浓度增大 (2分) 其他答案视而不见 (3分)
2 5 3 2
(4)每100.00 mL溶液中
附NH 的原理是 ▲ ,反应过程中消耗1mol O ,处理NO物质的量为 ▲
3 2
n(Fe2+)=6n(KCr O)=6×0.0200mol·L-1×12.00 mL×10-3 L·mL-1=1.44×10-3mol
mol。 2 2 7
(1分)
n ZnFe O )=n(Fe3+)=n(Fe2+)=×1.44×10-3mol =7.200×10-4 mol
2 4
2.000g样品中含n(ZnFe O )=7.200×10-4 mol×=7.200×10-3 mol(1分)
2 4
m(ZnFe O )=7.200×10-3mol×241g·mol-1=1.7352g
2 4
纯度=×100%=86.76%(1分) (3分)
【共17分】
15.(1)(酮)羰基、碳碳双键 (写对1个得1分) (2分) (2)加成反应 (2分)
(3) 二氧化铈(CeO)是一种脱硝催化剂,能在Ce4+和Ce3+之间改变氧化状态,将NO氧化 (3) (3分)
2
为NO ,并引起氧空位的形成,得到新的铈氧化物((Ce O )。铈氧化物催化脱硝时可
2 8 15
能的变化如题17图2所示。
①Ce O 中Ce4+和Ce3+个数比为 ▲ 。
8 15
②生成1mol Ce O ,氧化标准状况下NO的体积为 ▲ L。 (4) 或 (3分)
8 15
( 5 )
CHCH3 O2 HCHO H2
OH Cu, (CH3)2NH, 催化剂 催化剂
化学参考答案
一步一分、四步全对得5分,条件明显错误熔断,最后一步加氢可以先用硼氢
化钠还原羰基,后加氢还原苯环和碳碳双键。第三个产物双键的位置错误,其
单项选择题:本题包括13小题,每小题3分,共计39分。每小题只有一个选项符合题意。
余都对得3分 (5分)
【共15分】
1 2 3 4 5 6 7 8 9 10 11 12 13
16.(1)①5HCHO+4MnO+12H+ = 4Mn2++5CO ↑+11HO (3分)
2 2
B C A B D A D D A C D B C
②2 (2分)
③减小空气通入速率(1分),使空气中的HCHO被充分吸收(1分)。 (2分)
(2① 或 (2分)
②AgNO 溶液 (2分)
3
③向其中将入稍过量的稀盐酸充分反应(1分),过滤、洗涤滤渣(1分),将滤渣转
移至烧杯中,打开通风设备(1分),向滤渣中加入稍过量(1分)的10 mol·L-1的
HNO(1分)至固体完全溶解。
3
通风设备可以在现有位置之前打开,试剂顺序错得 0分,洗涤滤渣与稍过量遗
漏扣1分不熔断
(5分)
【共16分】
17(1)①−136.2 (2分)
②2HNO+(NH )CO=2N↑+CO↑+3HO (2分)
2 2 2 2 2 2
(2)氨气与催化剂之间形成N-H···O(1分)氢键(1分)及O-H···N(1分)氢键
写到1点得1分(3分)
4 (2分)
(3)①3:1 (2分) ②22.4L (2分)单位不写得1分
【共13分】