文档内容
2025~2026 学年高二 10 月夯基考
2
化 学
考生注意:
1.本试卷分选择题和非选择题两部分。满分100分,考试时间75分钟。
2.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上
对 应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各
题的答 题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无
效。
4.本卷命题范围:人教版选择性必修1第一章~第二章第二节。
5. 可能用到的相对原子质量:H1 C 12 N 14 O 16 Na 23 S32 CI 35.5
一、选择题(本题共14小题,每小题3分,共42分。在每小题给出的四个选项中只有一项是
符 合题目要求的)
1.我国提出“碳达峰”与“碳中和”目标,大力发展清洁能源。下列能源的利用过程,主要涉及
化 学能转化为电能的是
A.氢氧燃料电池供电 B.水力发电
C.太阳能热水器供热 D.核能发电
2.下列关于热化学方程式的表述正确的是
A. 已知C(石墨,s)——C(金刚石,s) △H>0,则石墨比金刚石稳定
B.已知强酸与强碱反应的中和热为△H=-57.3 kJ·mol-¹, 则反应 H₂SO₄(aq)
+2NaOH(aq) —Na₂SO₄(aq)+2H₂O(1) 的 △H=-114.6 kJ
C. 已知2H₂ (g)+Oz(g)—2H₂O(g) △H=-483.6 kJ ·mol-¹, 则氢气的燃烧热为
241.8kJ·mol- ¹
D. 已知CO(g)的燃烧热是283.0kJ ·mol-¹,则 2 2CO₂ (g)——2CO(g)+O₂ (g) 的反应热
△H=-566.0 kJ·mol-1
3.工业上利用甲烷和水蒸气在高温下制备氢气,涉及以下反应:
①CH4(g)+H₂O(g)——CO(g)+3H₂(g) △H₁—+206.2kJ·mol- ¹
②CO(g)+H₂O(g)—CO₂(g)+H₂(g)△H₂=—41.2kJ·mol-
¹ 则反应 CH₄ (g)+2H₂O(g) 一 CO₂ (g)+4H₂ (g) 的 △H 为
A.-165.0 kJ·mol- ¹ B.+165.0 kJ·mol- ¹
C.+247.4 kJ·mol- ¹ D.—247.4 kJ·mol- ¹
【高二10月夯基考 · 化学第1页(共6页)】 26-X-029B4.对于反应4NH₃(g)+5O₂(g) 4NO(g)+6H₂O(g), 下列表示该反应的化学反应速率最
快 的是
A.v(NH₃)=0.4 mol·L-¹·min⁻¹ B.v(O₂)=0.6mol·L- ¹ ·min- ¹
C.v(NO)=0.3 mol·L- ¹ ·min- ¹ D.v(H₂O)=0.96 mol·L- ¹ ·min- ¹
5.“光气’(COCl₂, 结构式为 是一种重要的化工原料,其制备反应的热化学方程
式 的结构视为C=0), 则该反应的△H 为
化学键 C=0 C=0 C1-C1 C—Cl
能量/kJ · mol- 799 1076 243 330
¹
A.—32 kJ·mol- ¹ B.+32 kJ·mol- ¹ C.-140kJ·mol- ¹ D.+140kJ·mol- ¹
6.如图是NO₂ (g) 和co(g) 反应生成(CO₂ (g) 和NO(g) 过程中的能量变化示意图。下列说法
◆能量
正 确的是
E:-134kF:moI-
E₂=368kJ·mol-¹
反应
生成物物
反应进程
o
A. 该反应的热化学方程式为 NO₂(g)+COg)—CO₂(g)+NO(g)△H=+234 kJ·mol- ¹
B.使用催化剂后,E₁ 和 Ez 的值都会减小,△H 的值也减小
C.反应达到平衡后,增大压强,v正、v逆均增大,且仍然相等
D.升高温度,该反应的平衡常数 K 增大
7. 在相同温度下,向三个体积均为2L的恒容密闭容器中,按如下方式投料,发生反应
CO(g)+ H₂O(g) 一 CO₂ (g)+H₂ (g), 则达到平衡时, CO 的转化率关系正确的是
容器 甲 乙 丙
1m ol CO 2 mol CO 1m ol CO
投料
1 mol H₂O 2 mol H₂O 2 mol H₂O
A. 甲 > 乙 > 丙 B. 丙 > 乙 > 甲 C. 丙 > 甲 > 乙 D. 丙 > 甲 =
乙
8.下列事实不能用勒夏特列原理解释的是
A. 开启啤酒瓶后,瓶中马上泛起大量泡沫
B. 加入 MnO₂ 能加快 H₂O₂ 分解
C.在 NO₂ 生成N₂O4的反应中,升高温度,红棕色加深
D. 溴水中存在平衡 Br₂+H₂O 一 HBr+HBrO, 当加入少量 AgNO₃ 固体后,溶液颜色变浅
9.工业合成氨(N₂+3H₂ 一 2NH₃) 中为了增大化学反应速率,下列措施中哪一项原理与其
他 三项不同
A.增大氮气的浓度 B. 增大氢气的浓度
C.加入铁触媒作催化剂 D.增大反应体系的压强
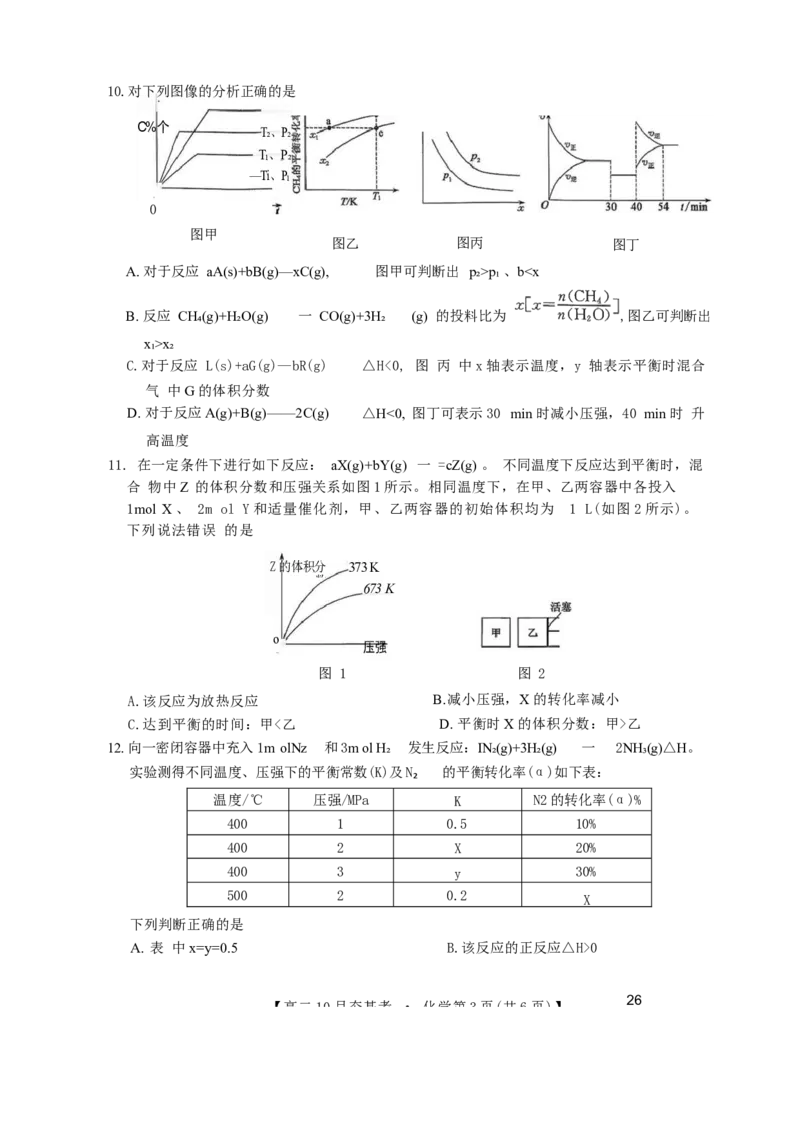
【高二10月夯基考 · 化学 第2页(共6页)】 26-X-029 B10.对下列图像的分析正确的是
C%个
T₂、P₂
T₁、P₂
—Ti、P₁
0
图甲
图乙 图丙 图丁
A. 对于反应 aA(s)+bB(g)—xC(g), 图甲可判断出 p₂>p₁ 、bx₂
C.对于反应 L(s)+aG(g)—bR(g) △H<0, 图 丙 中x轴表示温度,y 轴表示平衡时混合
气 中G的体积分数
D. 对于反应A(g)+B(g)——2C(g) △H<0, 图丁可表示30 min 时减小压强,40 min 时 升
高温度
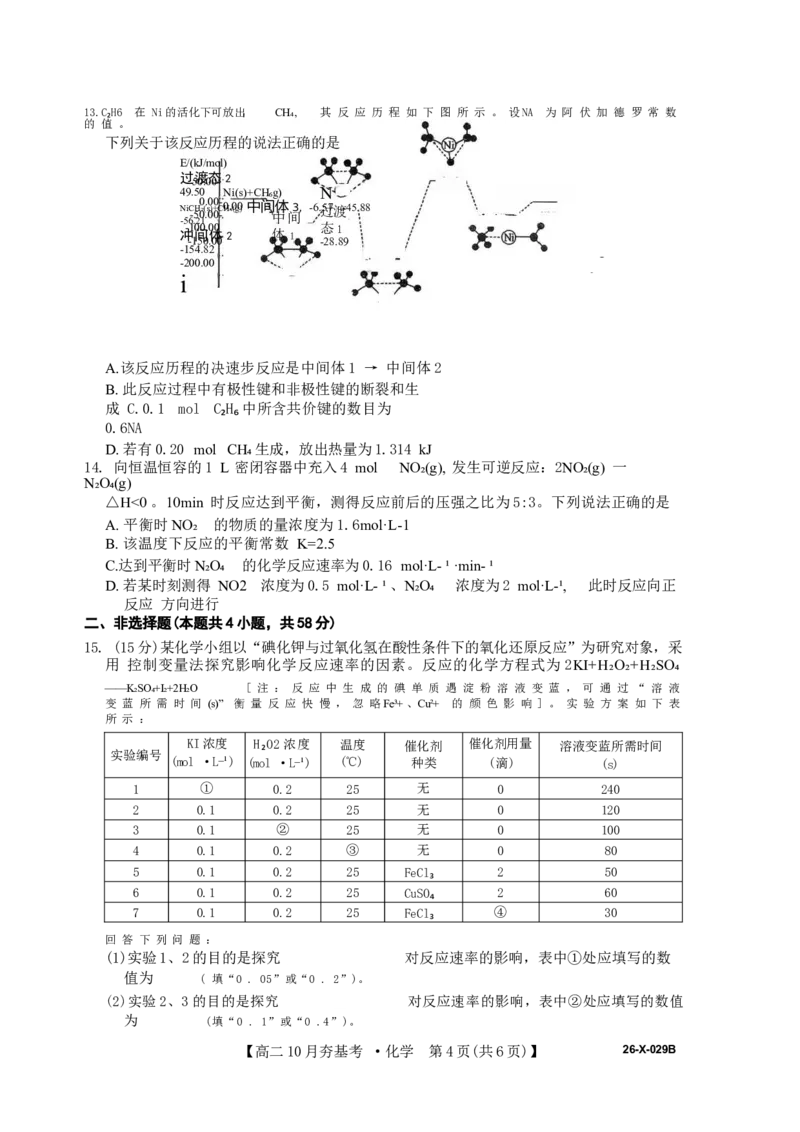
11. 在一定条件下进行如下反应: aX(g)+bY(g) 一 =cZ(g) 。 不同温度下反应达到平衡时,混
合 物中Z 的体积分数和压强关系如图1所示。相同温度下,在甲、乙两容器中各投入
1mol X 、 2m ol Y和适量催化剂,甲、乙两容器的初始体积均为 1 L(如图2所示)。
下列说法错误 的是
Z的体积分 373 K
数
673 K
o
压强
图 1 图 2
A.该反应为放热反应 B.减小压强,X的转化率减小
C.达到平衡的时间:甲<乙 D. 平衡时X的体积分数:甲>乙
12. 向一密闭容器中充入1m olNz 和3m ol H₂ 发生反应:IN₂(g)+3H₂(g) 一 2NH₃(g)△H。
实验测得不同温度、压强下的平衡常数(K)及N₂ 的平衡转化率(α)如下表:
温度/℃ 压强/MPa K N2的转化率(α)%
400 1 0.5 10%
400 2 X 20%
400 3 y 30%
500 2 0.2
X
下列判断正确的是
A. 表 中x=y=0.5 B.该反应的正反应△H>0
26
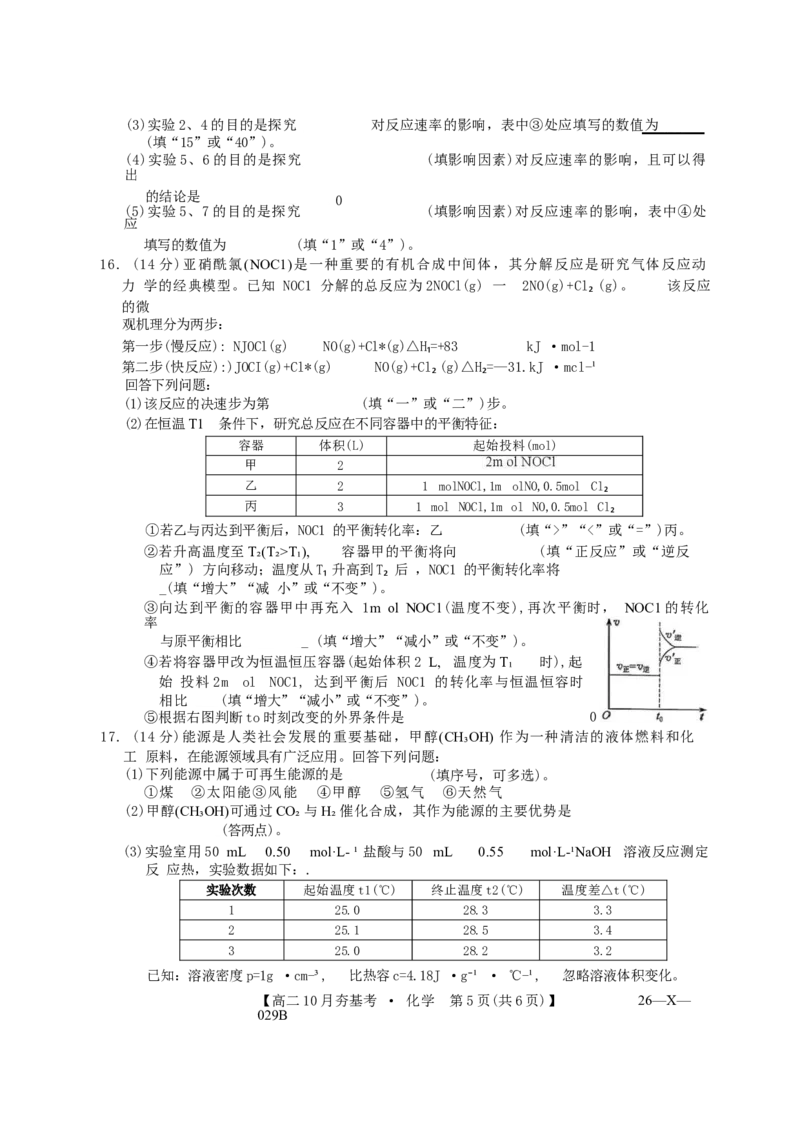
【高二10月夯基考 · 化学第3页(共6页)】13.C₂H6 在 Ni的活化下可放出 CH₄, 其 反 应 历 程 如 下 图 所 示 。 设NA 为 阿 伏 加 德 罗 常 数
的 值 。
下列关于该反应历程的说法正确的是
E/(kJ/mol)
过 5 渡 0.0 态 0- 2
49.50 Ni(s)+CH₆g) N
0.00-
NiCH₂(s)+CH0.₄0(g0) 中间体3, -6.过57渡 -45.88
-50.00- 中间
-56.21
-100.00 态1
冲间体2 体1
-150.00 -28.89
-154.82
-200.00 C
i ●
A.该反应历程的决速步反应是中间体1 → 中间体2
B. 此反应过程中有极性键和非极性键的断裂和生
成 C.0.1 mol C₂H₆中所含共价键的数目为
0.6NA
D. 若有0.20 mol CH₄生成,放出热量为1.314 kJ
14. 向恒温恒容的1 L 密闭容器中充入4 mol NO₂(g), 发生可逆反应:2NO₂(g) 一
N₂O₄(g)
△H<0 。10min 时反应达到平衡,测得反应前后的压强之比为5:3。下列说法正确的是
A. 平衡时NO₂ 的物质的量浓度为1.6mol·L-1
B. 该温度下反应的平衡常数 K=2.5
C.达到平衡时N₂O₄ 的化学反应速率为0.16 mol·L- ¹ ·min- ¹
D. 若某时刻测得 NO2 浓度为0.5 mol·L- ¹ 、N₂O₄ 浓度为2 mol·L-¹, 此时反应向正
反应 方向进行
二、非选择题(本题共4小题,共58分)
15. (15分)某化学小组以“碘化钾与过氧化氢在酸性条件下的氧化还原反应”为研究对象,采
用 控制变量法探究影响化学反应速率的因素。反应的化学方程式为2KI+H₂O₂+H₂SO₄
——K₂SO₄+I₂+2H₂O [ 注 : 反 应 中 生 成 的 碘 单 质 遇 淀 粉 溶 液 变 蓝 , 可 通 过 “ 溶 液
变 蓝 所 需 时 间 (s)” 衡 量 反 应 快 慢 , 忽 略Fe³+ 、Cu²+ 的 颜 色 影 响 ] 。 实 验 方 案 如 下 表
所 示 :
KI浓度 H₂O2浓度 温度 催化剂 催化剂用量 溶液变蓝所需时间
实验编号
(mol ·L-¹) (mol ·L-¹) (℃) 种类 (滴) (s)
1 ① 0.2 25 无 0 240
2 0.1 0.2 25 无 0 120
3 0.1 ② 25 无 0 100
4 0.1 0.2 ③ 无 0 80
5 0.1 0.2 25 FeCl₃ 2 50
6 0.1 0.2 25 CuSO₄ 2 60
7 0.1 0.2 25 FeCl₃ ④ 30
回 答 下 列 问 题 :
(1)实验1、2的目的是探究 对反应速率的影响,表中①处应填写的数
值为 ( 填“0 . 05”或“0 . 2”)。
(2)实验2、3的目的是探究 对反应速率的影响,表中②处应填写的数值
为 (填“0 . 1”或“0 .4”)。
【高二10月夯基考 ·化学 第4页(共6页)】 26-X-029B(3)实验2、4的目的是探究 对反应速率的影响,表中③处应填写的数值为
(填“15”或“40”)。
(4)实验5、6的目的是探究 (填影响因素)对反应速率的影响,且可以得
出
的结论是 0
(5)实验5、7的目的是探究 (填影响因素)对反应速率的影响,表中④处
应
填写的数值为 (填“1”或“4”)。
16. (14 分)亚硝酰氯(NOC1)是一种重要的有机合成中间体,其分解反应是研究气体反应动
力 学的经典模型。已知 NOC1 分解的总反应为2NOCl(g) 一 2NO(g)+Cl₂ (g)。 该反应
的微
观机理分为两步:
第一步(慢反应): NJOCl(g) NO(g)+Cl*(g)△H₁=+83 kJ ·mol-1
第二步(快反应):)JOCI(g)+Cl*(g) NO(g)+Cl₂ (g)△H₂=—31.kJ ·mcl-¹
回答下列问题:
(1)该反应的决速步为第 (填“一”或“二”)步。
(2)在恒温T1 条件下,研究总反应在不同容器中的平衡特征:
容器 体积(L) 起始投料(mol)
甲 2
乙 2 1 molNOCl,1m olNO,0.5mol Cl₂
丙 3 1 mol NOCl,1m ol NO,0.5mol Cl₂
①若乙与丙达到平衡后,NOC1 的平衡转化率:乙 (填“>”“<”或“=”)丙。
②若升高温度至T₂(T₂>T₁), 容器甲的平衡将向 (填“正反应”或“逆反
应”) 方向移动;温度从T₁ 升高到T₂ 后 ,NOC1 的平衡转化率将
_(填“增大”“减 小”或“不变”)。
③向达到平衡的容器甲中再充入 1m ol NOC1(温度不变),再次平衡时, NOC1的转化
率
与原平衡相比 _ (填“增大”“减小”或“不变”)。
④若将容器甲改为恒温恒压容器(起始体积2 L, 温度为T₁ 时),起
始 投料2m ol NOC1, 达到平衡后 NOC1 的转化率与恒温恒容时
相比 (填“增大”“减小”或“不变”)。
⑤根据右图判断to时刻改变的外界条件是 0
17. (14分)能源是人类社会发展的重要基础,甲醇(CH₃OH) 作为一种清洁的液体燃料和化
工 原料,在能源领域具有广泛应用。回答下列问题:
(1)下列能源中属于可再生能源的是 (填序号,可多选)。
①煤 ②太阳能③风能 ④甲醇 ⑤氢气 ⑥天然气
(2)甲醇(CH₃OH)可通过CO₂ 与H₂ 催化合成,其作为能源的主要优势是
(答两点)。
(3)实验室用50 mL 0.50 mol·L- ¹ 盐酸与50 mL 0.55 mol·L-¹NaOH 溶液反应测定
反 应热,实验数据如下:.
实验次数 起始温度t1(℃) 终止温度t2(℃) 温度差△t(℃)
1 25.0 28.3 3.3
2 25.1 28.5 3.4
3 25.0 28.2 3.2
已知:溶液密度p=1g ·cm-³, 比热容c=4.18J ·g⁻¹ · ℃-¹, 忽略溶液体积变化。
【高二10月夯基考 · 化学 第5页(共6页)】 26—X—
029B①计算该中和反应反应热△H= kJ · mol- ¹ (保留一位小数)。
【高二10月夯基考 · 化学 第5页(共6页)】 26—X—
029B②写出该中和反应的热化学方程式:_
③已知弱酸电离出H+需要吸收热量。若用相同浓度的CH₃COOH 溶液代替盐酸进
行 实验,测得的中和热△H会 (填“偏大”“偏小”或“不变”)。
(4)已知下列反应的焓变(25℃,101 kPa):
)△H₁=—726.5 kJ·mol-
¹ C(s,石墨)+O₂ (g)——CO₂ (g) △Hz=-393.5kJ·mol- ¹
=
kJ·mol- ¹。
②工业上常用 CO 与 H₂ 合成甲醇: CO(g)+2H₂ (g)=CH₃OH(g) △H₅=
—90.7kJ·mol-¹, 结合 CH₃OH(1)——CH₃OH(g) △H6=+35.2kJ·mol-¹, 计
算CO(g) 的燃烧热△H= kJ·mol⁻¹。
18. (15分)工业上丁烷脱氢制丁烯(C₄H8) 是重要的化工过程,其反应原理: C₄H₁₀(g)
一 C₄H₈ (g)+H₂ (g)△H=+124 kJ ·mol-¹。回答下列问题:
(1)丁烷脱氢制丁烯的反应中正反应的活化能 (填“大于”“小于”或“等于”)逆反
应 的活化能。
如
(2)下列能说明该反应在恒温恒压密闭容器中达到平衡状态的是 (填字
母)。 A.C₄H₈ 的物质的量分数保持不变
B.n(H₂):n(C.H₈) 保持不变
C. 气体密度保持不变
D. 速率关系:v(C₄H₈)=v(C₄H₁₀)
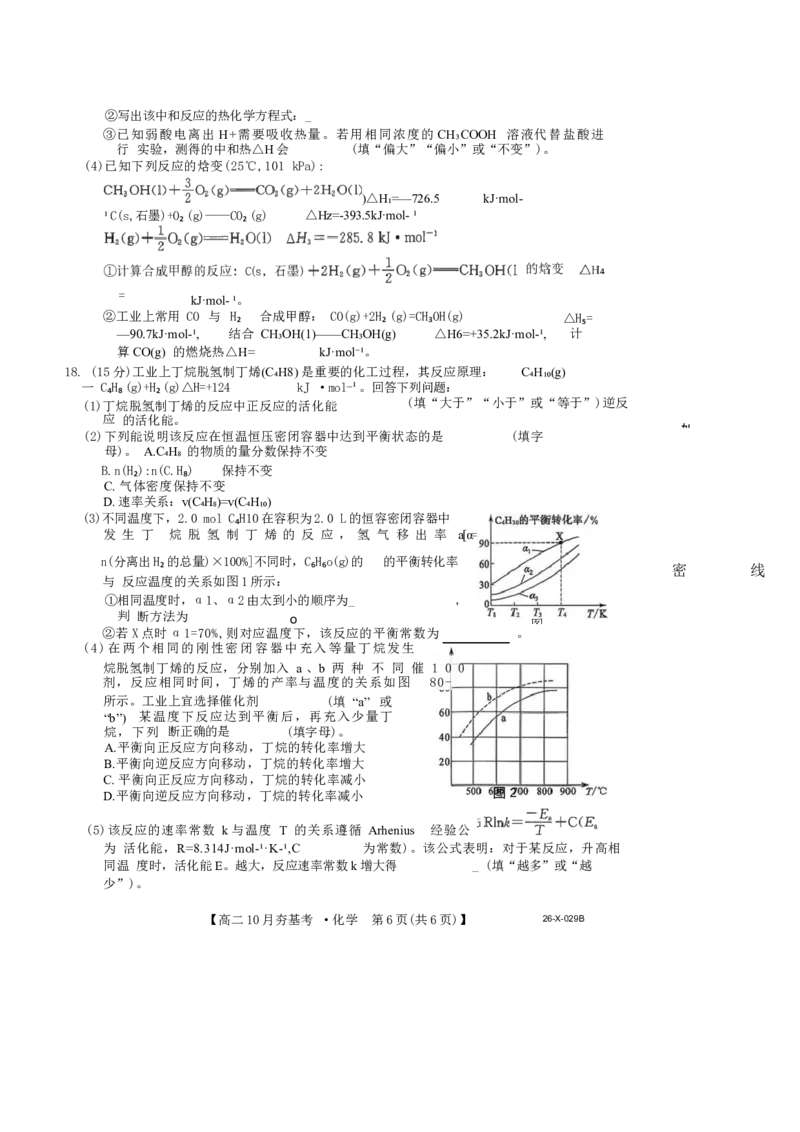
(3)不同温度下,2.0 mol C₄H10在容积为2.0 L的恒容密闭容器中
发 生 丁 烷 脱 氢 制 丁 烯 的 反 应 , 氢 气 移 出 率 a[α=
n(分离出H₂ 的总量)×100%]不同时,C₆H₆o(g)的 的平衡转化率
密 线
与 反应温度的关系如图1所示:
①相同温度时,α1、α2由太到小的顺序为_ ,
判 断方法为 o
图
②若X点时α1=70%,则对应温度下,该反应的平衡常数为 。
(4)在两个相同的刚性密闭容器中充入等量丁烷发生
烷脱氢制丁烯的反应,分别加入 a 、b 两 种 不 同 催 1 0 0
剂,反应相同时间,丁烯的产率与温度的关系如图 80-
所示。工业上宜选择催化剂 (填 “a” 或
“b”) 某温度下反应达到平衡后,再充入少量丁
烷,下列 断正确的是 (填字母)。
A.平衡向正反应方向移动,丁烷的转化率增大
B.平衡向逆反应方向移动,丁烷的转化率增大
C. 平衡向正反应方向移动,丁烷的转化率减小
D.平衡向逆反应方向移动,丁烷的转化率减小 图 2
(5)该反应的速率常数 k与温度 T 的关系遵循 Arhenius 经验公
为 活化能,R=8.314J·mol-¹·K-¹,C 为常数)。该公式表明:对于某反应,升高相
同温 度时,活化能E。越大,反应速率常数k增大得 _ (填“越多”或“越
少”)。
【高二10月夯基考 ·化学 第6页(共6页)】 26-X-029B