文档内容
山西大学附中
2025—2026 学年第一学期高二年级 12 月月考
化学试题
时长:75分钟 内容:化学反应原理 试卷满分:100分
可能用到的相对原子质量:H1 O16 Na23 S32 Cl35.5
一、选择题:本题共15小题,每小题3分,共45分。每小题只有一项符合题目要求。
1.化学与人类社会可持续发展息息相关。下列说法不正确的是( )
A.可用FeS除去废水中的Hg2+
B.为防止金属腐蚀可采用离子注入的方法在金属表面形成钝化膜
C.锂离子电池充电时锂离子从负极脱嵌,放电时锂离子从正极脱嵌
D.加入混凝剂聚合氯化铝,可使污水中细小悬浮物聚集成大颗粒
2.N 为阿伏加德罗常数的值。下列叙述正确的是( )
A
A.12gNaHSO 固体中含阳离子数目为0.1N
4 A
B.64gSO 和16gO 混合,充分反应后总分子数为N
2 2 A
C.pH=2的H SO 溶液中H+的数目为0.02N
2 4 A
D.1.0L1.0mol·L-1的Na CO 溶液中CO2-的数目为N
2 3 3 A
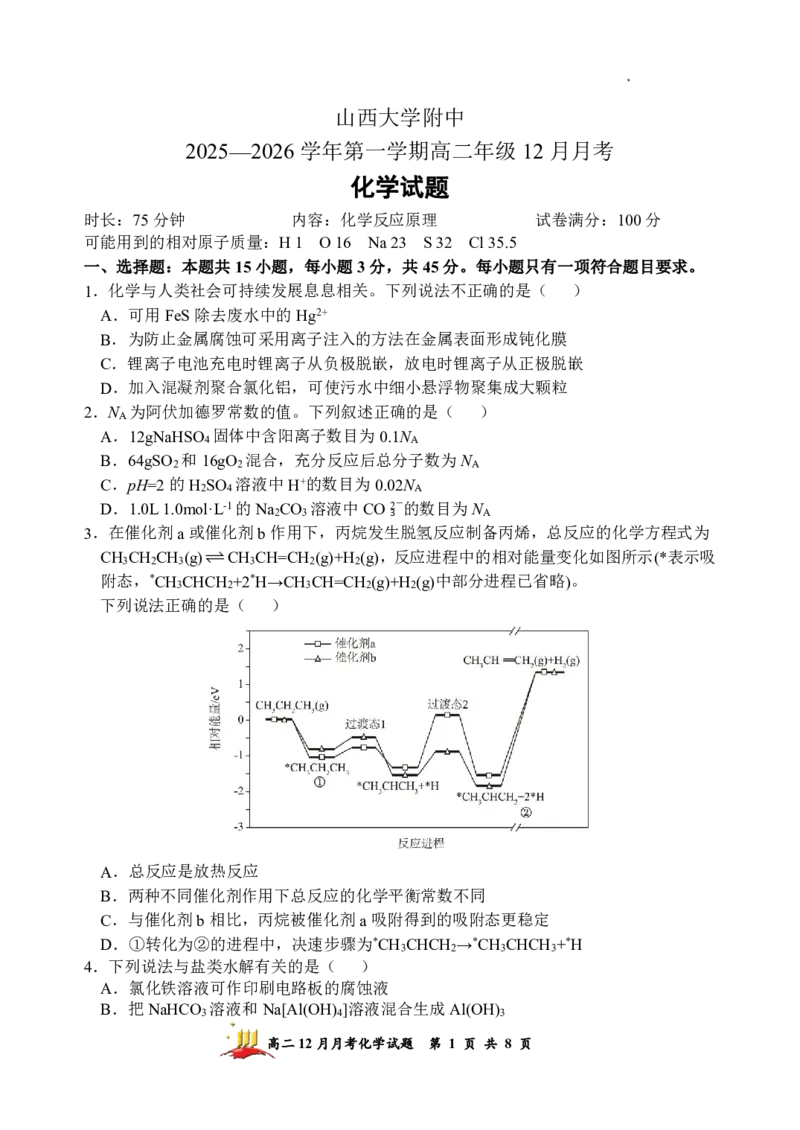
3.在催化剂a或催化剂b作用下,丙烷发生脱氢反应制备丙烯,总反应的化学方程式为
CH CH CH (g)CH CH=CH (g)+H (g),反应进程中的相对能量变化如图所示(*表示吸
3 2 3 3 2 2
附态,*CH CHCH +2*H→CH CH=CH (g)+H (g)中部分进程已省略)。
3 2 3 2 2
下列说法正确的是( )
A.总反应是放热反应
B.两种不同催化剂作用下总反应的化学平衡常数不同
C.与催化剂b相比,丙烷被催化剂a吸附得到的吸附态更稳定
D.①转化为②的进程中,决速步骤为*CH CHCH →*CH CHCH +*H
3 2 3 3
4.下列说法与盐类水解有关的是( )
A.氯化铁溶液可作印刷电路板的腐蚀液
B.把NaHCO 溶液和Na[Al(OH) ]溶液混合生成Al(OH)
3 4 3
高二12月月考化学试题 第 1 页 共 8 页
学科网(北京)股份有限公司C.实验室盛放Na SiO 溶液的试剂瓶不能用带磨口玻璃塞的玻璃瓶
2 3
D.常温下等物质的量浓度的NH NO 溶液比Cu(NO ) 溶液酸性弱
4 3 3 2
5.常温下,下列有关溶液的叙述正确的是( )
A.pH=a的醋酸稀溶液,稀释10倍后,溶液的pH=b,则b=a+1
B.在滴有酚酞溶液的氨水里,加入NH Cl至溶液恰好无色,则此时溶液的pH<7
4
C.1.0×10-3mol·L-1盐酸的pH=3.0,1.0×10-8mol·L-1盐酸的pH=8.0
D.若1mLpH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11
6.下列关于铁腐蚀与防护的反应式正确的是( )
A.铁经过发蓝处理形成致密氧化膜:Fe+2HNO (浓)=FeO+2NO ↑+H O
3 2 2
B.铁发生腐蚀生锈的反应:3Fe+2O +xH O=Fe O ·xH O
2 2 3 4 2
C.破损的镀锌铁皮在氨水中,锌电极上的电极反应式:O +2H O+4e-=4OH—
2 2
D.取铁腐蚀溶液滴入K [Fe(CN) ]溶液:K++Fe2++[Fe(CN) ]3—=KFe[Fe(CN) ]↓
3 6 6 6
7.由下列实验操作和现象得出的结论正确的是( )
选项 实验操作 现象 结论
分别测定0.10mol·L-1HCOONa HCOONa溶液的pH 结合H+的能力:
A
和CH COONa溶液的pH 更小 HCOO—>CH COO—
3 3
B 向CuSO 4 溶液中通入H 2 S气体 出现黑色沉淀(CuS) 酸性:H 2 SCaC O
2mol·L-1乙酸,加热 2 4 2 4
D 向Na 2 HPO 4 溶液中滴加AgNO 3 溶液 出现黄色沉淀(Ag 3 PO 4 ) Na 2 HPO 4 发生了水解反应
8.右图为氯碱工业中,离子交换膜法电解饱和食盐水示意
图。下列说法不正确的是( )
A.电极A为阳极,发生氧化反应生成氯气
B.电极B可以采用石墨或铁
C.饱和NaCl从b处进,NaOH溶液从c处出
D.当外电路转移1mol电子,离子交换膜迁移1molOH—
9.金属腐蚀会对设备产生严重危害,腐蚀快慢与材料种类、所处环境有关。对海水中钢
闸门的防腐措施如图。下列说法正确的是( )
A.辅助阳极材料自身可能失去电子
B.钢闸门表面腐蚀电流为零时,阳极上不发生化学反应
C.钢闸门不被保护时,越靠近底端腐蚀越严重
D.外加电压改变时,钢闸门表面可发生反应:
O +4e—+2H O=4OH—
2 2
高二12月月考化学试题 第 2 页 共 8 页
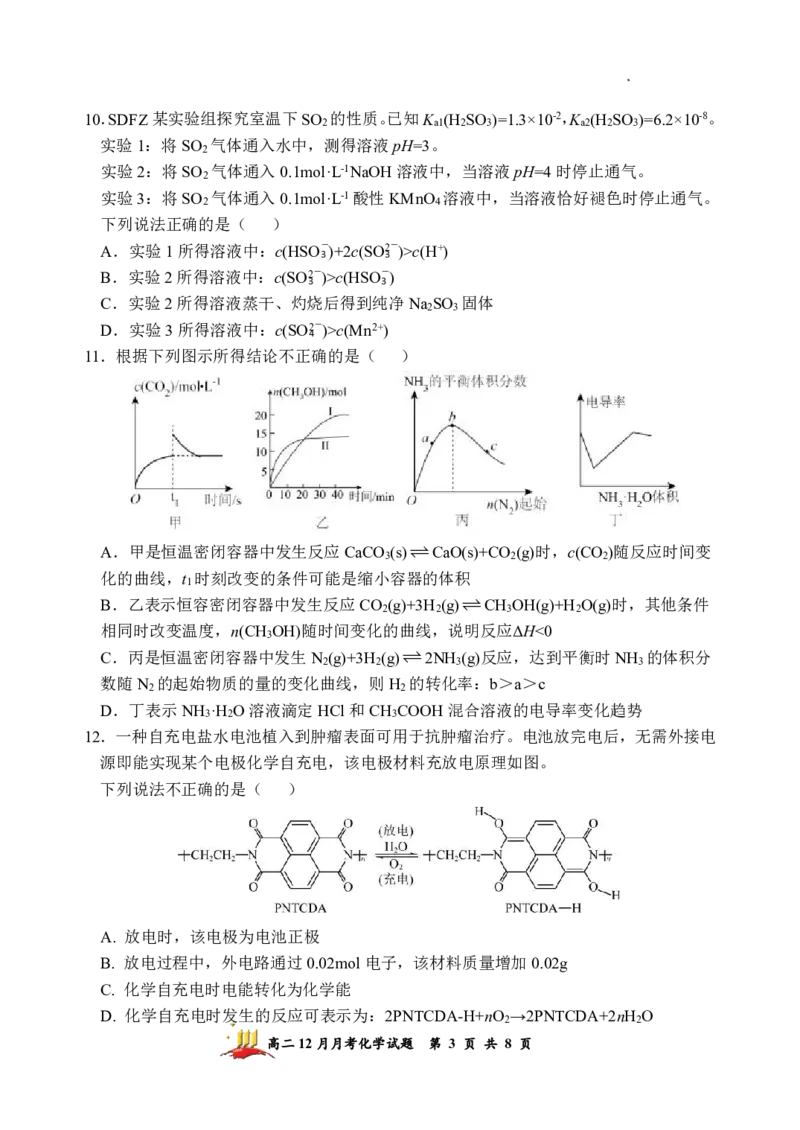
学科网(北京)股份有限公司10.SDFZ某实验组探究室温下SO 的性质。已知K (H SO )=1.3×10-2,K (H SO )=6.2×10-8。
2 a1 2 3 a2 2 3
实验1:将SO 气体通入水中,测得溶液pH=3。
2
实验2:将SO 气体通入0.1mol·L-1NaOH溶液中,当溶液pH=4时停止通气。
2
实验3:将SO 气体通入0.1mol·L-1酸性KMnO 溶液中,当溶液恰好褪色时停止通气。
2 4
下列说法正确的是( )
A.实验1所得溶液中:c(HSO-)+2c(SO2-)>c(H+)
3 3
B.实验2所得溶液中:c(SO2-)>c(HSO-)
3 3
C.实验2所得溶液蒸干、灼烧后得到纯净Na SO 固体
2 3
D.实验3所得溶液中:c(SO2-)>c(Mn2+)
4
11.根据下列图示所得结论不正确的是( )
A.甲是恒温密闭容器中发生反应CaCO (s)CaO(s)+CO (g)时,c(CO )随反应时间变
3 2 2
化的曲线,t 时刻改变的条件可能是缩小容器的体积
1
B.乙表示恒容密闭容器中发生反应CO (g)+3H (g)CH OH(g)+H O(g)时,其他条件
2 2 3 2
相同时改变温度,n(CH OH)随时间变化的曲线,说明反应ΔH<0
3
C.丙是恒温密闭容器中发生N (g)+3H (g)2NH (g)反应,达到平衡时NH 的体积分
2 2 3 3
数随N 的起始物质的量的变化曲线,则H 的转化率:b>a>c
2 2
D.丁表示NH ·H O溶液滴定HCl和CH COOH混合溶液的电导率变化趋势
3 2 3
12.一种自充电盐水电池植入到肿瘤表面可用于抗肿瘤治疗。电池放完电后,无需外接电
源即能实现某个电极化学自充电,该电极材料充放电原理如图。
下列说法不正确的是( )
A. 放电时,该电极为电池正极
B. 放电过程中,外电路通过0.02mol电子,该材料质量增加0.02g
C. 化学自充电时电能转化为化学能
D. 化学自充电时发生的反应可表示为:2PNTCDA-H+nO →2PNTCDA+2nH O
2 2
高二12月月考化学试题 第 3 页 共 8 页
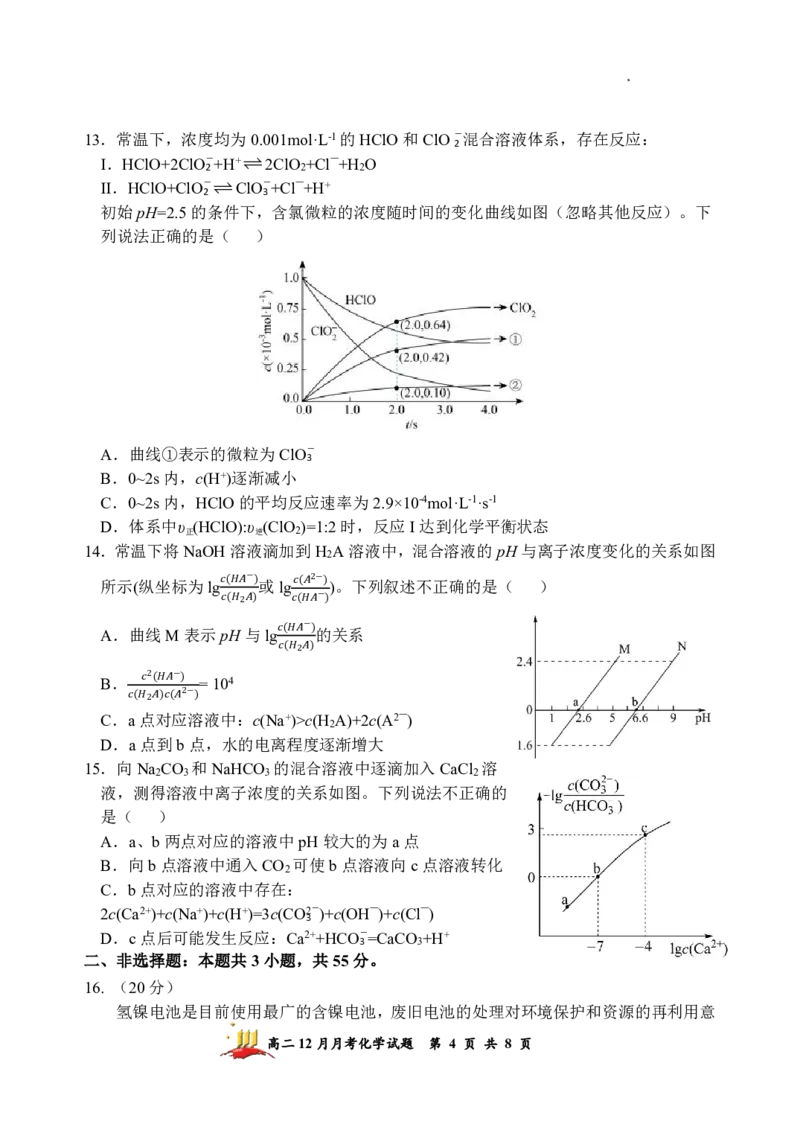
学科网(北京)股份有限公司13.常温下,浓度均为0.001mol·L-1的HClO和ClO-混合溶液体系,存在反应:
2
I.HClO+2ClO-+H+2ClO +Cl—+H O
2 2 2
II.HClO+ClO-ClO-+Cl—+H+
2 3
初始pH=2.5的条件下,含氯微粒的浓度随时间的变化曲线如图(忽略其他反应)。下
列说法正确的是( )
A.曲线①表示的微粒为ClO-
3
B.0~2s内,c(H+)逐渐减小
C.0~2s内,HClO的平均反应速率为2.9×10-4mol·L-1·s-1
D.体系中υ (HClO):υ (ClO )=1:2时,反应I达到化学平衡状态
正 逆 2
14.常温下将NaOH溶液滴加到H A溶液中,混合溶液的pH与离子浓度变化的关系如图
2
所示(纵坐标为lg 或lg )。下列叙述不正确的是( )
− 2−
( ) ( )
−
( 2 ) ( )
A.曲线M表示pH与lg 的关系
−
( )
( 2 )
B. =104
2 −
( )
C. a( 点2 对) (应 2− 溶) 液中:c(Na+)>c(H A)+2c(A2—)
2
D.a点到b点,水的电离程度逐渐增大
15.向Na CO 和NaHCO 的混合溶液中逐滴加入CaCl 溶
2 3 3 2
液,测得溶液中离子浓度的关系如图。下列说法不正确的
是( )
A.a、b两点对应的溶液中pH较大的为a点
B.向b点溶液中通入CO 可使b点溶液向c点溶液转化
2
C.b点对应的溶液中存在:
2c(Ca2+)+c(Na+)+c(H+)=3c(CO2-)+c(OH—)+c(Cl—)
3
D.c点后可能发生反应:Ca2++HCO-=CaCO +H+
3 3
二、非选择题:本题共3小题,共55分。
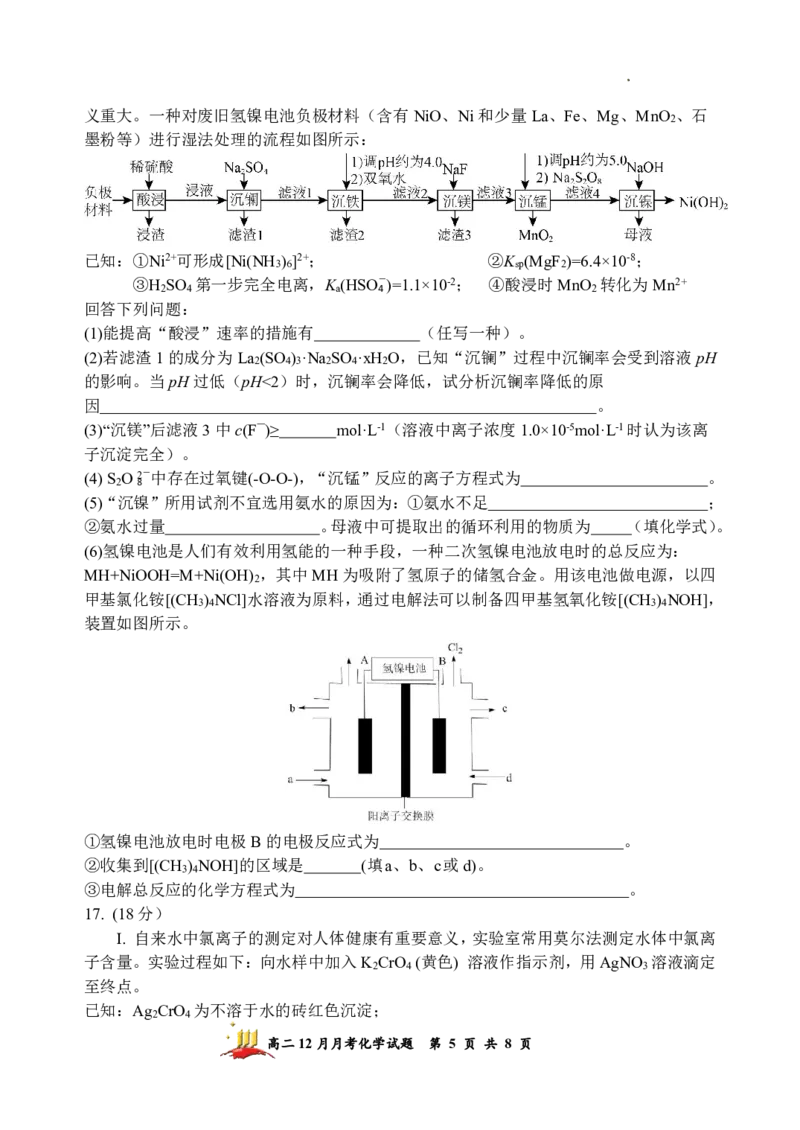
16. (20分)
氢镍电池是目前使用最广的含镍电池,废旧电池的处理对环境保护和资源的再利用意
高二12月月考化学试题 第 4 页 共 8 页
学科网(北京)股份有限公司义重大。一种对废旧氢镍电池负极材料(含有NiO、Ni和少量La、Fe、Mg、MnO 、石
2
墨粉等)进行湿法处理的流程如图所示:
已知:①Ni2+可形成[Ni(NH ) ]2+; ②K (MgF )=6.4×10-8;
3 6 sp 2
③H SO 第一步完全电离,K (HSO-)=1.1×10-2; ④酸浸时MnO 转化为Mn2+
2 4 a 4 2
回答下列问题:
(1)能提高“酸浸”速率的措施有 (任写一种)。
(2)若滤渣1的成分为La (SO ) ·Na SO ·xH O,已知“沉镧”过程中沉镧率会受到溶液pH
2 4 3 2 4 2
的影响。当pH过低(pH<2)时,沉镧率会降低,试分析沉镧率降低的原
因 。
(3)“沉镁”后滤液3中c(F—)≥ mol·L-1(溶液中离子浓度1.0×10-5mol·L-1时认为该离
子沉淀完全)。
(4)S O2-中存在过氧键(-O-O-),“沉锰”反应的离子方程式为 。
2 8
(5)“沉镍”所用试剂不宜选用氨水的原因为:①氨水不足 ;
②氨水过量 。母液中可提取出的循环利用的物质为 (填化学式)。
(6)氢镍电池是人们有效利用氢能的一种手段,一种二次氢镍电池放电时的总反应为:
MH+NiOOH=M+Ni(OH) ,其中MH为吸附了氢原子的储氢合金。用该电池做电源,以四
2
甲基氯化铵[(CH ) NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH ) NOH],
3 4 3 4
装置如图所示。
①氢镍电池放电时电极B的电极反应式为 。
②收集到[(CH ) NOH]的区域是 (填a、b、c或d)。
3 4
③电解总反应的化学方程式为 。
17. (18分)
I. 自来水中氯离子的测定对人体健康有重要意义,实验室常用莫尔法测定水体中氯离
子含量。实验过程如下:向水样中加入K CrO (黄色) 溶液作指示剂,用AgNO 溶液滴定
2 4 3
至终点。
已知:Ag CrO 为不溶于水的砖红色沉淀;
2 4
高二12月月考化学试题 第 5 页 共 8 页
学科网(北京)股份有限公司常温下K (AgCl)=1.8×10-10,K (Ag CrO )=1.8×10-12。
sp sp 2 4
回答下列问题:
(1)滴定时,应使用 (填“酸式”或“碱式”)滴定管。
(2)水样应调至中性或弱碱性,强酸性时加入K CrO 溶液发生反应的离子方程式
2 4
是 。
(3)滴定达到终点的判断标志是 。
(4)实验过程中测得数据如下表:
编号 1 2 3
V(水样)/mL 10.00 10.00 10.00
c(AgNO )/mol·L-1 0.0010
3
V(AgNO )/mL 3.75 4.01 3.99
3
计算水样中氯离子的含量为 mg/L。
(5)已知2AgCl+CrO2- 2Cl—+Ag CrO ,计算出该反应的平衡常数为 。
4 2 4
(6)下列情况会造成实验测定结果偏低的是 。(填标号)
A.滴定前,未使用标准液润洗滴定管
B.滴定前,滴定管尖嘴悬挂有液滴
C.滴定前仰视读数,滴定后俯视读数
D.滴定前尖嘴部分充满溶液,滴定结束时滴定管尖嘴有气泡
II.以银盐为例探究沉淀溶解的反应规律。
向两份等量AgI、Ag S固体中加入2mL3mol·L-1硝酸,水浴加热。AgI不溶解;盛有
2
Ag S的试管中黑色固体逐渐减少,有无色气泡产生,溶液中出现乳白色浑浊,试管口处
2
气体略显红棕色,最终无黑色沉淀,有淡黄色沉淀。
(7)由“溶液中出现乳白色浑浊”推测Ag S溶于硝酸经过两步反应:
2
i.Ag S+2H+ 2Ag++H S;
2 2
ii.写出ii的离子方程式: 。
(8)实验室回收了一定质量AgI,欲将其转化为AgNO 溶液,实验所需试剂为 。
3
18.(17分)
乙烯是重要的工业原料,可用多种方法制备。
Ⅰ.CO 催化加氢法制乙烯:2CO (g)+6H (g) C H (g)+4H O(g) ΔH
2 2 2 2 4 2
已知:①H 、C H 燃烧热的ΔH分别为:-285.8kJ/mol、-1411.0kJ/mol;
2 2 4
②H O(l)=H O(g) ΔH =+44.0kJ/mol
2 2 1
(1)该反应的ΔH= kJ/mol,该反应在 (填“高温”或“低温”)能自发进行。
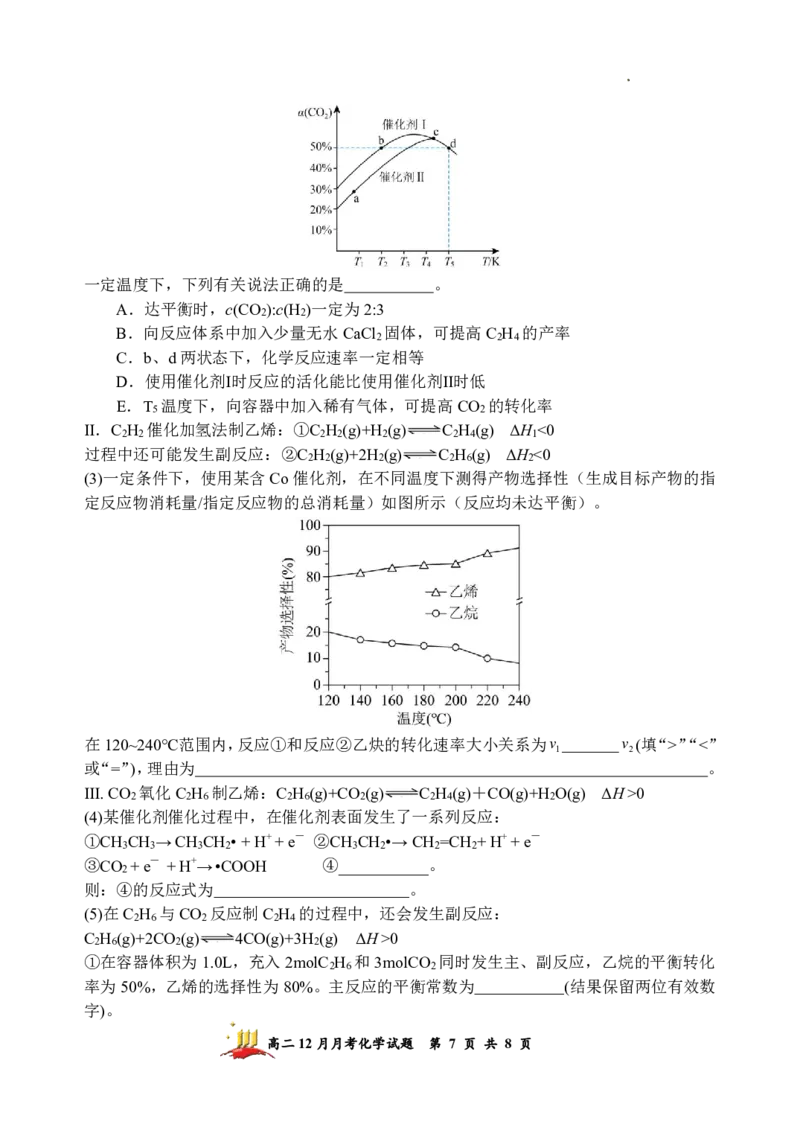
(2)将CO 和H 按物质的量之比为2:3充入恒容密闭容器中,分别在不同催化剂条件下发
2 2
生反应,测得相同时间CO 的转化率与温度的关系如图所示:
2
高二12月月考化学试题 第 6 页 共 8 页
学科网(北京)股份有限公司一定温度下,下列有关说法正确的是 。
A.达平衡时,c(CO ):c(H )一定为2:3
2 2
B.向反应体系中加入少量无水CaCl 固体,可提高C H 的产率
2 2 4
C.b、d两状态下,化学反应速率一定相等
D.使用催化剂Ⅰ时反应的活化能比使用催化剂Ⅱ时低
E.T 温度下,向容器中加入稀有气体,可提高CO 的转化率
5 2
II.C H 催化加氢法制乙烯:①C H (g)+H (g) C H (g) ΔH <0
2 2 2 2 2 2 4 1
过程中还可能发生副反应:②C H (g)+2H (g) C H (g) ΔH <0
2 2 2 2 6 2
(3)一定条件下,使用某含Co催化剂,在不同温度下测得产物选择性(生成目标产物的指
定反应物消耗量/指定反应物的总消耗量)如图所示(反应均未达平衡)。
在120~240℃范围内,反应①和反应②乙炔的转化速率大小关系为v v (填“>”“<”
1 2
或“=”),理由为 。
III.CO 氧化C H 制乙烯:C H (g)+CO (g) C H (g)+CO(g)+H O(g) ΔH>0
2 2 6 2 6 2 2 4 2
(4)某催化剂催化过程中,在催化剂表面发生了一系列反应:
①CH CH →CH CH •+H++e— ②CH CH •→CH =CH +H++e—
3 3 3 2 3 2 2 2
③CO +e— +H+→•COOH ④___________。
2
则:④的反应式为 。
(5)在C H 与CO 反应制C H 的过程中,还会发生副反应:
2 6 2 2 4
C H (g)+2CO (g) 4CO(g)+3H (g) ΔH>0
2 6 2 2
①在容器体积为1.0L,充入2molC H 和3molCO 同时发生主、副反应,乙烷的平衡转化
2 6 2
率为50%,乙烯的选择性为80%。主反应的平衡常数为 (结果保留两位有效数
字)。
高二12月月考化学试题 第 7 页 共 8 页
学科网(北京)股份有限公司②其他条件相同时,1molC H 与1molCO 经相同反应时间测得如表实验数据:
2 6 2
实验 温度/K 催化剂 C H 的产率%
2 4
400 催化剂1 55.0
实验1
400 催化剂2 62.3
500 催化剂1 68.5
实验2
500 催化剂2 80.1
已知两种催化剂的活性受温度影响不大,比较相同温度时,催化剂2催化下C H 产率更
2 4
高的原因是 。
高二12月月考化学试题 第 8 页 共 8 页
学科网(北京)股份有限公司