文档内容
友好学校第七十六届期末联考
高三化学
说明:本试卷共19题,满分100分,共8页。考试用时90分钟。
注意事项:
1.答题前,考生先将自己的姓名、准考证号填写清楚,将条形码粘贴到条形码区域内。
2.选择题必须用2B铅笔填涂;非选择题必须用0.5mm黑色中性笔书写,字体工整,笔迹清
楚。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效,在草
纸、试题卷上答题无效。
4.保持卡面清洁,不要折叠,不要弄破、弄皱、不准使用涂改液、修正带、刮纸刀。
可能用到的相对原子质量:H-1O-16N-14C-12Na-23Fe-56
第I卷(选择题 共45分)
一、选择题:(本题包括15小题,每小题3分,共45分,每小题只有一个选项符合题意)
1. 化学与生产、生活密切相关。下列做法或说法错误的是
.
A 将煤气中毒患者移至空气流通处进行救治
B. 医用药品常在低温、干燥的环境中密封保存
C. 农业生产中草木灰和铵态氮肥混合使用以增加肥效
D. 和 溶液可作为焊接除锈剂
【答案】C
【解析】
【详解】A.煤气中毒又叫一氧化碳中毒,一氧化碳与血红蛋白的结合能力比氧气大得多,血红蛋白的数
量是有限的,这样,就使氧失去了与血红蛋白结合的机会,因此,发现有人煤气中毒,迅速关紧煤气阀,
打开门窗通风,降低空气中的一氧化碳浓度,快速移到通风处,再实施人工呼吸救治,故A正确;
B.高温可使生物制剂中的蛋白质变性而失效,也可使某些中药里的有效成分挥发,降低它们的药效,所
以医用药品应在低温、干燥的环境下密封保存,故B正确;
C.草木灰与铵态氮肥混合使用会生成氨气,丧失肥效,故C错误;
D.NH C和 溶液为强酸弱碱盐,水解呈酸性,铁锈可以和酸反应,可作为焊接除锈剂,故D正确;
4
故选:C。
2. 下列过程中,涉及化学变化的是( )
第1页/共18页
学科网(北京)股份有限公司A. 用黏土制作陶坯 B. 甘油加水作护肤剂
C. 用熟苹果催熟猕猴桃 D. 用四氯化碳擦去圆珠笔油渍
【答案】C
【解析】
【详解】用黏土制作陶坯是外形变化,属于物理变化,故A错误;甘油加水作护肤剂,甘油与水互溶,属
于物理变化,故B错误;用熟苹果催熟猕猴桃,用熟苹果释放乙烯,“生”的水果中含有大量淀粉,成熟
的过程中淀粉被水解成糖,属于化学变化,故C正确;用四氯化碳擦去圆珠笔油渍,圆珠笔油渍溶于四氯
化碳,属于物理变化,故D错误。
3. 下列说法不正确的是
A. 浙糯4号糯米或赤霞珠葡萄都可以用来酿酒
B. 福尔马林能使蛋白质变性,常用于浸制生物标本
C. 油脂属于高分子化合物,可用于制造肥皂和油漆
D. 食物中的纤维素能刺激肠道蠕动,有助于消化,但不能为运动时提供能量
【答案】C
【解析】
【详解】A.浙糯4号糯米或赤霞珠葡萄均含有糖类,则都可以用来酿酒,A正确;
B.福尔马林能使蛋白质变性,则常用于浸制生物标本,B正确;
C.油脂不属于高分子化合物,C错误;
D.食物中的纤维素能刺激肠道蠕动,有助于消化,但人体不含有水解纤维素的酶,则不能为运动时提供
能量,D正确;
故选C。
4. 下列化学反应的离子方程式正确的是
A. 在H18O中投入NaO 固体:2 H 18O+2Na O=4Na+ +4OH-+18O↑
2 2 2 2 2 2 2
B. 向AlCl 溶液中加入过量的浓氨水: Al3++4NH·H O = AlO +4 +2H O
3 3 2 2
C. 向FeI 溶液中通入少量Cl:2Fe2++ Cl =2Cl-+2Fe3+
2 2 2
D. Fe O 溶于稀硝酸的反应:3Fe O+28H++ =9Fe3++NO↑+14H O
3 4 3 4 2
【答案】D
【解析】
【详解】A.NaO 与水反应时,NaO 既是氧化剂,又是还原剂,水中的氧元素不变价,O 分子中不含
2 2 2 2 2
18O,18O应该在OH-中,正确的离子方程式为:2H18O+2Na O═2OH-+218OH-+4Na++O ↑,故A错误;
2 2 2 2
B.向AlCl 溶液中加入过量的浓氨水,氯化铝与氨水发生反应,生成氢氧化铝沉淀和氯化铵,正确的离子
3
第2页/共18页
学科网(北京)股份有限公司方程式为Al3++3NH·H O=Al(OH) ↓+3 ,故B 错误;
3 2 3
C.FeI 溶液中通入少量的Cl,碘离子还原性大于亚铁离子,少量的氯气只氧化碘离子,发生反应的离子
2 2
方程式为2I-+Cl═I +2Cl-,故C错误;
2 2
D.Fe O 溶于稀硝酸,硝酸具有氧化性,能够将亚铁离子氧化成铁离子,二者发生氧化还原反应,该反应
3 4
的离子方程式为3Fe O+28H++ =9Fe3++NO↑+14H O,故D正确;
3 4 2
答案为D。
5. 向下列溶液中逐渐通入 至过量,最终体系中无沉淀的是
A. B.
C. D.
【答案】B
【解析】
【详解】A.HSO 是弱电解质,NH 溶于水产生NH ▪H O,NH ▪H O促进HSO 的电离,产生更多的
2 3 3 3 2 3 2 2 3
,然后会产生BaSO 沉淀,故A错误;
3
B.NH 溶于水产生NH ▪H O,NH ▪H O与HCO 反应不产生沉淀,NH ▪H O与 会反应但也不会产
3 3 2 3 2 2 3 3 2
生沉淀,所以该离子组内不产生沉淀,故B正确;
C.NH 溶于水后产生NH ▪H O,NH ▪H O会与Mg2+和Ag+反应产生沉淀,故C错误;
3 3 2 3 2
D.NH 溶于水产生NH ▪H O,NH ▪H O与Cu2+反应产生Cu(OH) 沉淀,与Al3+反应产生Al(OH) 沉淀,故
3 3 2 3 2 2 3
D错误;
故本题选B.
6. 为阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,4.48LCO中含有的分子数为
B. 稀盐酸中,氢原子的数目为0.05
C. 在足量 中燃烧,消耗 时,转移的电子数为2
第3页/共18页
学科网(北京)股份有限公司D. 标准状况下,22.4L 含有的原子数为3
【答案】C
【解析】
【详解】A.常温常压下,不能用气体摩尔体积计算,故A错误;
B.溶液中水也含有氢原子,故B错误;
C. 在足量 中燃烧, ,消耗 时,转移的电子数为2 ,故C正确;
D.标准状况下,水不是气体,不能用气体摩尔体积计算,故D错误;
故答案为C。
7. 下列表示不正确的是
A. 羟基的电子式: B. 氯乙烯的结构简式:
C. 基态亚铁离子的电子排布式: D. 分子的球棍模型:
【答案】B
【解析】
【详解】A.羟基中氧原子有1个未成对电子,羟基的电子式是 ,故A正确
B.氯乙烯分子式为C HCl,结构简式为 ,故B错误;
2 3
C.基态亚铁离子核外有24个电子,电子排布式为 ,故C正确;
D. 分子空间构型是三角锥,球棍模型为 ,故D正确;
选B 。
8. 不能说明氯的非金属性强于溴的事实是( )
A. HClO 酸性强于HBrO B. HBr的分解温度低于HCl
4 4
C. FeBr 溶液中滴少量氯水,溶液变黄 D. BrCl中氯为﹣1价
2
【答案】C
【解析】
【详解】A.应根据最高价氧化物对应的水化物的酸性比较非金属性强弱,即HClO>HBrO ,故A正确;
4 4
B.HBr的分解温度低于HCl,说明HBr较不稳定,则可说明氯的非金属性强于溴,故B正确;
第4页/共18页
学科网(北京)股份有限公司C.向FeBr 溶液中滴加少量氯水,亚铁离子还原性大于溴离子,少量氯气会将亚铁离子氧化,产物分别是
2
铁离子,铁离子在溶液中呈现浅黄色,不能证明氯的非金属性强于溴,故C错误;
D.BrCl中氯为-1价说明氯原子吸引电子能力强,说明氯的非金属性强于溴,故D正确;
故答案为C。
【点睛】比较非金属元素的非金属性强弱,可根据单质之间的置换反应、对应最高价氧化物的水化物的酸
性、氢化物的稳定性、与氢气反应的难易程度、对键合电子的吸引,与变价金属反应时金属元素的化合价
等角度判断。
9. 目前人工固氮普遍采用的是氨的工业合成。氢气与氮气在固体催化剂表面合成氨的过程如下图所示。
下列说法错误的是
A. ②→③释放能量
B. 为了提高氨的脱附速率,应适时地将氨从反应后的混合气体中分离出来
C. 该过程中包含旧化学键的断裂和新化学键的生成
D. 该催化剂可提高单位时间生成物的产率
【答案】A
【解析】
【详解】A.断键吸收能量,②→③为断键过程,吸收能量,故A错误;
B.及时分离产物,平衡正向移动,有利于生成氨气,故B正确;
C.该过程中包氮氮键、氢氢键的断裂和氮氢键的生成,故C正确;
D.催化剂加快反应速率,所以催化剂能提高单位时间的生产效率,提高单位时间生成物的产率,故D正
确;
选A 。
10. 下列实验操作,现象与结论匹配的是
选
操作 现象 结论
项
将缠绕铜丝灼烧后反复插入盛乙醇的试管,然后滴入酸 酸性高锰酸钾溶 乙醇催化氧化生成乙
A
性高锰酸钾溶液 液褪色 醛
2NO (g) NO(g)Δ
B 将装有NO 的平衡球放入热水中 颜色加深 2 2 4
2
H>0
向含0.1mol的FeI 溶液中通入0.1molCl ,再滴加淀粉
C 2 2 溶液变蓝色 还原性:I->Fe2+
溶液
第5页/共18页
学科网(北京)股份有限公司向碳酸钠溶液中加入稀硫酸,反应产生的气体通入苯酚
D 溶液变浑浊 酸性:碳酸>苯酚
钠溶液中
A. A B. B C. C D. D
【答案】D
【解析】
【详解】A.乙醇和乙醛均能使酸性高锰酸钾溶液褪色,A不符合题意;
B.NO 为红棕色气体,NO 为无色气体,加热后颜色变深,说明平衡逆向进行,逆反应为吸热反应,则
2 2 4
正反应应为放热反应,B不符合题意;
C.氯气为0.1mol,由反应关系可知,若亚铁离子先反应,也会有部分碘离子反应生成碘单质,使淀粉变
蓝,C不符合题意;
D.碳酸钠与硫酸反应生成二氧化碳,二氧化碳与苯酚钠反应生成微溶于水的苯酚,D符合题意;
故答案为:D。
11. 下列叙述正确的是
A. 常温下,将pH=1的稀盐酸与pH=13的BOH溶液等体积混合,所得溶液pH一定为7
B. 常温下,将pH=9的 溶液与pH=9的NaOH溶液混合,混合溶液pH一定为9
C. 常温时, , ,等浓度的上述两种酸分别与NaOH固
体反应后呈中性,忽略溶液体积变化则溶液中:
D. 已知 ,向盛有 溶液的试管中加入适量 ,振荡静置后 层显紫红色,说明
在 中的溶解度比在水中的大
【答案】B
【解析】
【详解】A.不确定BOH是强碱还是弱碱,故等体积混合,所得溶液pH不一定为7,A错误;
B.两者碱性相同,且不发生反应,则常温下,将pH=9的 溶液与pH=9的NaOH溶液混合,
混合溶液pH一定为9,B正确;
C.对HF反应后溶液由电荷守恒可知 ,对醋酸反应后溶液由电荷守恒
第6页/共18页
学科网(北京)股份有限公司可知 ;溶液显中性,则均有 ,由数据可知,
HF酸性更强,等浓度的上述两种酸分别与NaOH固体反应后呈中性,则HF消耗氢氧化钠的量更多,故
HF反应后溶液钠离子浓度更大,则有 ,C错误
D.已知 ,向盛有 溶液的试管中加入适量 ,振荡静置后 层显紫红色,说平衡
正向移动生成碘单质为四氯化碳萃取,D错误;
故选B。
12. 高铁酸钠( )是一种绿色消毒剂,可用于饮用水处理。制备高铁酸钠的离子方程式为
,则下列说法不正确的是
A. 在反应中 被还原,发生氧化反应
B. 氧化剂与还原剂的物质的量之比为3:2
C. 上述反应生成1mol高铁酸根离子,转移3mol电子
D. 高铁酸根离子具有强氧化性,溶于水能生成氢氧化铁胶体和氧气
【答案】A
【解析】
【详解】A.在反应中 化合价升高,发生氧化反应被氧化,A错误;
B.反应中 化合价升高做还原剂,次氯酸根离子做氧化剂,由方程式可知,氧化剂与还原剂的物质的
量之比为3:2,B正确;
C.上述反应铁化合价由+3变为+6,则生成1mol高铁酸根离子,转移3mol电子,C正确;
D.高铁酸根离子中铁元素处于高价态,具有强氧化性,溶于水能生成氢氧化铁胶体和氧气,D正确;
故选A。
13. 五种短周期主族元素X、Y、Z、M、Q的原子序数依次增大,X的2p轨道半充满,Y的s能级电子数
和p能级电子数相等, Z是至今发现的电负性最大的元素,M在元素周期表中处于周期序数等于族序数的
位置,Q的单质被广泛用作半导体材料。下列叙述中不正确的是
A. 元素的第一电离能:XX>Y
第7页/共18页
学科网(北京)股份有限公司D. 最高价氧化物对应的水化物的酸性:X>Q>M
【答案】A
【解析】
【分析】五种短周期主族元素X、Y、Z、M、Q的原子序数依次增大,X的2p轨道半充满,则X为N;Y
的s能级电子数和p能级电子数相等,Y原子核外电子排布式为1s22s22p4,则Y为O;Z是至今发现的电负
性最大的元素,则Z是F元素,M在元素周期表中处于周期序数等于族序数的位置,M为Al,Q的单质被
广泛用作半导体材料,Q为Si。
【详解】A.X、Y、Z为N、O、F,同周期元素第一电离能从左往右逐渐增大,N的2p轨道为半充满,
第一电离能大于O元素,则元素的第一电离能:YX>Y,C正确;
3 2
D.X、Q、M分别为N、Si、Al,最高价氧化物对应的水化物分别为HNO、HSiO、Al(OH),酸性:
3 2 3 3
X>Q>M,D正确;
故选A。
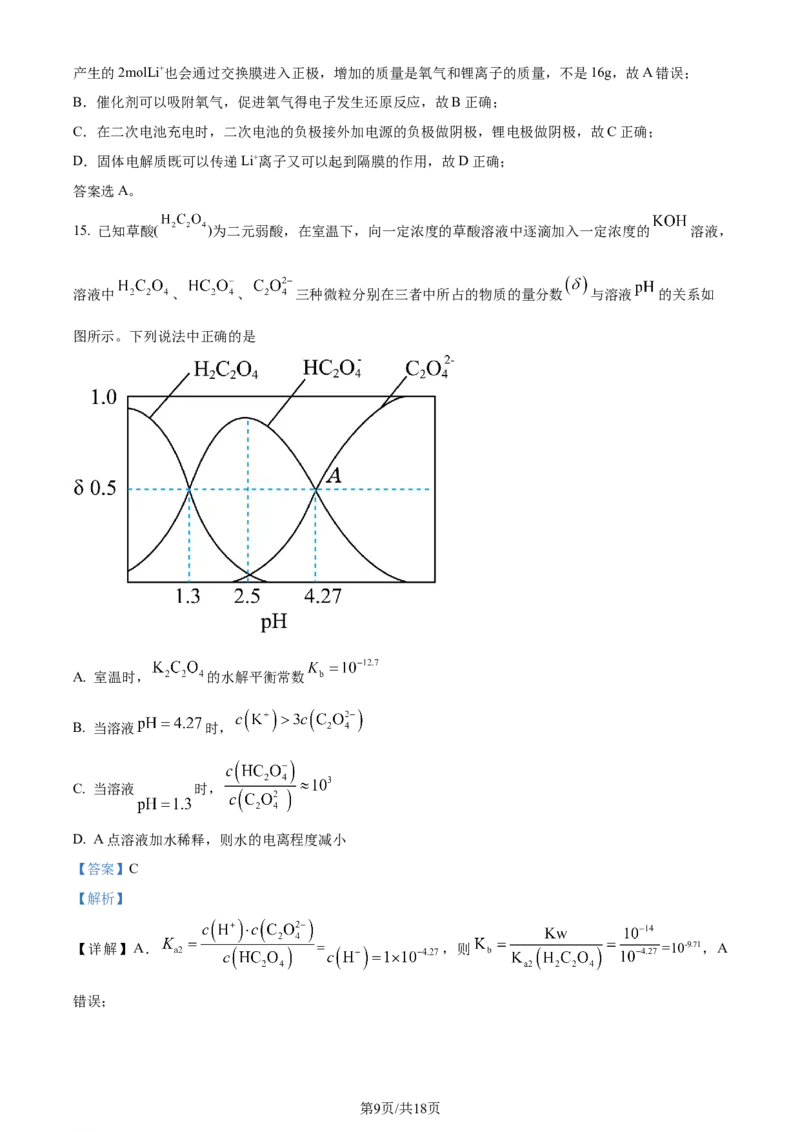
14. 一种新型的锂—空气二次电池的工作原理如图所示。下列说法中错误的是
A. 电路中有2mol电子通过时,水性电解液的质量增加16g
B. 催化剂可以吸附氧气,促进氧气得电子发生还原反应
C. 电池充电时,电子从电源负极流向锂电极,锂电极作阴极
D. 固体电解质既可以传递离子又可以起到隔膜的作用
【答案】A
【解析】
【分析】在锂—空气二次电池中,活泼金属锂是负极,通入氧气的一极为正极,负极锂失去电子形成Li+离
子进入溶液,并通过交换膜到达正极一边,正极上氧气得电子生成氢氧根离子,1molO 得到4mol电子。
2
【详解】A.电路中有2mol电子通过时,水性电解液正极一边有0.5molO16g进入水性电解液,同时负极
2
第8页/共18页
学科网(北京)股份有限公司产生的2molLi+也会通过交换膜进入正极,增加的质量是氧气和锂离子的质量,不是16g,故A错误;
B.催化剂可以吸附氧气,促进氧气得电子发生还原反应,故B正确;
C.在二次电池充电时,二次电池的负极接外加电源的负极做阴极,锂电极做阴极,故C正确;
D.固体电解质既可以传递Li+离子又可以起到隔膜的作用,故D正确;
答案选A。
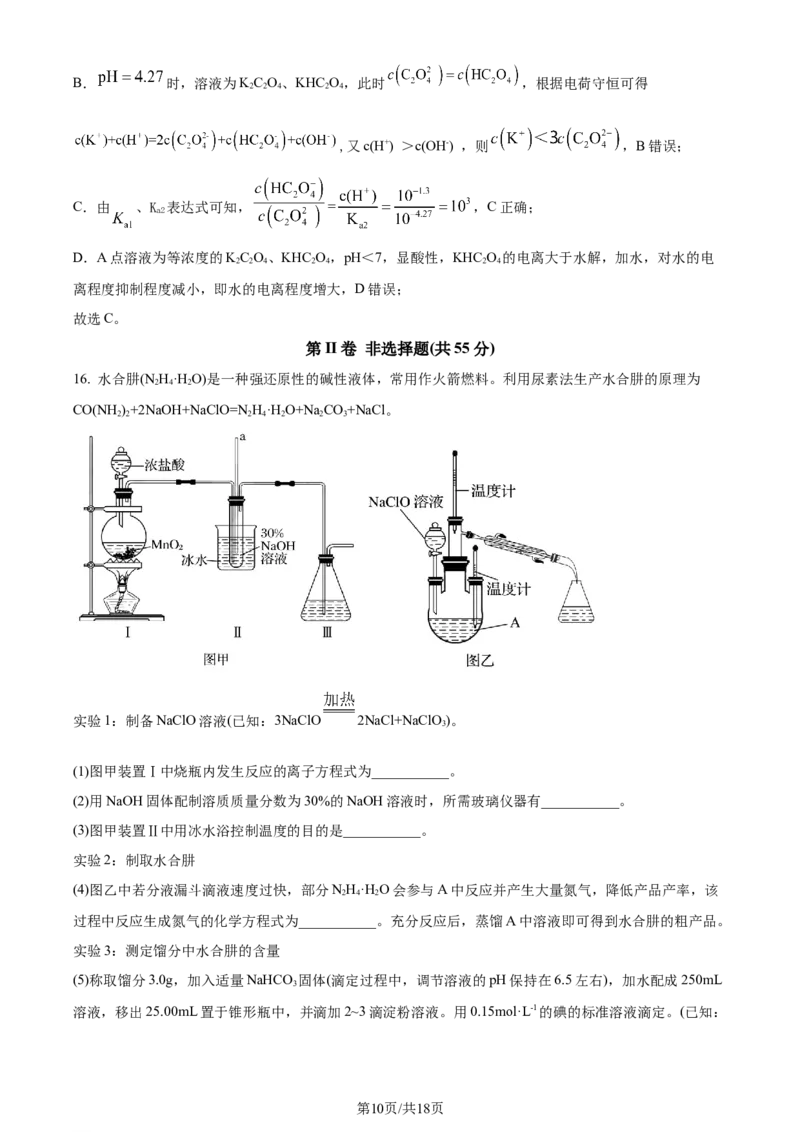
15. 已知草酸( )为二元弱酸,在室温下,向一定浓度的草酸溶液中逐滴加入一定浓度的 溶液,
溶液中 、 、 三种微粒分别在三者中所占的物质的量分数 与溶液 的关系如
图所示。下列说法中正确的是
A. 室温时, 的水解平衡常数
B. 当溶液 时,
C. 当溶液 时,
D. A点溶液加水稀释,则水的电离程度减小
【答案】C
【解析】
【详解】A. = ,则 =10-9.71,A
错误;
第9页/共18页
学科网(北京)股份有限公司B. 时,溶液为KC O、KHC O,此时 ,根据电荷守恒可得
2 2 4 2 4
,又c(H+) >c(OH-) ,则 ,B错误;
C.由 、K 表达式可知, = ,C正确;
a2
D.A点溶液为等浓度的KC O、KHC O,pH<7,显酸性,KHC O 的电离大于水解,加水,对水的电
2 2 4 2 4 2 4
离程度抑制程度减小,即水的电离程度增大,D错误;
故选C。
第II卷 非选择题(共55分)
16. 水合肼(N H·H O)是一种强还原性的碱性液体,常用作火箭燃料。利用尿素法生产水合肼的原理为
2 4 2
CO(NH)+2NaOH+NaClO=N H·H O+Na CO+NaCl。
2 2 2 4 2 2 3
实验1:制备NaClO溶液(已知:3NaClO 2NaCl+NaClO )。
3
(1)图甲装置Ⅰ中烧瓶内发生反应的离子方程式为___________。
(2)用NaOH固体配制溶质质量分数为30%的NaOH溶液时,所需玻璃仪器有___________。
(3)图甲装置Ⅱ中用冰水浴控制温度的目的是___________。
实验2:制取水合肼
(4)图乙中若分液漏斗滴液速度过快,部分NH·H O会参与A中反应并产生大量氮气,降低产品产率,该
2 4 2
过程中反应生成氮气的化学方程式为___________。充分反应后,蒸馏A中溶液即可得到水合肼的粗产品。
实验3:测定馏分中水合肼的含量
(5)称取馏分3.0g,加入适量NaHCO 固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成250mL
3
溶液,移出25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液。用0.15mol·L-1的碘的标准溶液滴定。(已知:
第10页/共18页
学科网(北京)股份有限公司NH·H O+2I =N ↑+4HI+H O)
2 4 2 2 2 2
①该实验滴定终点的判断:___________
②滴定操作中若不加入适量NaHCO 固体,则测量结果会___________(填“偏大”“偏小”“无影响”)。
3
③下列能导致馏分中水合肼的含量测定结果偏高的是___________(填字母)。
a.锥形瓶清洗干净后未干燥 b.滴定前,滴定管内无气泡,滴定后有气泡
c.读数时,滴定前平视,滴定后俯视 d.盛标准液的滴定管水洗后,直接装标准液
④实验测得消耗I 溶液的平均值为20.00mL,馏分中水合肼(N H·H O)的质量分数为___________。
2 2 4 2
【答案】 ①. MnO +4H++2Cl- Mn2++Cl↑+2H O ②. 量筒、烧杯、玻璃棒 ③. 防止NaClO
2 2 2
分解,影响水合肼的产率 ④. NH·H O+2NaClO=N ↑+3H O+2NaCl ⑤. 当滴入最后一滴碘的标准溶
2 4 2 2 2
液时,溶液由无色变为蓝色,且半分钟内不变 ⑥. 偏大 ⑦. d ⑧. 25%
【解析】
【分析】由图可知,装置I由二氧化锰和浓盐酸制备氯气;装置II由氯气和氢氧化钠溶液制备次氯酸钠;
装置III是尾气处理装置;图乙中的由CO(NH) 与NaOH、NaClO反应制备水合肼。实验1:制备NaClO
2 2
溶液(已知:3NaClO 2NaCl+NaClO )。
3
【详解】(1)图甲装置Ⅰ中烧瓶内发生反应的离子方程式为MnO +4H++2Cl- Mn2++Cl↑+2H O。
2 2 2
(2)用NaOH固体配制溶质质量分数为30%的NaOH溶液时,所需玻璃仪器有量筒、烧杯、玻璃棒。
(3)由题中信息(已知:3NaClO 2NaCl+NaClO )可知,图甲装置Ⅱ中用冰水浴控制温度的目的是
3
防止NaClO分解,影响水合肼的产率。
实验2:制取水合肼
(4)图乙中若分液漏斗滴液速度过快,部分NH·H O会参与A 中反应并产生大量氮气,降低产品产率,该
2 4 2
过程中反应生成氮气的化学方程式为NH·H O+2NaClO=N ↑+3H O+2NaCl。充分反应后,蒸馏A中溶液即
2 4 2 2 2
可得到水合肼的粗产品。
实验3:测定馏分中水合肼的含量
(5)称取馏分3.0g,加入适量NaHCO 固体(滴定过程中,调节溶液的pH 保持在6.5 左右),加水配成
3
250mL溶液,移出25.00mL置于锥形瓶中,并滴加2~3 滴淀粉溶液。用0.15mol·L-1的碘的标准溶液滴定。
(已知:NH·H O+2I =N ↑+4HI+H O)。
2 4 2 2 2 2
①该实验滴定终点的判断:当滴入最后一滴碘的标准溶液时,溶液由无色变为蓝色,且半分钟内不变。
第11页/共18页
学科网(北京)股份有限公司②水合肼(N H·H O)是一种强还原性的碱性液体,滴定操作中若不加入适量NaHCO 固体控制溶液的pH,
2 4 2 3
则碘会在碱性条件下发生歧化反应而消耗较多的碘,所以测量结果会偏大。
③下列实验操作:a.锥形瓶清洗干净后未干燥,不影响测定结果;b.滴定前,滴定管内无气泡,滴定后有
气泡,则标准液的体积读数偏小;c.读数时,滴定前平视,滴定后俯视,则标准液的体积读数偏小;d.盛
标准液的滴定管水洗后,直接装标准液,则标准液会被残留的水稀释,从而消耗标准液的体积偏大。综上
所述,能导致馏分中水合肼的含量测定结果偏高的是d。
④实验测得消耗I 溶液的平均值为20.00mL,由反应的化学方程式NH•H O+2I =N ↑+4HI+H O可知,
2 2 4 2 2 2 2
n(N H•H O)= n(I)= =0.0015mol,馏分中水合肼(N H·H O)的质量分数为
2 4 2 2 2 4 2
25%。
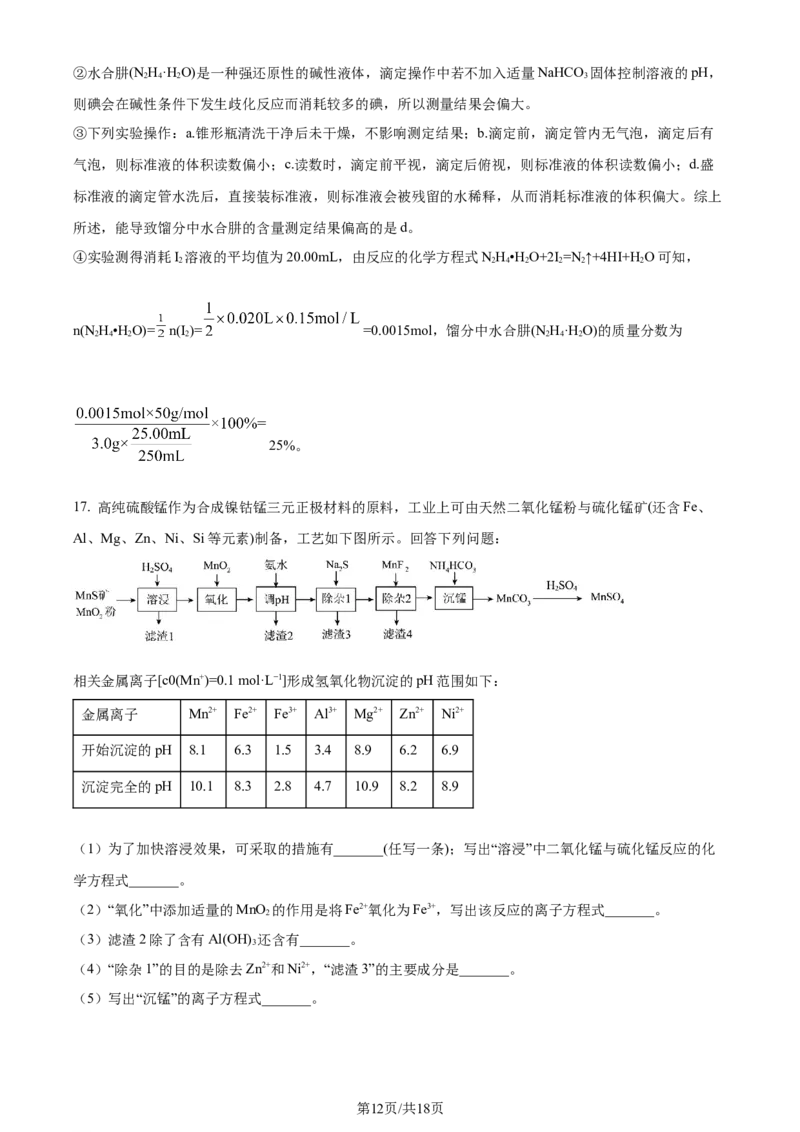
17. 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、
Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
金属离子 Mn2+ Fe2+ Fe3+ Al3+ Mg2+ Zn2+ Ni2+
开始沉淀的pH 8.1 6.3 1.5 3.4 8.9 6.2 6.9
沉淀完全的pH 10.1 8.3 2.8 4.7 10.9 8.2 8.9
(1)为了加快溶浸效果,可采取的措施有_______(任写一条);写出“溶浸”中二氧化锰与硫化锰反应的化
学方程式_______。
(2)“氧化”中添加适量的MnO 的作用是将Fe2+氧化为Fe3+,写出该反应的离子方程式_______。
2
(3)滤渣2除了含有Al(OH) 还含有_______。
3
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是_______。
(5)写出“沉锰”的离子方程式_______。
第12页/共18页
学科网(北京)股份有限公司(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNiCo MnO,其中Ni、Co、Mn的
x y z 2
化合价分别为+2、+3、+4。当x=y= 时,z=_______。
【 答 案 】 ( 1 ) ① . 将 矿 物 碾 碎 、 加 热 、 增 大 硫 酸 的 浓 度 等 ② .
MnO +MnS+2H SO =2MnSO +S+2H O
2 2 4 4 2
(2)MnO +2Fe2++4H+=2Fe3++ Mn2+ +2H O
2 2
(3)Fe(OH) (4)NiS和ZnS
3
(5)Mn2++2 =MnCO↓+CO ↑+H O
3 2 2
(6)
【解析】
【分析】溶浸:加硫酸溶浸,根据问题(1)可知,发生MnO +MnS+2H SO =S+2MnSO +2H O,含硅元素物
2 2 4 4 2
质,如果是二氧化硅,二氧化硅不与稀硫酸反应,作为沉淀沉降出来,如果是硅酸盐,则转化成硅酸沉淀,
其余元素转化成相应的离子;
的
氧化:利用MnO 氧化性将Fe2+氧化成Fe3+;
2
调pH:加入氨水,调节pH,让Al3+、Fe3+以氢氧化物形式沉淀出来;
除杂1:加入NaS,根据问题(4)可知,该目的是除去Zn2+、Ni2+;
2
除杂2:加入MnF ,该步骤是除去Mg2+;
2
沉锰:加入碳酸氢铵,得到MnCO 沉淀;
3
据此分析解答。
【小问1详解】
为了加快溶浸效果,可采取的措施有粉碎、搅拌、适当升高温度、适当提高硫酸浓度等;利用二氧化锰的
氧化性将MnS氧化成S单质,其反应方程式为MnO +MnS+2H SO =S+2MnSO +2H O;故答案为粉碎、搅
2 2 4 4 2
拌、适当升高温度、适当提高硫酸浓度等;MnO +MnS+2H SO =S+2MnSO +2H O;
2 2 4 4 2
【小问2详解】
利用MnO 的氧化性将Fe2+氧化成Fe3+,其离子方程式为MnO +2Fe2++4H+=2Fe3++Mn2++2H O;故答案为
2 2 2
MnO +2Fe2++4H+=2Fe3++Mn2++2H O;
2 2
【小问3详解】
根据流程以及表中数据可知,调pH,使Al3+、Fe3+以氢氧化物形式沉淀出来,滤渣2成分是Al(OH) 、
3
第13页/共18页
学科网(北京)股份有限公司Fe(OH) ,故答案为Fe(OH) ;
3 3
【小问4详解】
除杂1的目的是Zn2+、Ni2+,则滤渣3的主要成分是NiS、ZnS,故答案为NiS、ZnS;
【小问5详解】
加入碳酸氢铵,生成碳酸锰沉淀,其离子方程式为Mn2++2 =MnCO↓+CO ↑+H O;故答案为Mn2++2
3 2 2
=MnCO↓+CO ↑+H O;
3 2 2
【小问6详解】
利用化合价代数和 为0,得出1+2x+3y+4z=4,将x=y= 代入,推出z= ;故答案为 。
18. NO 是形成雾霾天气的主要原因之一,以NO 为主的污染综合治理是当前重要的研究课题。
x x
(1)通常可采用氢气进行催化还原,消除NO造成的污染。
已知:①N(g)+O(g)=2NO(g) H=akJ·mol-1;
2 2
②2H
2
(g)+O
2
(g)=2H
2
O(1) H=b△kJ·mol-1;
③H
2
O(g)=H
2
O(1) H=ck△J·mol-1。
则催化还原反应2H△2 (g)+2NO(g)=2H
2
O(g)+N
2
(g) ΔH=____。
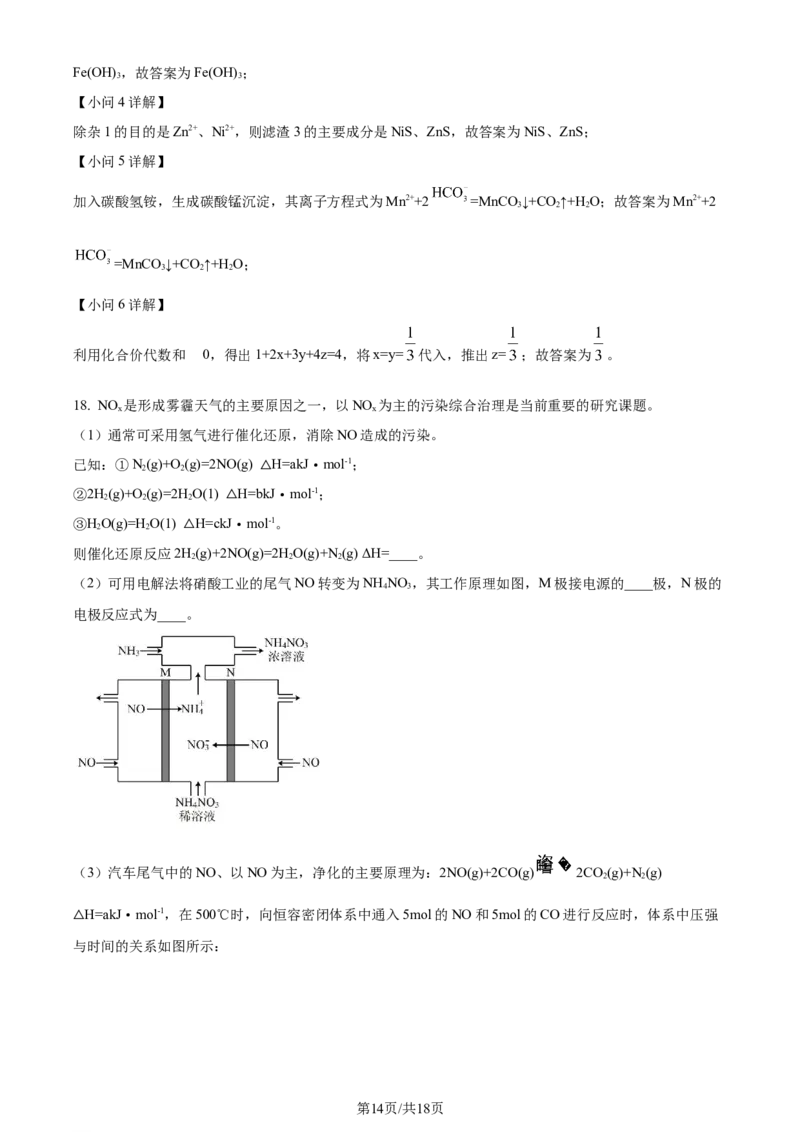
(2)可用电解法将硝酸工业的尾气NO转变为NH NO ,其工作原理如图,M极接电源的____极,N极的
4 3
电极反应式为____。
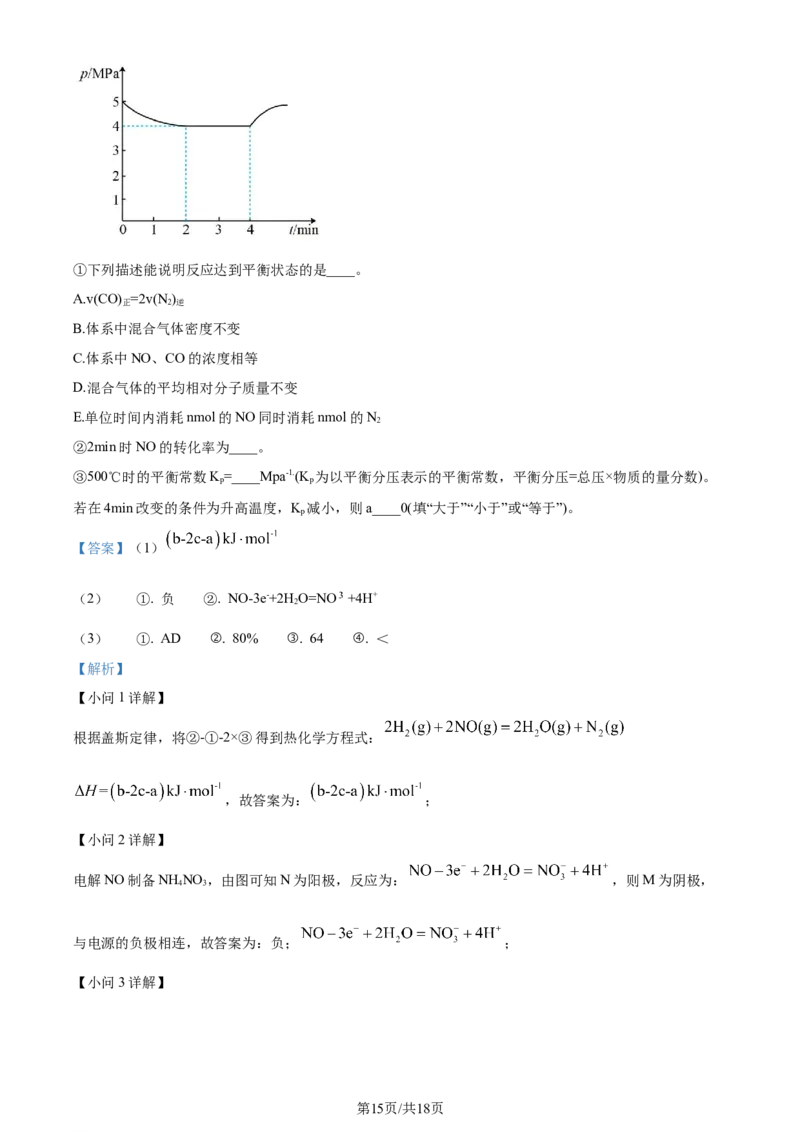
(3)汽车尾气中的NO、以NO为主,净化的主要原理为:2NO(g)+2CO(g) 2CO(g)+N(g)
2 2
H=akJ·mol-1,在500℃时,向恒容密闭体系中通入5mol的NO和5mol的CO进行反应时,体系中压强
△与时间的关系如图所示:
第14页/共18页
学科网(北京)股份有限公司①下列描述能说明反应达到平衡状态的是____。
A.v(CO) =2v(N )
正 2 逆
B.体系中混合气体密度不变
C.体系中NO、CO的浓度相等
D.混合气体的平均相对分子质量不变
E.单位时间内消耗nmol的NO同时消耗nmol的N
2
②2min时NO的转化率为____。
③500℃时的平衡常数K=____Mpa-1.(K 为以平衡分压表示的平衡常数,平衡分压=总压×物质的量分数)。
p p
若在4min改变的条件为升高温度,K 减小,则a____0(填“大于”“小于”或“等于”)。
p
【答案】(1)
(2) ①. 负 ②. NO-3e-+2H O=NO +4H+
2
(3) ①. AD ②. 80% ③. 64 ④. <
【解析】
【小问1详解】
根据盖斯定律,将②-①-2×③得到热化学方程式:
,故答案为: ;
【小问2详解】
电解NO制备NH NO ,由图可知N为阳极,反应为: ,则M为阴极,
4 3
与电源的负极相连,故答案为:负; ;
【小问3详解】
第15页/共18页
学科网(北京)股份有限公司①A.由反应可知,当 ,说明反应达到平衡,A项正确;
B.体积不变,反应体系都是气体,混合气体的质量始终不变,从反应开始到平衡,密度始终不变,体系
中混合气体密度不变不能说明反应达到平衡,B项错误;
C.体系中NO、CO的浓度相等,不能说明正逆反应速率相等,不能说明反应达到平衡,C项错误;
D.气体总质量不变,混合气体的平均相对分子质量不再改变,说明各物质的物质的量不变,达平衡状态,
D项正确;
E.单位时间内消耗n mol的NO 同时消耗 n mol的N,正逆反应速率不相等,说明反应没有达到平衡,E
2
项错误;
故答案为:AD;
②向体积不变的密闭体系中通入5 mol的NO 和5 mol的CO进行反应时存在:
2min时,总压是4Mpa,0min时,总压是5Mpa,则 = ,解得x=4,NO的转化
率为 =80%,故答案为:80%;
③由②可知,平衡时分压p(NO)= Mpa=0.5Mpa,p(CO)= Mpa=0.5Mpa,p(CO)=
2
Mpa=2Mpa,p(N )= Mpa=1Mpa,K = = =64;4 min时升高温度,K 减小,
2 p p
说明升高温度平衡逆向移动,则该反应是放热反应,△H= akJ/mol<0,故答案为:64;小于。
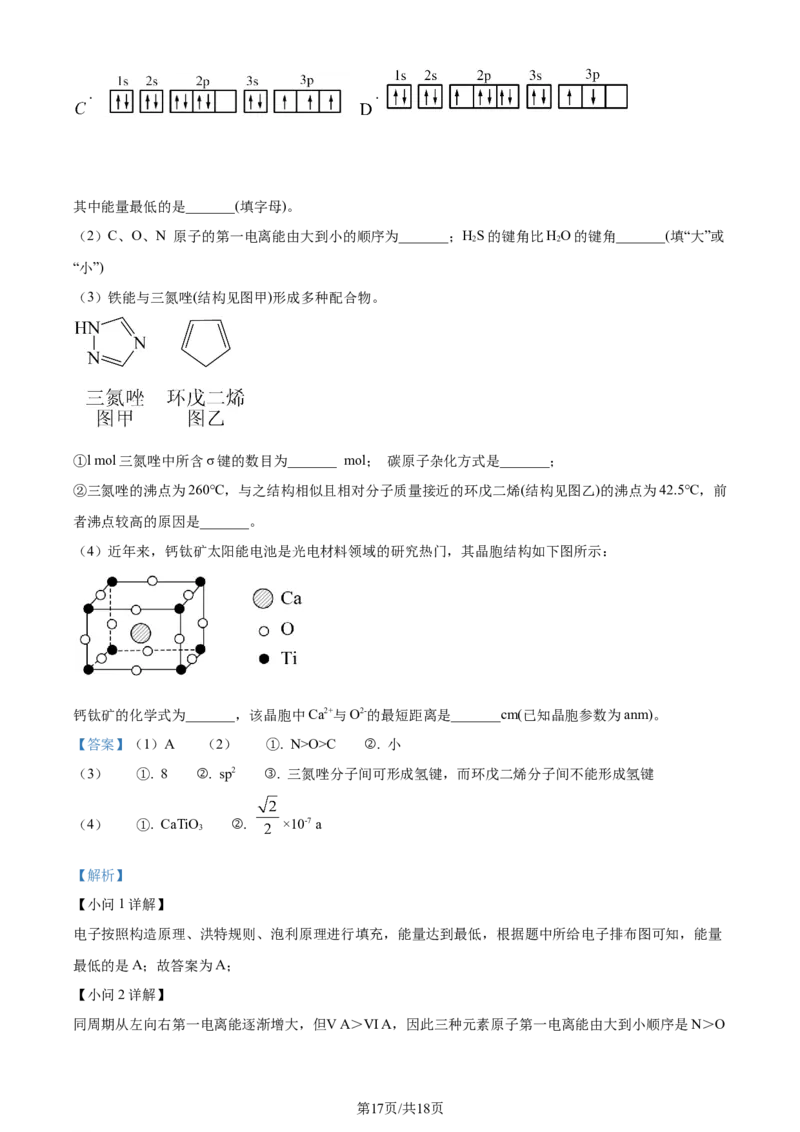
19. 由H、C、O、N、S、Al、Fe、Ti等元素能形成多种物质。这些物质有许多用途。请回答下列问题:
(1)某同学写出了铝原子的4种不同状态的电子排布图:
. .
第16页/共18页
学科网(北京)股份有限公司. .
其中能量最低的是_______(填字母)。
(2)C、O、N 原子的第一电离能由大到小的顺序为_______;HS的键角比HO的键角_______(填“大”或
2 2
“小”)
(3)铁能与三氮唑(结构见图甲)形成多种配合物。
①l mol三氮唑中所含σ键的数目为_______ mol; 碳原子杂化方式是_______;
②三氮唑的沸点为260℃,与之结构相似且相对分子质量接近的环戊二烯(结构见图乙)的沸点为42.5℃,前
者沸点较高的原因是_______。
(4)近年来,钙钛矿太阳能电池是光电材料领域的研究热门,其晶胞结构如下图所示:
钙钛矿的化学式为_______,该晶胞中Ca2+与O2-的最短距离是_______cm(已知晶胞参数为anm)。
【答案】(1)A (2) ①. N>O>C ②. 小
(3) ①. 8 ②. sp2 ③. 三氮唑分子间可形成氢键,而环戊二烯分子间不能形成氢键
(4) ①. CaTiO ②. ×10-7 a
3
【解析】
【小问1详解】
电子按照构造原理、洪特规则、泡利原理进行填充,能量达到最低,根据题中所给电子排布图可知,能量
最低的是A;故答案为A;
【小问2详解】
同周期从左向右第一电离能逐渐增大,但ⅤA>ⅥA,因此三种元素原子第一电离能由大到小顺序是N>O
第17页/共18页
学科网(北京)股份有限公司>A;HS、HO中S、O价层电子对数均为4,有2个孤电子对,氧元素电负性比S大,且氧原子半径小
2 2
于S,因此HO中成键电子对之间的斥力大,键角大,故答案为N>O>A;小;
2
【小问3详解】
①根据三氮唑结构简式,1个三氮唑所含σ键数目为8,因此1mol三氮唑所含σ键物质的量为8mol,碳原
子有3个σ键数,无孤电子对,杂化类型为sp2,故答案为8;sp2;
②三氮唑中含有N原子,三氮唑分子间能形成分子间氢键,熔沸点高;故答案为三氮唑分子间可形成氢键,
而环戊二烯分子间不能形成氢键;
【小问4详解】
Ca位于晶胞体内,个数为1,O位于棱上,个数为 =3,Ti位于顶点,个数为 =1,化学式为
CaTiO ,根据图像可知,Ca2+、O2-最短距离是面对角线的 ,即距离为 ×10-7 acm;故答案为CaTiO ;
3 3
×10-7 a。
第18页/共18页
学科网(北京)股份有限公司