文档内容
2024-2025 学年度上期高 2025 届半期考试
化学试卷
考试时间:75分钟 满分:100分
可能用到的相对原子质量:H 1 C 12 N 14 O 16
一、选择题(本题共14小题,每小题3分,共42分。每小题只有一个选项符合题意)
1.巴蜀文化是中华灿烂文明的重要组成部分。下列对文物或物品的主要化学成分描述错误的是
文物
或
物品
乐山大佛 三星堆青铜立人像 自贡井盐 唐代蜀锦
选项 A.硅酸盐、二氧化硅 B.纯铜 C.氯化钠 D.蛋白质
2.下列化学用语或图示表达不正确的是
A.羟基的电子式为
B.硼酸(H BO )分子的结构简式为
3 3
C.用电子云轮廓图表示sp3杂化过程为
D.氚的原子结构模型为
3.化学与生活息息相关,下列物质的性质与用途对应关系错误的是
选项 物质 性质 用途
A 活性炭 吸附性 分解室内甲醛
B 维生素C 还原性 补铁时做抗氧化剂
C ClO 强氧化性 自来水消毒剂
2
D 聚乳酸 生物可降解性 制作一次性餐具
4.一种制备钴配合物[Co(NH ) ]Cl 的反应原理为:2CoCl +2NH Cl+10NH +H O 2[Co(NH ) ]Cl +2H O,
3 6 3 2 4 3 2 2 3 6 3 2
设N 为阿伏伽德罗常数的值。下列说法错误的是
A
A.消耗标准状况下11.2 L NH 时,反应中转移电子数为0.1 N
3 A
B.氧化剂与还原剂的物质的量之比为1:2
C.N、O原子反应前后杂化方式相同
D.1 mol [Co(NH ) ]Cl 含有σ键的数目为18 N
3 6 3 A
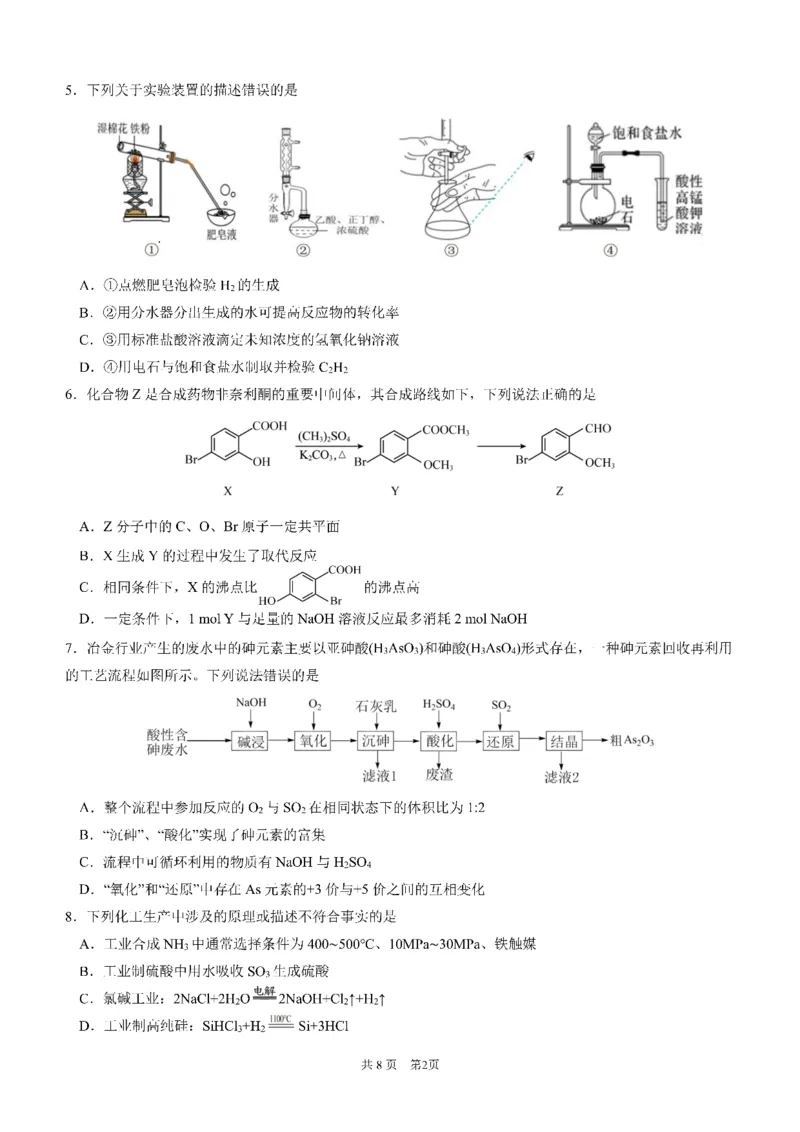
共8页 第1页9.β-月桂烯与O 的加成反应的部分机理和反应势能变化如图所示。下列说法错误的是
3
A.β-月桂烯的核磁共振氢谱有7组峰
B.POZ-Anti比POZ-Syn更稳定
C.升高温度,
𝑐(POZ−Syn)
减小
𝑐(POZ−Anti)
D.β-月桂烯与O 经历两种历程得到 释放的能量相同
3
10.下列实验操作、现象和结论中存在错误的是
选项 实验操作 现象 结论
分别向等浓度、等体积的KCl溶液
KCl 溶液中无白色沉淀,
A 和 KI 溶液中滴加 2 滴相同的银氨 相同温度下Ksp(AgCl)>Ksp(AgI)
KI溶液中有黄色沉淀
溶液,充分振荡后静置
在试管中加入2 mL 0.5 mol/L CuCl [Cu(H O) ]2+(蓝色) + 4Cl-
2 2 4
B 溶液变为绿色
溶液,用酒精灯加热 [CuCl ]2-(黄色)+4H O ΔH>0
4 2
取少量NH HSO 样品溶于水,加入
4 3
C 产生白色沉淀 原样品已经完全变质
盐酸酸化,再加入BaCl 溶液
2
向 2 mL 10% NaOH 溶液中加入 5
D 滴 5% CuSO 溶液,振荡后滴加 2 产生砖红色沉淀 葡萄糖为还原性糖
4
mL 10%葡萄糖溶液,加热
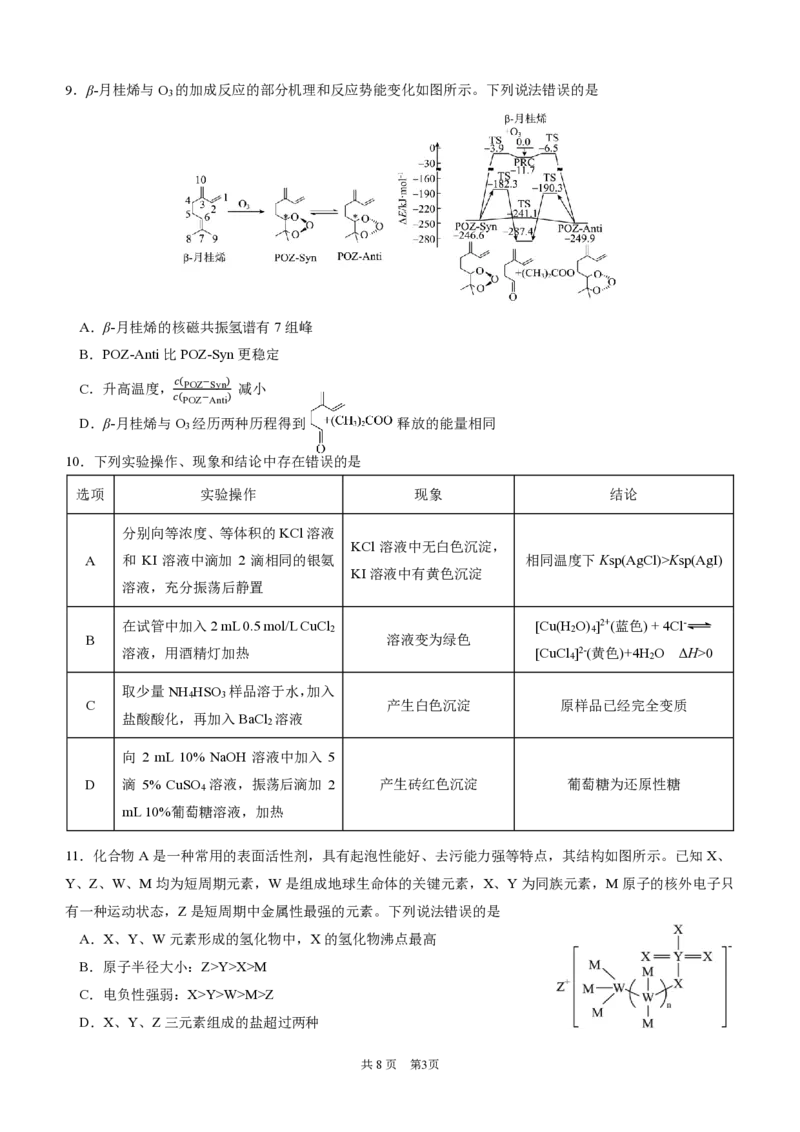
11.化合物A是一种常用的表面活性剂,具有起泡性能好、去污能力强等特点,其结构如图所示。已知X、
Y、Z、W、M均为短周期元素,W是组成地球生命体的关键元素,X、Y为同族元素,M原子的核外电子只
有一种运动状态,Z是短周期中金属性最强的元素。下列说法错误的是
A.X、Y、W元素形成的氢化物中,X的氢化物沸点最高
B.原子半径大小:Z>Y>X>M
C.电负性强弱:X>Y>W>M>Z
D.X、Y、Z三元素组成的盐超过两种
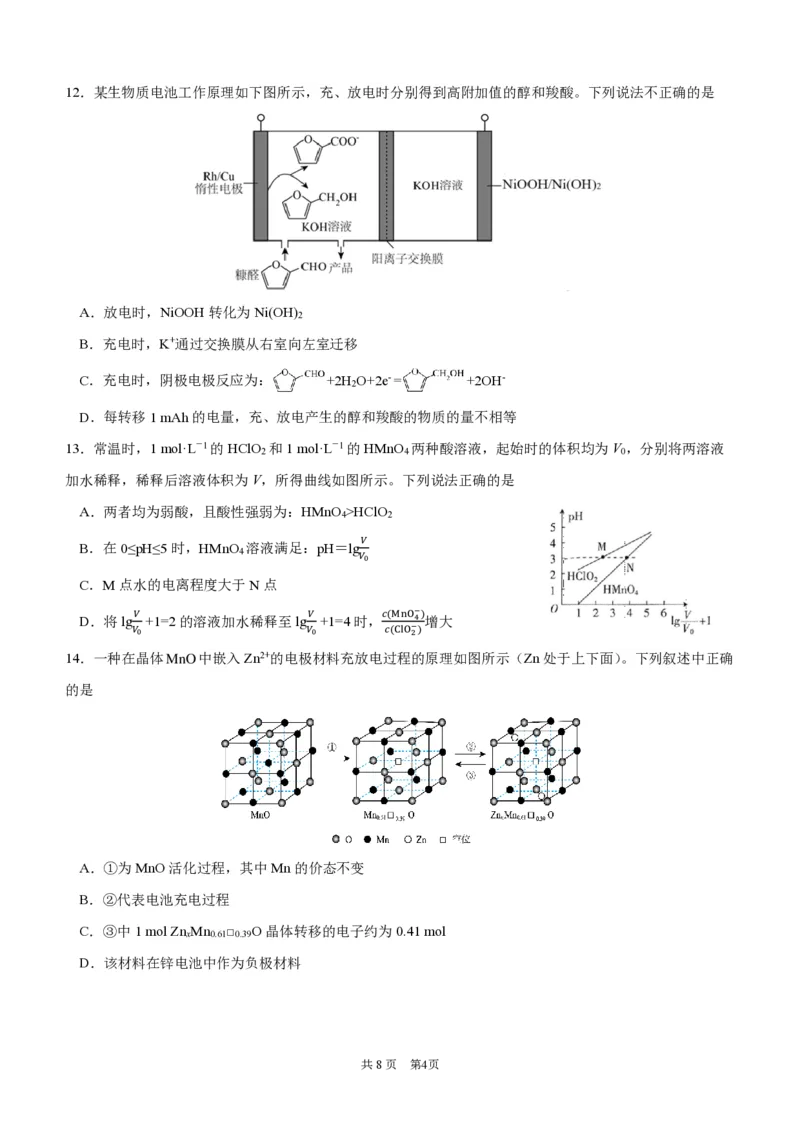
共8页 第3页12.某生物质电池工作原理如下图所示,充、放电时分别得到高附加值的醇和羧酸。下列说法不正确的是
A.放电时,NiOOH转化为Ni(OH)
2
B.充电时,K+通过交换膜从右室向左室迁移
C.充电时,阴极电极反应为: +2H O+2e- = +2OH-
2
D.每转移1 mAh的电量,充、放电产生的醇和羧酸的物质的量不相等
13.常温时,1 mol·L-1的HClO 和1 mol·L-1的HMnO 两种酸溶液,起始时的体积均为V ,分别将两溶液
2 4 0
加水稀释,稀释后溶液体积为V,所得曲线如图所示。下列说法正确的是
A.两者均为弱酸,且酸性强弱为:HMnO >HClO
4 2
𝑉
B.在0≤pH≤5时,HMnO 溶液满足:pH=lg
4
𝑉0
C.M点水的电离程度大于N点
𝑉 𝑉 𝑐(MnO−)
D.将lg +1=2的溶液加水稀释至lg +1=4时, 4 增大
𝑉0 𝑉0 𝑐(ClO
2
−)
14.一种在晶体
共8页 第4页
M n O 中嵌入Zn2+的电极材料充放电过程的原理如图所示(Zn处于上下面)。下列叙述中正确
的是
A.①为MnO活化过程,其中Mn的价态不变
B.②代表电池充电过程
C.③中1 mol Zn Mn □ O晶体转移的电子约为0.41 mol
x 0.61 0.39
D.该材料在锌电池中作为负极材料二、非选择题(本题共4小题,共58分)
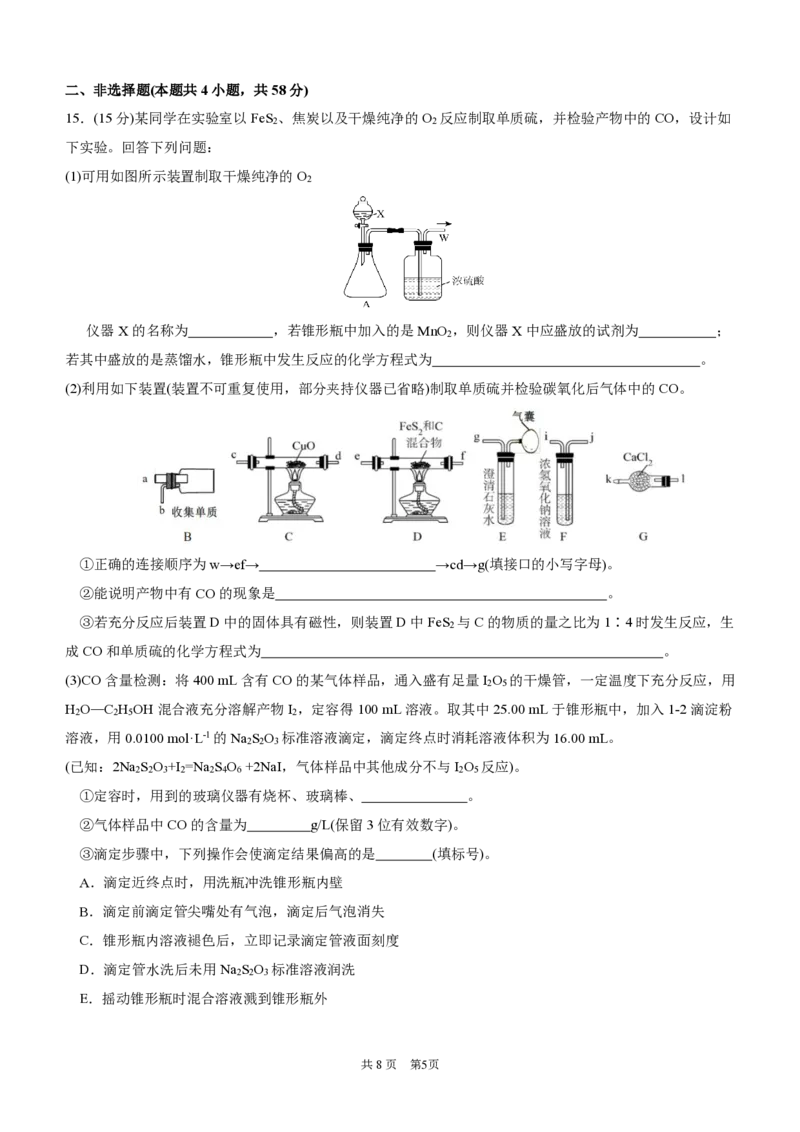
15.(15分)某同学在实验室以FeS 、焦炭以及干燥纯净的O 反应制取单质硫,并检验产物中的CO,设计如
2 2
下实验。回答下列问题:
(1)可用如图所示装置制取干燥纯净的O
2
仪器X的名称为 ,若锥形瓶中加入的是MnO ,则仪器X中应盛放的试剂为 ;
2
若其中盛放的是蒸馏水,锥形瓶中发生反应的化学方程式为 。
(2)利用如下装置(装置不可重复使用,部分夹持仪器已省略)制取单质硫并检验碳氧化后气体中的CO。
①正确的连接顺序为w→ef→ →cd→g(填接口的小写字母)。
②能说明产物中有CO的现象是 。
③若充分反应后装置D中的固体具有磁性,则装置D中FeS 与C的物质的量之比为1∶4时发生反应,生
2
成CO和单质硫的化学方程式为 。
(3)CO含量检测:将400 mL含有CO的某气体样品,通入盛有足量I O 的干燥管,一定温度下充分反应,用
2 5
H O—C H OH混合液充分溶解产物I ,定容得100 mL溶液。取其中25.00 mL于锥形瓶中,加入1-2滴淀粉
2 2 5 2
溶液,用0.0100 mol·L-1的Na S O 标准溶液滴定,滴定终点时消耗溶液体积为16.00 mL。
2 2 3
(已知:2Na S O +I =Na S O +2NaI,气体样品中其他成分不与I O 反应)。
2 2 3 2 2 4 6 2 5
①定容时,用到的玻璃仪器有烧杯、玻璃棒、 。
②气体样品中CO的含量为 g/L(保留3位有效数字)。
③滴定步骤中,下列操作会使滴定结果偏高的是 (填标号)。
A.滴定近终点时,用洗瓶冲洗锥形瓶内壁
B.滴定前滴定管尖嘴处有气泡,滴定后气泡消失
C.锥形瓶内溶液褪色后,立即记录滴定管液面刻度
D.滴定管水洗后未用Na S O 标准溶液润洗
2 2 3
E.摇动锥形瓶时混合溶液溅到锥形瓶外
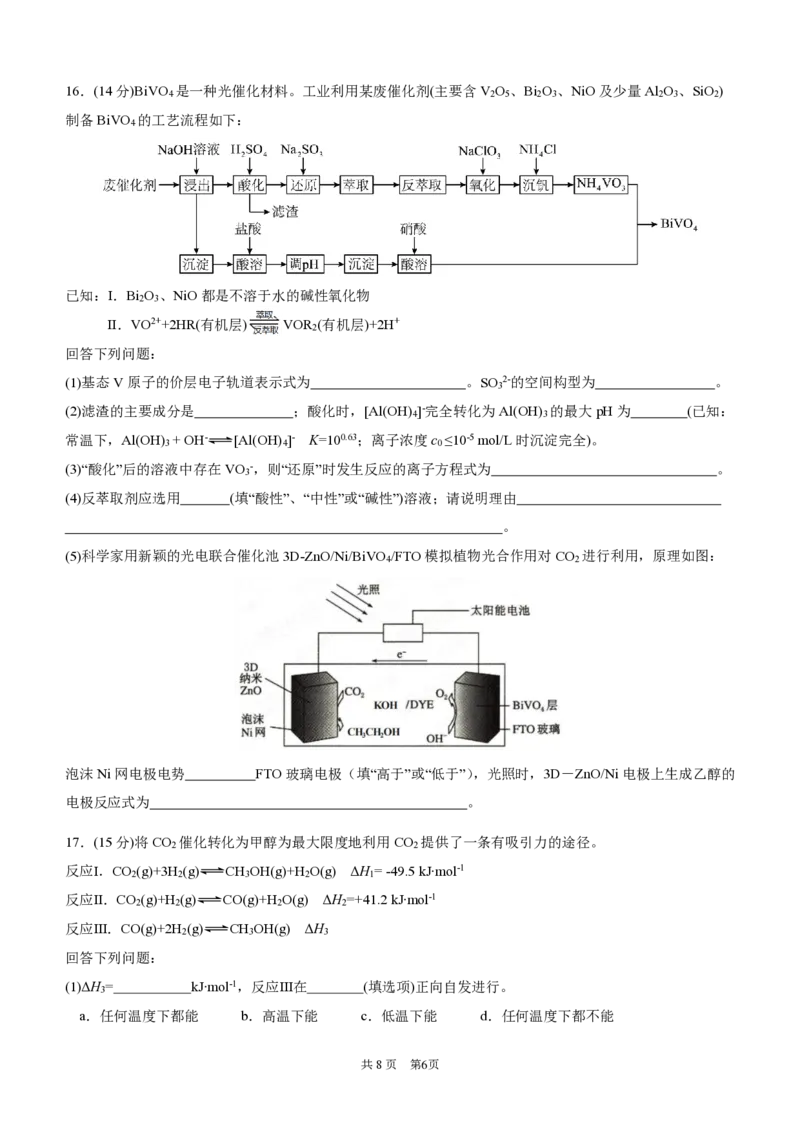
共8页 第5页16.(14分)BiVO 是一种光催化材料。工业利用某废催化剂(主要含V O 、Bi O 、NiO及少量Al O 、SiO )
4 2 5 2 3 2 3 2
制备BiVO 的工艺流程如下:
4
已知:Ⅰ.Bi O 、NiO都是不溶于水的碱性氧化物
2 3
Ⅱ.VO2++2HR(有机层) VOR (有机层)+2H+
2
回答下列问题:
(1)基态V原子的价层电子轨道表示式为 。SO 2-的空间构型为 。
3
(2)滤渣的主要成分是 ;酸化时,[Al(OH) ]-完全转化为Al(OH) 的最大pH为 (已知:
4 3
常温下,Al(OH) + OH- [Al(OH) ]- K=100.63;离子浓度c ≤10-5 mol/L时沉淀完全)。
3 4 0
(3)“酸化”后的溶液中存在VO -,则“还原”时发生反应的离子方程式为 。
3
(4)反萃取剂应选用 (填“酸性”、“中性”或“碱性”)溶液;请说明理由
。
(5)科学家用新颖的光电联合催化池3D-ZnO/Ni/BiVO /FTO模拟植物光合作用对CO 进行利用,原理如图:
4 2
泡沫Ni网电极电势 FTO玻璃电极(填“高于”或“低于”),光照时,3D-ZnO/Ni电极上生成乙醇的
电极反应式为 。
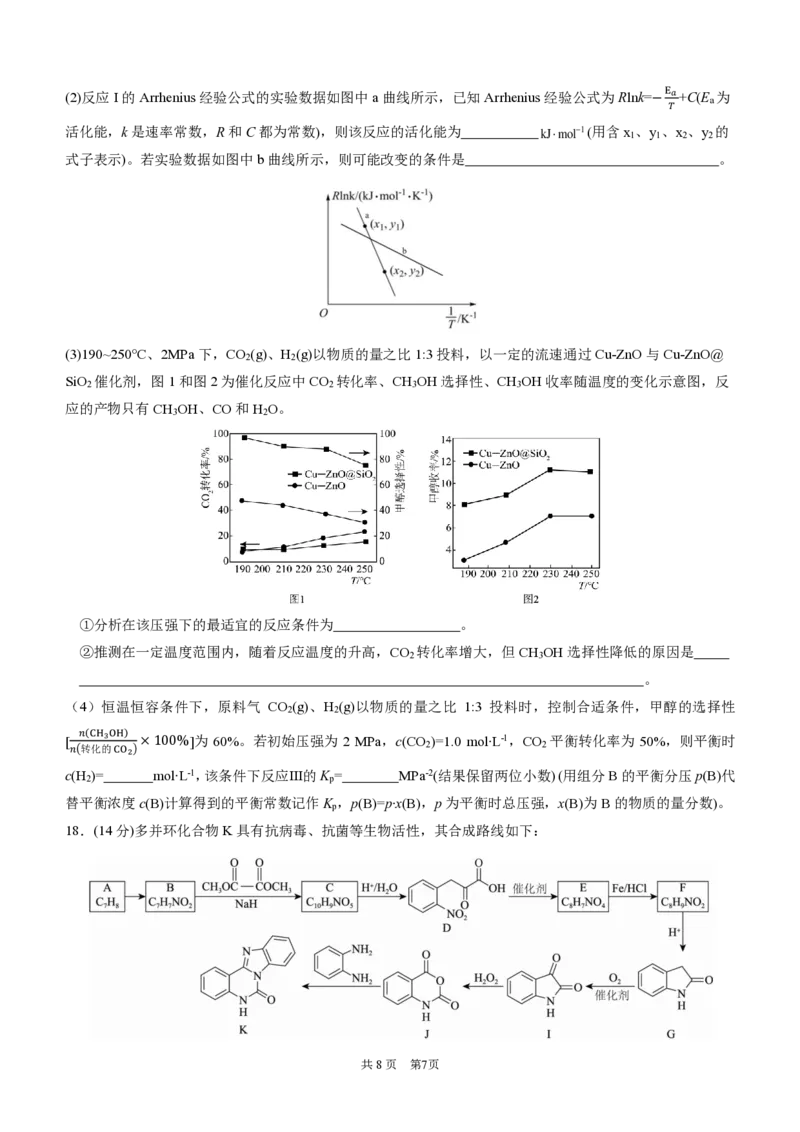
17.(15分)将CO 催化转化为甲醇为最大限度地利用CO 提供了一条有吸引力的途径。
2 2
反应Ⅰ.CO (g)+3H (g) CH OH(g)+H O(g) ΔH = -49.5 kJ∙mol-1
2 2 3 2 1
反应Ⅱ.CO (g)+H (g) CO(g)+H O(g) ΔH =+41.2 kJ∙mol-1
2 2 2 2
反应Ⅲ.CO(g)+2H (g) CH OH(g) ΔH
2 3 3
回答下列问题:
(1)ΔH = kJ∙mol-1,反应Ⅲ在 (填选项)正向自发进行。
3
a.任何温度下都能 b.高温下能 c.低温下能 d.任何温度下都不能
共8页 第6页(2)反应I的Arrhenius经验公式的实验数据如图中a曲线所示,已知Arrhenius经验公式为Rlnk=−
E𝑎
+C(E 为
a
𝑇
活化能,k是速率常数,R和C都为常数),则该反应的活化能为
共8页 第7页
k J m o −l 1 (用含x 、y 、x 、y 的 1 1 2 2
式子表示)。若实验数据如图中b曲线所示,则可能改变的条件是 。
(3)190~250°C、2MPa下,CO (g)、H (g)以物质的量之比1:3投料,以一定的流速通过Cu-ZnO与Cu-ZnO@
2 2
SiO 催化剂,图1和图2为催化反应中CO 转化率、CH OH选择性、CH OH收率随温度的变化示意图,反
2 2 3 3
应的产物只有CH OH、CO和H O。
3 2
①分析在该压强下的最适宜的反应条件为 。
②推测在一定温度范围内,随着反应温度的升高,CO 转化率增大,但CH OH选择性降低的原因是
2 3
。
(4)恒温恒容条件下,原料气 CO (g)、H (g)以物质的量之比 1:3 投料时,控制合适条件,甲醇的选择性
2 2
[
𝑛(CH3OH)
×100%]为 60%。若初始压强为 2 MPa,c(CO )=1.0 mol∙L-1,CO 平衡转化率为 50%,则平衡时
𝑛(转化的CO2) 2 2
c(H )= mol∙L-1,该条件下反应Ⅲ的K = MPa-2(结果保留两位小数) (用组分B的平衡分压p(B)代
2 p
替平衡浓度c(B)计算得到的平衡常数记作K ,p(B)=p∙x(B),p为平衡时总压强,x(B)为B的物质的量分数)。
p
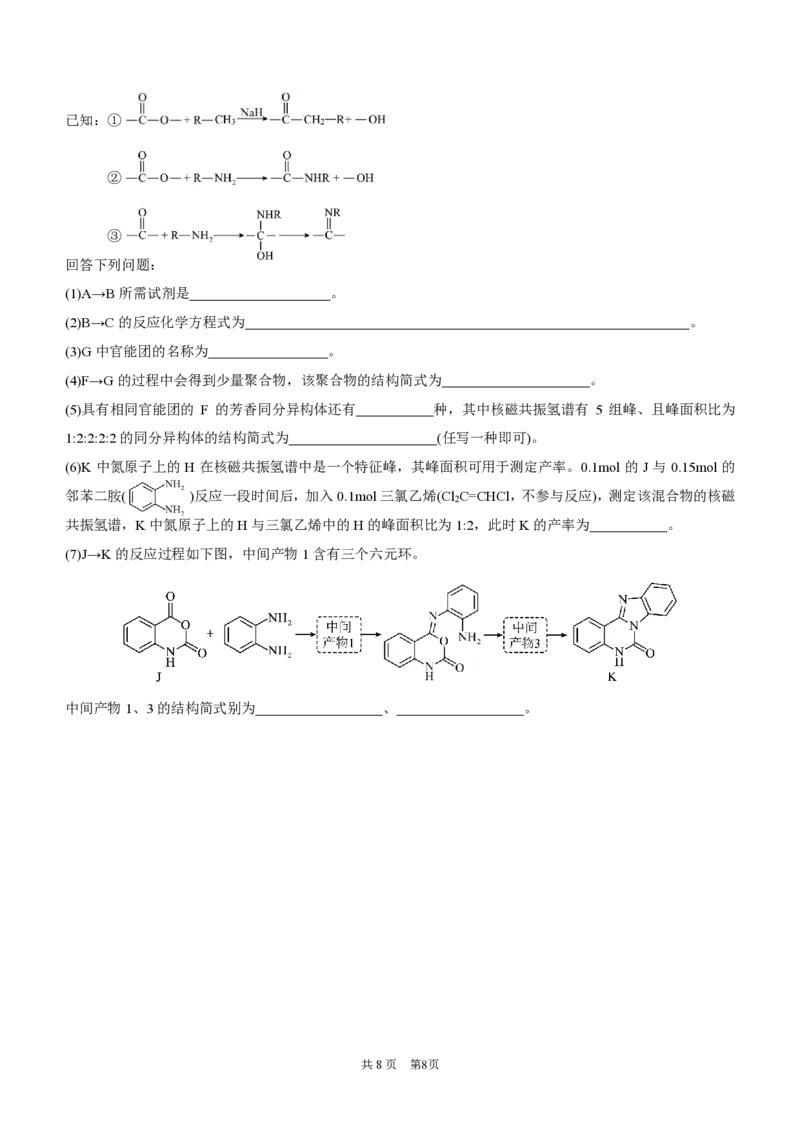
18.(14分)多并环化合物K具有抗病毒、抗菌等生物活性,其合成路线如下:已知:①
②
③
回答下列问题:
(1)A→B所需试剂是 。
(2)B→C的反应化学方程式为 。
(3)G中官能团的名称为 。
(4)F→G的过程中会得到少量聚合物,该聚合物的结构简式为 。
(5)具有相同官能团的 F 的芳香同分异构体还有 种,其中核磁共振氢谱有 5 组峰、且峰面积比为
1:2:2:2:2的同分异构体的结构简式为 (任写一种即可)。
(6)K 中氮原子上的H 在核磁共振氢谱中是一个特征峰,其峰面积可用于测定产率。0.1mol 的 J 与 0.15mol 的
邻苯二胺( )反应一段时间后,加入0.1mol三氯乙烯(Cl C=CHCl,不参与反应),测定该混合物的核磁
2
共振氢谱,K中氮原子上的H与三氯乙烯中的H的峰面积比为1:2,此时K的产率为 。
(7)J→K的反应过程如下图,中间产物1含有三个六元环。
中间产物1、3的结构简式别为 、 。
共8页 第8页