文档内容
1
清新区 2024~2025 学年高二 12 月期末四校联考
化学试题
满分100分,考试用时75分钟。
注意事项:
1.答题前,先将自己的姓名、准考证号、考场号、座位号填写在试卷和答题卡上,并将准考
证号条形码粘贴在答题卡上的指定位置。
2.非选择题的作答:用黑色签字笔直接答在答题卡上对应的答题区域内。写在试卷、草稿纸
和答题卡上的非答题区域均无效。
可能用到的相对原子质量:
一、单选题(第1-10题,每小题2分;第11-16小题,每小题4分。总共44分)
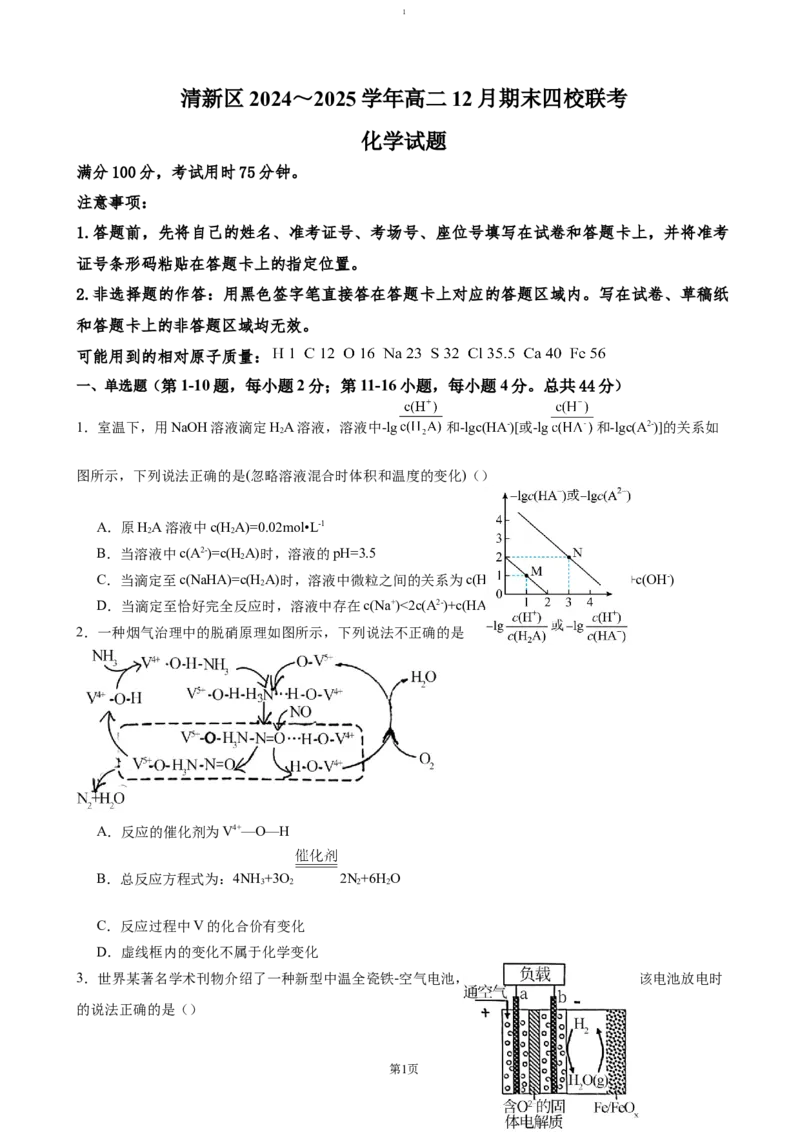
1.室温下,用NaOH溶液滴定HA溶液,溶液中-lg 和-lgc(HA-)[或-lg 和-lgc(A2-)]的关系如
2
图所示,下列说法正确的是(忽略溶液混合时体积和温度的变化)()
A.原HA溶液中c(HA)=0.02mol•L-1
2 2
B.当溶液中c(A2-)=c(H A)时,溶液的pH=3.5
2
C.当滴定至c(NaHA)=c(H A)时,溶液中微粒之间的关系为c(HA)+c(H+)>c(Na+)+c(A2-)+c(OH-)
2 2
D.当滴定至恰好完全反应时,溶液中存在c(Na+)<2c(A2-)+c(HA-)
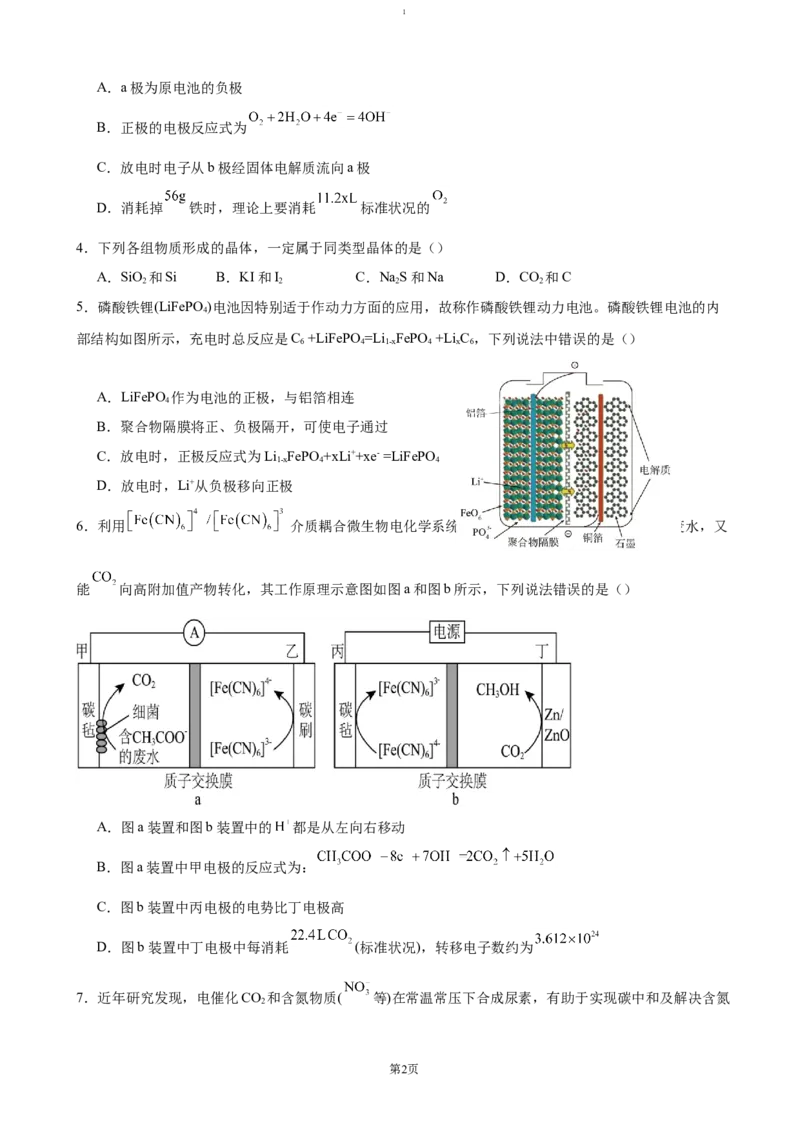
2.一种烟气治理中的脱硝原理如图所示,下列说法不正确的是
A.反应的催化剂为V4+—O—H
B.总反应方程式为:4NH +3O 2N+6H O
3 2 2 2
C.反应过程中V的化合价有变化
D.虚线框内的变化不属于化学变化
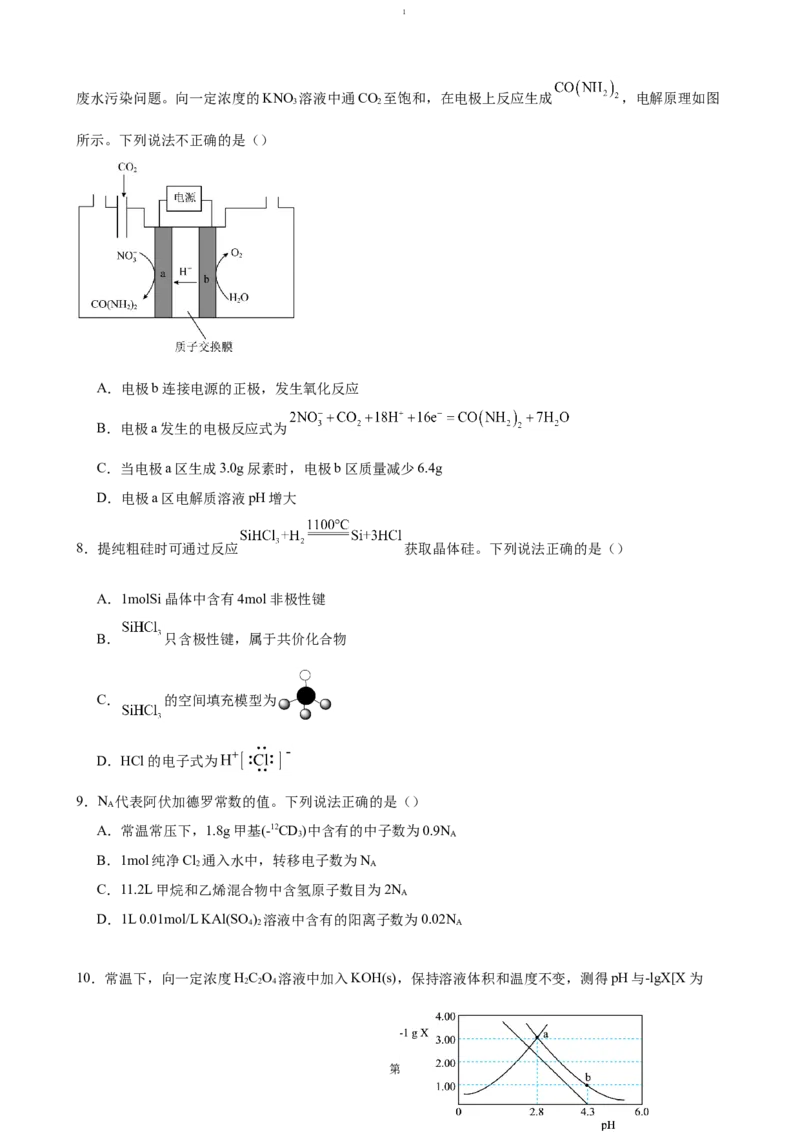
3.世界某著名学术刊物介绍了一种新型中温全瓷铁-空气电池,其结构如图所示。下列有关该电池放电时
的说法正确的是()
第1页1
A.a极为原电池的负极
B.正极的电极反应式为
C.放电时电子从b极经固体电解质流向a极
D.消耗掉 铁时,理论上要消耗 标准状况的
4.下列各组物质形成的晶体,一定属于同类型晶体的是()
A.SiO 和Si B.KI和I C.NaS和Na D.CO 和C
2 2 2 2
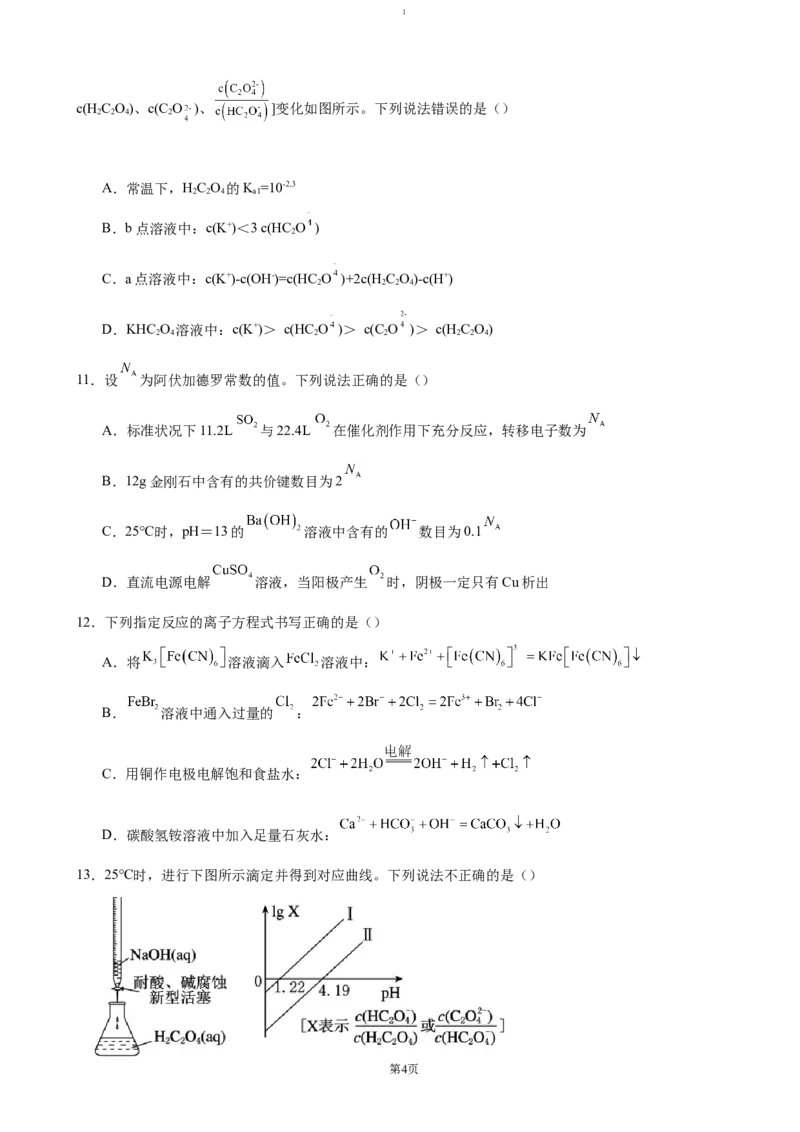
5.磷酸铁锂(LiFePO )电池因特别适于作动力方面的应用,故称作磷酸铁锂动力电池。磷酸铁锂电池的内
4
部结构如图所示,充电时总反应是C +LiFePO =Li FePO +LiC ,下列说法中错误的是()
6 4 1-x 4 x 6
A.LiFePO 作为电池的正极,与铝箔相连
4
B.聚合物隔膜将正、负极隔开,可使电子通过
C.放电时,正极反应式为Li FePO +xLi++xe- =LiFePO
1-x 4 4
D.放电时,Li+从负极移向正极
6.利用 介质耦合微生物电化学系统与电催化还原 系统,既能净化废水,又
能 向高附加值产物转化,其工作原理示意图如图a和图b所示,下列说法错误的是()
A.图a装置和图b装置中的 都是从左向右移动
B.图a装置中甲电极的反应式为:
C.图b装置中丙电极的电势比丁电极高
D.图b装置中丁电极中每消耗 (标准状况),转移电子数约为
7.近年研究发现,电催化CO 和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮
2
第2页1
废水污染问题。向一定浓度的KNO 溶液中通CO 至饱和,在电极上反应生成 ,电解原理如图
3 2
所示。下列说法不正确的是()
A.电极b连接电源的正极,发生氧化反应
B.电极a发生的电极反应式为
C.当电极a区生成3.0g尿素时,电极b区质量减少6.4g
D.电极a区电解质溶液pH增大
8.提纯粗硅时可通过反应 获取晶体硅。下列说法正确的是()
A.1molSi晶体中含有4mol非极性键
B. 只含极性键,属于共价化合物
C. 的空间填充模型为
D.HCl的电子式为
9.N 代表阿伏加德罗常数的值。下列说法正确的是()
A
A.常温常压下,1.8g甲基(-12CD)中含有的中子数为0.9N
3 A
B.1mol纯净Cl 通入水中,转移电子数为N
2 A
C.11.2L甲烷和乙烯混合物中含氢原子数目为2N
A
D.1L 0.01mol/L KAl(SO ) 溶液中含有的阳离子数为0.02N
4 2 A
10.常温下,向一定浓度HC O 溶液中加入KOH(s),保持溶液体积和温度不变,测得pH与-lgX[X为
2 2 4
第3页1
c(HC O)、c(C O )、 ]变化如图所示。下列说法错误的是()
2 2 4 2
A.常温下,HC O 的K =10-2.3
2 2 4 a1
B.b点溶液中:c(K+)<3 c(HC O )
2
C.a点溶液中:c(K+)-c(OH-)=c(HC O )+2c(H C O)-c(H+)
2 2 2 4
D.KHC O 溶液中:c(K+)> c(HC O )> c(C O )> c(HC O)
2 4 2 2 2 2 4
11.设 为阿伏加德罗常数的值。下列说法正确的是()
A.标准状况下11.2L 与22.4L 在催化剂作用下充分反应,转移电子数为
B.12g金刚石中含有的共价键数目为2
C.25℃时,pH=13的 溶液中含有的 数目为0.1
D.直流电源电解 溶液,当阳极产生 时,阴极一定只有Cu析出
12.下列指定反应的离子方程式书写正确的是()
A.将 溶液滴入 溶液中:
B. 溶液中通入过量的 :
C.用铜作电极电解饱和食盐水:
D.碳酸氢铵溶液中加入足量石灰水:
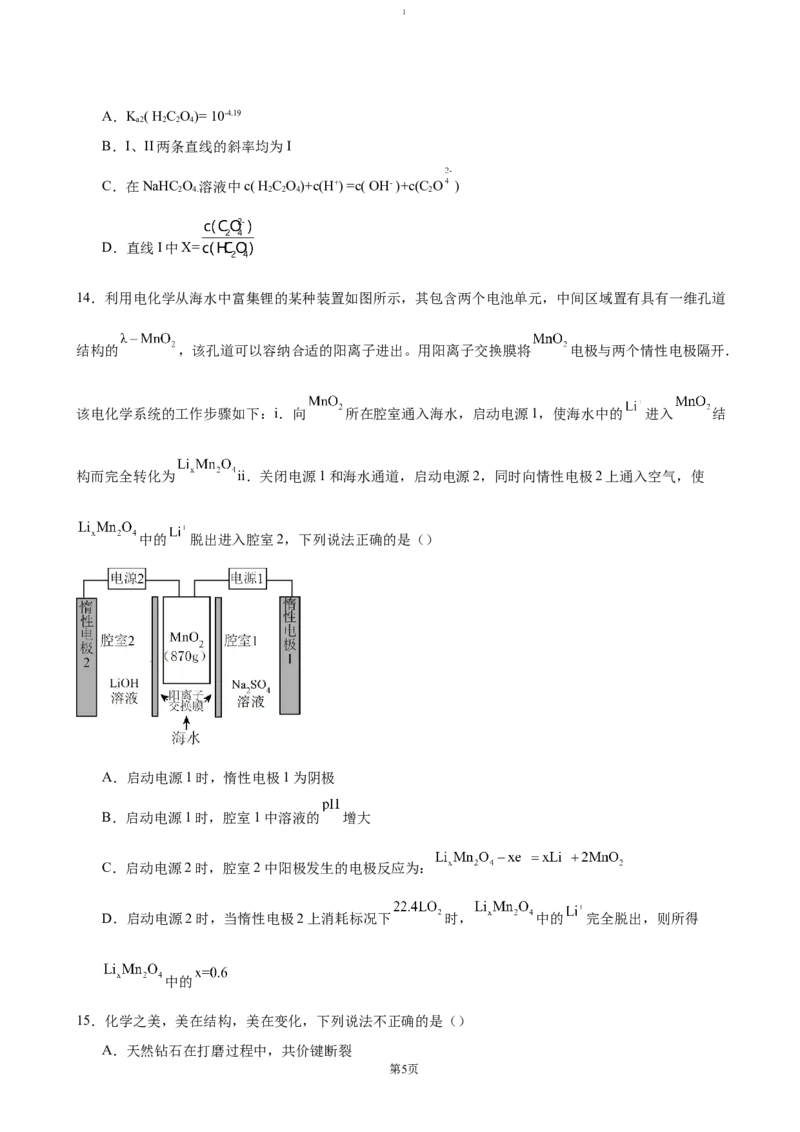
13.25℃时,进行下图所示滴定并得到对应曲线。下列说法不正确的是()
第4页1
A.K ( H C O)= 10-4.19
a2 2 2 4
B.I、II两条直线的斜率均为I
C.在NaHC O 溶液中c( H C O)+c(H+) =c( OH- )+c(C O )
2 4. 2 2 4 2
D.直线I中X=
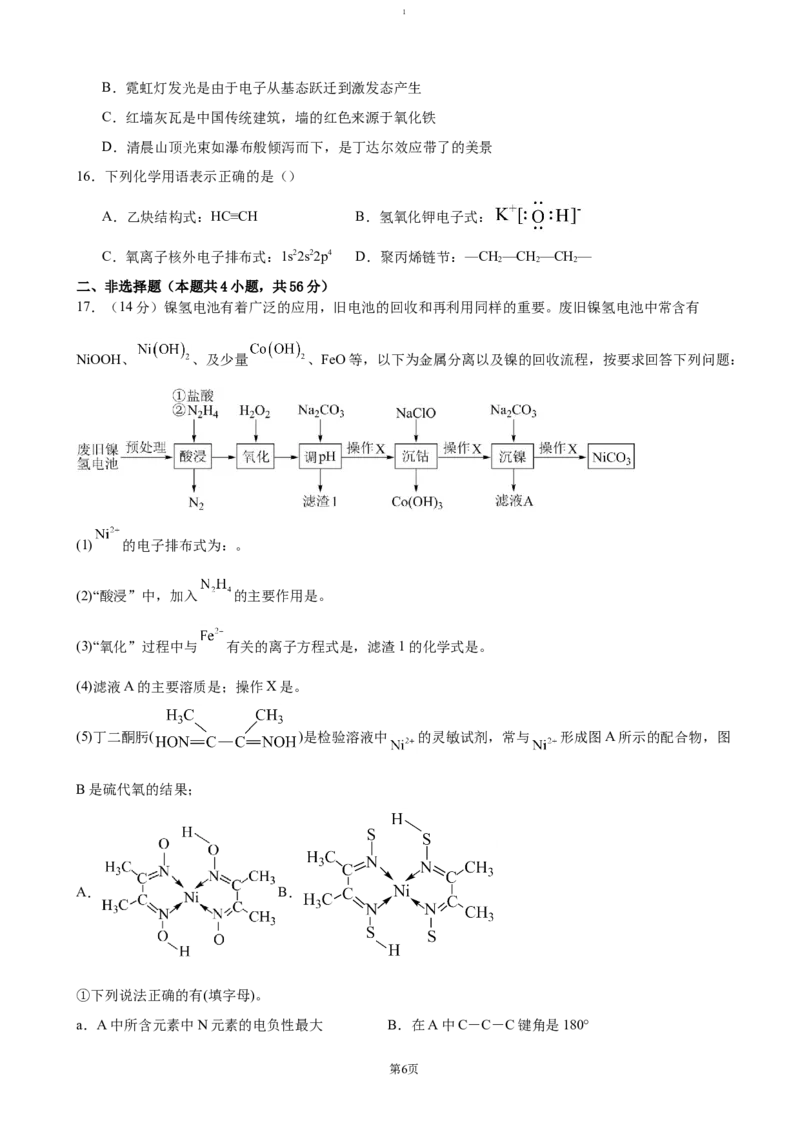
14.利用电化学从海水中富集锂的某种装置如图所示,其包含两个电池单元,中间区域置有具有一维孔道
结构的 ,该孔道可以容纳合适的阳离子进出。用阳离子交换膜将 电极与两个情性电极隔开.
该电化学系统的工作步骤如下:i.向 所在腔室通入海水,启动电源1,使海水中的 进入 结
构而完全转化为 ii.关闭电源1和海水通道,启动电源2,同时向情性电极2上通入空气,使
中的 脱出进入腔室2,下列说法正确的是()
A.启动电源1时,惰性电极1为阴极
B.启动电源1时,腔室1中溶液的 增大
C.启动电源2时,腔室2中阳极发生的电极反应为:
D.启动电源2时,当惰性电极2上消耗标况下 时, 中的 完全脱出,则所得
中的
15.化学之美,美在结构,美在变化,下列说法不正确的是()
A.天然钻石在打磨过程中,共价键断裂
第5页1
B.霓虹灯发光是由于电子从基态跃迁到激发态产生
C.红墙灰瓦是中国传统建筑,墙的红色来源于氧化铁
D.清晨山顶光束如瀑布般倾泻而下,是丁达尔效应带了的美景
16.下列化学用语表示正确的是()
A.乙炔结构式:HC≡CH B.氢氧化钾电子式:
C.氧离子核外电子排布式:1s22s22p4 D.聚丙烯链节:—CH—CH—CH—
2 2 2
二、非选择题(本题共4小题,共56分)
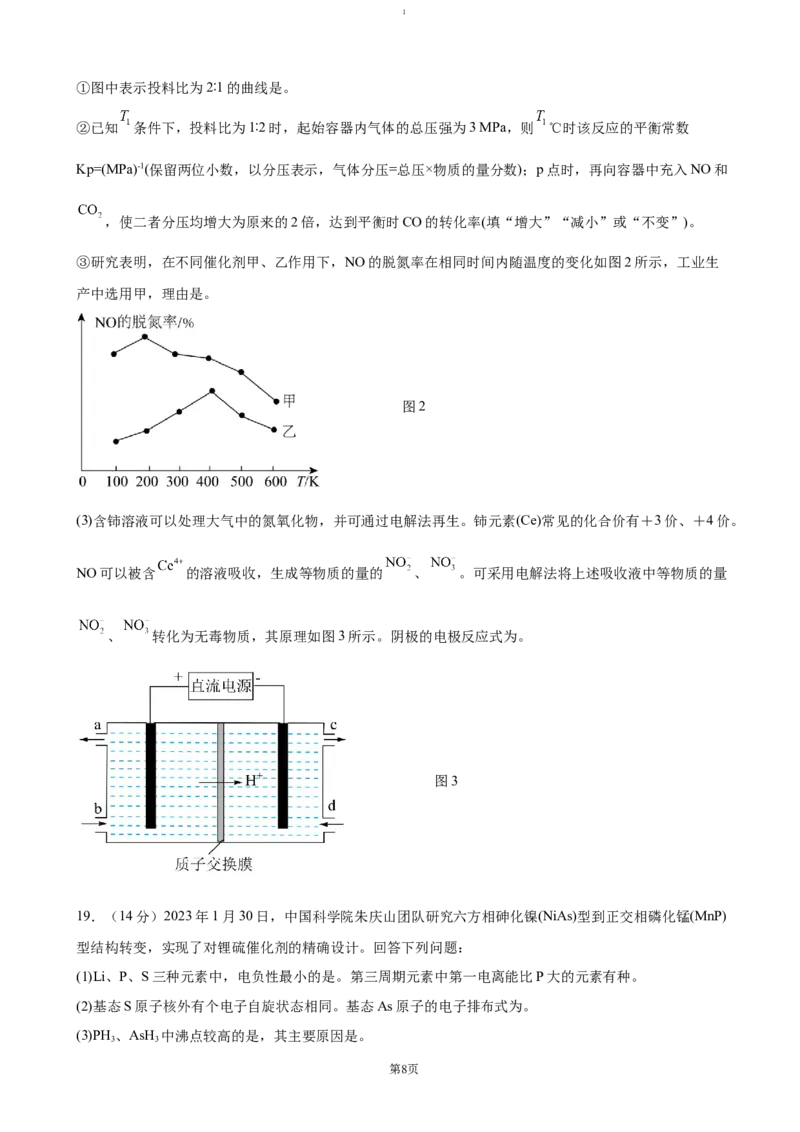
17.(14分)镍氢电池有着广泛的应用,旧电池的回收和再利用同样的重要。废旧镍氢电池中常含有
NiOOH、 、及少量 、FeO等,以下为金属分离以及镍的回收流程,按要求回答下列问题:
(1) 的电子排布式为:。
(2)“酸浸”中,加入 的主要作用是。
(3)“氧化”过程中与 有关的离子方程式是,滤渣1的化学式是。
(4)滤液A的主要溶质是;操作X是。
(5)丁二酮肟( )是检验溶液中 的灵敏试剂,常与 形成图A所示的配合物,图
B是硫代氧的结果;
A. B.
①下列说法正确的有(填字母)。
a.A中所含元素中N元素的电负性最大 B.在A中C-C-C键角是180°
第6页1
C.在B中-SH上的S原子采取 杂化 D.在B中存在σ键、π键与配位键
②化合物A的熔、沸点高于化合物B的原因是。
18.(16分)汽车等交通工具为出行、物流带来了舒适和方便。然而,燃油车排放的尾气中含有大量的氮
氧化物, 的处理是环境科学研究的热点课题。
(1)利用活性炭对NO进行吸附是处理氮氧化物的途径之一、向容积恒为2 L的密闭容器中加入活性炭(足量)
和NO,发生反应 ,NO和 的物质的量变化如下
表所示:
物质的量/mol
0 5 min 10 min 15 min 20 min 25 min 30 min
NO 2.0 1.16 0.80 0.80 0.50 0.40 0.40
0 0.42 0.60 0.60 0.75 0.80 0.80
①在 温度下,0~5 min内,以 表示该反应速率v(N )=;第15 min后,将温度调整为 ,数据变化如
2
上表所示,则TT(填“>”“<”或“=”)。
1 2
②若为绝热恒容容器,下列表示该反应已达到平衡状态的是(填序号)。
A合气体的密度不再变化B.温度不再变化
C.NO和 的消耗速率之比为1∶2D.混合气体中
(2)汽车尾气的净化装置中,在适当催化剂的作用下,CO和NO发生反应:
。向一恒容密闭容器中,充入1 mol CO气体
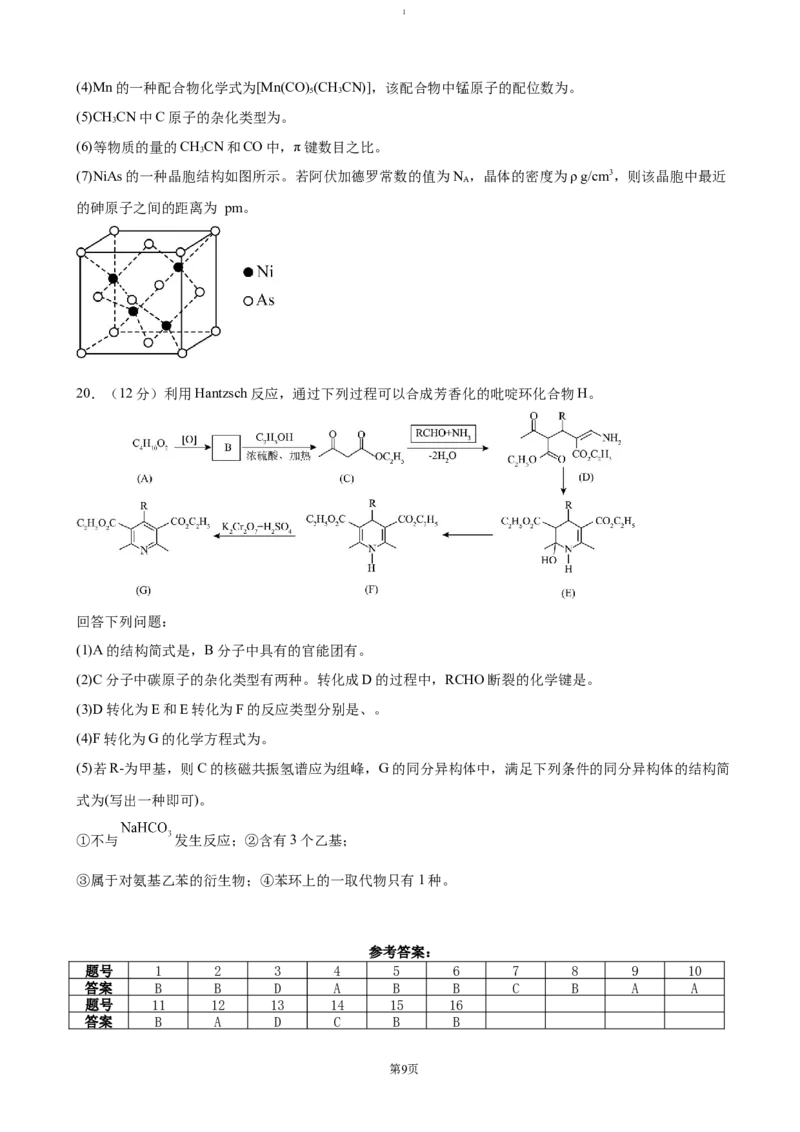
和一定量的NO气体,图1是3种投料比[n(CO)∶n(NO)]分别为2∶1、1∶1、1∶2时,反应温度对CO平衡转化
率的影响曲线。
图1
第7页1
①图中表示投料比为2∶1的曲线是。
②已知 条件下,投料比为1∶2时,起始容器内气体的总压强为3 MPa,则 ℃时该反应的平衡常数
Kp=(MPa)-1(保留两位小数,以分压表示,气体分压=总压×物质的量分数);p点时,再向容器中充入NO和
,使二者分压均增大为原来的2倍,达到平衡时CO的转化率(填“增大”“减小”或“不变”)。
③研究表明,在不同催化剂甲、乙作用下,NO的脱氮率在相同时间内随温度的变化如图2所示,工业生
产中选用甲,理由是。
图2
(3)含铈溶液可以处理大气中的氮氧化物,并可通过电解法再生。铈元素(Ce)常见的化合价有+3价、+4价。
NO可以被含 的溶液吸收,生成等物质的量的 、 。可采用电解法将上述吸收液中等物质的量
、 转化为无毒物质,其原理如图3所示。阴极的电极反应式为。
图3
19.(14分)2023年1月30日,中国科学院朱庆山团队研究六方相砷化镍(NiAs)型到正交相磷化锰(MnP)
型结构转变,实现了对锂硫催化剂的精确设计。回答下列问题:
(1)Li、P、S三种元素中,电负性最小的是。第三周期元素中第一电离能比P大的元素有种。
(2)基态S原子核外有个电子自旋状态相同。基态As原子的电子排布式为。
(3)PH 、AsH 中沸点较高的是,其主要原因是。
3 3
第8页1
(4)Mn的一种配合物化学式为[Mn(CO) (CHCN)],该配合物中锰原子的配位数为。
5 3
(5)CH CN中C原子的杂化类型为。
3
(6)等物质的量的CHCN和CO中,π键数目之比。
3
(7)NiAs的一种晶胞结构如图所示。若阿伏加德罗常数的值为N ,晶体的密度为ρ g/cm3,则该晶胞中最近
A
的砷原子之间的距离为 pm。
20.(12分)利用Hantzsch反应,通过下列过程可以合成芳香化的吡啶环化合物H。
回答下列问题:
(1)A的结构简式是,B分子中具有的官能团有。
(2)C分子中碳原子的杂化类型有两种。转化成D的过程中,RCHO断裂的化学键是。
(3)D转化为E和E转化为F的反应类型分别是、。
(4)F转化为G的化学方程式为。
(5)若R-为甲基,则C的核磁共振氢谱应为组峰,G的同分异构体中,满足下列条件的同分异构体的结构简
式为(写出一种即可)。
①不与 发生反应;②含有3个乙基;
③属于对氨基乙苯的衍生物;④苯环上的一取代物只有1种。
参考答案:
题号 1 2 3 4 5 6 7 8 9 10
答案 B B D A B B C B A A
题号 11 12 13 14 15 16
答案 B A D C B B
第9页1
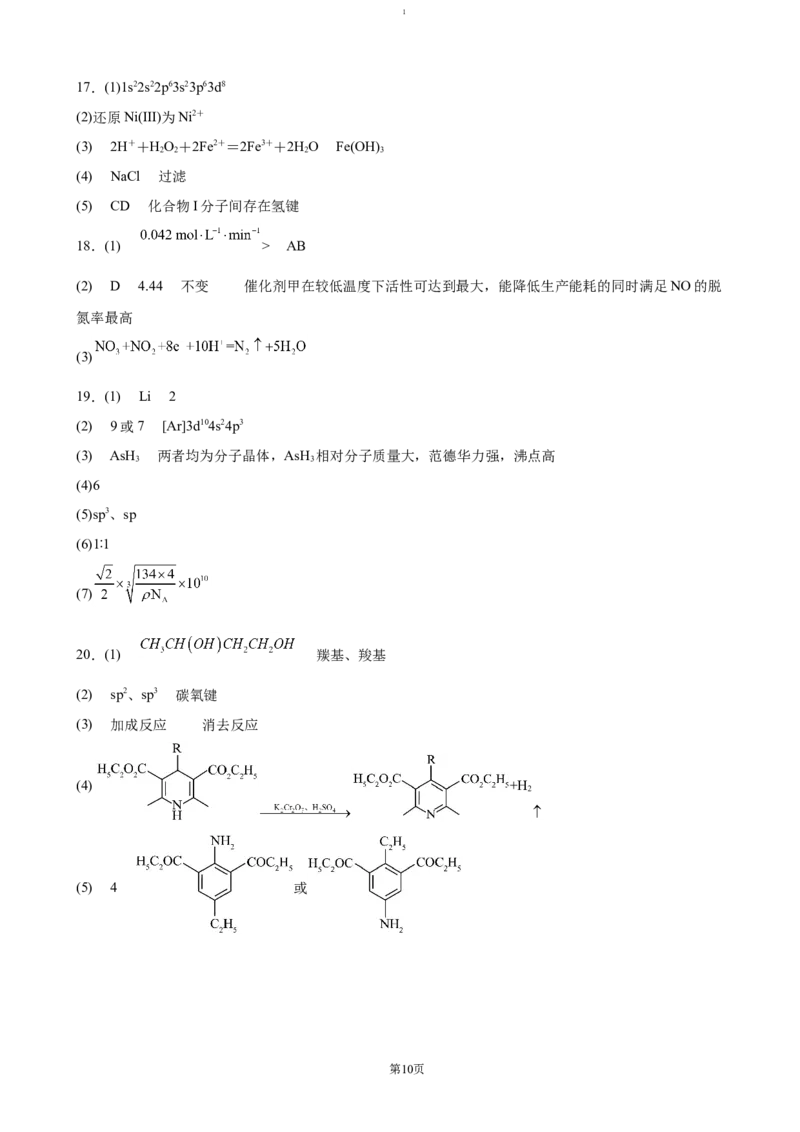
17.(1)1s22s22p63s23p63d8
(2)还原Ni(III)为Ni2+
(3) 2H++HO+2Fe2+=2Fe3++2HO Fe(OH)
2 2 2 3
(4) NaCl 过滤
(5) CD 化合物I分子间存在氢键
18.(1) > AB
(2) D 4.44 不变 催化剂甲在较低温度下活性可达到最大,能降低生产能耗的同时满足NO的脱
氮率最高
(3)
19.(1) Li 2
(2) 9或7 [Ar]3d104s24p3
(3) AsH 两者均为分子晶体,AsH 相对分子质量大,范德华力强,沸点高
3 3
(4)6
(5)sp3、sp
(6)1∶1
(7)
20.(1) 羰基、羧基
(2) sp2、sp3 碳氧键
(3) 加成反应 消去反应
(4) +H
2
(5) 4 或
第10页