文档内容
2024—2025学年度下学期成都七中高三年级入学考试
化学试卷
考试时间:75分钟 总分:100分
可能用到的相对原子质量:H-1 C-12 O-16 S-32 Cu-64 Ag-108
一、选择题:本题共15小题,每题3分,共45分。每小题只有一个选项符合题目要求。
1.生活处处有化学,下列叙述错误的是
A.亚硝酸钠可作为食品保鲜剂,过量食用可能致癌
B.维生素C可用作水果罐头中的抗氧化剂
C.味精是一种常用的增味剂,其主要成分为谷氨酸钠
D.阿司匹林是一种重要的合成高分子药物,具有解热镇痛作用
2.化学用语可以表达化学过程,下列化学用语表达错误的是
A.HCl的形成过程用电子式表示为:
B.亚铜氨溶液除去合成氨原料气中的CO:[Cu(NH ) ]++CO+NH ⇌[Cu(NH ) CO]+
3 2 3 3 3
C.用电子云轮廓图示意p-p π键的形成:
D.制备芳纶纤维凯芙拉:
3.设N 为阿伏加德罗常数的值。下列说法正确的是
A
A.标准状况下,22.4 L HCl气体中H+数目为N
A
B.6.4 g S 和S 的混合物中所含的电子数为3.2 N
2 8 A
C.标准状况下,22.4 L的SO 与足量的O 反应,生成SO 的分子数为N
2 2 3 A
D.加热条件下,64 g Cu分别与足量Cl 、S充分反应,转移的电子数均为2 N
2 A
4.下列反应的离子方程式书写正确的是
A.向FeI 溶液中滴加少量氯水:2Fe2++Cl =2Fe3++2Cl−
2 2
B.泡沫灭火器的反应原理:2Al3++3CO2−+3H O= 2Al(OH) ↓+3CO ↑
3 2 3 2
C.将稀硫酸加入硫代硫酸钠溶液中:S O2−+SO2−+4H+=2SO ↑+S↓+2H O
2 3 4 2 2
D.Fe与稀硝酸反应,当𝑛(Fe):𝑛(HNO )=1:1时,3Fe+2NO−+8H+=3Fe2++2NO↑+4H O
3 3 2
5.下列依据相关数据作出的推断中,不正确的是
A.依据相同温度下可逆反应的Q与K大小的比较,可推断反应进行的方向
B.依据相同温度下一元弱酸的K ,可推断两个同浓度同温度一元弱酸稀溶液的pH大小
a
C.依据SiO 和CO 的相对分子质量,可推断它们的熔点大小
2 2
D.依据F、Cl、Br、I的氢化物分子中氢卤键的键能,可推断它们的热稳定性强弱
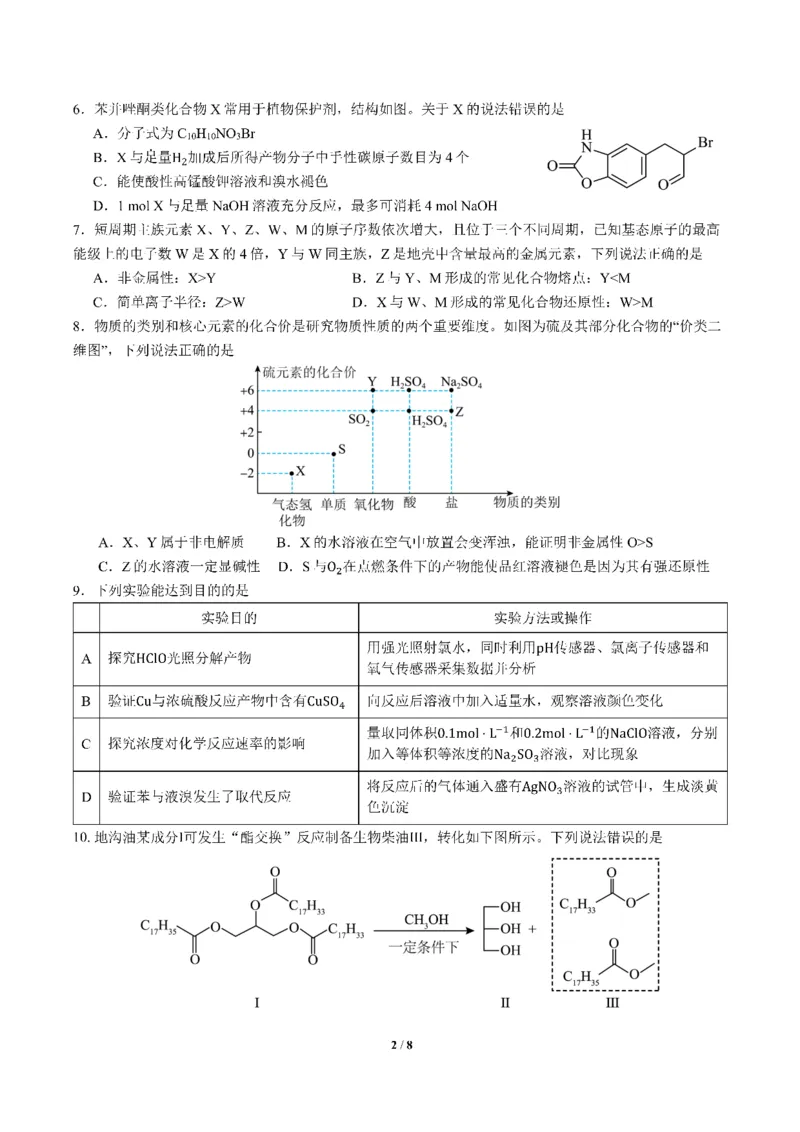
1 / 8A. Ⅰ和Ⅲ均为高级脂肪酸酯
B. 生物柴油与石化柴油均可水解
C. 为使Ⅰ充分转化,甲醇的物质的量应大于Ⅰ的3倍
D. 水萃取法分离Ⅱ和Ⅲ时,加入NaCl可提升分离效果
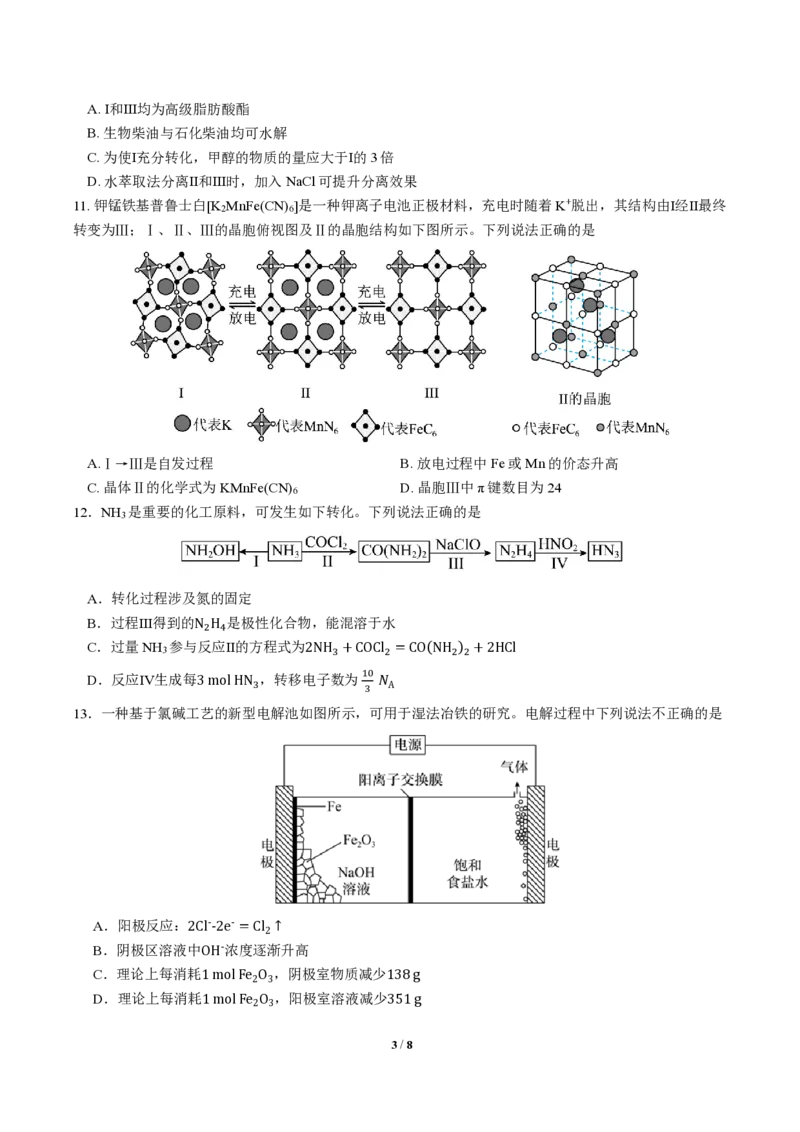
11. 钾锰铁基普鲁士白[K MnFe(CN) ]是一种钾离子电池正极材料,充电时随着K+脱出,其结构由Ⅰ经Ⅱ最终
2 6
转变为Ⅲ;Ⅰ、Ⅱ、Ⅲ的晶胞俯视图及Ⅱ的晶胞结构如下图所示。下列说法正确的是
A.Ⅰ→Ⅲ是自发过程 B. 放电过程中Fe或Mn的价态升高
C. 晶体Ⅱ的化学式为KMnFe(CN) D. 晶胞Ⅲ中π键数目为24
6
12.NH 是重要的化工原料,可发生如下转化。下列说法正确的是
3
A.转化过程涉及氮的固定
B.过程Ⅲ得到的N H 是极性化合物,能混溶于水
2 4
C.过量NH 参与反应Ⅱ的方程式为2NH +COCl =CO(NH ) +2HCl
3 3 2 2 2
10
D.反应Ⅳ生成每3 mol HN ,转移电子数为 𝑁
3 A
3
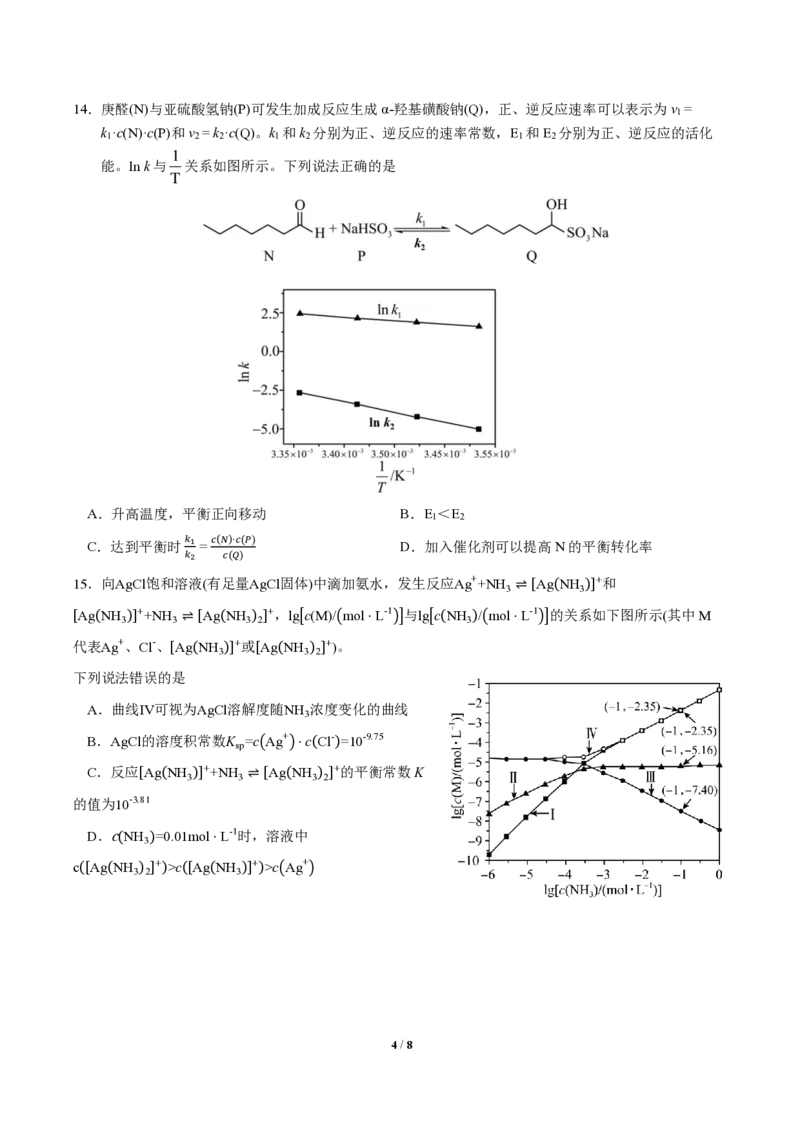
13.一种基于氯碱工艺的新型电解池如图所示,可用于湿法冶铁的研究。电解过程中下列说法不正确的是
A.阳极反应:2Cl--2e- =Cl ↑
2
B.阴极区溶液中OH-浓度逐渐升高
C.理论上每消耗1 mol Fe O ,阴极室物质减少138 g
2 3
D.理论上每消耗1 mol Fe O ,阳极室溶液减少351 g
2 3
3 / 814.庚醛(N)与亚硫酸氢钠(P)可发生加成反应生成α-羟基磺酸钠(Q),正、逆反应速率可以表示为v =
1
k ·c(N)·c(P)和v = k ·c(Q)。k 和k 分别为正、逆反应的速率常数,E 和E 分别为正、逆反应的活化
1 2 2 1 2 1 2
1
能。ln k与 关系如图所示。下列说法正确的是
T
A.升高温度,平衡正向移动 B.E <E
1 2
C.达到平衡时
𝑘1
=
𝑐(𝑁)·𝑐(𝑃)
D.加入催化剂可以提高N的平衡转化率
𝑘2 𝑐(𝑄)
15.向AgCl饱和溶液(有足量AgCl固体)中滴加氨水,发生反应Ag++NH ⇌[Ag(NH )]+和
3 3
[Ag(NH )]++NH ⇌[Ag(NH ) ]+,lg[c(M)/(mol⋅L-1)]与lg[c(NH )/(mol⋅L-1)]的关系如下图所示(其中M
3 3 3 2 3
代表Ag+、Cl-、[Ag(NH )]+或[Ag(NH ) ]+)。
3 3 2
下列说法错误的是
A.曲线Ⅳ可视为AgCl溶解度随NH 浓度变化的曲线
3
B.AgCl的溶度积常数K =c(Ag+)⋅c(Cl-)=10-9.75
sp
C.反应[Ag(NH )]++NH ⇌[Ag(NH ) ]+的平衡常数K
3 3 3 2
的值为10-3.81
D.c(NH )=0.01mol⋅L-1时,溶液中
3
c([Ag(NH ) ]+)>c([Ag(NH )]+)>c(Ag+)
3 2 3
4 / 8二、非选择题:本题共4小题,共55分。
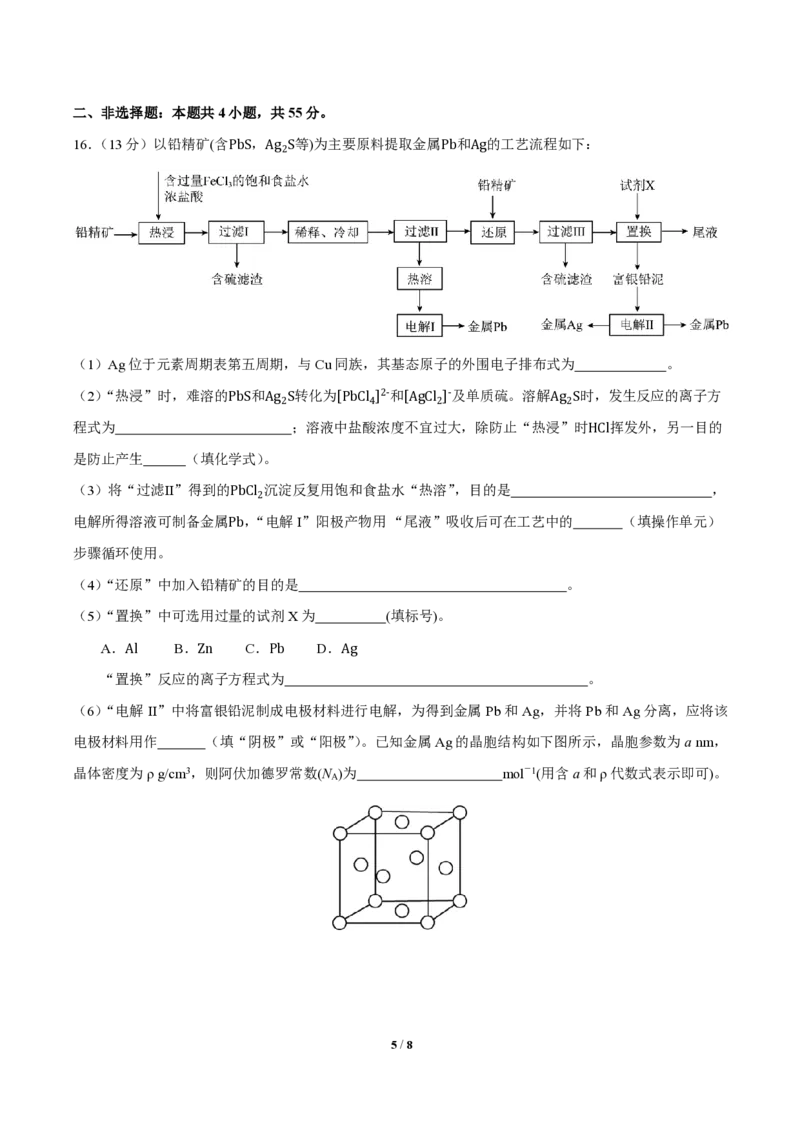
16.(13分)以铅精矿(含PbS,Ag S等)为主要原料提取金属Pb和Ag的工艺流程如下:
2
(1)Ag位于元素周期表第五周期,与Cu同族,其基态原子的外围电子排布式为 。
(2)“热浸”时,难溶的PbS和Ag S转化为[PbCl ]2-和[AgCl ]-及单质硫。溶解Ag S时,发生反应的离子方
2 4 2 2
程式为 ;溶液中盐酸浓度不宜过大,除防止“热浸”时HCl挥发外,另一目的
是防止产生 (填化学式)。
(3)将“过滤Ⅱ”得到的PbCl 沉淀反复用饱和食盐水“热溶”,目的是 ,
2
电解所得溶液可制备金属Pb,“电解I”阳极产物用 “尾液”吸收后可在工艺中的 (填操作单元)
步骤循环使用。
(4)“还原”中加入铅精矿的目的是 。
(5)“置换”中可选用过量的试剂X为 (填标号)。
A.Al B.Zn C.Pb D.Ag
“置换”反应的离子方程式为 。
(6)“电解 II”中将富银铅泥制成电极材料进行电解,为得到金属 Pb和 Ag,并将 Pb和Ag分离,应将该
电极材料用作 (填“阴极”或“阳极”)。已知金属Ag的晶胞结构如下图所示,晶胞参数为a nm,
晶体密度为ρ g/cm3,则阿伏加德罗常数(N )为 mol-1(用含a和ρ代数式表示即可)。
A
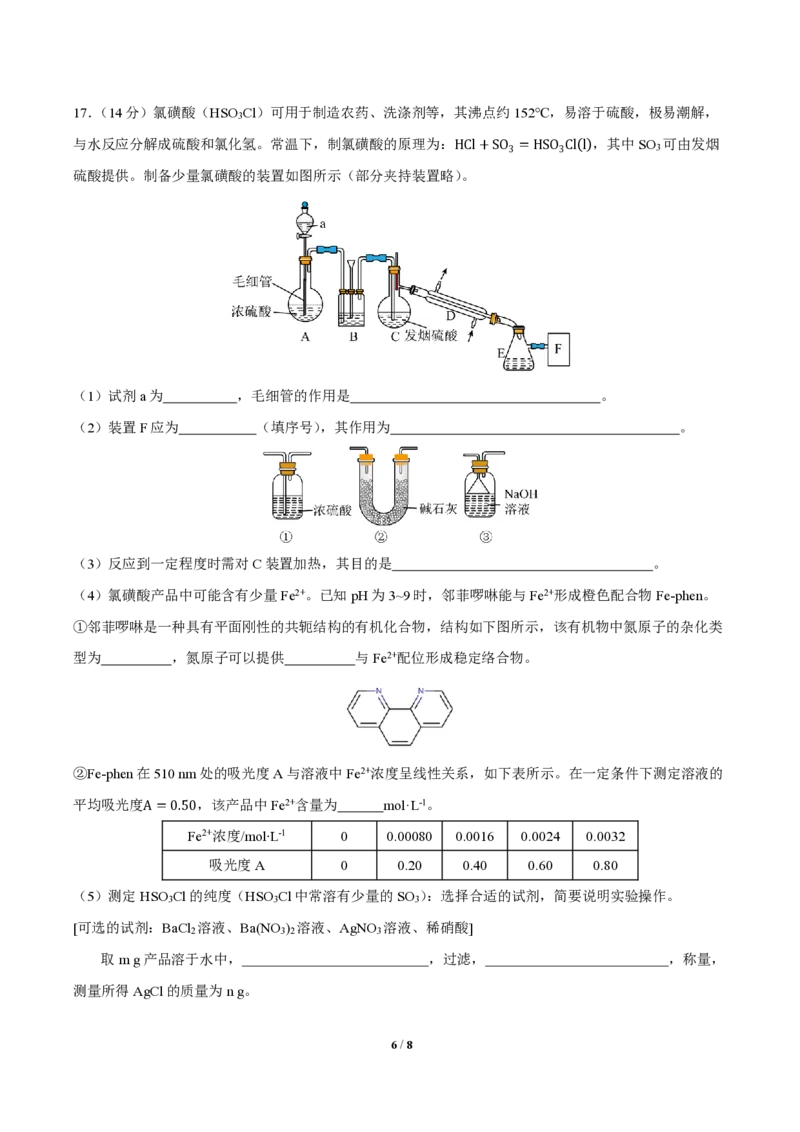
5 / 817.(14分)氯磺酸(HSO Cl)可用于制造农药、洗涤剂等,其沸点约152℃,易溶于硫酸,极易潮解,
3
与水反应分解成硫酸和氯化氢。常温下,制氯磺酸的原理为:HCl+SO =HSO Cl(l),其中SO 可由发烟
3 3 3
硫酸提供。制备少量氯磺酸的装置如图所示(部分夹持装置略)。
(1)试剂a为 ,毛细管的作用是 。
(2)装置F应为 (填序号),其作用为 。
(3)反应到一定程度时需对C装置加热,其目的是 。
(4)氯磺酸产品中可能含有少量Fe2+。已知pH为3~9时,邻菲啰啉能与Fe2+形成橙色配合物Fe-phen。
①邻菲啰啉是一种具有平面刚性的共轭结构的有机化合物,结构如下图所示,该有机物中氮原子的杂化类
型为 ,氮原子可以提供 与Fe2+配位形成稳定络合物。
②Fe-phen在510 nm处的吸光度A与溶液中Fe2+浓度呈线性关系,如下表所示。在一定条件下测定溶液的
平均吸光度A=0.50,该产品中Fe2+含量为 mol·L-1。
Fe2+浓度/mol∙L-1 0 0.00080 0.0016 0.0024 0.0032
吸光度A 0 0.20 0.40 0.60 0.80
(5)测定HSO Cl的纯度(HSO Cl中常溶有少量的SO ):选择合适的试剂,简要说明实验操作。
3 3 3
[可选的试剂:BaCl 溶液、Ba(NO ) 溶液、AgNO 溶液、稀硝酸]
2 3 2 3
取m g产品溶于水中, ,过滤, ,称量,
测量所得AgCl的质量为n g。
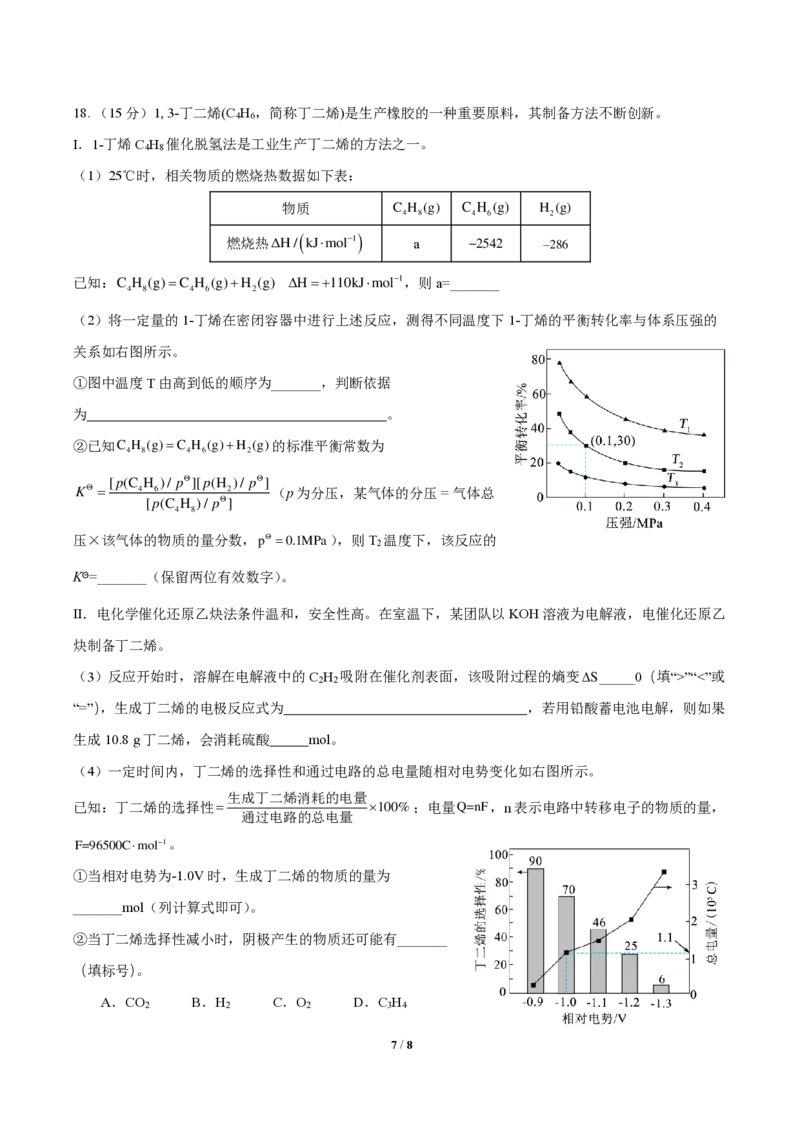
6 / 818. (15分)1,3-丁二烯(C H ,简称丁二烯)是生产橡胶的一种重要原料,其制备方法不断创新。
4 6
Ⅰ.1-丁烯C H 催化脱氢法是工业生产丁二烯的方法之一。
4 8
(1)25℃时,相关物质的燃烧热数据如下表:
物质
7 / 8
C
4
H
8
( g ) C
4
H
6
( g ) H
2
( g )
燃烧热ΔH/
( kJmol−1)
a −2542 − 2 8 6
已知:C H (g)=C H (g)+H (g) H=+110kJmol−1,则a=_______
4 8 4 6 2
(2)将一定量的1-丁烯在密闭容器中进行上述反应,测得不同温度下1-丁烯的平衡转化率与体系压强的
关系如右图所示。
①图中温度T由高到低的顺序为_______,判断依据
为 。
②已知C H (g)=C H (g)+H (g)的标准平衡常数为
4 8 4 6 2
[p(C H )/ p][p(H )/ p]
K = 4 6 2 (p为分压,某气体的分压 = 气体总
[p(C H )/ p]
4 8
压×该气体的物质的量分数,p =0.1MPa),则T 温度下,该反应的
2
KΘ=_______(保留两位有效数字)。
Ⅱ.电化学催化还原乙炔法条件温和,安全性高。在室温下,某团队以KOH溶液为电解液,电催化还原乙
炔制备丁二烯。
(3)反应开始时,溶解在电解液中的C H 吸附在催化剂表面,该吸附过程的熵变
2 2
S _____0(填“>”“<”或
“=”),生成丁二烯的电极反应式为 ,若用铅酸蓄电池电解,则如果
生成10.8 g丁二烯,会消耗硫酸 mol。
(4)一定时间内,丁二烯的选择性和通过电路的总电量随相对电势变化如右图所示。
生成丁二烯消耗的电量
已知:丁二烯的选择性= 100%;电量
通过电路的总电量
Q = n F ,n表示电路中转移电子的物质的量,
F=96500Cmol−1。
①当相对电势为-1.0V时,生成丁二烯的物质的量为
_______mol(列计算式即可)。
②当丁二烯选择性减小时,阴极产生的物质还可能有_______
(填标号)。
A.CO B.H C.O D.C H
2 2 2 3 4
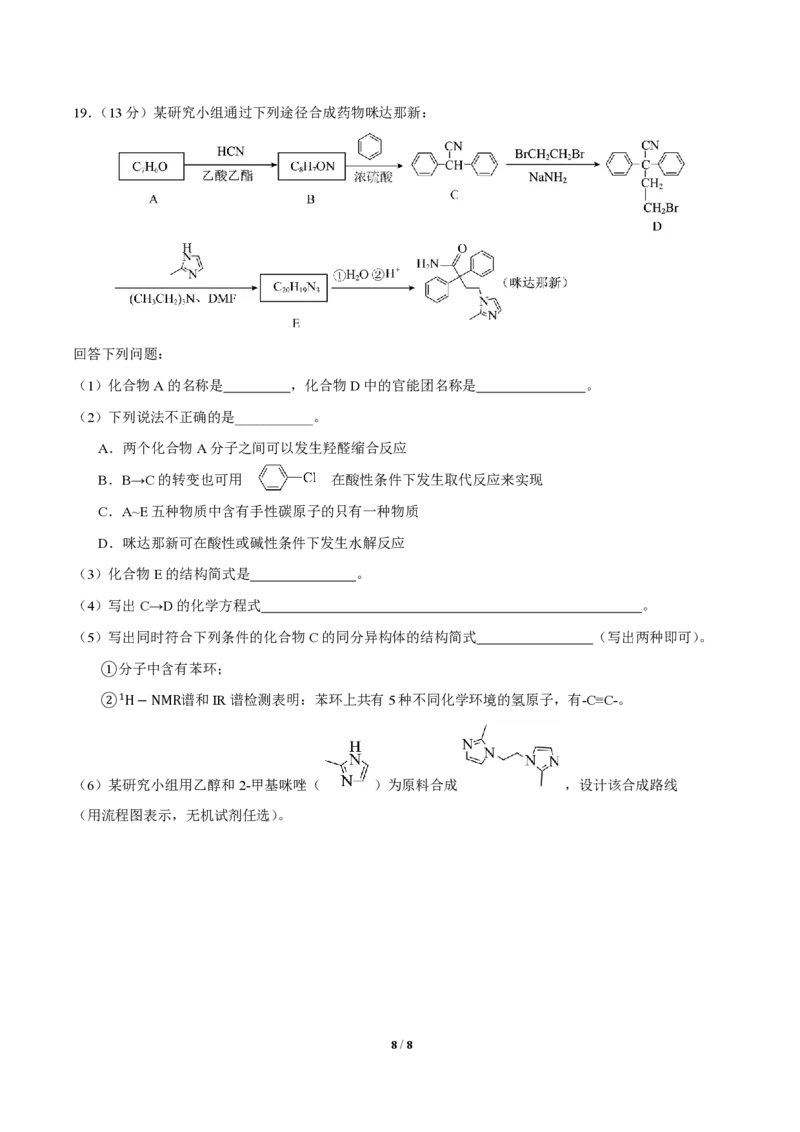
。19.(13分)某研究小组通过下列途径合成药物咪达那新:
回答下列问题:
(1)化合物A的名称是 ,化合物D中的官能团名称是 。
(2)下列说法不正确的是___________。
A.两个化合物A分子之间可以发生羟醛缩合反应
B.B→C的转变也可用 在酸性条件下发生取代反应来实现
C.A~E五种物质中含有手性碳原子的只有一种物质
D.咪达那新可在酸性或碱性条件下发生水解反应
(3)化合物E的结构简式是 。
(4)写出C→D的化学方程式 。
(5)写出同时符合下列条件的化合物C的同分异构体的结构简式 (写出两种即可)。
①分子中含有苯环;
②1H−NMR谱和IR谱检测表明:苯环上共有5种不同化学环境的氢原子,有-C≡C-。
(6)某研究小组用乙醇和2-甲基咪唑( )为原料合成 ,设计该合成路线
(用流程图表示,无机试剂任选)。
8 / 8