文档内容
2024-2025 学年第一学期 10 月份六校联合调研试卷
高二化学
可能用到的相对原子质量:H1 C12 N14 Fe56 Na23
一、选择题:共13小题,每题3分,共39分。每题只有一个选项最符合题意。
1.2024年4月24日是第九个“中国航天日”,主题是“极目楚天共襄星汉”。下列有关中国空间站说法
不正确的是( )
A.太阳能电池中的单晶硅——半导体材料
B.外表面的高温结构碳化硅陶瓷——硅酸盐材料
C.外层的热控保温材料石墨烯——无机非金属材料
D.太空机械臂的主要成分铝合金——金属材料
2.反应 应用于石油开采。下列说法正确的是( )
A. 的电子式为 B. 中N元素的化合价为+5
C. 分子中存在 键 D. 中含有非极性共价键
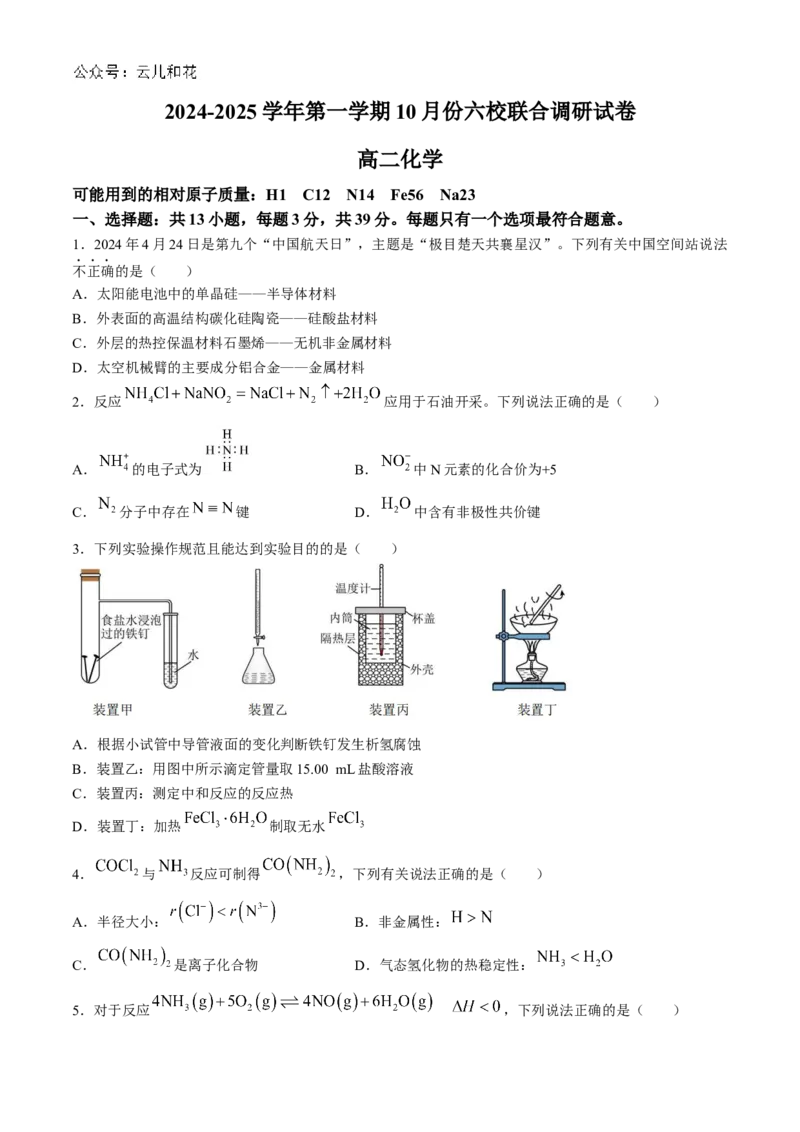
3.下列实验操作规范且能达到实验目的的是( )
A.根据小试管中导管液面的变化判断铁钉发生析氢腐蚀
B.装置乙:用图中所示滴定管量取15.00 mL盐酸溶液
C.装置丙:测定中和反应的反应热
D.装置丁:加热 制取无水
4. 与 反应可制得 ,下列有关说法正确的是( )
A.半径大小: B.非金属性:
C. 是离子化合物 D.气态氢化物的热稳定性:
5.对于反应 ,下列说法正确的是( )
学科网(北京)股份有限公司A.1 mol 断裂的同时有1 mol 断裂,说明反应到达该条件下的平衡状态
B.该反应的平衡常数可表达为
C.适当降温加压可提高 的平衡转化率
D.分离出 , 增大,平衡向正反应方向移动
6.CO能将溶液中的 还原为Pd,生成黑色沉淀,该反应可用于检验 CO。燃煤烟气中的 可用
饱和溶液进行捕集。下列化学反应表示正确的是( )
A.焦炭与石英砂反应:
B.CO与酸性 溶液反应:
C. 的水解反应:
D. 饱和溶液与足量 反应:
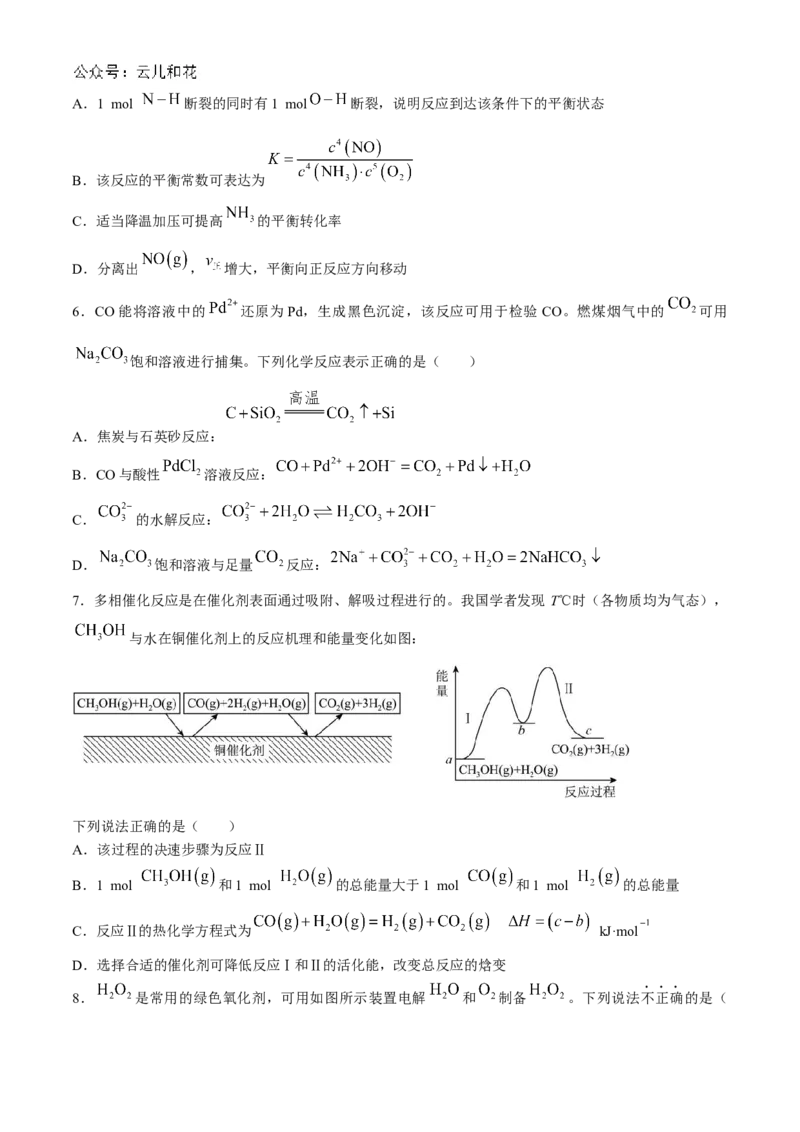
7.多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现 T℃时(各物质均为气态),
与水在铜催化剂上的反应机理和能量变化如图:
下列说法正确的是( )
A.该过程的决速步骤为反应Ⅱ
B.1 mol 和1 mol 的总能量大于1 mol 和1 mol 的总能量
C.反应Ⅱ的热化学方程式为 kJ·mol
D.选择合适的催化剂可降低反应Ⅰ和Ⅱ的活化能,改变总反应的焓变
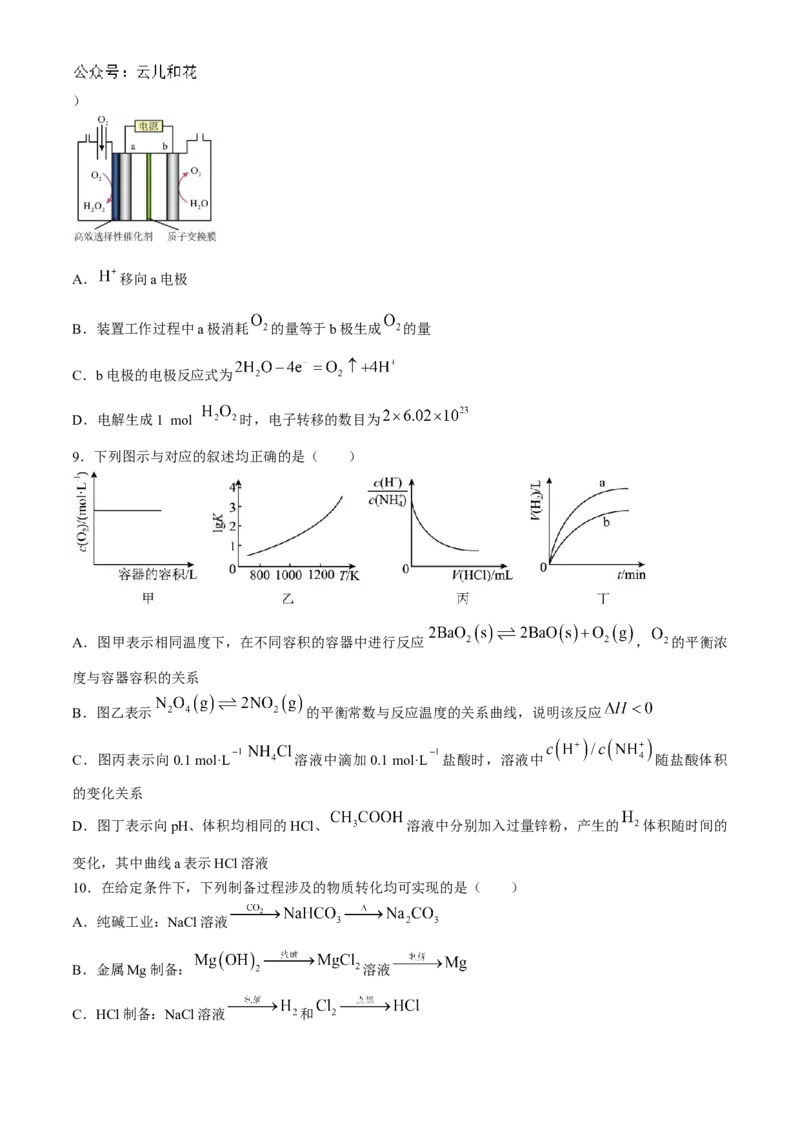
8. 是常用的绿色氧化剂,可用如图所示装置电解 和 制备 。下列说法不正确的是(
学科网(北京)股份有限公司)
A. 移向a电极
B.装置工作过程中a极消耗 的量等于b极生成 的量
C.b电极的电极反应式为
D.电解生成1 mol 时,电子转移的数目为
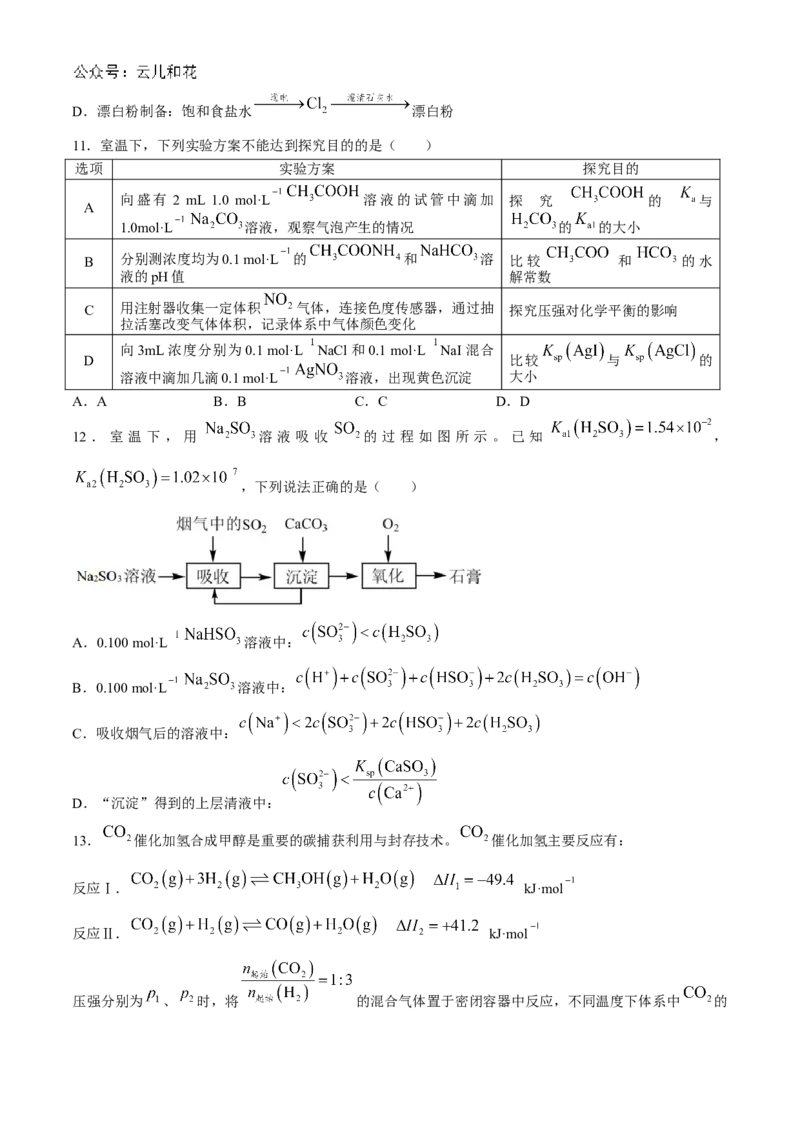
9.下列图示与对应的叙述均正确的是( )
A.图甲表示相同温度下,在不同容积的容器中进行反应 , 的平衡浓
度与容器容积的关系
B.图乙表示 的平衡常数与反应温度的关系曲线,说明该反应
C.图丙表示向0.1 mol·L 溶液中滴加0.1 mol·L 盐酸时,溶液中 随盐酸体积
的变化关系
D.图丁表示向pH、体积均相同的HCl、 溶液中分别加入过量锌粉,产生的 体积随时间的
变化,其中曲线a表示HCl溶液
10.在给定条件下,下列制备过程涉及的物质转化均可实现的是( )
A.纯碱工业:NaCl溶液
B.金属Mg制备: 溶液
C.HCl制备:NaCl溶液 和
学科网(北京)股份有限公司D.漂白粉制备:饱和食盐水 漂白粉
11.室温下,下列实验方案不能达到探究目的的是( )
选项 实验方案 探究目的
向盛有 2 mL 1.0 mol·L 溶液的试管中滴加 探 究 的 与
A
1.0mol·L 溶液,观察气泡产生的情况 的 的大小
B 分别测浓度均为0.1 mol·L 的 和 溶 比较 和 的水
液的pH值 解常数
C 用注射器收集一定体积 气体,连接色度传感器,通过抽 探究压强对化学平衡的影响
拉活塞改变气体体积,记录体系中气体颜色变化
向3mL浓度分别为0.1 mol·L NaCl和0.1 mol·L NaI混合
D 比较 与 的
溶液中滴加几滴0.1 mol·L 溶液,出现黄色沉淀 大小
A.A B.B C.C D.D
12 . 室 温 下 , 用 溶 液 吸 收 的 过 程 如 图 所 示 。 已 知 ,
,下列说法正确的是( )
A.0.100 mol·L 溶液中:
B.0.100 mol·L 溶液中:
C.吸收烟气后的溶液中:
D.“沉淀”得到的上层清液中:
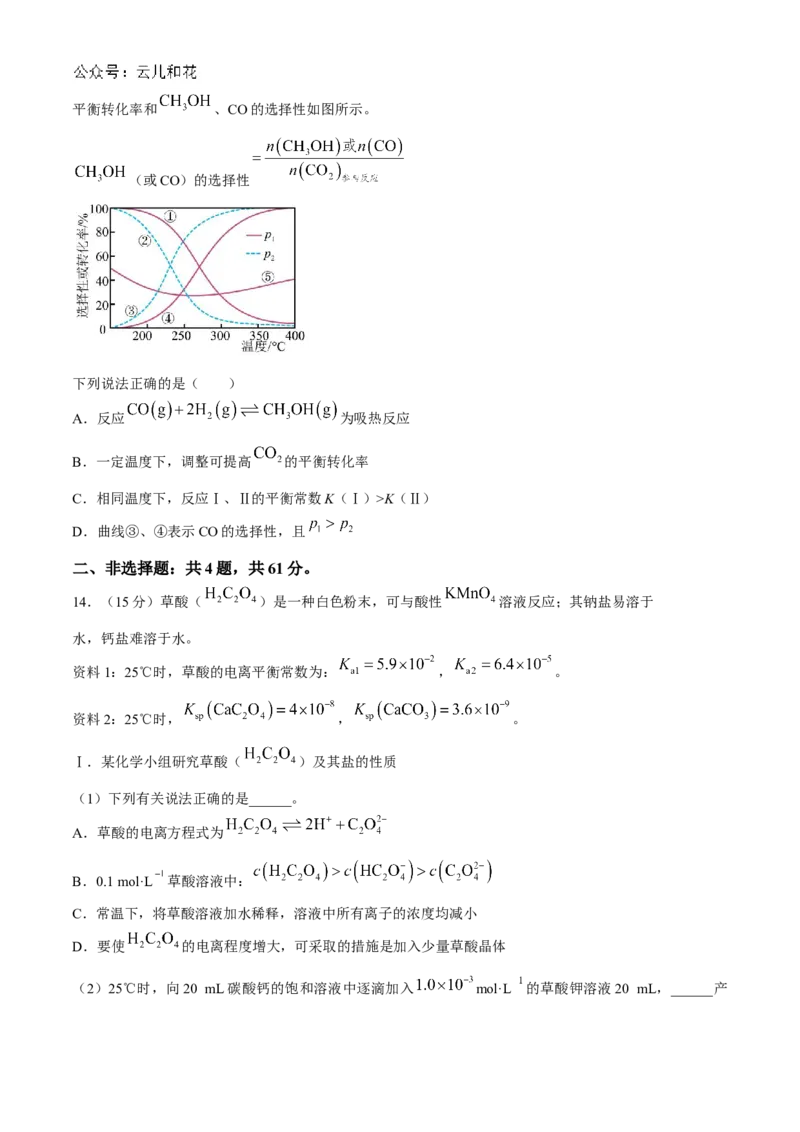
13. 催化加氢合成甲醇是重要的碳捕获利用与封存技术。 催化加氢主要反应有:
反应Ⅰ. kJ·mol
反应Ⅱ. kJ·mol
压强分别为 、 时,将 的混合气体置于密闭容器中反应,不同温度下体系中 的
学科网(北京)股份有限公司平衡转化率和 、CO的选择性如图所示。
(或CO)的选择性
下列说法正确的是( )
A.反应 为吸热反应
B.一定温度下,调整可提高 的平衡转化率
C.相同温度下,反应Ⅰ、Ⅱ的平衡常数K(Ⅰ)>K(Ⅱ)
D.曲线③、④表示CO的选择性,且
二、非选择题:共4题,共61分。
14.(15分)草酸( )是一种白色粉末,可与酸性 溶液反应;其钠盐易溶于
水,钙盐难溶于水。
资料1:25℃时,草酸的电离平衡常数为: , 。
资料2:25℃时, , 。
Ⅰ.某化学小组研究草酸( )及其盐的性质
(1)下列有关说法正确的是______。
A.草酸的电离方程式为
B.0.1 mol·L 草酸溶液中:
C.常温下,将草酸溶液加水稀释,溶液中所有离子的浓度均减小
D.要使 的电离程度增大,可采取的措施是加入少量草酸晶体
(2)25℃时,向20 mL碳酸钙的饱和溶液中逐滴加入 mol·L 的草酸钾溶液20 mL,______产
学科网(北京)股份有限公司生草酸钙沉淀(填“能”或“不能”)。
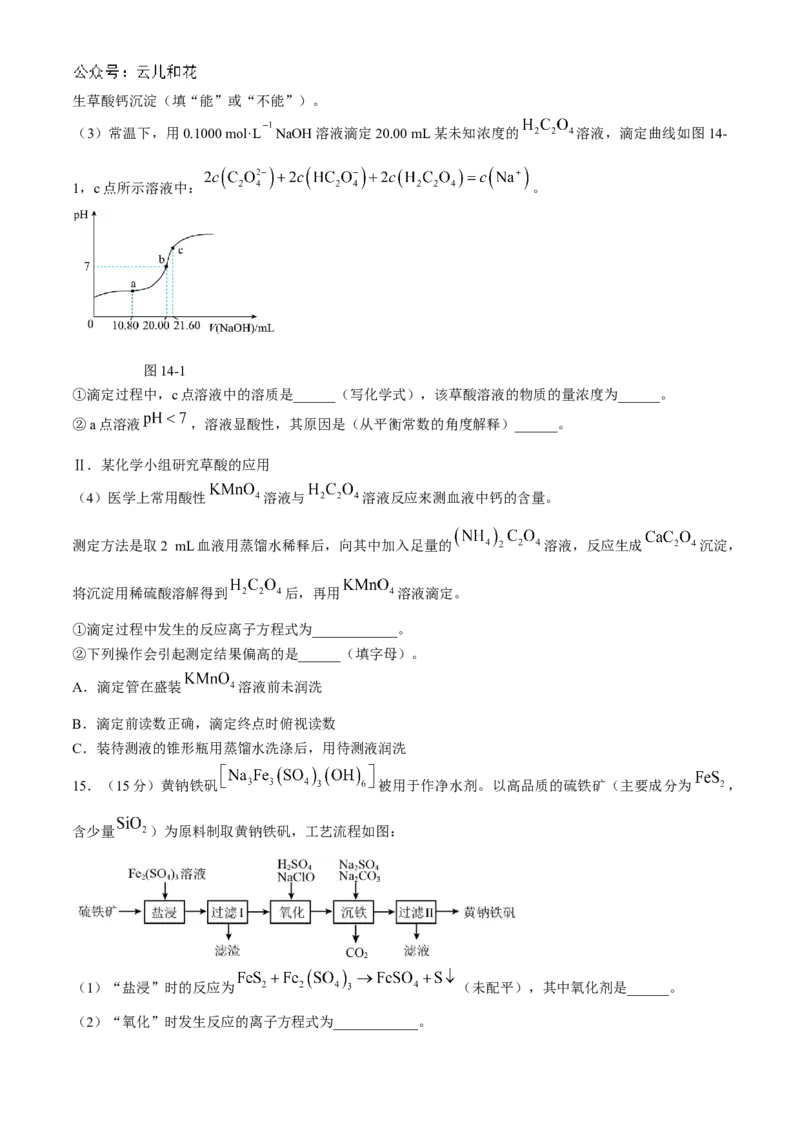
(3)常温下,用0.1000 mol·L NaOH溶液滴定20.00 mL某未知浓度的 溶液,滴定曲线如图14-
1,c点所示溶液中: 。
图14-1
①滴定过程中,c点溶液中的溶质是______(写化学式),该草酸溶液的物质的量浓度为______。
②a点溶液 ,溶液显酸性,其原因是(从平衡常数的角度解释)______。
Ⅱ.某化学小组研究草酸的应用
(4)医学上常用酸性 溶液与 溶液反应来测血液中钙的含量。
测定方法是取2 mL血液用蒸馏水稀释后,向其中加入足量的 溶液,反应生成 沉淀,
将沉淀用稀硫酸溶解得到 后,再用 溶液滴定。
①滴定过程中发生的反应离子方程式为____________。
②下列操作会引起测定结果偏高的是______(填字母)。
A.滴定管在盛装 溶液前未润洗
B.滴定前读数正确,滴定终点时俯视读数
C.装待测液的锥形瓶用蒸馏水洗涤后,用待测液润洗
15.(15分)黄钠铁矾 被用于作净水剂。以高品质的硫铁矿(主要成分为 ,
含少量 )为原料制取黄钠铁矾,工艺流程如图:
(1)“盐浸”时的反应为 (未配平),其中氧化剂是______。
(2)“氧化”时发生反应的离子方程式为____________。
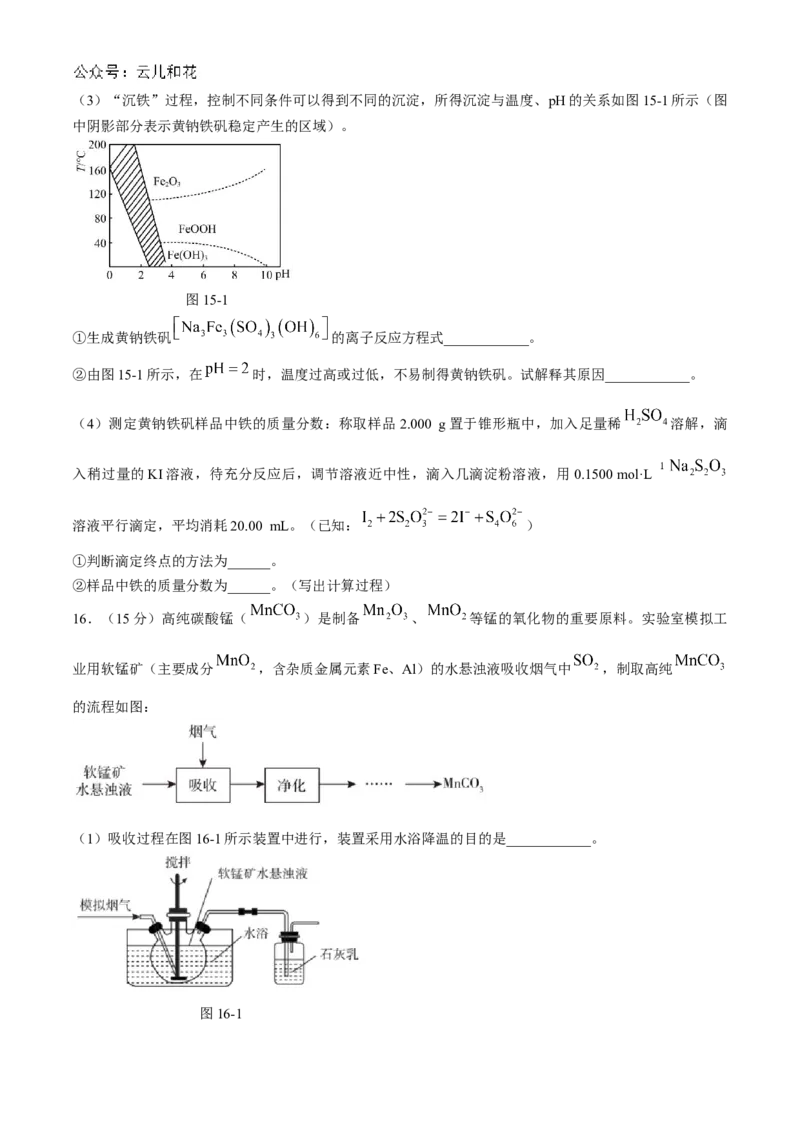
学科网(北京)股份有限公司(3)“沉铁”过程,控制不同条件可以得到不同的沉淀,所得沉淀与温度、pH的关系如图15-1所示(图
中阴影部分表示黄钠铁矾稳定产生的区域)。
图15-1
①生成黄钠铁矾 的离子反应方程式____________。
②由图15-1所示,在 时,温度过高或过低,不易制得黄钠铁矾。试解释其原因____________。
(4)测定黄钠铁矾样品中铁的质量分数:称取样品2.000 g置于锥形瓶中,加入足量稀 溶解,滴
入稍过量的KI溶液,待充分反应后,调节溶液近中性,滴入几滴淀粉溶液,用 0.1500 mol·L
溶液平行滴定,平均消耗20.00 mL。(已知: )
①判断滴定终点的方法为______。
②样品中铁的质量分数为______。(写出计算过程)
16.(15分)高纯碳酸锰( )是制备 、 等锰的氧化物的重要原料。实验室模拟工
业用软锰矿(主要成分 ,含杂质金属元素Fe、Al)的水悬浊液吸收烟气中 ,制取高纯
的流程如图:
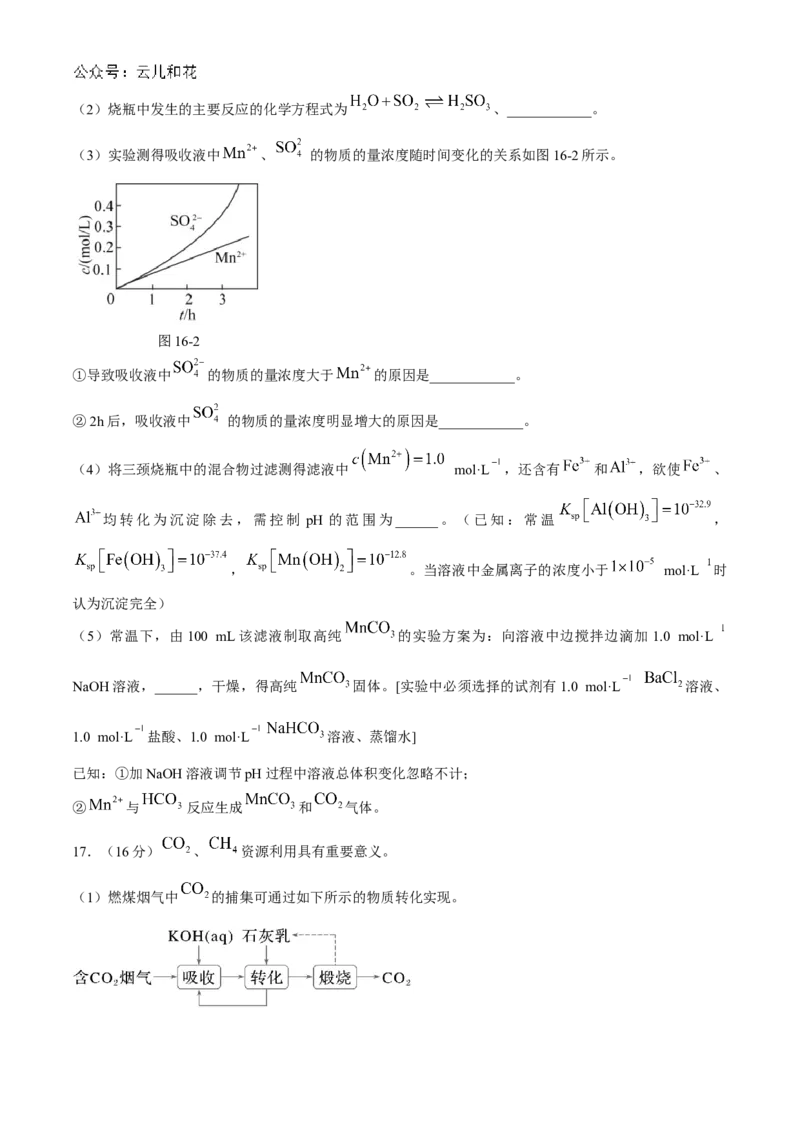
(1)吸收过程在图16-1所示装置中进行,装置采用水浴降温的目的是____________。
图16-1
学科网(北京)股份有限公司(2)烧瓶中发生的主要反应的化学方程式为 、____________。
(3)实验测得吸收液中 、 的物质的量浓度随时间变化的关系如图16-2所示。
图16-2
①导致吸收液中 的物质的量浓度大于 的原因是____________。
②2h后,吸收液中 的物质的量浓度明显增大的原因是____________。
(4)将三颈烧瓶中的混合物过滤测得滤液中 mol·L ,还含有 和 ,欲使 、
均转化为沉淀除去,需控制 pH 的范围为______。(已知:常温 ,
, 。当溶液中金属离子的浓度小于 mol·L 时
认为沉淀完全)
(5)常温下,由100 mL该滤液制取高纯 的实验方案为:向溶液中边搅拌边滴加 1.0 mol·L
NaOH溶液,______,干燥,得高纯 固体。[实验中必须选择的试剂有1.0 mol·L 溶液、
1.0 mol·L 盐酸、1.0 mol·L 溶液、蒸馏水]
已知:①加NaOH溶液调节pH过程中溶液总体积变化忽略不计;
② 与 反应生成 和 气体。
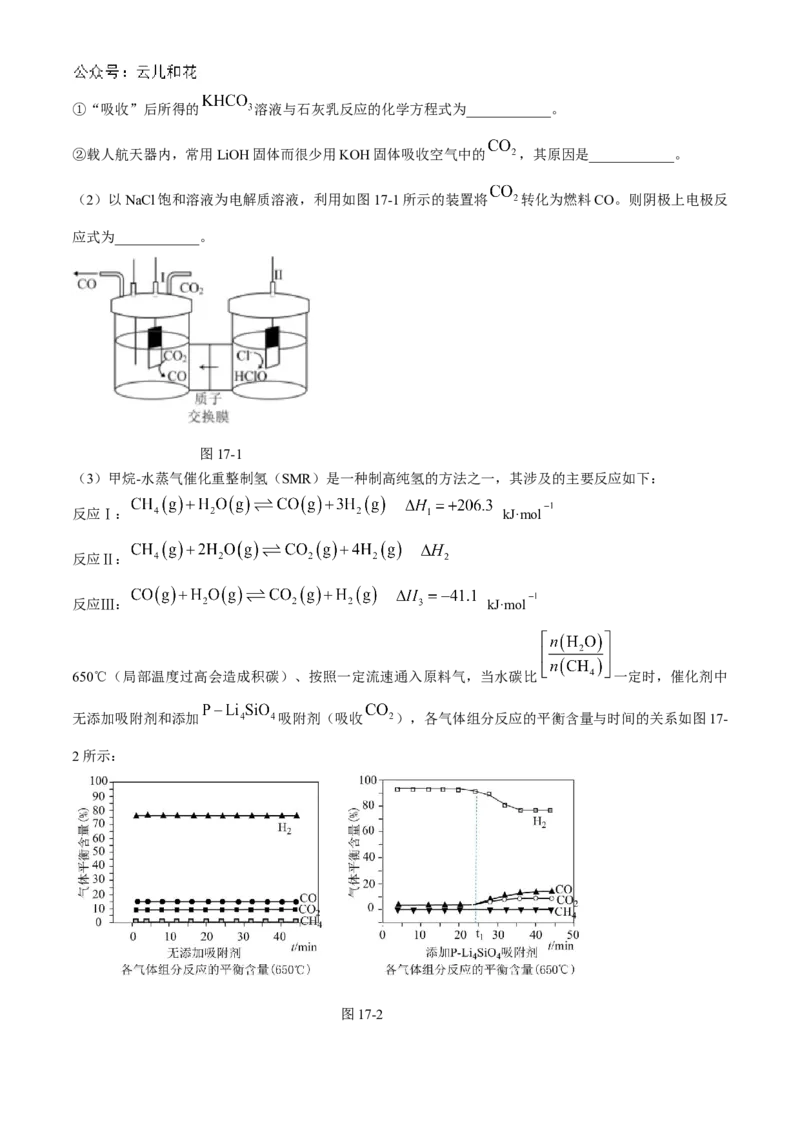
17.(16分) 、 资源利用具有重要意义。
(1)燃煤烟气中 的捕集可通过如下所示的物质转化实现。
学科网(北京)股份有限公司①“吸收”后所得的 溶液与石灰乳反应的化学方程式为____________。
②载人航天器内,常用LiOH固体而很少用KOH固体吸收空气中的 ,其原因是____________。
(2)以NaCl饱和溶液为电解质溶液,利用如图17-1所示的装置将 转化为燃料CO。则阴极上电极反
应式为____________。
图17-1
(3)甲烷-水蒸气催化重整制氢(SMR)是一种制高纯氢的方法之一,其涉及的主要反应如下:
反应Ⅰ: kJ·mol
反应Ⅱ:
反应Ⅲ: kJ·mol
650℃(局部温度过高会造成积碳)、按照一定流速通入原料气,当水碳比 一定时,催化剂中
无添加吸附剂和添加 吸附剂(吸收 ),各气体组分反应的平衡含量与时间的关系如图17-
2所示:
图17-2
学科网(北京)股份有限公司①反应Ⅱ的 ______kJ·mol 。
②催化剂中添加 吸附剂与无添加吸附剂比较, min前 的平衡含量升高, 、CO和
的平衡含量降低; min后 的平衡含量降低, 、CO和 的平衡含量升高,最后与无添
加吸附剂时的含量相同,可能的原因是____________。
③实验时发现 min后 的平衡含量低于理论平衡值,CO的平衡含量高于理论平衡值,可能的原因是
____________。(用化学反应方程式表示)
2024-2025 学年第一学期 10 月份六校联合调研试卷
高二化学参考答案
一、选择题:共13小题,每题3分,共39分。每题只有一个选项最符合题意。
1 2 3 4 5 6 7 8 9 10 11 12 13
B C B D A D C B A C B C D
二、非选择题
14.(15分)
(1)B(2分)(2)不能(2分)
(3)① (1分),0.054 mol/L(2分)
②a点溶液中的溶质是 , , ,前者大于后者,所以电离
程度大于水解程度,溶液显酸性。(3分)
(4) (3分)
②AC(2分)
15.(15分)
(1) (2分)(2) (3分)
(3)① (3分)
②温度过高, 水解程度增大并分解为 导致产率低;温度过低, 水解程度小,不易生成黄
钠铁矾(2分)
(4)①滴入最后一滴 溶液,溶液由蓝色变为无色,且30s内颜色不复原(2分)
学科网(北京)股份有限公司② , ,可知: (1分)
则有: mol,(1分)
则黄钠铁矾中Fe的质量分数为: (1分)
16.(15分)
(1)增大 的溶解性(2分);(2) (3分)
(3)①部分 (或 )在溶液中被氧气氧化生成 (2分),
② 对氧气氧化 (或 )具有催化作用(2分),
(4) (3分)
(5)同时不断测定溶pH,当 时停止滴加,过滤,向所得滤液中边搅拌边加入200 mL 1.0
mol·L 溶液,过滤,用蒸馏水洗涤滤渣,至取最后一次洗涤滤液加入1.0 mol·L 溶液无
沉淀生成,停止洗涤(4分)
17.(16分)
(1)① (3分)
②相同质量的LiOH固体可吸收更多二氧化碳(2分)
(2) (3分)
(3)①+165.2(2分)
②)添加 吸附剂,降低了 的浓度,反应Ⅱ、Ⅲ平衡正向移动; min后, 吸
附剂失效。(3分)
③ (3分)
学科网(北京)股份有限公司