文档内容
试题类型A
绝密★启用前
C.风力发电机 D.新能源汽车电池
怀仁大地高中学校 2025-2026 学年上学期第一次月考 A.A B.B C.C D.D
3.下列化学反应过程中的能量变化与下图相符的是
高二化学
(考试时间:75分钟 试卷满分:100分)
注意事项:
1. 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。答卷前,考生务必将自己的姓名、准考证号
填写在答题卡上。
2. 回答第Ⅰ卷时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮 A. B.
擦干净后,再选涂其他答案标号。写在本试卷上无效。
3. 回答第Ⅱ卷时,将答案写在答题卡上。写在本试卷上无效。
C. D.
4. 考试结束后,将答题卡交回。
第Ⅰ卷
4.反应 的能量变化示意图如图所示。下列说法正确的是
一、选择题:本题共14小题,每题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列说法或表示正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B. 金刚石,s 石墨,s ,所以石墨比金刚石稳定
C.已知: ,则 的燃烧热为
D.HCl和NaOH反应的中和热 ,则 和 反应的反应热 A. 和 的内能之和为
B.该反应每生成1molAB,放出能量
C.该反应每生成2个AB分子,吸收能量
2.“能源”是人们生活中不可或缺的一部分。下列属于将化学能转化为热能的是
D.反应 吸收的能量
5.以 为原料合成 的相关反应为:① ;②
。部分键能数据如下表所示,则 共价键的键能是
A.太阳能热水器烧水 B.自热火锅发热包
共价键
键能/ 803 414 326 464
A. B. C. D.
化学试题 第15页(共48页) 化学试题 第16页(共48页)
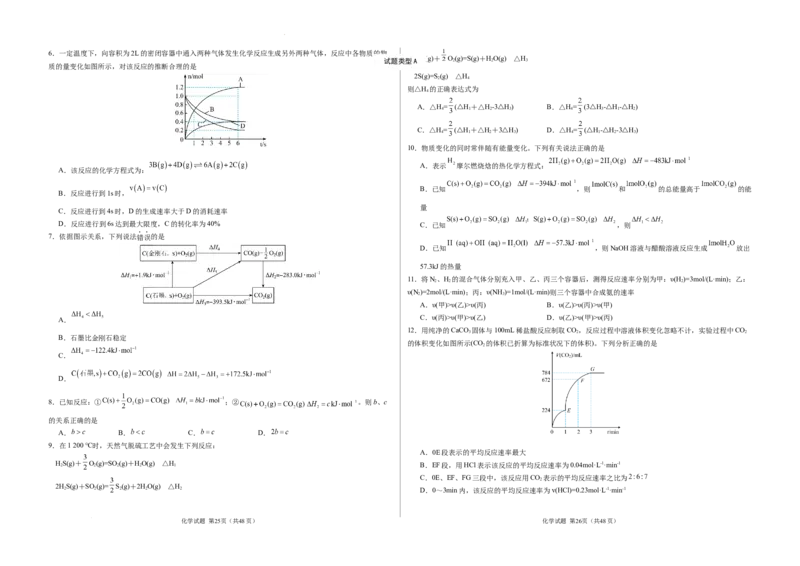
学科网(北京)股份有限公司6.一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应生成另外两种气体,反应中各物质的物
HS(g)+ O(g)=S(g)+HO(g) △H
试题类型A 2 2 2 3
质的量变化如图所示,对该反应的推断合理的是
2S(g)=S(g) △H
2 4
则△H 的正确表达式为
4
A.△H= (△H+△H-3△H) B.△H= (3△H-△H-△H)
4 1 2 3 4 3 1 2
C.△H= (△H+△H+3△H) D.△H= (△H-△H-3△H)
4 1 2 3 4 1 2 3
10.物质变化的同时常伴随有能量变化。下列有关说法正确的是
A.表示 摩尔燃烧焓的热化学方程式:
A.该反应的化学方程式为:
B.已知 ,则 和 的总能量高于 的能
B.反应进行到1s时,
量
C.反应进行到4s时,D的生成速率大于D的消耗速率
D.反应进行到6s达到最大限度,C的转化率为40% C.已知 ,则
7.依据图示关系,下列说法错误的是
D.已知 ,则NaOH溶液与醋酸溶液反应生成 放出
57.3kJ的热量
11.将N、H 的混合气体分别充入甲、乙、丙三个容器后,测得反应速率分别为甲:υ(H )=3mol/(L·min);乙:
2 2 2
υ(N )=2mol/(L·min);丙:υ(NH )=1mol/(L·min)则三个容器中合成氨的速率
2 3
A.υ(甲)>υ(乙)>υ(丙) B.υ(乙)>υ(丙)>υ(甲)
C.υ(丙)>υ(甲)>υ(乙) D.υ(乙)>υ(甲)>υ(丙)
A.
12.用纯净的CaCO 固体与100mL稀盐酸反应制取CO,反应过程中溶液体积变化忽略不计,实验过程中CO
3 2 2
B.石墨比金刚石稳定
的体积变化如图所示(CO 的体积已折算为标准状况下的体积)。下列分析正确的是
2
C.
D.
8.已知反应:① ;② 。则b、c
的关系正确的是
A. B. C. D.
9.在1 200 ℃时,天然气脱硫工艺中会发生下列反应:
A.0E段表示的平均反应速率最大
H 2 S(g)+ O 2 (g)=SO 2 (g)+H 2 O(g) △H 1 B.EF段,用HCl表示该反应的平均反应速率为0.04mol·L-1·min-1
C.0E、EF、FG三段中,该反应用CO 表示的平均反应速率之比为
2
2HS(g)+SO (g)= S(g)+2HO(g) △H
2 2 2 2 2 D.0~3min内,该反应的平均反应速率为v(HCl)=0.23mol·L-1·min-1
化学试题 第25页(共48页) 化学试题 第26页(共48页)
学科网(北京)股份有限公司A.一定温度下容器中压强不变 B.混合气体中c(CO)不变
13.常温下向烧杯中加入 溶液、 溶液和稀硫酸,发生反应:
C.v (H )=v (H O) D.c(CO)=c(CO)
正 2 逆 2 2
E.氢气转化率不变
。下列情况表明上述可逆反应达到平衡状态的
(4)下列措施可以提高H 的平衡转化率的是___________(填字母)
2
试题类型A
是 A.选择适当的催化剂 B.增大压强
C.及时分离HO(g) D.升高温度
2
A. 保持不变 B. 保持不变
(5)某温度下,平衡浓度符合下式:c(CO)·c(H)=c(CO)·c(HO),试判断此时的温度为 ℃。
2 2 2
(6)800℃,某时刻测得c(CO)=0.5mol·L-1,c(CO)=0.5mol·L-1,c(H)=1.5mol·L-1,c(HO)=0.5mol·L-1,则此时反应
2 2 2
C.溶液pH不再变化 D. 是否达到平衡状态 (填“是”“否”)。此时,v v (填“<”“>”“=”)。
正 逆
16.(10分)碳是形成化合物种类最多的元素,其单质及其化合物是人类生产生活的主要能源物质。请回答下
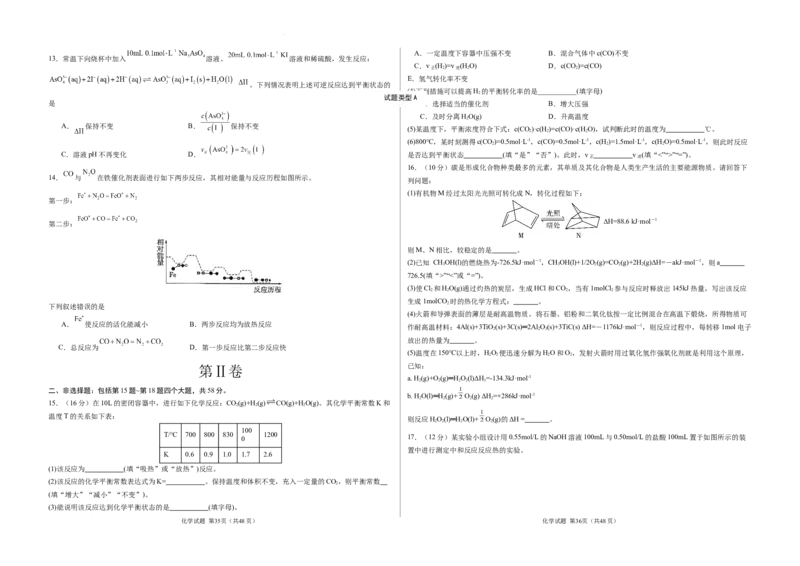
14. 与 在铁催化剂表面进行如下两步反应,其相对能量与反应历程如图所示。
列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
第一步:
ΔH=88.6 kJ·mol-1
第二步:
则M、N相比,较稳定的是 。
(2)已知 CHOH(l)的燃烧热为-726.5kJ·mol-1,CHOH(l)+1/2O(g)=CO (g)+2H(g)ΔH=-akJ·mol-1,则a
3 3 2 2 2
726.5(填“>”“<”或“=”)。
(3)使Cl 和HO(g)通过灼热的炭层,生成HCl和CO,当有1molCl 参与反应时释放出145kJ热量,写出该反应
2 2 2 2
生成1molCO 时的热化学方程式: 。
2
下列叙述错误的是
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可
A. 使反应的活化能减小 B.两步反应均为放热反应
作耐高温材料:4Al(s)+3TiO (s)+3C(s)═2Al O(s)+3TiC(s) ΔH=-1176kJ·mol-1,则反应过程中,每转移1mol电子
2 2 3
放出的热量为 。
C.总反应为 D.第一步反应比第二步反应快
(5)温度在150℃以上时,HO 便迅速分解为HO和O,发射火箭时用过氧化氢作强氧化剂就是利用这个原理,
2 2 2 2
第Ⅱ卷 已知:
a. H(g)+O(g)═H O(l)ΔH=-134.3kJ·mol-1
2 2 2 2 1
二、非选择题:包括第15题~第18题四个大题,共58分。
b. HO(l)═H (g)+ O(g) ΔH =+286kJ·mol-1
2 2 2 2
15.(16分)在10L的密闭容器中,进行如下化学反应:CO(g)+H(g) CO(g)+HO(g)。其化学平衡常数K和
2 2 2
温度T的关系如下表:
则反应HO(l)═H O(l)+ O(g)的ΔH = 。
2 2 2 2
100
T/℃ 700 800 830 1200
0 17.(12分)某实验小组设计用0.55mol/L的NaOH溶液100mL与0.50mol/L的盐酸100mL置于如图所示的装
置中进行测定中和反应反应热的实验。
K 0.6 0.9 1.0 1.7 2.6
(1)该反应为 (填“吸热”或“放热”)反应。
(2)该反应的化学平衡常数表达式为K= 。保持温度和体积不变,充入一定量的CO,则平衡常数
2
(填“增大”“减小”“不变”)。
(3)能说明该反应达到化学平衡状态的是 (填字母)。
化学试题 第35页(共48页) 化学试题 第36页(共48页)
学科网(北京)股份有限公司“>”、“<”或“=”)
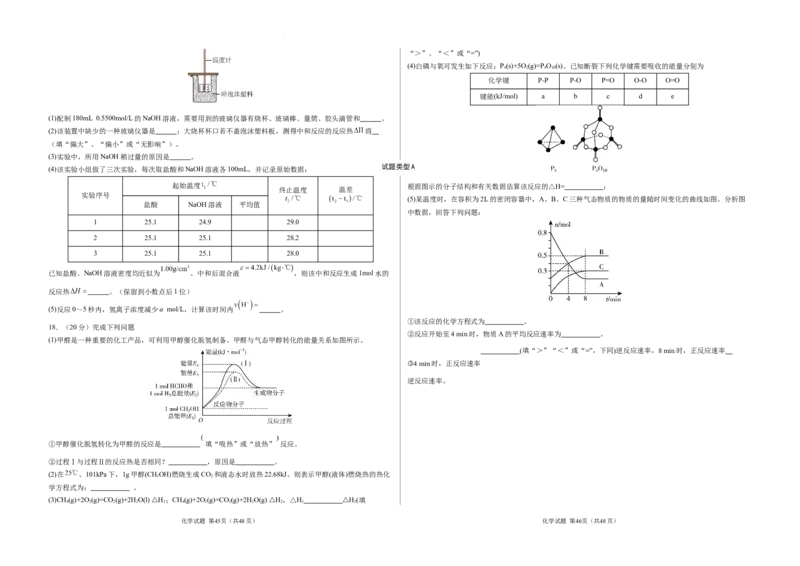
(4)白磷与氧可发生如下反应:P(s)+5O(g)=P O (s)。已知断裂下列化学键需要吸收的能量分别为
4 2 4 10
化学键 P-P P-O P=O O-O O=O
键能(kJ/mol) a b c d e
(1)配制180mL 0.5500mol/L的NaOH溶液,需要用到的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管和 。
(2)该装置中缺少的一种玻璃仪器是 ;大烧杯杯口若不盖泡沫塑料板,测得中和反应的反应热 将
(填“偏大”、“偏小”或“无影响”)。
(3)实验中,所用NaOH稍过量的原因是 。
试题类型A
(4)该实验小组做了三次实验,每次取盐酸和NaOH溶液各100mL,并记录原始数据:
起始温度 根据图示的分子结构和有关数据估算该反应的△H= ;
终止温度 温差
实验序号
(5)某温度时,在容积为2L的密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图。分析图
盐酸 NaOH溶液 平均值
中数据,回答下列问题:
1 25.1 24.9 29.0
2 25.1 25.1 28.2
3 25.1 25.1 28.0
已知盐酸、NaOH溶液密度均近似为 。中和后混合液 ,则该中和反应生成1mol水的
反应热 。(保留到小数点后1位)
(5)反应0~5秒内,氢离子浓度减少a mol/L,计算该时间内 。
①该反应的化学方程式为 。
18.(20分)完成下列问题
②反应开始至4 min时,物质A的平均反应速率为 。
(1)甲醛是一种重要的化工产品,可利用甲醇催化脱氢制备。甲醛与气态甲醇转化的能量关系如图所示。
(填“>”“<”或“=”,下同)逆反应速率,8 min时,正反应速率
③4 min时,正反应速率
逆反应速率。
①甲醇催化脱氢转化为甲醛的反应是 填“吸热”或“放热” 反应。
②过程Ⅰ与过程Ⅱ的反应热是否相同? ,原因是 。
(2)在 、101kPa下,1g甲醇(CHOH)燃烧生成CO 和液态水时放热22.68kJ。则表示甲醇(液体)燃烧热的热化
3 2
学方程式为: 。
(3)CH (g)+2O(g)=CO (g)+2HO(l) △H ;CH(g)+2O(g)=CO (g)+2HO(g) △H,△H △H(填
4 2 2 2 1 4 2 2 2 2 1 2
化学试题 第45页(共48页) 化学试题 第46页(共48页)
学科网(北京)股份有限公司