文档内容
南京市协同体七校 2024—2025 学年第一学期期中联合考试
高三化学试题
考试时间:75分钟 满分:100分
注意事项:
1.本试卷所有试题必须作答在答题卡上规定的位置,否则不给分
2.答题务必将自己姓名,准考证信息用0.5毫米黑色墨水签字笔填写在试卷答题卡上.
可能用到的相对原子质量:H—1 C—12 O—16 Fe—56
一、 单项选择题:共13题,每题3分,共39分。 每题只有一个选项最符合题意。
1.我国科学家已经实现了从CO 到淀粉的全合成,下列有关说法正确的是( )
2
A.CO 为碱性氧化物 B.淀粉结构中含有
2
C.全合成属于化学变化 D.全合成过程中CO 作还原剂
2
2.工业上由 、 和 可制备 。下列说法中正确的是( )
A. 的电子式为 B. 中含有非极性共价键
C. 中 元素的化合价为+4价 D. 的空间结构为直线形
3.下列比较关系正确的是( )
A.第一电离能:N>O B.还原性:HBr>HI
C.碱性:Al(OH)>Mg(OH) D.离子半径:Na+>F-
3 2
4.氯气可用来制备将氢氧化铁氧化为高铁酸根离子的氧化剂,下列装置应用于实验室制氯气
并回收氯化锰的实验,能达到实验目的的是( )
A.用装置甲制取Cl
2
B.用装置乙除去Cl 中少量HCl
2
C.用装置丙分离MnO 和MnCl 溶液
2 2
D.用装置丁蒸干MnCl 溶液制MnCl·4HO
2 2 25.下列化学反应表示正确的是( )
A.少量 通入NaClO溶液中:
B.向饱和食盐水中通入氨气和过量二氧化碳
C.用惰性电极电解饱和NaCl溶液:
D.稀硫酸与稀氢氧化钾溶液发生反应:
6.下列有关物质的性质与用途具有对应关系的是( )
A. 易溶于水,可用于工业电解制备镁
B.NaClO溶液具有碱性,可用NaClO作漂白液
C. 熔点较高,可用作干燥剂
D. 水解生成具有吸附性的 胶体,可用作净水剂
7.在给定条件下,下列制备过程涉及的物质转化均可实现的是( )
A.HCl制备: 溶液 和
B.金属Mg制备: 溶液
C.纯碱工业: 溶液
D.硫酸工业:
8.利用硝酸工业的尾气(含NO、NO)获得Ca(NO) 的部分工艺流程如下:
2 2 2
下列说法不正确的是 ( )
A. 反应NO(g)+NO(g) NO(g)的ΔS<0
2 2 3
B. 若尾气中n(NO)∶n(NO)<1∶1,Ca(NO) 产品中Ca(NO) 含量升高
2 2 2 3 2
C.为使尾气中NOx被充分吸收,尾气与石灰乳采用气液逆流接触吸收D. Ca(NO)
在酸性溶液中分解的离子方程式为3NO-
+2H+
NO-
+2NO↑+HO
2 2 2 3 2
9.阿托酸甲酯能用于治疗肠道疾病,它可由阿托酸经过下列反应合成:
下列说法正确的是( )
A.阿托酸甲酯的分子式为
B.阿托酸可发生取代反应、加成反应和消去反应
C.阿托酸苯环上的二氯代物共有5种
D. 阿托酸分子最多能与 氢气发生加成反应
10.通过2NO(g)+2CO(g) 2CO(g)+N(g) ΔH=-746.5kJ·mol-1催化还原的方法,可将汽
⇌ 2 2
车尾气中有害气体转化为无害气体。下列说法正确的是( )
A.该反应在任何条件下都能自发进行
B.反应的平衡常数可表示为K=
C.其它条件不变,增大 的值,NO的转化率下降
D.使用高效的催化剂可以降低反应的焓变
11.根据实验操作和现象,下列得出的结论正确的是( )
选
实验操作和现象 实验结论
项
某待测溶液中先加入Ba(NO) 溶液,产生白色沉淀,再加足量的盐 该待测溶液含有
A 3 2
酸,仍有白色沉淀
B 向FeCl 溶液中滴加KI-淀粉溶液,溶液变蓝 氧化性:Fe3+>I
3 2
将体积大小相同的镁片和铝片用导线连接好,同时插入盛有浓NaOH 金属性Al比Mg
C
溶液的烧杯中。镁片表面有大量气泡,铝片逐渐溶解 强
将乙醇和浓硫酸的混合液加热,将生成的气体通入溴水中,溴水褪 乙醇只发生了消
D
色 去反应A.A B.B C.C D.D
12.有机酸种类繁多,甲酸(HCOOH)是常见的一元酸,常温下,Ka=1.8×10-4;草酸(HCO)是
2 2 4
常见的二元酸,常温下,Ka=5.4×10-2,Ka=5.4×10-5。下列说法错误的是( )
1 2
A.甲酸钠溶液中:c(Na+)>c(HCOO-)>c(H+)>c(OH-)
B.草酸氢钠溶液中加入甲酸钠溶液至中性:c(Na+)=c(HCO )+2c(CO )+c(HCOO-)
2 2
C.NaCO 溶液中:c(HCO )+2c(HCO)+c(H+)=c(OH-)
2 2 4 2 2 2 4
D.足量甲酸与草酸钠溶液反应:
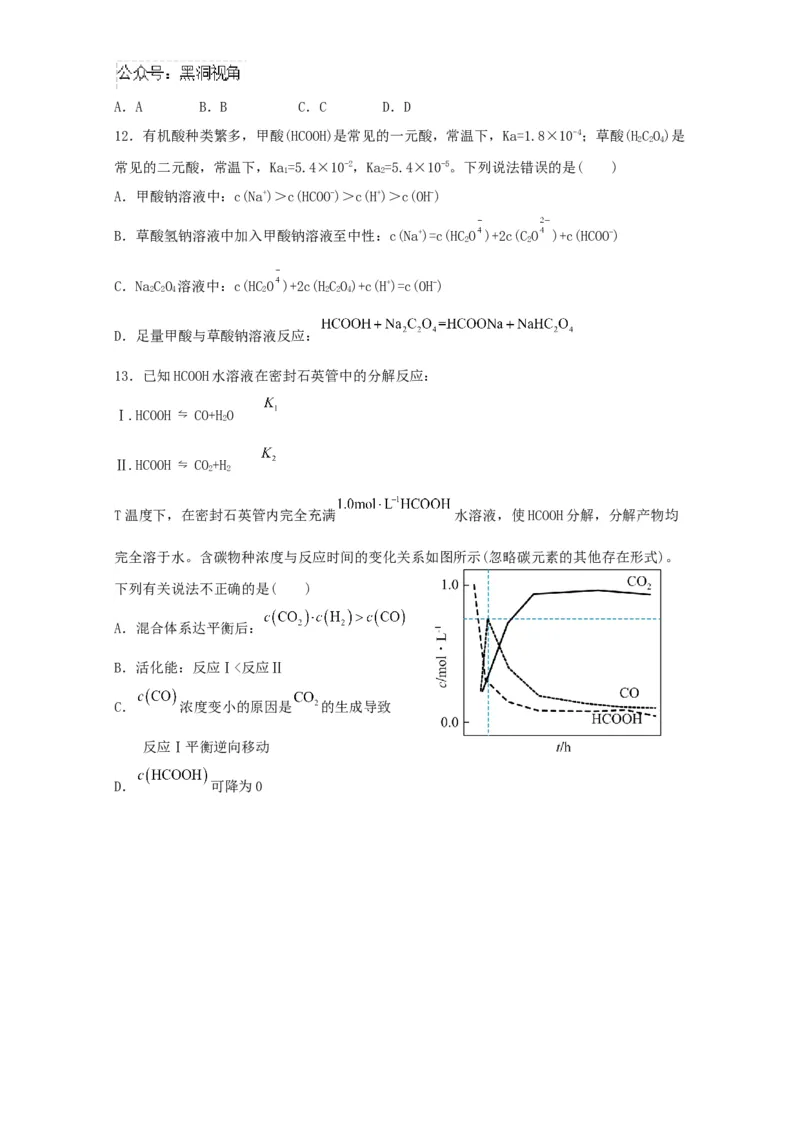
13.已知HCOOH水溶液在密封石英管中的分解反应:
Ⅰ.HCOOH ⇋ CO+HO
2
Ⅱ.HCOOH ⇋ CO+H
2 2
T温度下,在密封石英管内完全充满 水溶液,使HCOOH分解,分解产物均
完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。
下列有关说法不正确的是( )
A.混合体系达平衡后:
B.活化能:反应Ⅰ<反应Ⅱ
C. 浓度变小的原因是 的生成导致
反应Ⅰ平衡逆向移动
D. 可降为0二、非选择题:共4题,共61分。
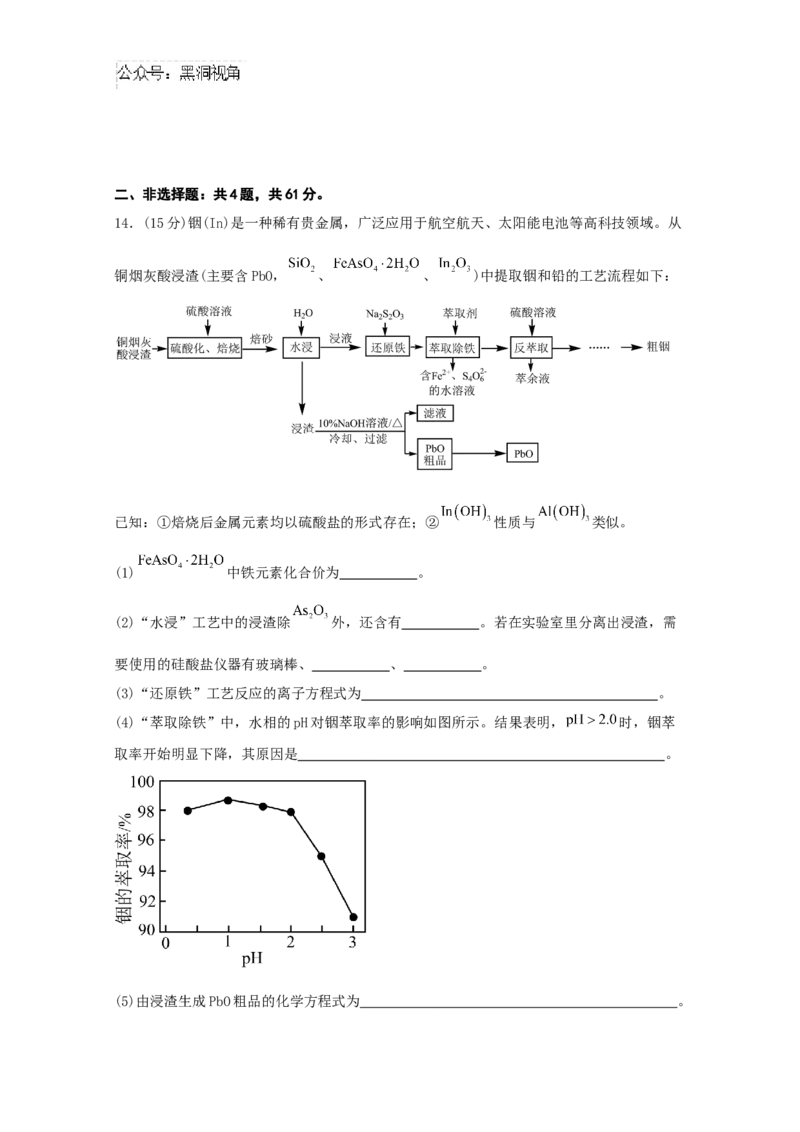
14.(15分)铟(In)是一种稀有贵金属,广泛应用于航空航天、太阳能电池等高科技领域。从
铜烟灰酸浸渣(主要含PbO, 、 、 )中提取铟和铅的工艺流程如下:
已知:①焙烧后金属元素均以硫酸盐的形式存在;② 性质与 类似。
(1) 中铁元素化合价为 。
(2)“水浸”工艺中的浸渣除 外,还含有 。若在实验室里分离出浸渣,需
要使用的硅酸盐仪器有玻璃棒、 、 。
(3)“还原铁”工艺反应的离子方程式为 。
(4)“萃取除铁”中,水相的pH对铟萃取率的影响如图所示。结果表明, 时,铟萃
取率开始明显下降,其原因是 。
(5)由浸渣生成PbO粗品的化学方程式为 。(6)整个工艺流程中,可循环利用的溶液是 。
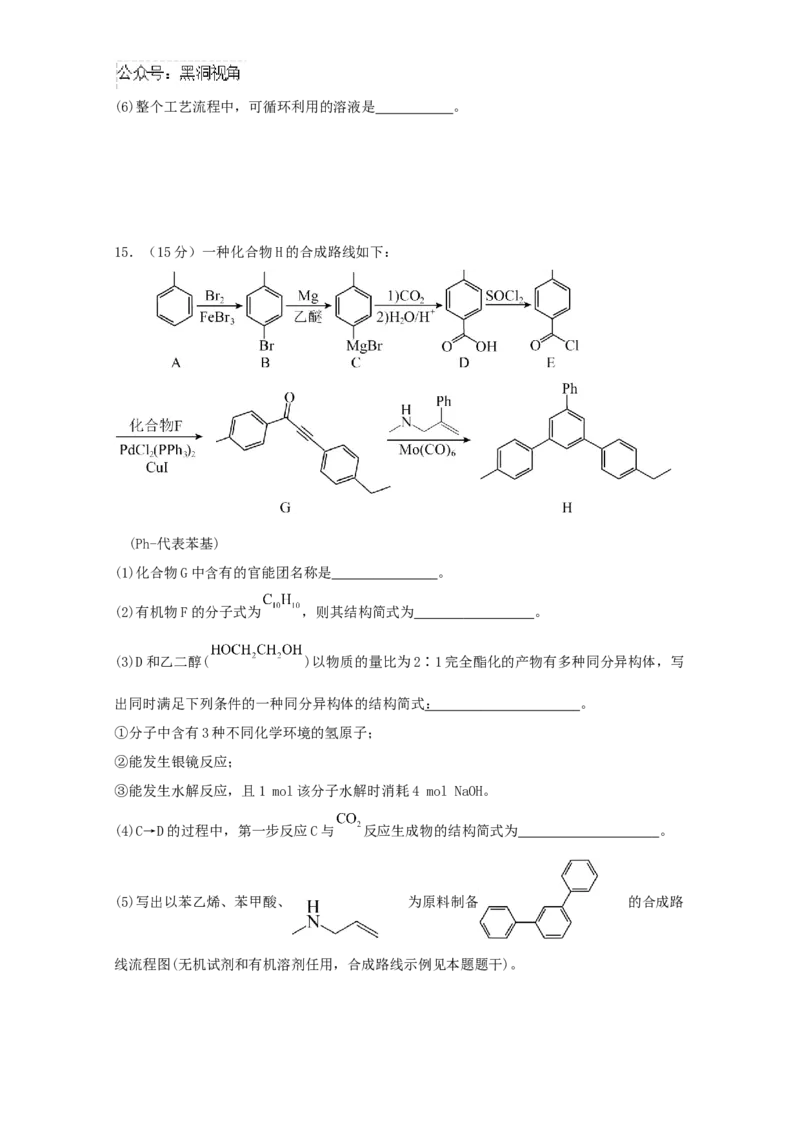
15.(15分)一种化合物H的合成路线如下:
(Ph-代表苯基)
(1)化合物G中含有的官能团名称是 。
(2)有机物F的分子式为 ,则其结构简式为 。
(3)D和乙二醇( )以物质的量比为2∶1完全酯化的产物有多种同分异构体,写
出同时满足下列条件的一种同分异构体的结构简式 : 。
①分子中含有3种不同化学环境的氢原子;
②能发生银镜反应;
③能发生水解反应,且1 mol该分子水解时消耗4 mol NaOH。
(4)C→D的过程中,第一步反应C与 反应生成物的结构简式为 。
(5)写出以苯乙烯、苯甲酸、 为原料制备 的合成路
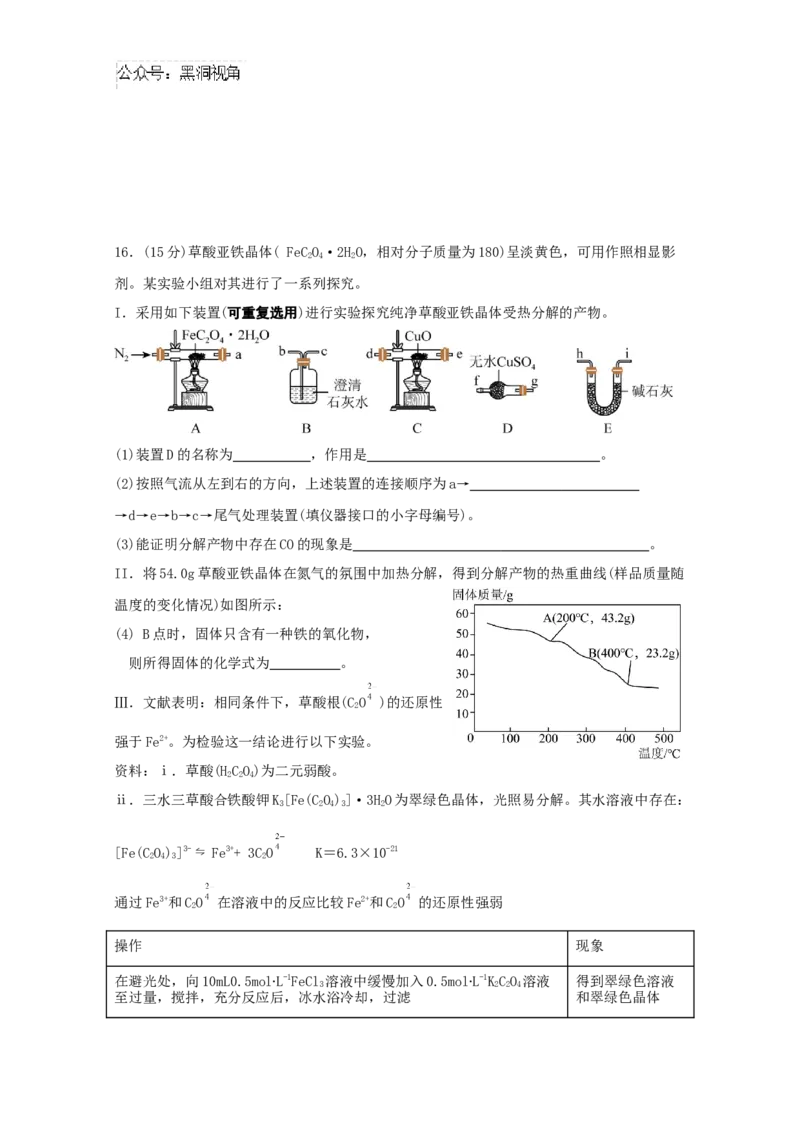
线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)。16.(15分)草酸亚铁晶体( FeCO·2HO,相对分子质量为180)呈淡黄色,可用作照相显影
2 4 2
剂。某实验小组对其进行了一系列探究。
I.采用如下装置(可重复选用)进行实验探究纯净草酸亚铁晶体受热分解的产物。
(1)装置D的名称为 ,作用是 。
(2)按照气流从左到右的方向,上述装置的连接顺序为a→
→d→e→b→c→尾气处理装置(填仪器接口的小字母编号)。
(3)能证明分解产物中存在CO的现象是 。
II.将54.0g草酸亚铁晶体在氮气的氛围中加热分解,得到分解产物的热重曲线(样品质量随
温度的变化情况)如图所示:
(4) B点时,固体只含有一种铁的氧化物,
则所得固体的化学式为 。
Ⅲ.文献表明:相同条件下,草酸根(CO )的还原性
2
强于Fe2+。为检验这一结论进行以下实验。
资料:ⅰ.草酸(HCO)为二元弱酸。
2 2 4
ⅱ.三水三草酸合铁酸钾K[Fe(CO)]·3HO为翠绿色晶体,光照易分解。其水溶液中存在:
3 2 4 3 2
[Fe(CO)]3- ⇋ Fe3++ 3CO K=6.3×10-21
2 4 3 2
通过Fe3+和CO 在溶液中的反应比较Fe2+和CO 的还原性强弱
2 2
操作 现象
在避光处,向10mL0.5mol∙L-1FeCl 溶液中缓慢加入0.5mol∙L-1KCO 溶液 得到翠绿色溶液
3 2 2 4
至过量,搅拌,充分反应后,冰水浴冷却,过滤 和翠绿色晶体(5)取实验中的少量晶体洗净,配成溶液,滴加KSCN溶液,不变红。继续加入硫酸,溶液变
红。加硫酸后溶液变红的原因是 。
(6)经检验,翠绿色晶体为K[Fe(CO)]·3HO。请设计实验,确认实验中没有发生氧化还原
3 2 4 3 2
反应的操作和现象是 。
17. (16分)乙硫醇(CHSH)的综合利用及治理是当前环境领域关注的焦点之一。
2 5
(1) 家用煤气中可掺入微量具有难闻气味的乙硫醇。
已知:CHOH(g)+HS(g) CHSH(g)+HO(g) ΔH=-32 kJ/mol
2 5 2 2 5 2 1
CHOH(g)+3O(g) 2CO(g)+3HO(g) ΔH=-1 277 kJ/mol
2 5 2 2 2 2
2HS(g)+3O(g) 2SO(g)+2HO(g) ΔH=-1 036 kJ/mol
2 2 2 2 3
则反应2CHSH(g)+9O(g) 4CO(g)+6HO(g)+2SO(g)的ΔH= 。
2 5 2 2 2 2
(2) KFeO 是一种高效多功能的新型绿色水处理剂,可用于除去废水中的CHSH。已知CHSH
2 4 2 5 2 5
水溶液中的物种分布分数如图1所示。
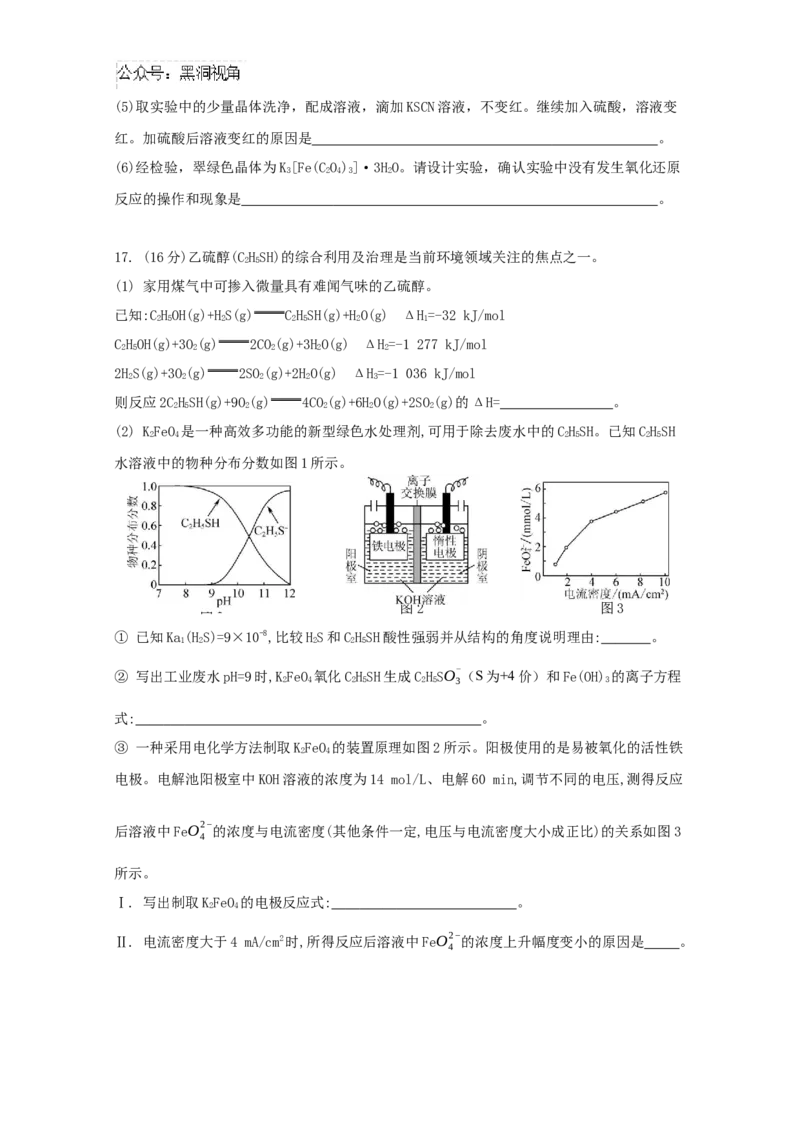
图1 图2 图3
① 已知Ka(HS)=9×10-8,比较HS和CHSH酸性强弱并从结构的角度说明理由: 。
1 2 2 2 5
② 写出工业废水pH=9时,KFeO
氧化CHSH生成CHSO-
(S为+4价)和Fe(OH) 的离子方程
2 4 2 5 2 5 3 3
式: 。
③ 一种采用电化学方法制取KFeO 的装置原理如图2所示。阳极使用的是易被氧化的活性铁
2 4
电极。电解池阳极室中KOH溶液的浓度为14 mol/L、电解60 min,调节不同的电压,测得反应
后溶液中FeO2−
的浓度与电流密度(其他条件一定,电压与电流密度大小成正比)的关系如图3
4
所示。
Ⅰ. 写出制取KFeO 的电极反应式: 。
2 4
Ⅱ. 电流密度大于4
mA/cm2时,所得反应后溶液中FeO2−
的浓度上升幅度变小的原因是 。
4