文档内容
化学
注意:本试卷分第一部分选择题和第二部分非选择题,共100分,考试时间75分钟。
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 S-32 C1-35.5 K-39 Co-59
单项选择题:本题包括13小题,每小题3分,共计39分。每小题只有一个选项符合题意。
1.2024年4月24日是第九个“中国航天日”,主题是“极目楚天 共襄星汉”。下列有关中国空间站说
法不正确的是( )
A.太阳能电池中的单晶硅——半导体材料
B.外层的热控保温材料石墨烯——无机材料
C.外表面的高温结构碳化硅陶瓷——硅酸盐材料
D.外壳的烧蚀材料之一酚醛树脂——高分子材料
2.反应 可制含氯消毒剂。下列说法正确的
( )
A.HCl和NaCl所含化学键类型相同 B. 的空间结构为三角锥形
C. 是由极性键构成的非极性分子 D.中子数为18的Cl原子:
3.实验室制取 并探究其性质的实验原理和装置均正确的是( )
A. 制取 B. 收集
C. 验证 漂白性 D. 吸收尾气中的
4.对金属材料中C、H、O、N、S的含量进行定性和定量分析,可以确定金属材料的等级。下列说法正确
的是( )
A.电离能大小: B.沸点高低:
C.酸性强弱: D.半径大小:
阅读下列材料,完成5~7题
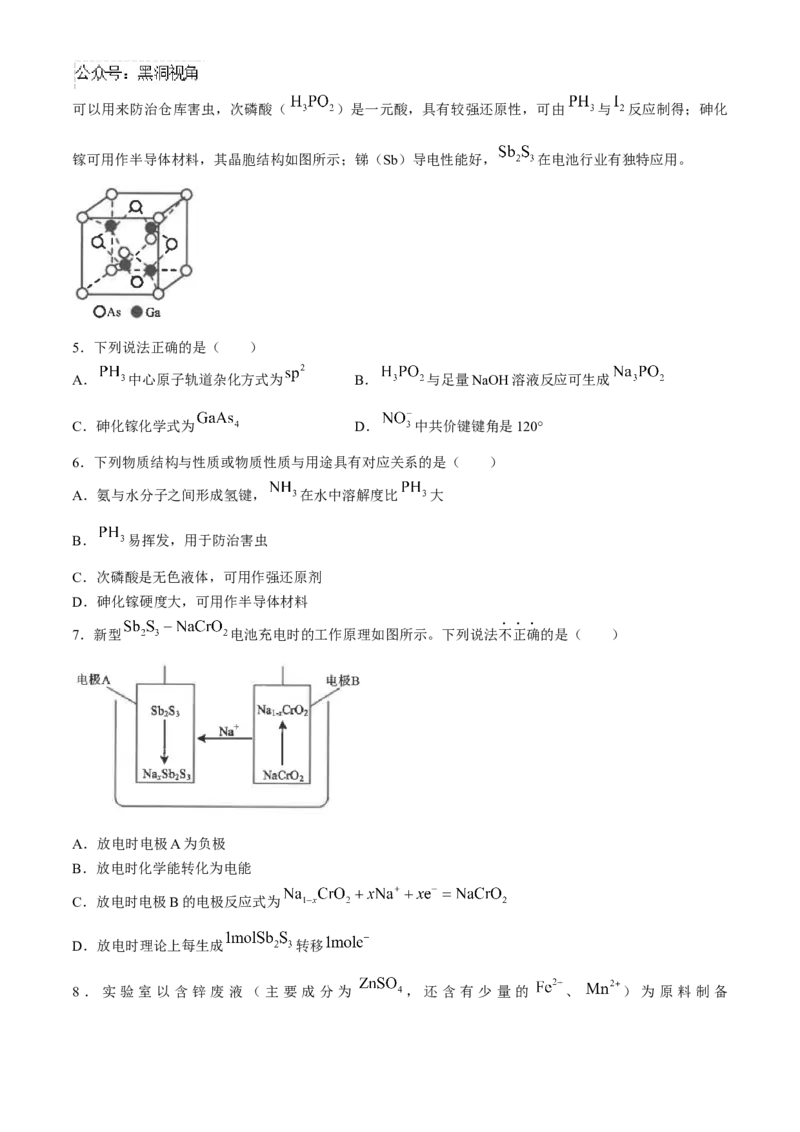
周期表中第ⅤA族元素及其化合物应用广泛。以 为原料可制得 、 等产品;可以用来防治仓库害虫,次磷酸( )是一元酸,具有较强还原性,可由 与 反应制得;砷化
镓可用作半导体材料,其晶胞结构如图所示;锑(Sb)导电性能好, 在电池行业有独特应用。
5.下列说法正确的是( )
A. 中心原子轨道杂化方式为 B. 与足量NaOH溶液反应可生成
C.砷化镓化学式为 D. 中共价键键角是120°
6.下列物质结构与性质或物质性质与用途具有对应关系的是( )
A.氨与水分子之间形成氢键, 在水中溶解度比 大
B. 易挥发,用于防治害虫
C.次磷酸是无色液体,可用作强还原剂
D.砷化镓硬度大,可用作半导体材料
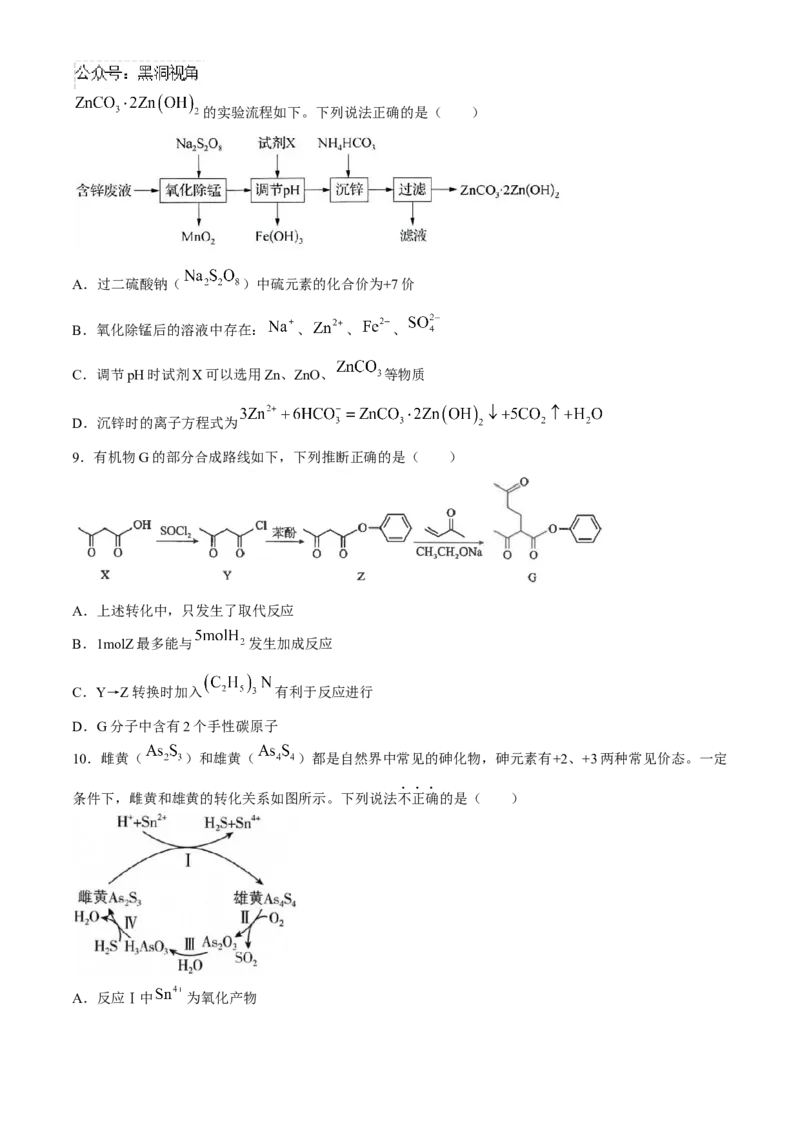
7.新型 电池充电时的工作原理如图所示。下列说法不正确的是( )
A.放电时电极A为负极
B.放电时化学能转化为电能
C.放电时电极B的电极反应式为
D.放电时理论上每生成 转移
8.实验室以含 锌废 液(主 要成分为 ,还含有 少量的 、 )为原料制 备的实验流程如下。下列说法正确的是( )
A.过二硫酸钠( )中硫元素的化合价为+7价
B.氧化除锰后的溶液中存在: 、 、 、
C.调节pH时试剂X可以选用Zn、ZnO、 等物质
D.沉锌时的离子方程式为
9.有机物G的部分合成路线如下,下列推断正确的是( )
A.上述转化中,只发生了取代反应
B.1molZ最多能与 发生加成反应
C.Y→Z转换时加入 有利于反应进行
D.G分子中含有2个手性碳原子
10.雌黄( )和雄黄( )都是自然界中常见的砷化物,砷元素有+2、+3两种常见价态。一定
条件下,雌黄和雄黄的转化关系如图所示。下列说法不正确的是( )
A.反应Ⅰ中 为氧化产物B.反应Ⅰ中 和 恰好完全反应时,其物质的量之比为2:1
C.若反应Ⅱ中转移电子0.7mol,则生成
D.反应Ⅲ和Ⅳ均属于非氧化还原反应
11.由下列实验事实可推导出结论的是( )
选项 实验事实(均为室温) 结论
A
分别测定NaClO溶液和 溶液的pH:
B
向 固体中加入过量饱和 溶液,有 生成
向苯酚钠溶液中通入过量 ,发生反应:
C
( )
D 乙醇的极性比水的弱
在 溶液中加入乙醇,析出蓝色晶体
12.一种获得硫酸盐的过程如图所示。室温下,用 的NaOH溶液吸收 ,若通入 所引起
的溶液体积变化和 挥发可忽略,溶液中含硫物种的浓度 。
的电离常数为 , 。
下列说法正确的是( )
A.若“吸收”后 ,则
B.若“吸收”后溶液pH=7,则
C.若“吸收”后 ,则溶液中
D.若“吸收”后溶液pH-5,则氧化过程中主要反应为:
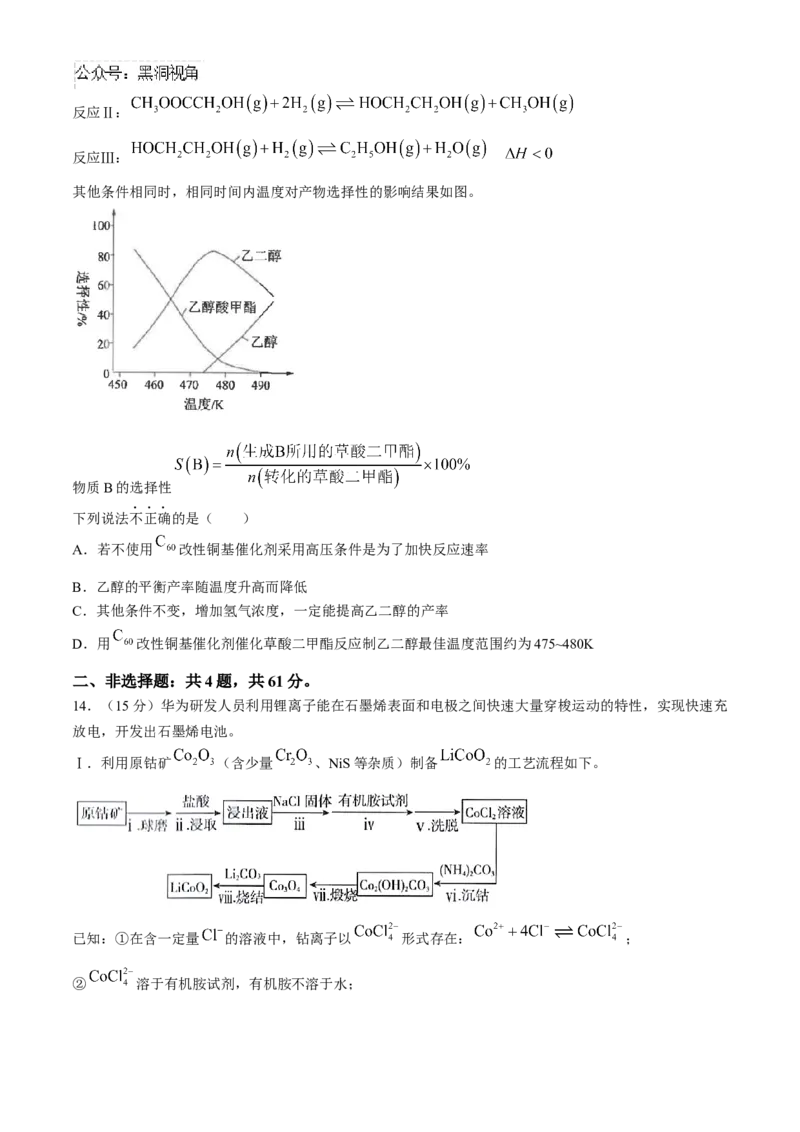
13.中国科学家首次用 改性铜基催化剂,将草酸二甲酯加氢制乙二醇的反应条件从高压降至常压。草
酸二甲酯加氢的主要反应有:
反应Ⅰ:反应Ⅱ:
反应Ⅲ:
其他条件相同时,相同时间内温度对产物选择性的影响结果如图。
物质B的选择性
下列说法不正确的是( )
A.若不使用 改性铜基催化剂采用高压条件是为了加快反应速率
B.乙醇的平衡产率随温度升高而降低
C.其他条件不变,增加氢气浓度,一定能提高乙二醇的产率
D.用 改性铜基催化剂催化草酸二甲酯反应制乙二醇最佳温度范围约为475~480K
二、非选择题:共4题,共61分。
14.(15分)华为研发人员利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,实现快速充
放电,开发出石墨烯电池。
Ⅰ.利用原钴矿 (含少量 、NiS等杂质)制备 的工艺流程如下。
已知:①在含一定量 的溶液中,钻离子以 形式存在: ;
② 溶于有机胺试剂,有机胺不溶于水;题14-图1 题14-图2
(1)基态 的价层电子排布式为__________。
(2)步骤ⅱ中出现了淡黄色沉淀,写出发生该反应的离子方程式__________。
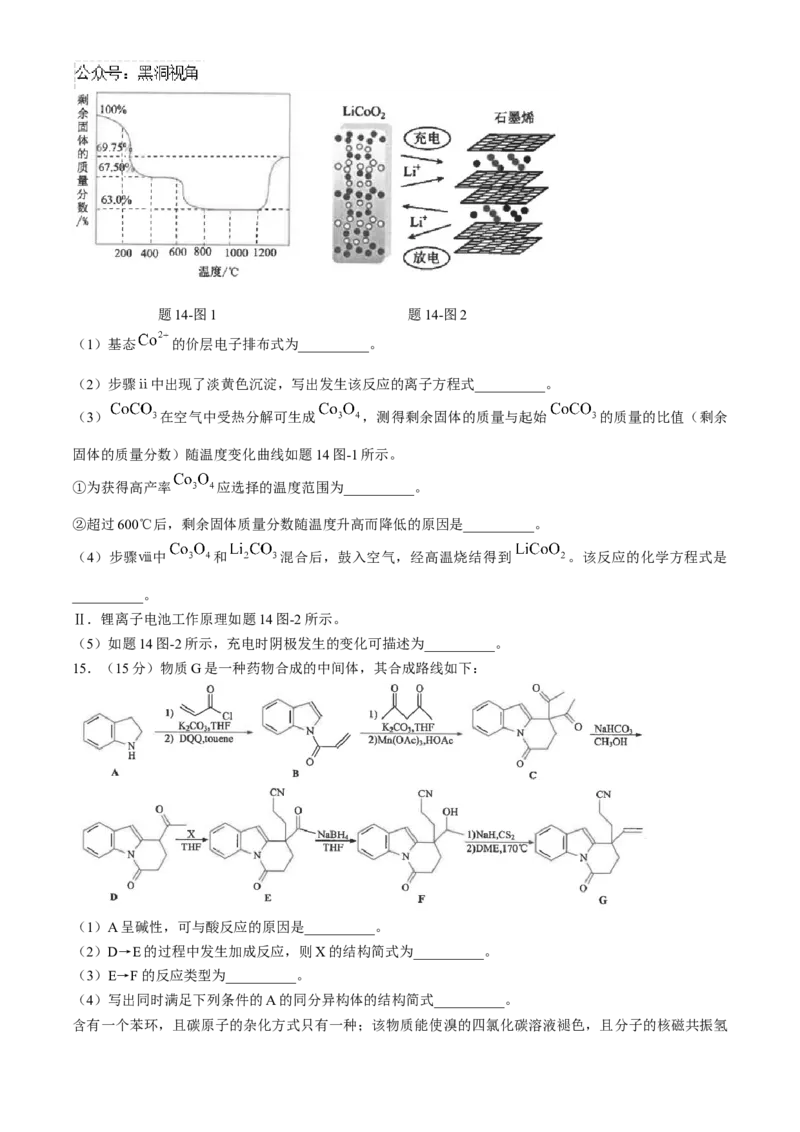
(3) 在空气中受热分解可生成 ,测得剩余固体的质量与起始 的质量的比值(剩余
固体的质量分数)随温度变化曲线如题14图-1所示。
①为获得高产率 应选择的温度范围为__________。
②超过600℃后,剩余固体质量分数随温度升高而降低的原因是__________。
(4)步骤ⅷ中 和 混合后,鼓入空气,经高温烧结得到 。该反应的化学方程式是
__________。
Ⅱ.锂离子电池工作原理如题14图-2所示。
(5)如题14图-2所示,充电时阴极发生的变化可描述为__________。
15.(15分)物质G是一种药物合成的中间体,其合成路线如下:
(1)A呈碱性,可与酸反应的原因是__________。
(2)D→E的过程中发生加成反应,则X的结构简式为__________。
(3)E→F的反应类型为__________。
(4)写出同时满足下列条件的A的同分异构体的结构简式__________。
含有一个苯环,且碳原子的杂化方式只有一种;该物质能使溴的四氯化碳溶液褪色,且分子的核磁共振氢谱中有5个峰。
(5)已知: 。写出以 2-羟基丙腈( )、丙酮为原料制备
的合成路线流程图(须使用 和THF,无机试剂和有机溶剂任用,合成路线流程图见本题
题干)。
16.(15分)实验室中可用氨浸法从含有杂质的ZnO中提锌,并制备硫酸锌。
Ⅰ.氨浸法提锌
已知:
ⅰ.
ⅱ.M的结构简式如图所示,R为 ,两个羟基中、酚羟基酸性较强。
(1) 和 浸取ZnO发生反应的离子方程式为__________。
(2)下列实验操作一定能提高浸取锌的效率的有__________。
A.水浴加热ZnO与混合溶液 B.研磨ZnO为粉末
C.延长浸取时间 D.适当加快搅拌速率
(3)M能与 形成稳定的配合物X,相关反应为 。
①补全图中X的结构并用“…”标出氢键__________。②X中形成氢键有利于 的萃取,原因可能是__________。
(4)从平衡移动的角度解释 能提高有机溶液中X含量的原因__________。
Ⅱ.制作 。
(5) 的溶解度曲线如图所示。
补充完整由含 X 的有机溶液制取 的实验方案:向分液漏斗中加入含 X 的有机溶液,
__________,干燥,得到 。
(可选择的试剂: 溶液, 溶液,热蒸馏水)
17.(16分)黄铁矿( )可用于制硫和处理废水。
(1)黄铁矿、焦炭和适量空气混合加热制硫,发生反应: 。
上述反应中生成CO而不是 的原因是:__________。
(2)制硫反应所得气体经冷凝回收 后,尾气中还含有CO和 。将尾气通过催化剂进行处理,发生
反应Ⅰ,同时发生副反应Ⅱ。
反应Ⅰ:
反应Ⅱ:
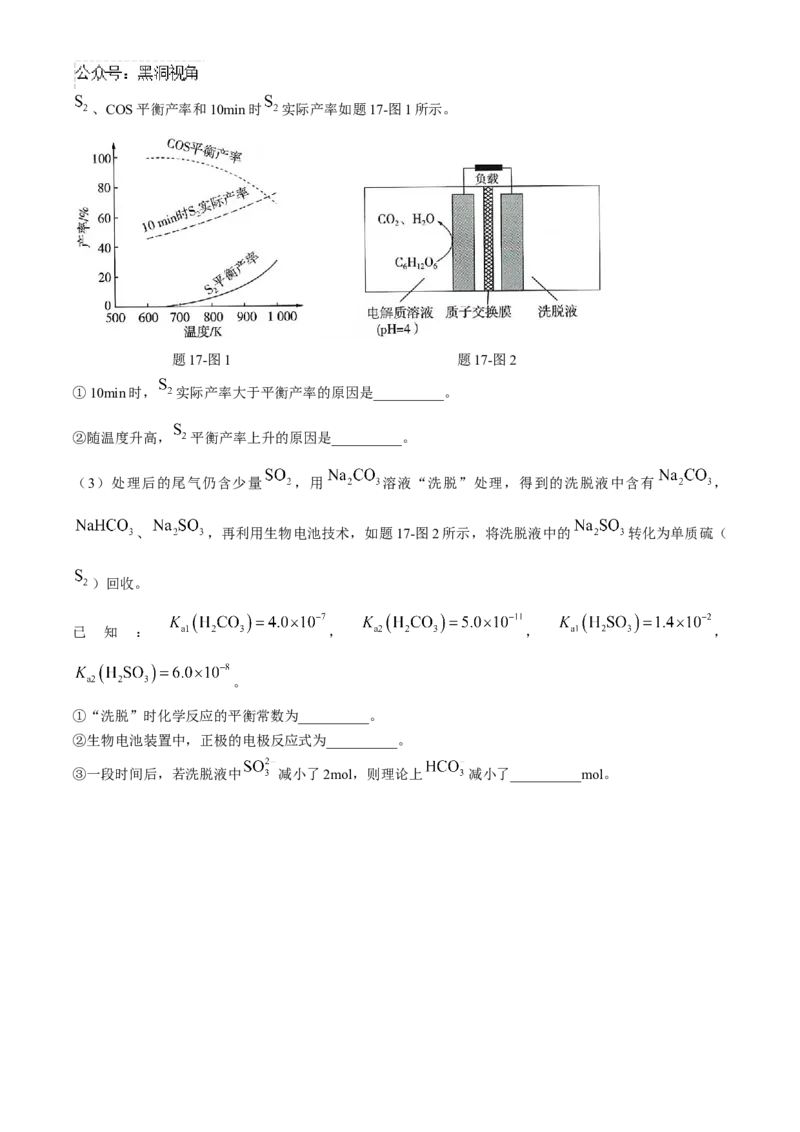
理论分析及实验结果表明,600~1000K范围内, 平衡转化率接近100%。其他条件相同,不同温度下,、COS平衡产率和10min时 实际产率如题17-图1所示。
题17-图1 题17-图2
①10min时, 实际产率大于平衡产率的原因是__________。
②随温度升高, 平衡产率上升的原因是__________。
(3)处理后的尾气仍含少量 ,用 溶液“洗脱”处理,得到的洗脱液中含有 ,
、 ,再利用生物电池技术,如题17-图2所示,将洗脱液中的 转化为单质硫(
)回收。
已 知 : , , ,
。
①“洗脱”时化学反应的平衡常数为__________。
②生物电池装置中,正极的电极反应式为__________。
③一段时间后,若洗脱液中 减小了2mol,则理论上 减小了__________mol。化学答案
1-5.CBBAD 6-10.ADDCB 11-13.DAC
14.(15分)
(1) (2分)
(2) (2分)
(3)①400~600℃(2分)
②温度超过600℃, 转化为CoO,质量减小。(2分)
(4) (3分)
(5)充电时,锂离子在外加电场的作用下从 中脱嵌,(1分)同时阴极石墨烯获得电子在表面聚
集,(1分)吸引锂离子嵌入石墨烯的层状结构中(1分)(3分)
15.(15分)
(1)N原子可提供孤电子对与 形成配位键(2分)
(2) (3分)
(3)还原反应(2分)
(4) (3分)
(5)
(第一步条件必须用信息中的,否则熔断,每步一分)(共5分)
【共15分】
16.(15分)
(1) (2分)
(2)BD(2分 有错不得分)(3)① (2分)
②提高X在有机溶剂中的溶解性或降低X在水中的溶解性(2分)
(4) 与 反应, 降低,(1分)促进 向正向移动,
(1分)导致 增大,促进 向正向移动(1分)(共3分)
(5)加入 溶液反萃取(1分,浓度错误熔断),多次萃取,并合并水层(1分,不熔断),
将水溶液蒸发至有大量晶体析出(1分),趁热过滤(1分,无趁热熔断),用热蒸馏水洗涤2~3次。(1
分)
(共5分)
17.(16分)
(1)为避免 被 过渡氧化, 不能过量,C不完全燃烧生成CO。(2分)
(2)①反应Ⅰ的活化能较低,反应反应Ⅰ速率比反应Ⅱ快, 与CO主要生成 ,超过平衡产率。(2
分)
②温度升高,反应Ⅱ平衡逆向移动,使 、 增大;对于反应Ⅰ,浓度改变对平衡的影响超过
温度改变的影响,平衡正向移动(3分 无比较关系0分)
(3)① (3分)
②
或 (3分)
③4(3分)