文档内容
配套《高中必刷题 化学 必修第一册 LK》使用
第2章 元素与物质世界
第3节 氧化还原反应
课时2氧化剂和还原剂 氧化还原反应的应用
一、氧化剂和还原剂
1.氧化还原反应的相关概念
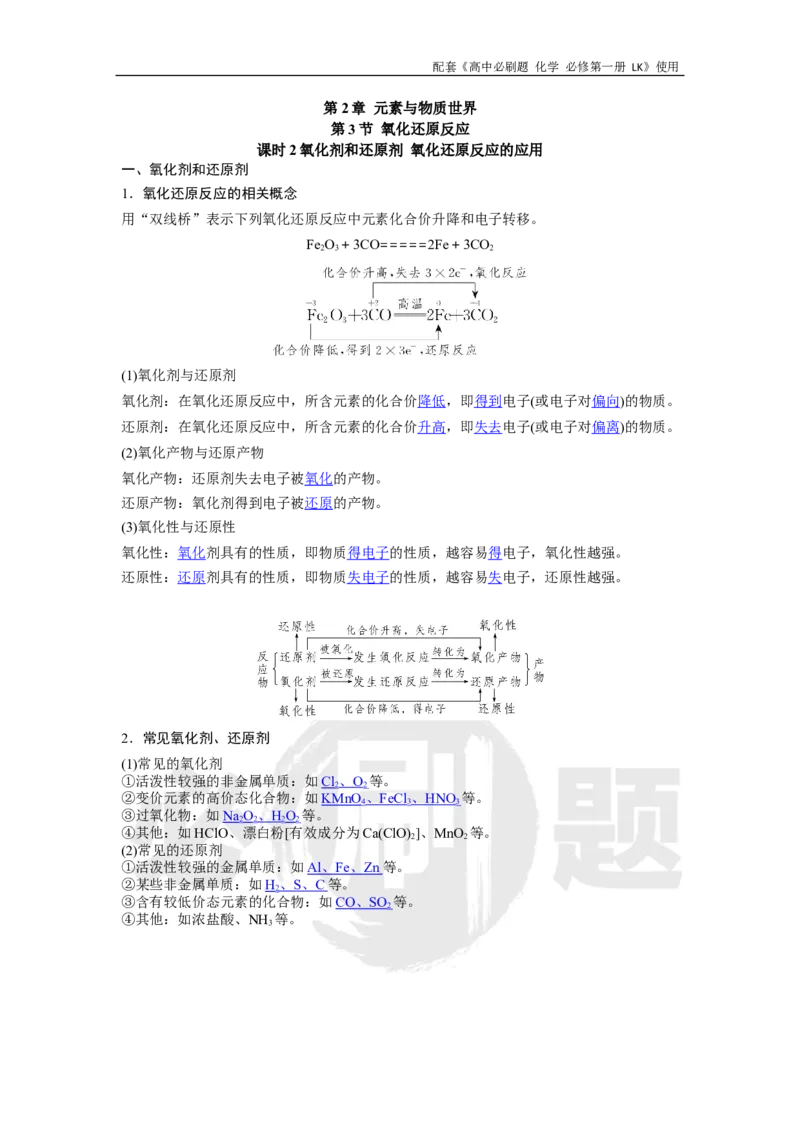
用“双线桥”表示下列氧化还原反应中元素化合价升降和电子转移。
Fe O+3CO=====2Fe+3CO
2 3 2
(1)氧化剂与还原剂
氧化剂:在氧化还原反应中,所含元素的化合价降低,即得到电子(或电子对偏向)的物质。
还原剂:在氧化还原反应中,所含元素的化合价升高,即失去电子(或电子对偏离)的物质。
(2)氧化产物与还原产物
氧化产物:还原剂失去电子被氧化的产物。
还原产物:氧化剂得到电子被还原的产物。
(3)氧化性与还原性
氧化性:氧化剂具有的性质,即物质得电子的性质,越容易得电子,氧化性越强。
还原性:还原剂具有的性质,即物质失电子的性质,越容易失电子,还原性越强。
2.常见氧化剂、还原剂
(1)常见的氧化剂
①活泼性较强的非金属单质:如Cl 、 O 等。
2 2
②变价元素的高价态化合物:如KMnO 、 FeC l 、 HNO 等。
4 3 3
③过氧化物:如NaO 、 H O 等。
2 2 2 2
④其他:如HClO、漂白粉[有效成分为Ca(ClO) ]、MnO 等。
2 2
(2)常见的还原剂
①活泼性较强的金属单质:如 Al 、 Fe 、 Zn 等。
②某些非金属单质:如H 、 S 、 C 等。
2
③含有较低价态元素的化合物:如 CO 、 SO 等。
2
④其他:如浓盐酸、NH 等。
3