文档内容
2020 浙江省台州市中考化学真题及答案
一、选择题(本题有6个题,每小题4分,共24分。请选出一个符合题意的正确选项,不选、多
选、错选均不给分)
1.(4分)食盐是生活中重要的调味品,化学式为NaCl,其中氯元素的化合价为﹣1,则钠元
素的化合价为( )
A.﹣2 B.﹣1 C.+1 D.+2
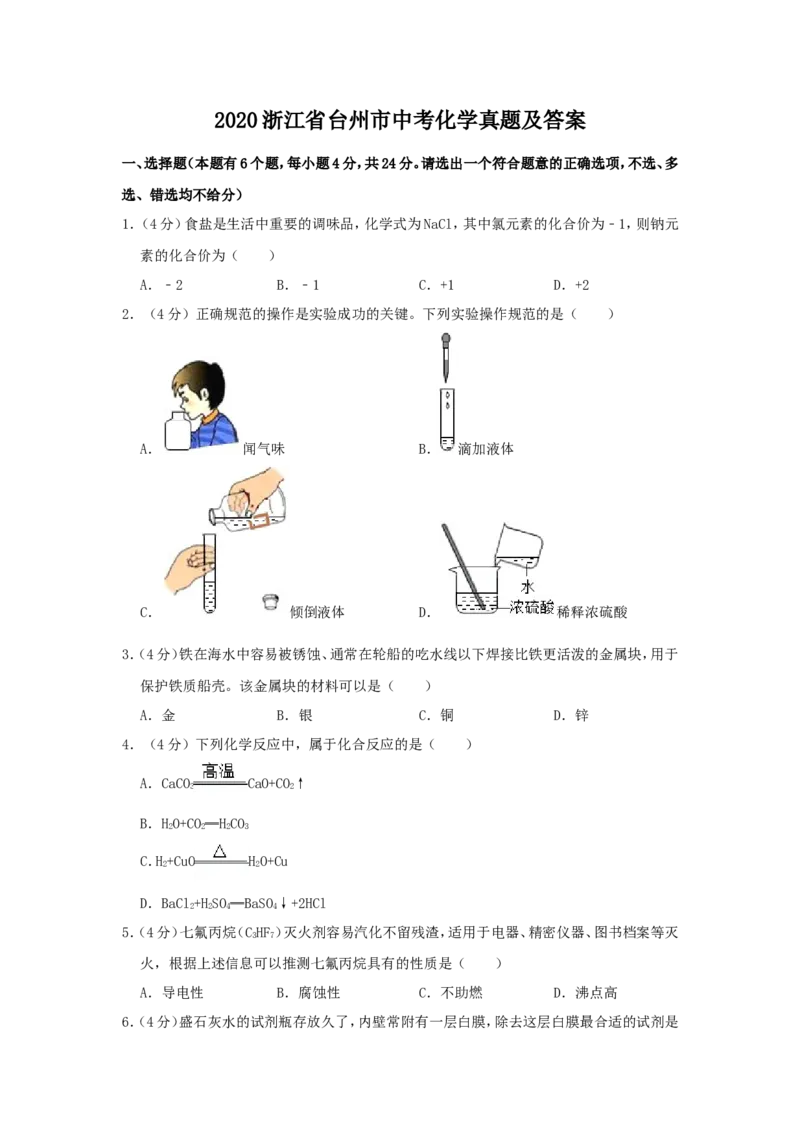
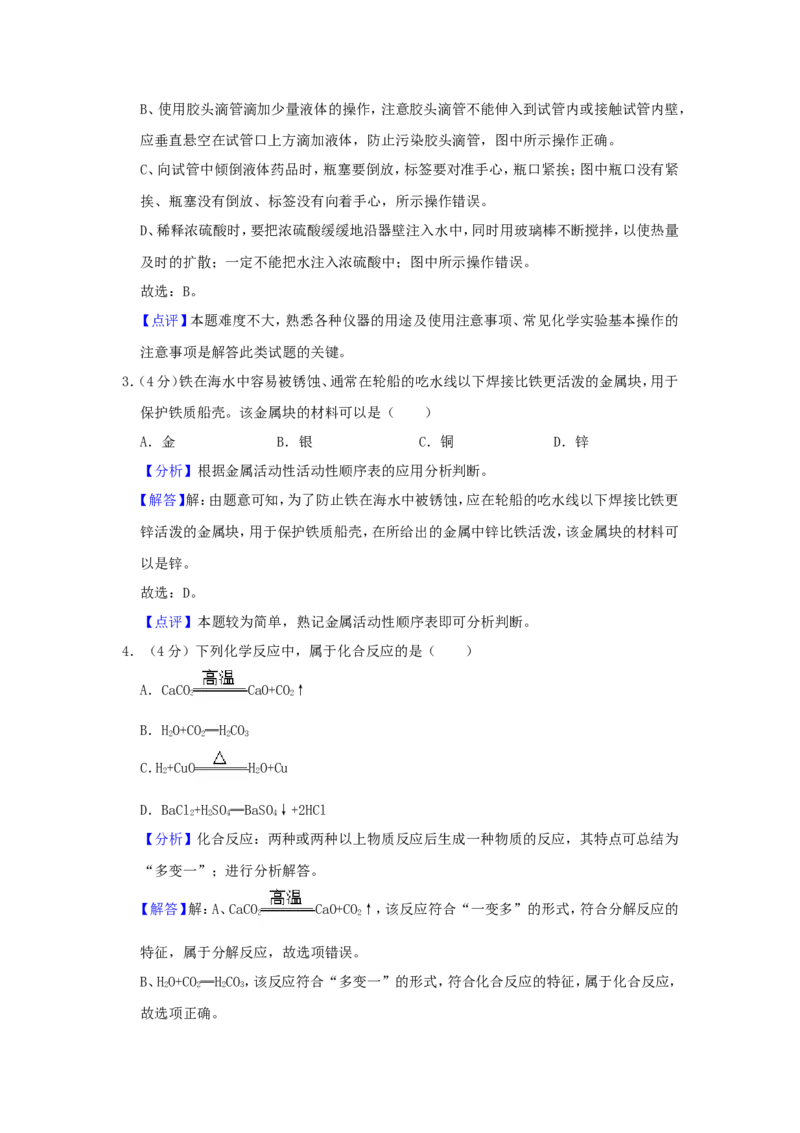
2.(4分)正确规范的操作是实验成功的关键。下列实验操作规范的是( )
A. 闻气味 B. 滴加液体
C. 倾倒液体 D. 稀释浓硫酸
3.(4分)铁在海水中容易被锈蚀、通常在轮船的吃水线以下焊接比铁更活泼的金属块,用于
保护铁质船壳。该金属块的材料可以是( )
A.金 B.银 C.铜 D.锌
4.(4分)下列化学反应中,属于化合反应的是( )
A.CaCO CaO+CO↑
3 2
B.HO+CO═HCO
2 2 2 3
C.H+CuO HO+Cu
2 2
D.BaCl+HSO═BaSO↓+2HCl
2 2 4 4
5.(4分)七氟丙烷(CHF)灭火剂容易汽化不留残渣,适用于电器、精密仪器、图书档案等灭
3 7
火,根据上述信息可以推测七氟丙烷具有的性质是( )
A.导电性 B.腐蚀性 C.不助燃 D.沸点高
6.(4分)盛石灰水的试剂瓶存放久了,内壁常附有一层白膜,除去这层白膜最合适的试剂是( )
A.蒸馏水 B.稀盐酸
C.硫酸铜溶液 D.氢氧化钠溶液
二、填空题(本题有2个小题,6空格,每空格2分,共12分)
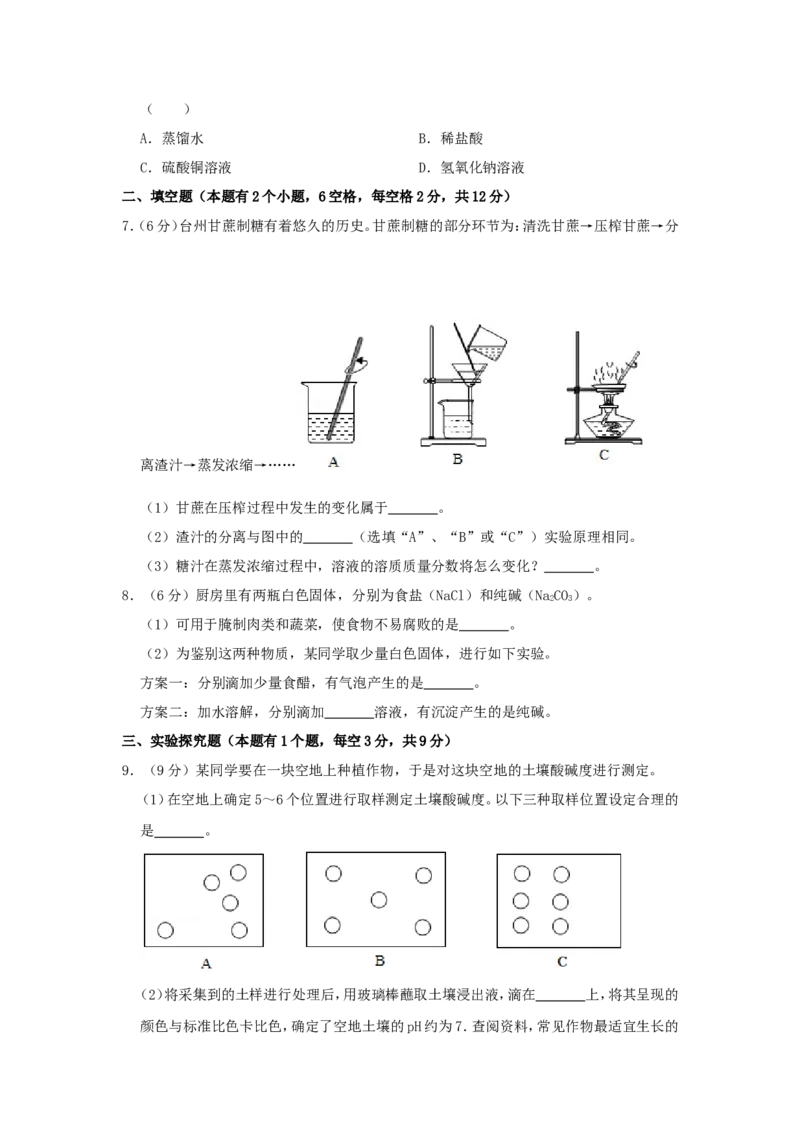
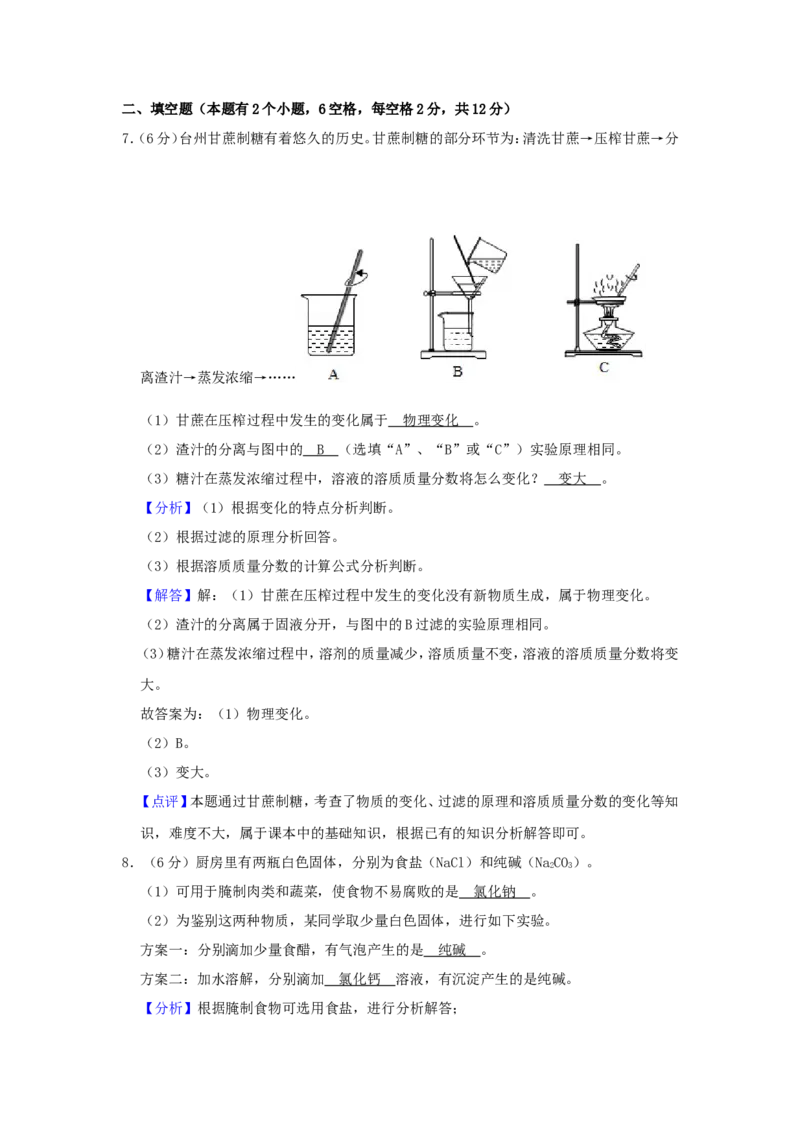
7.(6分)台州甘蔗制糖有着悠久的历史。甘蔗制糖的部分环节为:清洗甘蔗→压榨甘蔗→分
离渣汁→蒸发浓缩→……
(1)甘蔗在压榨过程中发生的变化属于 。
(2)渣汁的分离与图中的 (选填“A”、“B”或“C”)实验原理相同。
(3)糖汁在蒸发浓缩过程中,溶液的溶质质量分数将怎么变化? 。
8.(6分)厨房里有两瓶白色固体,分别为食盐(NaCl)和纯碱(NaCO)。
2 3
(1)可用于腌制肉类和蔬菜,使食物不易腐败的是 。
(2)为鉴别这两种物质,某同学取少量白色固体,进行如下实验。
方案一:分别滴加少量食醋,有气泡产生的是 。
方案二:加水溶解,分别滴加 溶液,有沉淀产生的是纯碱。
三、实验探究题(本题有1个题,每空3分,共9分)
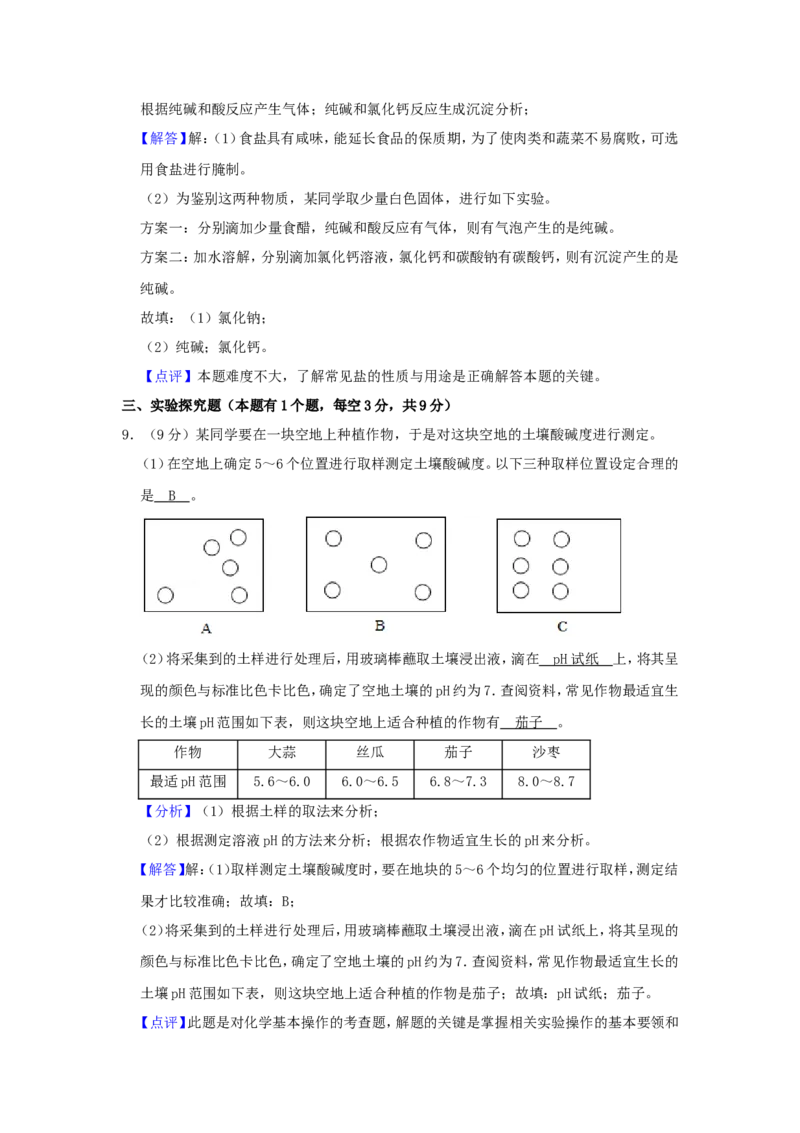
9.(9分)某同学要在一块空地上种植作物,于是对这块空地的土壤酸碱度进行测定。
(1)在空地上确定5~6个位置进行取样测定土壤酸碱度。以下三种取样位置设定合理的
是 。
(2)将采集到的土样进行处理后,用玻璃棒蘸取土壤浸出液,滴在 上,将其呈现的
颜色与标准比色卡比色,确定了空地土壤的pH约为7.查阅资料,常见作物最适宜生长的土壤pH范围如下表,则这块空地上适合种植的作物有 。
作物 大蒜 丝瓜 茄子 沙枣
最适pH范围 5.6~6.0 6.0~6.5 6.8~7.3 8.0~8.7
四、解答题(本题有3小题,第10-11题各8分,12题12分,共28分)
10.(8分)台州是“中国大棚葡萄之乡”。近年来,果农在农技部门指导帮助下,在葡萄架下
种植比较耐阴的豆科类、叶菜类等经济作物,获得了较好的经济效益。钾肥能促进糖类的
合成与运输,提高葡萄品质,在葡萄开花后要注意补充钾肥。下列属于钾肥的是
(填序号)。
①KCl
②CO(NH)
2 2
③NHHCO
4 3
11.(8分)碰碰香是一种常见的室内盆栽植物,因触碰后可散发出令人舒适的香气而得名,
其香气具有提神醒脑、驱避蚊虫的作用。碰碰香的香味物质中含量最多的是柠檬烯,其化
学式为C H .计算:
10 16
①柠檬烯中碳元素、氢元素的质量比为 。
②柠檬烯中碳元素的质量分数是多少?(计算结果精确到0.1%)
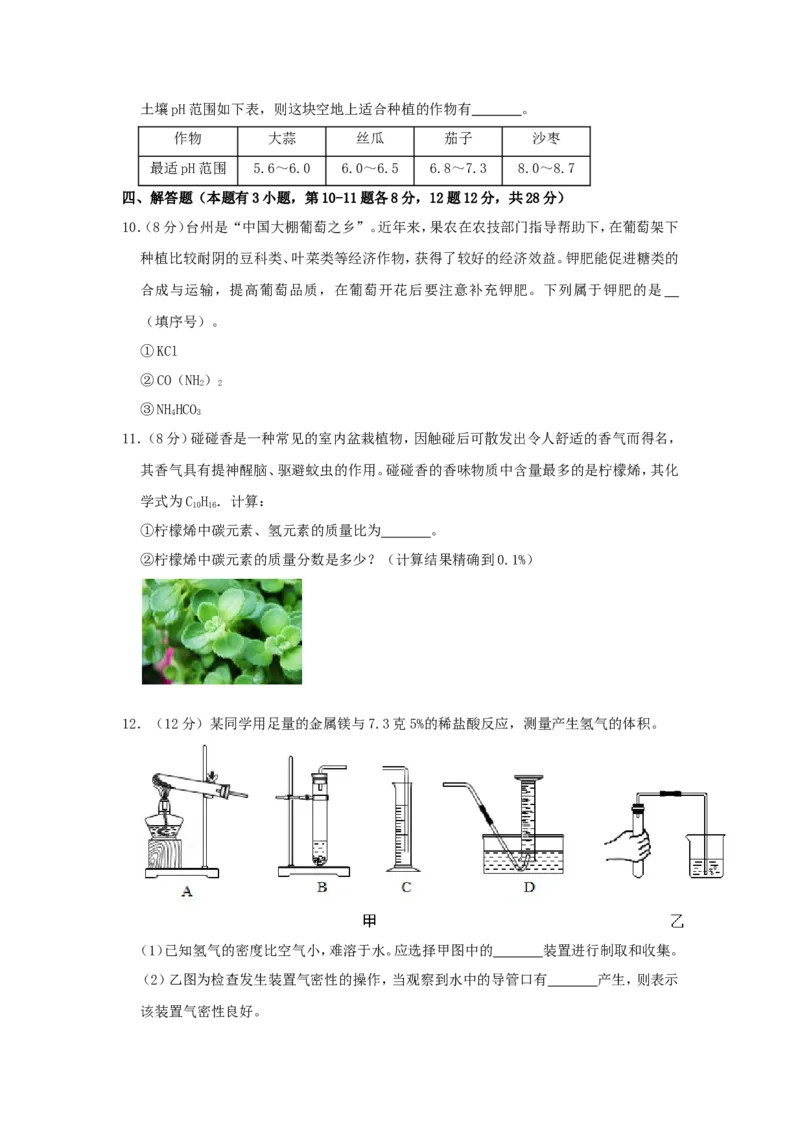
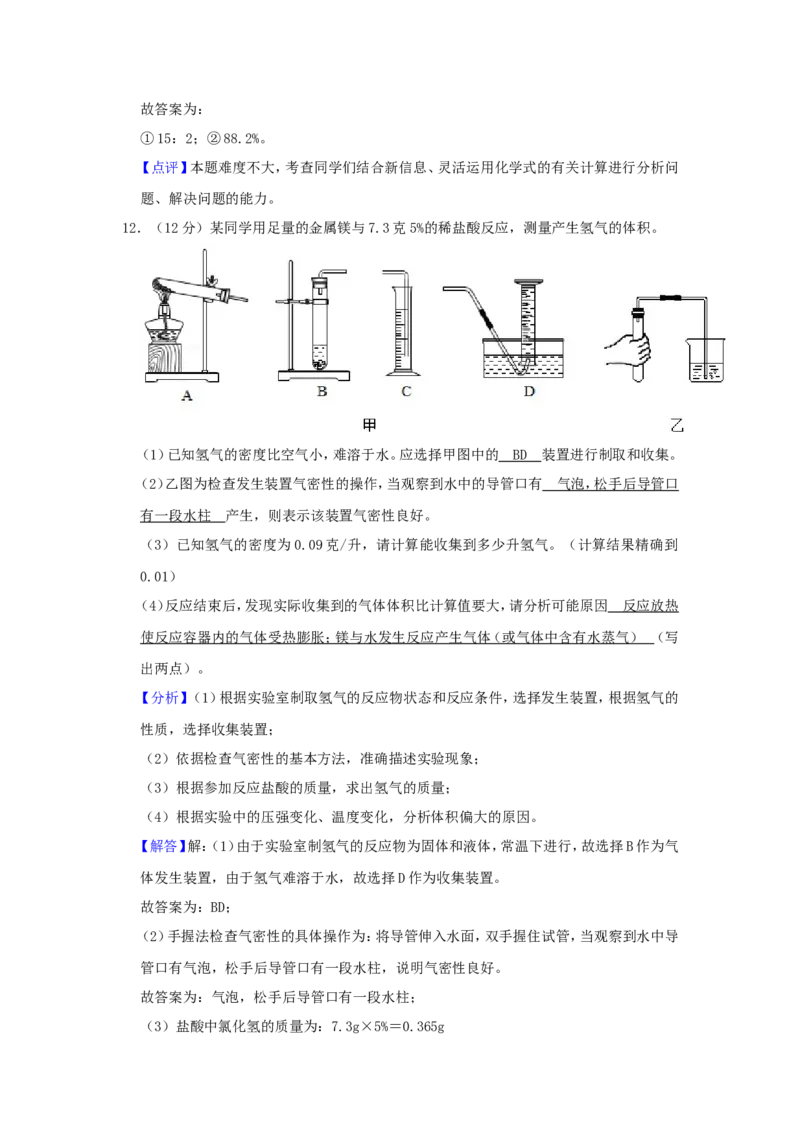
12.(12分)某同学用足量的金属镁与7.3克5%的稀盐酸反应,测量产生氢气的体积。
(1)已知氢气的密度比空气小,难溶于水。应选择甲图中的 装置进行制取和收集。
(2)乙图为检查发生装置气密性的操作,当观察到水中的导管口有 产生,则表示
该装置气密性良好。(3)已知氢气的密度为0.09克/升,请计算能收集到多少升氢气。(计算结果精确到
0.01)
(4)反应结束后,发现实际收集到的气体体积比计算值要大,请分析可能原因 (写
出两点)。2020年浙江省台州市中考化学试卷
参考答案与试题解析
一、选择题(本题有6个题,每小题4分,共24分。请选出一个符合题意的正确选项,不选、多
选、错选均不给分)
1.(4分)食盐是生活中重要的调味品,化学式为NaCl,其中氯元素的化合价为﹣1,则钠元
素的化合价为( )
A.﹣2 B.﹣1 C.+1 D.+2
【分析】根据在化合物中正负化合价代数和为零,结合NaCl的化学式进行解。
【解答】解:在NaCl中氯元素的化合价为﹣1价,设钠元素的化合价是x,根据在化合物中
正负化合价代数和为零,可得:x+(﹣1)=0,则x=+1价。
故选:C。
【点评】本题难度不大,掌握利用化合价的原则计算指定元素的化合价的方法等是正确解
答本题的关键。
2.(4分)正确规范的操作是实验成功的关键。下列实验操作规范的是( )
A. 闻气味 B. 滴加液体
C. 倾倒液体 D. 稀释浓硫酸
【分析】A、根据闻气体的气味时的方法(招气入鼻法)进行分析判断。
B、根据使用胶头滴管滴加少量液体的方法进行分析判断。
C、根据向试管中倾倒液体药品的方法进行分析判断。
D、根据浓硫酸的稀释方法(酸入水,沿器壁,慢慢倒,不断搅)进行分析判断。
【解答】解:A、闻气体的气味时,应用手在瓶口轻轻的扇动,使极少量的气体飘进鼻子中,
不能将鼻子凑到集气瓶口去闻气体的气味,图中所示操作错误。B、使用胶头滴管滴加少量液体的操作,注意胶头滴管不能伸入到试管内或接触试管内壁,
应垂直悬空在试管口上方滴加液体,防止污染胶头滴管,图中所示操作正确。
C、向试管中倾倒液体药品时,瓶塞要倒放,标签要对准手心,瓶口紧挨;图中瓶口没有紧
挨、瓶塞没有倒放、标签没有向着手心,所示操作错误。
D、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量
及时的扩散;一定不能把水注入浓硫酸中;图中所示操作错误。
故选:B。
【点评】本题难度不大,熟悉各种仪器的用途及使用注意事项、常见化学实验基本操作的
注意事项是解答此类试题的关键。
3.(4分)铁在海水中容易被锈蚀、通常在轮船的吃水线以下焊接比铁更活泼的金属块,用于
保护铁质船壳。该金属块的材料可以是( )
A.金 B.银 C.铜 D.锌
【分析】根据金属活动性活动性顺序表的应用分析判断。
【解答】解:由题意可知,为了防止铁在海水中被锈蚀,应在轮船的吃水线以下焊接比铁更
锌活泼的金属块,用于保护铁质船壳,在所给出的金属中锌比铁活泼,该金属块的材料可
以是锌。
故选:D。
【点评】本题较为简单,熟记金属活动性顺序表即可分析判断。
4.(4分)下列化学反应中,属于化合反应的是( )
A.CaCO CaO+CO↑
3 2
B.HO+CO═HCO
2 2 2 3
C.H+CuO HO+Cu
2 2
D.BaCl+HSO═BaSO↓+2HCl
2 2 4 4
【分析】化合反应:两种或两种以上物质反应后生成一种物质的反应,其特点可总结为
“多变一”;进行分析解答。
【解答】解:A、CaCO CaO+CO↑,该反应符合“一变多”的形式,符合分解反应的
3 2
特征,属于分解反应,故选项错误。
B、HO+CO═HCO,该反应符合“多变一”的形式,符合化合反应的特征,属于化合反应,
2 2 2 3
故选项正确。C、H+CuO HO+Cu,该反应是一种单质和一种化合物反应生成另一种单质和另一
2 2
种化合物的反应,属于置换反应,故选项错误。
D、BaCl+HSO═BaSO↓+2HCl,该反应是两种化合物相互交换成分生成两种新的化合物
2 2 4 4
的反应,属于复分解反应,故选项错误。
故选:B。
【点评】本题难度不大,掌握化合反应的特征(“多变一”)是正确解答本题的关键。
5.(4分)七氟丙烷(CHF)灭火剂容易汽化不留残渣,适用于电器、精密仪器、图书档案等灭
3 7
火,根据上述信息可以推测七氟丙烷具有的性质是( )
A.导电性 B.腐蚀性 C.不助燃 D.沸点高
【分析】根据七氟丙烷(CHF)灭火剂容易汽化不留残渣,适用于电器、精密仪器、图书档
3 7
案等灭火进行分析。
【解答】解:由于七氟丙烷可以做灭火剂,所以既不能燃烧也不支持燃烧,所以不助燃。
故选:C。
【点评】解答本题关键是熟悉灭火物质具有的性质。
6.(4分)盛石灰水的试剂瓶存放久了,内壁常附有一层白膜,除去这层白膜最合适的试剂是
( )
A.蒸馏水 B.稀盐酸
C.硫酸铜溶液 D.氢氧化钠溶液
【分析】根据盛石灰水的试剂瓶存放久了,内壁常附有一层白膜,是因为氢氧化钙能与空
气中的二氧化碳反应生成碳酸钙沉淀,进行分析判断。
【解答】解:盛石灰水的试剂瓶存放久了,内壁常附有一层白膜,氢氧化钙能与空气中的二
氧化碳反应生成碳酸钙沉淀,白膜的主要成分是碳酸钙。
A、白膜的主要成分是碳酸钙,碳酸钙难溶于水,用蒸馏水不能除去这层白膜,故选项错误。
B、白膜的主要成分是碳酸钙,碳酸钙能与稀盐酸反应生成易溶于水的氯化钙,可除去这
层白膜,故选项正确。
C、白膜的主要成分是碳酸钙,碳酸钙难溶于水,不能与硫酸铜溶液反应,故选项错误。
D、白膜的主要成分是碳酸钙,碳酸钙难溶于水,不能与氢氧化钠溶液反应,故选项错误。
故选:B。
【点评】本题难度不大,明确白膜的主要成分是碳酸钙、碳酸钙难溶于水、能与酸反应是正
确解答本题的关键。二、填空题(本题有2个小题,6空格,每空格2分,共12分)
7.(6分)台州甘蔗制糖有着悠久的历史。甘蔗制糖的部分环节为:清洗甘蔗→压榨甘蔗→分
离渣汁→蒸发浓缩→……
(1)甘蔗在压榨过程中发生的变化属于 物理变化 。
(2)渣汁的分离与图中的 B (选填“A”、“B”或“C”)实验原理相同。
(3)糖汁在蒸发浓缩过程中,溶液的溶质质量分数将怎么变化? 变大 。
【分析】(1)根据变化的特点分析判断。
(2)根据过滤的原理分析回答。
(3)根据溶质质量分数的计算公式分析判断。
【解答】解:(1)甘蔗在压榨过程中发生的变化没有新物质生成,属于物理变化。
(2)渣汁的分离属于固液分开,与图中的B过滤的实验原理相同。
(3)糖汁在蒸发浓缩过程中,溶剂的质量减少,溶质质量不变,溶液的溶质质量分数将变
大。
故答案为:(1)物理变化。
(2)B。
(3)变大。
【点评】本题通过甘蔗制糖,考查了物质的变化、过滤的原理和溶质质量分数的变化等知
识,难度不大,属于课本中的基础知识,根据已有的知识分析解答即可。
8.(6分)厨房里有两瓶白色固体,分别为食盐(NaCl)和纯碱(NaCO)。
2 3
(1)可用于腌制肉类和蔬菜,使食物不易腐败的是 氯化钠 。
(2)为鉴别这两种物质,某同学取少量白色固体,进行如下实验。
方案一:分别滴加少量食醋,有气泡产生的是 纯碱 。
方案二:加水溶解,分别滴加 氯化钙 溶液,有沉淀产生的是纯碱。
【分析】根据腌制食物可选用食盐,进行分析解答;根据纯碱和酸反应产生气体;纯碱和氯化钙反应生成沉淀分析;
【解答】解:(1)食盐具有咸味,能延长食品的保质期,为了使肉类和蔬菜不易腐败,可选
用食盐进行腌制。
(2)为鉴别这两种物质,某同学取少量白色固体,进行如下实验。
方案一:分别滴加少量食醋,纯碱和酸反应有气体,则有气泡产生的是纯碱。
方案二:加水溶解,分别滴加氯化钙溶液,氯化钙和碳酸钠有碳酸钙,则有沉淀产生的是
纯碱。
故填:(1)氯化钠;
(2)纯碱;氯化钙。
【点评】本题难度不大,了解常见盐的性质与用途是正确解答本题的关键。
三、实验探究题(本题有1个题,每空3分,共9分)
9.(9分)某同学要在一块空地上种植作物,于是对这块空地的土壤酸碱度进行测定。
(1)在空地上确定5~6个位置进行取样测定土壤酸碱度。以下三种取样位置设定合理的
是 B 。
(2)将采集到的土样进行处理后,用玻璃棒蘸取土壤浸出液,滴在 p H 试纸 上,将其呈
现的颜色与标准比色卡比色,确定了空地土壤的pH约为7.查阅资料,常见作物最适宜生
长的土壤pH范围如下表,则这块空地上适合种植的作物有 茄子 。
作物 大蒜 丝瓜 茄子 沙枣
最适pH范围 5.6~6.0 6.0~6.5 6.8~7.3 8.0~8.7
【分析】(1)根据土样的取法来分析;
(2)根据测定溶液pH的方法来分析;根据农作物适宜生长的pH来分析。
【解答】解:(1)取样测定土壤酸碱度时,要在地块的5~6个均匀的位置进行取样,测定结
果才比较准确;故填:B;
(2)将采集到的土样进行处理后,用玻璃棒蘸取土壤浸出液,滴在pH试纸上,将其呈现的
颜色与标准比色卡比色,确定了空地土壤的pH约为7.查阅资料,常见作物最适宜生长的
土壤pH范围如下表,则这块空地上适合种植的作物是茄子;故填:pH试纸;茄子。
【点评】此题是对化学基本操作的考查题,解题的关键是掌握相关实验操作的基本要领和原理。
四、解答题(本题有3小题,第10-11题各8分,12题12分,共28分)
10.(8分)台州是“中国大棚葡萄之乡”。近年来,果农在农技部门指导帮助下,在葡萄架下
种植比较耐阴的豆科类、叶菜类等经济作物,获得了较好的经济效益。钾肥能促进糖类的
合成与运输,提高葡萄品质,在葡萄开花后要注意补充钾肥。下列属于钾肥的是 ①
(填序号)。
①KCl
②CO(NH)
2 2
③NHHCO
4 3
【分析】根据含有氮元素的肥料称为氮肥,含有磷元素的肥料称为磷肥,含有钾元素的肥
料称为钾肥,同时含有氮、磷、钾三种元素中的两种或两种以上的肥料称为复合肥解答。
【解答】解:氯化钾中含有钾元素,属于钾肥,符合题意;尿素和碳酸氢铵中只含氮元素,
属于氮肥,不合题意。
故选:①。
【点评】本题难度不大,掌握常见化肥的种类是正确解答本题的关键。
11.(8分)碰碰香是一种常见的室内盆栽植物,因触碰后可散发出令人舒适的香气而得名,
其香气具有提神醒脑、驱避蚊虫的作用。碰碰香的香味物质中含量最多的是柠檬烯,其化
学式为C H .计算:
10 16
①柠檬烯中碳元素、氢元素的质量比为 1 5 : 2 。
②柠檬烯中碳元素的质量分数是多少?(计算结果精确到0.1%)
【分析】①根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分
析解答。
②根据化合物中元素的质量分数= ×100%,进行分析解答。
【解答】解:①柠檬烯中碳元素、氢元素的质量比为(12×10):(1×16)=15:2。
②柠檬烯中碳元素的质量分数是 ×100%≈88.2%。故答案为:
①15:2;②88.2%。
【点评】本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问
题、解决问题的能力。
12.(12分)某同学用足量的金属镁与7.3克5%的稀盐酸反应,测量产生氢气的体积。
(1)已知氢气的密度比空气小,难溶于水。应选择甲图中的 B D 装置进行制取和收集。
(2)乙图为检查发生装置气密性的操作,当观察到水中的导管口有 气泡,松手后导管口
有一段水柱 产生,则表示该装置气密性良好。
(3)已知氢气的密度为0.09克/升,请计算能收集到多少升氢气。(计算结果精确到
0.01)
(4)反应结束后,发现实际收集到的气体体积比计算值要大,请分析可能原因 反应放热
使反应容器内的气体受热膨胀;镁与水发生反应产生气体(或气体中含有水蒸气) (写
出两点)。
【分析】(1)根据实验室制取氢气的反应物状态和反应条件,选择发生装置,根据氢气的
性质,选择收集装置;
(2)依据检查气密性的基本方法,准确描述实验现象;
(3)根据参加反应盐酸的质量,求出氢气的质量;
(4)根据实验中的压强变化、温度变化,分析体积偏大的原因。
【解答】解:(1)由于实验室制氢气的反应物为固体和液体,常温下进行,故选择B作为气
体发生装置,由于氢气难溶于水,故选择D作为收集装置。
故答案为:BD;
(2)手握法检查气密性的具体操作为:将导管伸入水面,双手握住试管,当观察到水中导
管口有气泡,松手后导管口有一段水柱,说明气密性良好。
故答案为:气泡,松手后导管口有一段水柱;
(3)盐酸中氯化氢的质量为:7.3g×5%=0.365g设生成氢气的质量为x
Mg+2HCl═MgCl+H↑
2 2
73 2
0.365g x
═ 解得x=0.01g
则氢气的体积为 =0.11L
答:能收集到0.11升氢气。
(4)由于实际收集到的气体体积比计算值要大,分析得排出水的量大于理论上生成氢气
的体积,可能是由于金属与酸反应为放热反应,导致容器内气体受热膨胀,排出更多的水,
也可能是镁与酸反应,生成了氢气,排出更多的水,还可能是生成的氢气中混有水蒸气,
导致氢气的实际体积偏大。
故答案为:反应放热使反应容器内的气体受热膨胀;镁与水发生反应产生气体(或气体中
含有水蒸气)。
【点评】本题是一道气体制取问题,结合化学方程式计算,但整体难度不大。