文档内容
【中小学教辅资源店 微信:mlxt2022】
2022 年上海市中考真题精品解析(word 版)
化学部分
相对原子质量:H-1 C-12 N-14 O-16 Na-23 Ca-40
五、选择题(本大题共17题,共20分)
21~34每题只有1个正确选项,每题1分,共14分。
21.室温时某中性溶液的pH为( )
A. 1 B.3 C.7 D.10
【答案】C
【解析】A、pH -1的溶液显酸性,不合题意;
B、pH-3的溶液显酸性,不合题意;
C、pH-7的溶液呈中性,符合题意;
D、pH-10的溶液呈碱性,不合题意。
故选:C。
22.磷肥为植物生长提供的主要营养元素是( )
A.N B.P C.K D.Na
【答案】B
【解析】只含有氮、磷、钾这三种营养元素中的磷元素的肥料称为磷肥,磷肥为植物生长提供的
主要营养元素是P。
故选:B。
23.银元素以游离态存在的物质是( )
A.Ag B.AgCl C. AgO D.AgNO
2 3
【答案】A
【解析】A、Ag属于单质,银元素以游离态存在,该项正确,
B、AgCl属于化合物,银元素以化合态存在,该项错误,
C、AgO属于化合物,银元素以化合态存在,该项错误,
2
D、AgNO 属于化合物,银元素以化合态存在,该项错误,
3
故选:A。
24.会造成酸雨的物质是( )
A.SO B.H C.CH D.N
2 2 4 2
【答案】A
【解析】二氧化硫、二氧化氮、三氧化硫等污染物,这些物质或物质在空气中发生反应后的生成
物溶于雨水会形成酸雨,氢气、甲烷均不会造成酸雨,氮气是空气的主要成分之一,也不会造成
酸雨。
故选:A。
25.下列物质的组成中含有原子团的是( )
A.Zn B.ZnO C.ZnCl D.ZnSO
2 4
【答案】D【中小学教辅资源店 微信:mlxt2022】
【解析】A、Zn中没有原子团,A错误;
B、ZnO中没有原子团,B错误,
C、ZnCl2中没有原子团,C错误;
D、ZnSO4中含有原子团是SO2-,D正确;
4
故选:D。
26.在水的净化过程中,可用作吸附剂的是( )
A.氯气 B.氯化钠 C.活性炭 D.硫酸铜
【答案】C
【解析】在水的净化过程中,可用作吸附剂的是活性炭,是因为活性炭具有吸附性。
故选:C。
27.加入水中能形成溶液的是( )
A.氧化铜 B.铁粉 C.氢氧化铁 D.硝酸钾
【答案】D
【解析】A、氧化铜不溶于水,与水混合形成的是悬浊液,故错误;
B、铁粉不溶于水,与水混合形成的是悬浊液,故错误;
C、氢氧化铁不溶于水,与水混合形成的是悬浊液,故错误;
D、硝酸钾易溶于水能形成均一、稳定的混合物,属于溶液,正确;
故选:D。
28.互为同素异形体的一组物质是( )
A.氧气和臭氧 B.冰和干冰 C.生石灰和熟石灰 D.纯碱和烧碱
【答案】A
【解析】A、氧气和臭氧都是由氧元素形成的不同物质,都是单质,互为同素异形体,故选项正
确。
B、冰和干冰分别是固态的水、固态的二氧化碳,均属于化合物,不属于同素异形体,故选项错
误。
C、生石灰和熟石灰分别是氧化钙、氢氧化钙的俗称,均属于化合物,不属于同素异形体,故选
项错误。
D、纯碱和烧碱分别是碳酸钠、氢氧化钠的俗称,均属于化合物,不属于同素异形体,故选项错
误。
故选:A。
29.Mg(OH) 作止酸剂的主要原理是Mg(OH)+2HCl=MgCl+2HO该反应属于( )
2 2 2
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
【答案】D
【解析】氢氧化镁治疗胃酸过多的反应:Mg(OH)+2HCl=MgCl+2HO,该反应是由两种化合物相互
2 2
交换成分生成另外两种化合物的反应,属于复分解反应,所以D正确,A、B、C错误;
故选:D。【中小学教辅资源店 微信:mlxt2022】
30.干垃圾焚烧可用于发电,焚烧前一般需粉碎处理。粉碎的目的是( )
A.缓解温室效应 B.使可燃物分子变小
C.使其充分燃烧 D.减少参加反应的氧气量
【答案】C
【解析】干垃圾焚烧可用于发电,焚烧前一般需粉碎处理,粉碎可以增大可燃物与氧气的接触面
积,其目的是使燃料充分燃烧。
故选:C。
31.关于1mol氨(NH)的说法,正确的是( )
3
A.含有1mol氢原子 B.质量为17g
C.氮、氢元素质量比为1:3 D.氨的摩尔质量为17
【答案】B
【解析】A.1mol氨(NH)分子中含有3mol氢原子,故错误;
3
B.氨气的摩尔质量为17g/mol,因此1mol氨(NH)的质量为17g,故正确;
3
C.元素的质量比等于各原子的相对原子质量X原子个数之比,因此氮、氢元素质量比为
14:3,故错误;
D.氨的摩尔质量为17g/mol,故错误;
故选:B。
32.在CO+CuO Cu+CO,反应中,CO表现出( )
2
A.稳定性 B.还原性 C.可燃性 D.助燃性
【答案】B
【解析】由化学方程式CO+CuO Cu+CO 可知,在加热的条件下,一氧化碳夺取了氧化铜中的
2
氧,是还原剂,具有还原性。
故选:B。
33.关于电解水实验中生成的氢气和氧气,说法正确的是( )
A.都是无色气体 B.体积比为8:1
C.物质的量之比为1:1 D.密度均大于空气
【答案】A
【解析】电解水生成氢气和氧气,反应的化学方程式是2HO通电 2H↑+O↑。
2 2 2
A、氢气和氧气都是无色气体,该选项正确。
B、氢气和氧气体积比是2:1,该选项不正确。
C、氢气和氧气物质的量之比是2:1,该选项不正确。
D、氢气密度比空气小,氧气密度比空气大,
该选项不正确。
故选:A。【中小学教辅资源店 微信:mlxt2022】
34.关于二氧化碳的说法,正确的是( )
A.二氧化碳分子由碳原子和氧分子构成
B.能使紫色石蕊试液变蓝
C.常用块状大理石和稀硫酸反应制得
D.可用于制作碳酸饮料
【答案】D
【解析】A、二氧化碳分子由碳原子和氧原子构成,A错误;
B、二氧化碳的水溶液使紫色石蕊试液变红,B错误;
C、二氧化碳常用块状大理石和稀盐酸反应制得,C错误;
D、二氧化碳能与水反应生成碳酸,可以用于制作碳酸饮料,D正确;
故选:D。
35~37每题有1~2个正确选项,每题2分,共6分。有2个正确选项的,选对1个得1分,多选
或错选得0分。
35.5%的葡萄糖溶液可用于补充人体所需能量,“5%”表示( )
A.葡萄糖的质量分数 B.每100g溶液中含5g葡萄糖
C.葡萄糖的溶解度为5g/100g水 D.葡萄糖与水的质量比为5:100
【答案】AB
【解析】
5%的葡萄糖溶液,其含义是每100份质量的葡萄糖溶液中含有5份质量的葡萄糖,即溶液
中溶质和溶液的质量之比是5:100-1:20,或溶质和溶剂的质量之比为5:95-1:19,或溶剂
和溶液的质量之比为95:100=19:20。
A、葡萄糖的质量分数为5%,正确,
B、每100g葡萄糖溶液中含5g葡萄糖,正确;
C、溶解度是指在一定温度下,100g水中最多溶解的葡萄糖的质量,100g水中溶解5g,溶
液不一定饱和,错误,
D、溶液中溶质和溶剂的质量比为5g:95g=1:19,错误;
故选:AB。
36.甲烷和水蒸气制氢气的化学方程式为CH+HO CO+3H,有关说法正确的是( )
4 2 2
A.反应过程中碳元素的总质量保持不变
B.参加反应的CH 和HO的质量比为1:1
4 2
C.若生成3mol H 则有1mol CH 参加反应
2 4
D.反应物的摩尔质量之和等于生成物的摩尔质量之和
【答案】AC
【解析】
A、根据质量守恒定律,反应前后元素的种类和质量不变,所以反应过程中碳元素的总质量保持
不变,故选项说法正确。
B、由化学方程式为CH+HO CO+3H 可知,参加反应的CH.和H2O的质量比为
4 2 2
(12+1x4):(1<2+16)=8:9.故选项说法错误。【中小学教辅资源店 微信:mlxt2022】
C、由化学方程式为CH+HO CO+3H 可知,反应中H,和CH,的粒子个数比为3:1
4 2 2
,所以若生成3mol H,则有1mol CH 参加反应,故选项说法正确。
2 4
D、由质量守恒定律可知,反应物的质量总和等于生成物的质量总和,摩尔质量只是单位物
质的量的物质所具有的质量,故选项说法错误。故选 AC
37.下图表示甲、乙、丙三类物质的相互关系,甲包含全部乙、部分丙及其他物质。下表中符合
图示关系的是( )
选项 甲 乙 丙
A 含金属元素的盐 钠盐 硝酸盐
B 纯净物 单质 化合物
C 氧化物 酸性氧化物 碱性氧化物
D 含氢元素的化合物 酸 盐
【答案】AD
【解析】
A、钠盐属于含金属元素的盐,硝酸盐与含金属元素的盐属于交叉关系,正确;
B、纯净物包括单质和化合物,错误;
C、氧化物包括酸性氧化物和碱性氧化物,错误
D、酸属于含氢的化合物,有些盐含有氢元素,正确;
故选:AD。
六、简答题(本大题共4题,共30分)
38.硫酸盐的结晶水合物通常称为“矾”,我国多部古籍都有记载。
(1)东汉《神农本草经》记载,胆矾能“化铁为铜”。胆矾的化学式为 CuSO·5HO,胆矾受热
4 2
失去结晶水的过程属于_________(选填“物理”或“化学”)变化;将铁片浸入硫酸铜溶液可
实现“化铁为铜”,反应的化学方程是___________________________,说明铁的金属活动性比
铜_______(选填“强”或“弱”)。
(2)唐代《千金翼方》记载,明矾可入药用。明矾的化学式为KAl(SO)·12HO,其中含有
4 2 2
_______种金属元素;KSO 中K元素的化合价是______________。
2 4
(3)明代《天工开物》记载,绿矾可用黄铁矿为原料制得。绿矾的化学式为FeSO·7HO。
4 2
FeSO·7HO属于__________(选填“纯净物“或”混合物); 1mol FeSO 中约含有_______个S
4 2 4
原子。
【答案】
(1)化学;Fe+CuSO=FeSO+Cu;强
4 4
(2)两;+1
(3)纯净物;6.02×1023
【解析】
胆矾的化学式为CuSO·5HO,胆矾受热失去结晶水的过程中生成新物质,属于化学变化;将铁
4 2
片浸入硫酸铜溶液可实现“化铁为铜”,是因为铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学【中小学教辅资源店 微信:mlxt2022】
方 程 是 Fe+CuSO=FeSO+Cu , 说 明 铁 的 金 属 活 动 性 比 铜 强 。 故 答 案 为 : 化 学 ,
4 4
Fe+CuSO=FeSO+Cu;强。
4 4
(2)明矾的化学式为KAl(SO)·12HO,其中含有两种金属元素,即钾元素和铝元素;KSO 中K
4 2 2 2 4
元素的化合价是+1。故答案为:两;+1。
(3)绿矾的化学式为FeSO·7HO,FeSO·7HO属于纯净物;1mol FeSO 中约含有6.02x1023个S
4 2 4 2 4
原子。故答案为:纯净物;6.02x1023
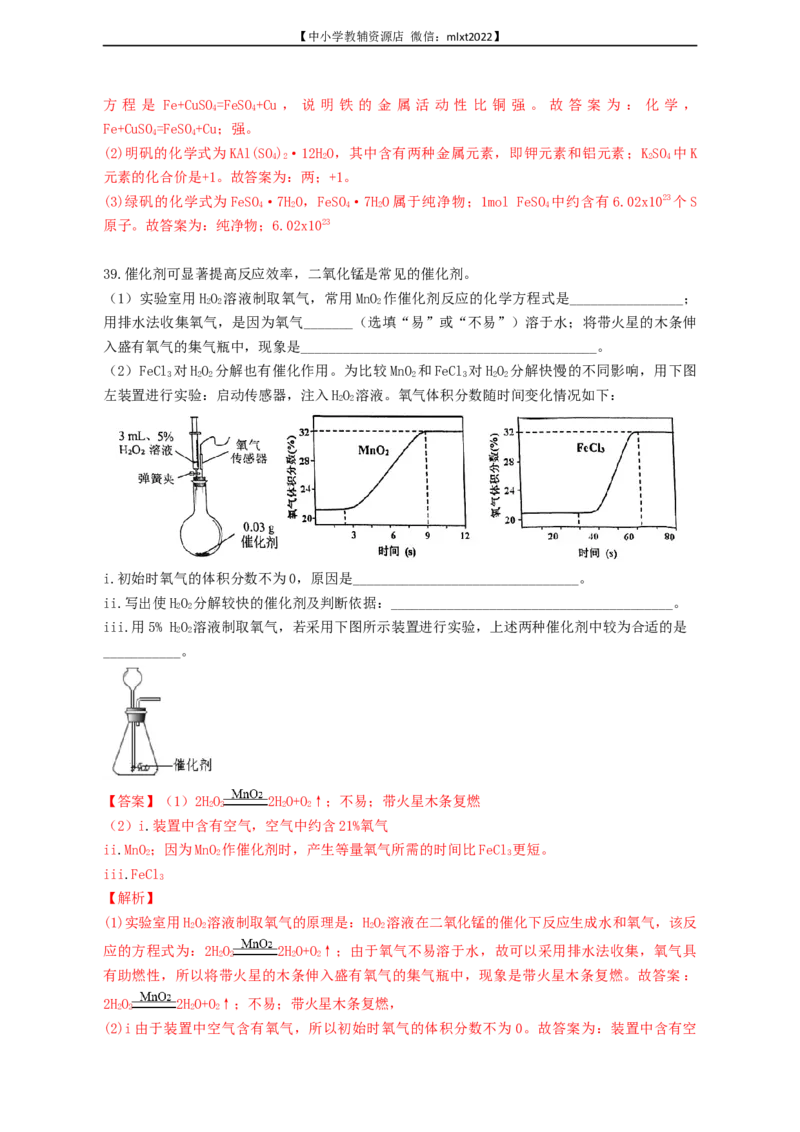
39.催化剂可显著提高反应效率,二氧化锰是常见的催化剂。
(1)实验室用HO 溶液制取氧气,常用MnO 作催化剂反应的化学方程式是________________;
2 2 2
用排水法收集氧气,是因为氧气_______(选填“易”或“不易”)溶于水;将带火星的木条伸
入盛有氧气的集气瓶中,现象是__________________________________________。
(2)FeCl 对HO 分解也有催化作用。为比较MnO 和FeCl 对HO 分解快慢的不同影响,用下图
3 2 2 2 3 2 2
左装置进行实验:启动传感器,注入HO 溶液。氧气体积分数随时间变化情况如下:
2 2
i.初始时氧气的体积分数不为0,原因是________________________________。
ii.写出使HO 分解较快的催化剂及判断依据:________________________________________。
2 2
iii.用5% HO 溶液制取氧气,若采用下图所示装置进行实验,上述两种催化剂中较为合适的是
2 2
___________。
【答案】(1)2HO 2HO+O↑;不易;带火星木条复燃
2 2 2 2
(2)i.装置中含有空气,空气中约含21%氧气
ii.MnO;因为MnO 作催化剂时,产生等量氧气所需的时间比FeCl 更短。
2 2 3
iii.FeCl
3
【解析】
(1)实验室用HO 溶液制取氧气的原理是:HO 溶液在二氧化锰的催化下反应生成水和氧气,该反
2 2 2 2
应的方程式为:2HO 2HO+O↑;由于氧气不易溶于水,故可以采用排水法收集,氧气具
2 2 2 2
有助燃性,所以将带火星的木条伸入盛有氧气的集气瓶中,现象是带火星木条复燃。故答案:
2HO 2HO+O↑;不易;带火星木条复燃,
2 2 2 2
(2)i由于装置中空气含有氧气,所以初始时氧气的体积分数不为 0。故答案为:装置中含有空【中小学教辅资源店 微信:mlxt2022】
气,空气中约含21%氧气,
i根据比较MnO 和FeCl 使HO 分解快慢的曲线图,可知当氧气体积分数都达到32%时,加MnO 用
2 3 2 2 2
的时间为9s,加FeCl 的时间大于60s;所以使HO 分解较快的催化剂是MnO ,原因是MnO 作催
3 2 2 2 2
化剂时,产生等量氧气所需的时间比FeCl 更短。故答案为:MnO ,因为MnO 作催化剂时,产生
3 2 2
等量氧气所需的时间比FeCl 更短,
3
i如图所示装置不能控制反应的速度,根据之前分析 MnO 比FeCl 使HO 分解速度更快,选择
2 3 2 2
FeCl 可以使HO 分解反应速度适中得到平稳的氧气流。故答案为:FeCl。
3 2 2 3
40.硫酸钾是重要的化工原料,在生产过程中常混有氯化钠杂质。
(1)用洁净的铂丝蘸取NaCl溶液灼烧,火焰呈_________色。
取少量KSO 溶液,滴入BaCl 溶液,现象是__________________________,反应的化学方程式是
2 4 2
__________________________________________________。
(2)硫酸钾和氯化钠的部分溶解度数据如有下表。100℃时,NaCl的溶解度为_______g/100g
水;
20℃时,10g水中最多溶解KSO_________g。
2 4
溶解度(g/100g水)
温度(℃) 0 20 60 100
NaCl 35.7 36.0 37.1 39.2
KSO 7.4 11.1 18.2 24.1
2 4
(3)某KSO 样品中混有NaCl杂质,可利用溶解度差异进行提纯。称取27.5g样品进行实验,
2 4
过程如下:
i.滤液B中,KSO_________(选填“达到”或“未达到”)饱和状态。
2 4
ii.27.5g样品中NaCl的质量是_________g。
iii. 分 析 上 述 实 验 , 说 明 设 计 步 骤 II 对 后 续 操 作 的 作 用 :
________________________________。
【答案】(1)黄;产生白色沉淀;KSO+BaCl=BaSO↓+2KCl
2 4 2 4
(2)39.2;1.11
(3)i.达到 ii.3.5
iii.根据步骤II的结果,可知样品中硫酸钾和氯化钠的质量;结合溶解度数据,获得较多硫酸
钾
【解析】(1)钠的焰色反应是黄色,所以用洁净的铂丝蘸取NaCl溶液灼烧,火焰呈黄色,取少量
KSO 溶液,滴入BaCl2溶液,硫酸钾和氯化钡反应生成硫酸钡沉淀和氯化钾,现象是产生白色沉
2 4
淀,化学方程式是KSO+BaCl2 =BaSO4++2KCl
2 4【中小学教辅资源店 微信:mlxt2022】
2)通过分析硫酸钾和氯化钠的部分溶解度数据,100°C时,NaCl的溶解度为39.2g/100g水;
20°C时,硫酸钾的溶解度是11.1g/100g水,所以10g水中最多溶解KSO 1.11g;
2 4
(3)i析出晶体后的溶液是饱和溶液,所以滤液B中,KSO 达到饱和状态;
2 4
ii 0°C时,硫酸钾的溶解度是7.4g/100g水,所以27.5g样品中NaCl的质量是
27.5g -12.9g-10.36g -7.4g/10=3.5g
iii分析上述实验,说明设计步骤II对后续操作的作用是:根据步骤II的结果,可知样品中硫
酸钾和氯化钠的质量,结合溶解度数据,获得较多的硫酸钾。
41.某种碳单质多孔材料中掺杂了氧化铁,为测定该材料中碳元素的含量,取 3.7g样品进行实
验,装置如下图所示。(夹持仪器省略,空气中CO 对实验的影响忽略不计)
2
通入氧气,点燃酒精灯,使样品充分燃烧,一段时间后停止通氧气;C中始终未出现浑浊。
(1)氧化铁的化学式是__________________。
(2)写出碳完全燃烧的化学方程式___________________________。
(3)将反应后装置B中药品放入水中搅拌,过滤。经检验,滤渣的成分是碳酸钙和氢氧化钙,
其中碳酸钙的质量为30.0 g;滤液中溶质的成分是____________________________。
( 4 ) 根 据 碳 酸 钙 的 质 量 能 否 确 定 样 品 中 碳 元 素 的 含 量 , 请 分 析 说 明
________________________。
【答案】(1)FeO
2 3
(2)C+O 点燃 CO
2 2
(3)NaOH、Ca(OH)
2
(4)能。因为C中未出现浑浊,说明生成的CO 全部转化为碳酸钙;根据碳元素质量守恒可知碳
2
酸钙中碳元素的质量等于样品中碳元素的质量,从而确定样品中碳元素的含量
【解析】(1)氧化铁即三氧化二铁,其的化学式是FeO;故答案为:FeO;
2 3 2 3
(2)碳完全燃烧生成二氧化碳,其化学方程式:C+O 点燃 CO;故答案为:C+O 点燃 CO
2 2 2 2
(3)样品中含有碳单质和铁,通入氧气完全反应后会产生二氧化碳和氧化铁,B装置吸收二氧化
碳,B装置内发生的反应有:2NaOH+CO=NaCO +HO;CaO+HO = Ca(OH);
2 2 3 2 2 2
Ca(OH)+NaCO = CaCO ↓++2NaOH;根据装置内存在的反应以及反应后装置B中药品放入水中搅
2 2 3 3
拌、过滤,滤渣的成分是碳酸钙和氢氧化钙,说明溶液中不含有碳酸钠,有 NaOH、Ca(OH) ;故
2
滤液中溶质的成分是NaOH、Ca(OH);故答案为:NaOH、 Ca(OH);
2 2
(4)能,因为C中未出现浑浊,说明生成的CO 全部转化为碳酸钙,根据碳元素质量守恒可知碳酸
2
钙中碳元素的质量等于样品中碳元素的质量,从而确定样品中碳元素的质量。故答案为:能,因
为C中未出现浑浊,说明生成的CO 全部转化为碳酸钙,根据碳元素守恒可知碳酸钙中碳元素的
2
质量等于样品中碳元素的质量,从而确定样品中碳元素的质量。【中小学教辅资源店 微信:mlxt2022】