文档内容
2021 年云南省中考化学试卷
1. 氢气 的下列性质属于化学性质的是
A. 无色、无气味
B. 密度比空气小
C. 难溶于水
D. 可以燃烧
【答案】D
【解析】
【详解】化学性质是物质在化学变化中表现出来的性质,无色、无气味、密度比空气小、难溶于水等均不
涉及化学变化,属于物理性质,可以燃烧涉及化学变化,属于化学性质。故选D。
2. 空气中的某种成分在通电时能发出不同颜色的光,可制成多种用途的电光源。该成分是
A. 氧气
B. 氮气
C. 稀有气体
D. 二氧化碳
【答案】C
【解析】
【详解】稀有气体在通电时能发出不同颜色的光,可制成多种用途的电光源,如航标灯、强照明灯、霓虹
灯等。故选C。
3. 把少量下列物质分别放入水中,充分搅拌,可得到溶液的是
A. 牛奶
B. 面粉
C. 花生油
D. 葡萄糖
【答案】D
【解析】
【分析】溶液是均一稳定的混合物;
【详解】A、牛奶不能和水形成均一、稳定的混合物,牛奶和水形成的是乳浊液,错误;
B、面粉不溶于水,不能和水形成均一、稳定的混合物,错误;
C、花生油不溶于水即不能够形成溶液,错误;
D、葡萄糖易溶于水,形成均一、稳定的混合物,属于溶液,正确。
故选D。4. 某《食物成分表》显示一些食物的能量值如下,其中能量最低的食物富含的营养素是
食物 菠菜 稻类 牛奶 豆油
能量(单位:kj/100g) 100 1435 226 3761
A. 蛋白质 B. 糖类 C. 油脂 D. 维生素
【答案】A
【解析】
【详解】其数值越大,即食物所含能量越高,上述食物中,菠菜含的能量为100kj/100g,其数值最小,
因此其能量最低,而绿色蔬菜中富含维生素。故选D。
5. 打开香水瓶盖闻到浓郁的香水气味,说明
A. 分子在不停地运动
B. 分子间有间隔
C. 分子的体积很小
D. 分子的质量很小
【答案】A
【解析】
【详解】打开香水瓶盖闻到浓郁的香水气味,是因为分子是不断运动的,香水气味的分子运动到我们的鼻
腔被我们感受到,所以有香水味,故选:A。
6. 幼儿及青少年缺钙会患
A. 佝偻病
B. 贫血
C. 甲状腺肿大
D. 龋齿
【答案】A
【解析】
【详解】A、钙主要存在于骨胳和牙齿中,使骨和牙齿具有坚硬的结构支架,缺乏幼儿和青少年会患佝偻
病,A正确。
B、缺铁容易引起贫血,B错误。
C、缺碘容易引起甲状腺肿大,C错误。
D、缺氟容易引起龋齿,D错误。
故选:A。7. 在pH=10的肥皂水中滴加酚酞溶液,溶液变
A. 无色
B. 红色
C. 蓝色
D. 紫色
【答案】B
【解析】
【详解】pH>7显碱性,pH=7显中性,pH<7显酸性;碱性溶液能使酚酞试液变红色,故选B。
8. 正确的实验操作是实验成功的保证,下列实验操作正确的是
A. 滴加液体 B. 取用固体
C. 量取液体 D. 加热液体
【答案】C
【解析】
【分析】本题考查实验仪器的规范使用。
【详解】A、使用胶头滴管滴加少量液体的操作,注意胶头滴管不能伸入到试管内或接触试管内壁,应垂
直悬空在试管口上方滴加液体,防止污染胶头滴管;故A不符合题意;
B、向试管中装块状固体药品时,先将试管横放,用镊子把块状固体放在试管口,再慢慢将试管竖立起来;
故B不符合题意;
C、量取液体时,视线要与液体的凹液面最低处保持水平读数;故C符合题意;
D、给试管中的液体加热时,用酒精灯的外焰加热试管里的液体,且液体体积不能超过试管容积的 ;故
D不符合题意;
故选:C。
【点睛】本题难度不大,熟悉各种仪器的用途及使用注意事项、常见化学实验基本操作的注意事项是解答此类试题的关键。
9. 嫦娥五号完成我国首次月球采样任务,带回1731g月壤,月壤中含有丰富的氦3.已知氦3的质子数为
2,中子数为1.氦3的核外电子数为
A. 1 B. 2 C. 3 D. 4
【答案】B
【解析】
【详解】原子中,核电荷数=核外电子数=质子数,氦3的质子数为2,故核外电子数为2,故选:B。
10. 草木灰能促进作物生长、增强抗病虫害和抗倒伏能力,其主要成分是KCO。KCO 属于
2 3 2 3
A. 钾肥 B. 磷肥 C. 氮肥 D. 复合肥
【答案】A
【解析】
【详解】含氮元素的化肥为氮肥,含钾元素的化肥属于钾肥,含磷元素属于磷肥,氮磷钾同时含有两种或
以上称为复合肥,碳酸钾含钾元素,为钾肥,故选:A。
11. 如图为氟原子的结构示意图,下列有关说法错误的是
A. 氟原子的最外层电子数为7
B. 氟原子核外有2个电子层
C. 氟原子易失电子
D. 氟原子的核电荷数为9
【答案】C
【解析】
【分析】原子结构示意图中,圆圈内的数字为质子数,弧线上的数字表示该层电子数;
【详解】由分析可知:
A、氟原子的最外层电子数为7,说法正确;
B、氟原子核外有2个电子层,说法正确;
C、氟原子最外层电子数为7,大于4,容易得到1个电子形成稳定结构,说法错误;
D、原子中质子数=核电荷数,氟原子的核电荷数为9,说法正确。
故选C。
12. 纳米医学上可用四氯金酸(HAuC1 )制备包裹药物的外壳,四氯金酸中氯元素的化合价为-1价,则金
4元素的化合价为
A. +2 B. +3 C. +4 D. +5
【答案】B
【解析】
【分析】
【详解】氢元素+1价,氯元素-1价,设金元素化合价为x,根据化合价代数和为零,(+1)+x+(-1)
4=0,x=+3,故选:B。
×13. “中东有石油,中国有稀土”。某种稀土元素在元素周期表中的相关信息如图所示,下列说法错误的
是
A. 铒属于金属元素
B. 铒的元素符号是Er
C. 铒的原子序数为68
D. 铒原子的质量为167.3g
【答案】D
【解析】
【详解】A、铒带“钅”属于金属元素,A正确。
B、元素周期表小方格右上方符号为元素符号,铒的元素符号是Er,B正确。
C、元素周期表小方格左上方数字表示原子序数,铒的原子序数为68,C正确。
D、相对原子质量单位是“1”不是“g”D错误。
故选:D。
14. 加热是最常见的反应条件,这一基本实验操作常要使用酒精灯。下列有关说法错误的是
A. 为了使酒精灯燃烧更旺,将灯内酒精添满,以增加可燃物
B. 酒精灯里的酒精洒到桌面上燃烧起来,可用湿抹布盖灭
C. 用完酒精灯后用灯帽盖灭,其灭火原理是隔绝氧气
D. 用燃着的木条点燃酒精灯,燃着的木条的作用是使温度达到可燃物的着火点
【答案】A
【解析】
【详解】A、酒精不能装得太满,以不超过灯壶容积的2/3为宜,若酒精量太多易受热膨胀,易使酒精溢出,发生实验安全事故,符合题意;
B、酒精灯里的酒精洒到桌面上燃烧起来,可用湿抹布盖灭,不能使用浇水的方法灭火,尤其是大量酒精
着火时,不符合题意;
C、用完酒精灯后用灯帽盖灭,灯帽使得酒精灯与空气隔绝,当灯帽内氧气完全耗尽后,酒精灯因为缺氧
而熄灭,其灭火原理是隔绝氧气,不符合题意;
D、用燃着的木条点燃酒精灯,燃着的木条的作用是使温度达到可燃物的着火点,物品燃烧三要素:氧气、
可燃物、着火点,酒精灯具备氧气、可燃物两大要素,燃着的木条则可以使酒精达到着火点,不符合题意。
故选A。
15. 白屈菜酸(C HO)具有止痛、止咳的功效。下列关于白屈菜酸的说法正确的是
7 4 6
A. 白屈菜酸属于氧化物
B. 白屈菜酸的相对分子质量为184g
C. 白屈菜酸中氧元素 的质量分数最大
D. 白屈菜酸中碳、氢、氧原子总数为17
【答案】C
【解析】
【分析】
【详解】A、氧化物由两种元素组成的化合物,且含有氧元素,白屈菜酸由碳、氢、氧三种元素组成,不
属于氧化物,A错误。
B、相对分子质量单位是“1”不是“g”,B错误。
C、白屈菜酸中碳、氢、氧元素质量比为(12 7):(1 4):(16 6)=21:1:24,氧元素的质量分数
最大,C正确。 × × ×
D、一个白屈菜酸分子中碳、氢、氧原子总数为17,D错误。
故选:C。
16. 下列实验方案错误的是
A. 探究NH NO 溶解时的温度变化
4 3B. 配制一定溶质质量分数的NaCl溶液
C. 验证木炭的还原性
D. 探究铁生锈的条件
【答案】B
【解析】
【详解】A、烧杯中放入温度计,随着硝酸铵的溶解,溶液温度改变,可以通过温度计时时观察体系温度变
化,方案正确,不符合题意;
B、配制一定质量分数的氯化钠溶液,首先取用、左物右码称量,用量筒量取溶剂,但量筒不能用于配制
溶液,物质溶解过程中常常有能量变化,可能损坏量筒,比如稀释浓 硫酸 ,放出的大量热容易使量筒炸
裂,量筒的口径小,不方便搅拌,所以量筒不能用来配制溶液,方案错误,符合题意;
C、碳与氧化铜加热时反应生成铜单质和二氧化碳,而生成的二氧化碳又能使得澄清石灰水变混浊,氧化
铁还原为铜单质的过程也伴随着颜色变化,黑色到紫红色,现象明显,方案正确,不符合题意;
D、从左至右,试管一铁钉生锈,试管二、三不生锈,试管二因为缺乏氧气而不生锈,试管三因为缺乏水
而不生锈,实验做到控制变量、互为对照,方案正确,不符合题意。
故选B。
17. 甲醛是一种防腐剂,下图是甲醛燃烧的微观示意图。有关说法错误的是A. 该反应为置换反应
B. 参加反应的两种物质的质量比为15:16
C. 生成物均由两种元素组成
D. 反应前后分子总数不变
【答案】A
【解析】
【分析】由微观示意图可知,反应物中有一个“ ”没有参加反应,反应化学方程式CHO+O
2 2
CO+H O。
2 2
【详解】A、由分析可知,生成物是两种化合物,该反应不属于置换反应,说法错误。
B、由微观示意图可知,该反应化学方程式为CHO+O CO+H O,故参加反应的两种物质的质量比为
2 2 2 2
30:32=15:16,说法正确。
C、由微观示意图可知生成物为二氧化碳和水,生成物均由两种元素组成,说法正确。
D、由化学方程式可知反应前后分子总数不变,说法正确。
故选:A。
18. 下列实验操作,能达到实验目的的是
选
实验目的 实验操作
项
A 鉴别羊毛纤维和蚕丝 灼烧后闻气味
B 除去木炭粉中混有的少量Fe O 加入足量稀盐酸充分反应,过滤,洗涤,干燥
2 3
鉴别NH C1和(NH )SO 固
C 4 4 2 4 加入熟石灰,研磨,闻气味
体
除去氢气中混有的少量氯化氢 将混合气体通过装有饱和NaCO 溶液的洗气瓶后,再通过浓
D 2 3
气体 硫酸干燥
A. A B. B C. C D. D【答案】B
【解析】
【详解】A、 羊毛纤维和蚕丝均含有蛋白质,灼烧后均有烧焦羽毛味,不能鉴别,错误;
B、加入足量稀盐酸和氧化铁充分反应,木炭不反应,过滤分离出固体木炭,洗涤,干燥,正确;
C、氯化铵和硫酸铵均含有铵根离子,加入熟石灰,研磨,均产生刺激性气味气体,不能鉴别,错误;
D、氯化氢和碳酸钠反应生成二氧化碳气体,引入新杂质,错误。
故选B。
19. A、B、C、D、E、F是初中化学常见的六种物质。A、B、D、E、F均由三种元素组成;A、B属于同
类别的物质;C物质在固态时俗称干冰;A、E均含有人体中含量最多的金属元素;F可用于玻璃、造纸、
纺织、洗涤剂的生产。部分反应物和产物已经略去,其中“一”表示两种物质间会反应,“→”表示一种
物质会一步转化成另一种物质。下列说法正确的是
A. A与C的反应是复分解反应
B. B一定是NaOH
C. D一定属于酸
D. E→C只能通过E与D反应实现
【答案】C
【解析】
【分析】C物质在固态时俗称干冰;C为二氧化碳,F可用于玻璃、造纸、纺织、洗涤剂的生产,故F为
碳酸钠,人体中含量最多的金属元素是钙元素,碳酸钠可以转化为E,且E含钙元素为碳酸钙,A含钙元
素且可以和二氧化碳反应为氢氧化钙,A、B属于同类别的物质,故B为碱,可以是氢氧化钠或氢氧化钾
等,D可以和氢氧化钙以及碳酸钙反应,且能转化为二氧化碳,D为酸,带入转化关系,符合题意。
【详解】A、由分析可知,A为氢氧化钙,C为二氧化碳,氢氧化钙和二氧化碳生成碳酸钙和水,没有交
换成分,不属于复分解反应,A错误。
B、B不一定是NaOH,还可以是氢氧化钾,如氢氧化钙和碳酸钾生成碳酸钙和氢氧化钾,B错误。
C、由分析可知,D一定为酸,C正确。
D、碳酸钙高温分解生成氧化钙和二氧化碳,E→C不只能通过E与D反应实现,D错误。
故选:C。20. 下列说法合理的有
①高炉炼铁炼得的是纯铁
②打开汽水瓶盖,看到气泡逸出,说明气体的溶解度随压强的减小而减小
③向充满CO 气体的软塑料瓶中倒入半瓶水,拧紧瓶盖,振荡,塑料瓶变瘪,说明CO 能与水发生反应
2 2
④某同学将一定量的NaCO 和Ba(OH) 溶液混合,要想检验反应后Ba(OH) 是否过量,选用NaCO
2 3 2 2 2 3
溶液、NaSO 溶液或FeCl 溶液均可
2 4 3
⑤向一定量的NaC1、MgSO 和HC1的混合溶液中逐滴加入NaOH溶液,右图表示加入NaOH溶液的质量
4
与某些物质的质量变化关系。则m点对应的溶液中有三种溶质,a可表示NaC1或HO的质量变化情况
2
A. 1个 B. 2个 C. 3个 D. 4个
【答案】B
【解析】
【详解】①、高炉炼铁最后冶炼得到的是生铁,因为冶炼时用到焦炭,会在冶炼过程中带来碳杂质,难以
得到纯铁,错误;
②、打开汽水瓶盖,使得汽水瓶内压强与大气压相等,这是瓶内气压减小,气泡逸出,说明气体的溶解度
随压强的减小而减小,正确;
③、塑料瓶变瘪也可能是因为二氧化碳溶解在水中,不能一定说明二氧化碳与水发生反应,错误;
④、碳酸钠与氢氧化钡反应生产碳酸钡沉淀和氢氧化钠,如果氢氧化钡过量,选用碳酸钠、硫酸钠溶液均
会产生白色沉淀,可以检验出来,而如果选氯化铁溶液这时棕红色沉淀的生成难以确定是由于氢氧化钡的
过量导致的,错误;
⑤、首先盐酸与氢氧化钠反应生成氯化钠和水,待盐酸完全耗尽后,氢氧化钠与硫酸镁反应,生成氢氧化
镁沉淀和硫酸钠直至硫酸镁完全耗尽,这时也就是m点的状态,这时溶液中有氯化钠、硫酸钠、盐酸三种
溶质,对于a曲线,开始时就有一定量的存在,之后加入盐酸后质量立即升高,因此其必定表示第一步反
应时的产物,即表示NaC1或H O的质量变化情况,正确;
2
综上,共有②⑤两说法正确。故选B。
21. 化学用语是国际通用语言,是学习化学的重要工具。
(1)用化学用语填空:①3个氢原子___________。
②2个二氧化氮分子___________。
③钾离子___________。
④地壳中含量最多的元素___________。
(2)写出符号“ ”中数字的含义:
①“+5”表示___________。
②“2”表示___________。
【答案】 (1). 3H (2). 2NO (3). K+ (4). O (5). 五氧化二磷中磷元素+5价 (6). 一个五
2
氧化二磷分子中磷原子个数为2个
【解析】
【详解】(1)①元素符号前面数字表示原子个数,故填:3H。
②化学式前面数字表示分子个数,故填:2NO 。
2
③一个钾离子带一个单位正电荷,标注在元素符号右上角,“1”省略不写,故填:K+。
④地壳中含量最多的元素是氧元素,故填:O。
(2)①元素符号上方数字表示化合价,故填:五氧化二磷中磷元素+5价。
②元素符号右下角数字,表示一个分子含某原子个数,故填:一个五氧化二磷分子中磷原子个数为2个。
22. 化学与我们的生产、生活、能源、环境息息相关。
(1)将下列物质和对应的用途连线___________。
物质 用途
碳酸钙 用于超导领域
C 补钙剂
60
食盐 调味剂
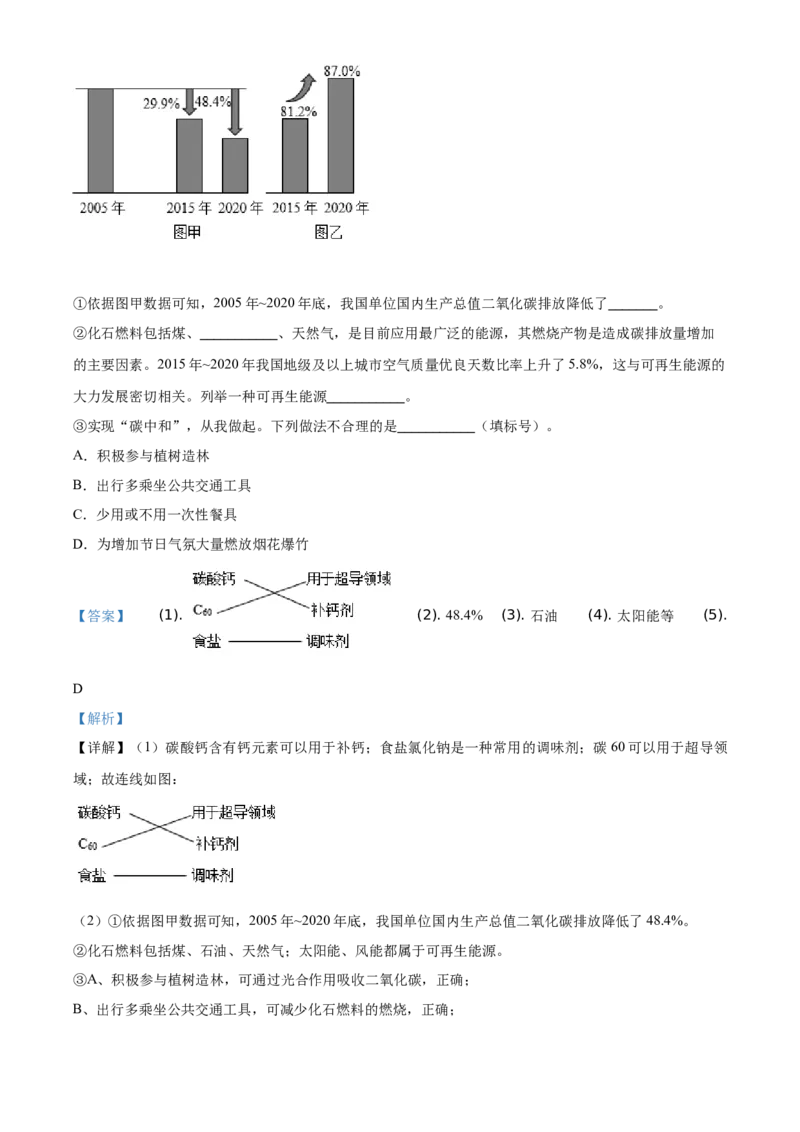
(2)2021年4月22日,习近平同志出席“领导人气候峰会”时,再次指出我国在2030年前“碳达峰”,
在2060年前实现“碳中和”。下图是我国近15年来单位国内生产总值二氧化碳排放示意图(图甲)和全
国地级及以上城市空气质量优良天数比率(图乙)。①依据图甲数据可知,2005年~2020年底,我国单位国内生产总值二氧化碳排放降低了_______。
②化石燃料包括煤、___________、天然气,是目前应用最广泛的能源,其燃烧产物是造成碳排放量增加
的主要因素。2015年~2020年我国地级及以上城市空气质量优良天数比率上升了5.8%,这与可再生能源的
大力发展密切相关。列举一种可再生能源___________。
③实现“碳中和”,从我做起。下列做法不合理的是___________(填标号)。
A.积极参与植树造林
B.出行多乘坐公共交通工具
C.少用或不用一次性餐具
D.为增加节日气氛大量燃放烟花爆竹
【答案】 (1). (2). 48.4% (3). 石油 (4). 太阳能等 (5).
D
【解析】
【详解】(1)碳酸钙含有钙元素可以用于补钙;食盐氯化钠是一种常用的调味剂;碳60可以用于超导领
域;故连线如图:
(2)①依据图甲数据可知,2005年~2020年底,我国单位国内生产总值二氧化碳排放降低了48.4%。
②化石燃料包括煤、石油、天然气;太阳能、风能都属于可再生能源。
③A、积极参与植树造林,可通过光合作用吸收二氧化碳,正确;
B、出行多乘坐公共交通工具,可减少化石燃料的燃烧,正确;C、少用或不用一次性餐具,可以节约资源,正确;
D、 为增加节日气氛大量燃放烟花爆竹,会生成二氧化碳等气体,不利于碳中和,错误。
故选D。
23. 在1800年,某科学家利用“伏打电池”在常温下对水进行通电分解,当正极产生了10mL的______,
负极产生的气体约为______mL,再次确认了水的组成。
【答案】 (1). 氧气 (2). 20
【解析】
【分析】电解水时,正极产生的是氧气,负极产生的是氢气,氧气和氢气的体积比约为1:2。
【详解】某科学家利用“伏打电池”在常温下对水进行通电分解,当正极产生了10mL的氧气,负极产生
的气体 氢气 约为20mL,再次确认了水的组成。
故填:氧气;20。
24. 《茶疏》中对泡茶过程有如下记载:“治壶、投茶、出浴、淋壶、烫杯、酾茶、品茶 ”,以上过
程涉及的操作有溶解、过滤等。在实验室进行过滤操作时玻璃棒的作用是______,过滤时液面高于滤纸边
缘会造成的后果是______。过滤______(填“能”或“不能”)将硬水软化。
【答案】 (1). 引流 (2). 滤液浑浊 (3). 不能
【解析】
【分析】
【详解】在实验室进行过滤操作时,玻璃棒的作用是引流,防止待过滤的固液混合物转移时洒在漏斗外。
过滤时液面高于滤纸边缘,部分固液混合物会不经滤纸过滤,直接从滤纸和漏斗的缝隙中流出,造成的后
果是滤液浑浊。过滤只能将固液分离,溶解在水中的可溶性钙、镁化合物不能除去,因此不能将硬水软化。
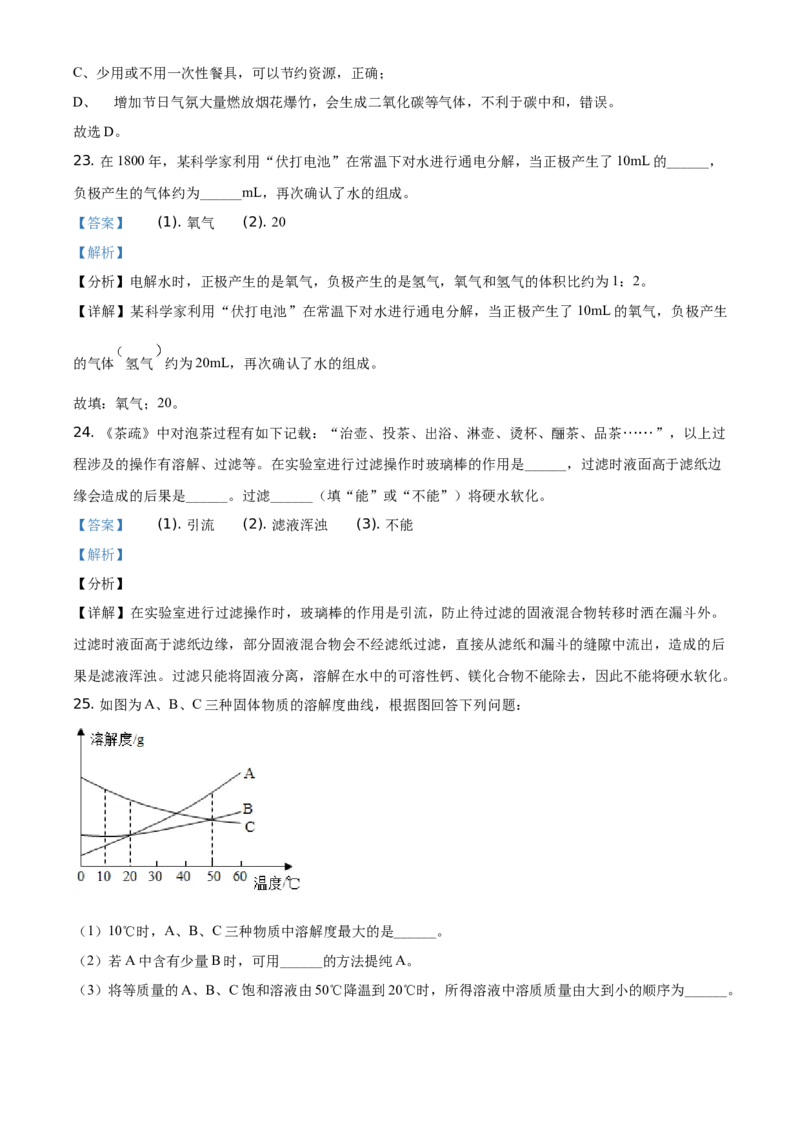
25. 如图为A、B、C三种固体物质的溶解度曲线,根据图回答下列问题:
(1)10℃时,A、B、C三种物质中溶解度最大的是______。
(2)若A中含有少量B时,可用______的方法提纯A。
(3)将等质量的A、B、C饱和溶液由50℃降温到20℃时,所得溶液中溶质质量由大到小的顺序为______。【答案】 (1). C (2). 降温结晶 (3).
【解析】
【分析】根据固体的溶解度曲线,可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶
质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断提纯晶体的方法。
【详解】(1)通过分析溶解度曲线可知, 时,A、B、C三种物质中溶解度最大的是C;
(2)A物质的溶解度受温度变化影响较大,B物质的溶解度受温度变化影响较小,所以若A中含有少量B
时,可用降温结晶的方法提纯A;
(3)将等质量的A、B、C饱和溶液由 降温到 时,降温后,A、B物质的溶解度减小,析出晶
体,还是饱和溶液,C物质的溶解度增大,不会析出晶体,应该按照 时的溶解度计算,50℃时,C的
溶解度大于20℃时,A的溶解度=20℃时,B的溶解度,所以50℃时,C的饱和溶液的溶质质量分数大于
20℃时,A的饱和溶液的溶质质量分数=20℃时,B的饱和溶液的溶质质量分数,所以所得溶液中溶质质量
由大到小的顺序为
【点睛】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解
决相关的问题,从而培养分析问题、解决问题的能力。
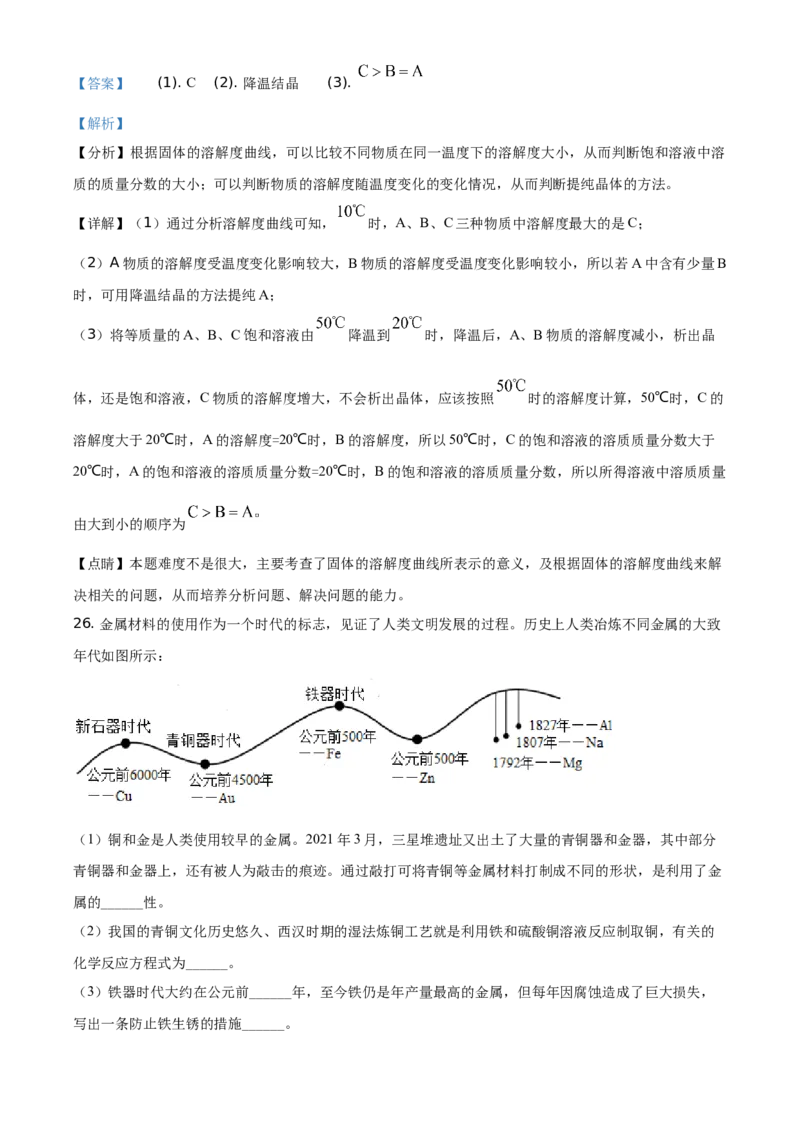
26. 金属材料的使用作为一个时代的标志,见证了人类文明发展的过程。历史上人类冶炼不同金属的大致
年代如图所示:
(1)铜和金是人类使用较早的金属。2021年3月,三星堆遗址又出土了大量的青铜器和金器,其中部分
青铜器和金器上,还有被人为敲击的痕迹。通过敲打可将青铜等金属材料打制成不同的形状,是利用了金
属的______性。
(2)我国的青铜文化历史悠久、西汉时期的湿法炼铜工艺就是利用铁和硫酸铜溶液反应制取铜,有关的
化学反应方程式为______。
(3)铁器时代大约在公元前______年,至今铁仍是年产量最高的金属,但每年因腐蚀造成了巨大损失,
写出一条防止铁生锈的措施______。(4)铝的利用距今100多年,现在铝的年产量得到大幅度的提高。铝虽然较活泼,但抗腐蚀性能好,原因
是______。
【答案】 (1). 延展 (2). (3). 500 (4). 刷漆(合理即可) (5).
铝和氧气生成一层致密的氧化膜阻止铝的进一步腐蚀
【解析】
【分析】本题考查金属的性质。
【详解】(1)通过敲打可将青铜等金属材料打制成不同的形状,是利用了金属的延展性;故填:延展;
(2)铁和硫酸铜溶液反应制取铜,同时生成硫酸亚铁,化学方程式为 ;故填:
;
(3)由图可知,铁器时代大约在公元前500年,至今铁仍是年产量最高的金属,但每年因腐蚀造成了巨大
损失,铁在与氧气和水蒸气同时接触时会发生锈蚀,所以铁生锈的预防措施可以刷漆、涂油等,故填:
500;刷漆(合理即可);
(4)铝虽然较活泼,但抗腐蚀性能好,原因是铝和氧气生成一层致密的氧化膜阻止铝的进一步腐蚀,故
填:铝和氧气生成一层致密的氧化膜阻止铝的进一步腐蚀。
【点睛】本题考查的是金属的有关知识,完成此题,可以依据已有的金属的性质进行。
27. (1)将一定量的锌和金属R的混合粉末加入一定量的氯化铜溶液中,溶液质量的变化情况如图所示。
下列说法错误的是______ 填标号 。
A.金属活动性
B.反应结束后过滤、滤渣中一定有Cu,可能有Zn和R
C.反应结束后过滤,若向滤渣中加入稀硫酸有气泡产生,则滤液一定无色
(2)某金属粉末含有Mg、Al、Cu、Ag中的一种或几种,取24g该金属粉末与足量稀盐酸反应产生2g氢
气,则该金属粉末的组成有______种情况。
【答案】 (1). BC (2). 7
【解析】【分析】(1)根据金属与酸、盐的反应来比较金属的活动性强弱及图像中溶液质量变化分析解答;
(2)镁、锌、铁、铝和稀盐酸反应生成盐和氢气,银不能和稀盐酸反应,然后根据金属与酸反应时生成
氢气质量关系解答。
要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、
盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来。
【详解】(1)A、将一定量的锌和金属R的混合粉末加入一定量的氯化铜溶液中,锌与氯化铜反应生成
氯化锌和铜,根据化学反应质量关系,65份质量锌生成铜64份质量,反应后固体质量减小,则反应后溶
液质量增加,由溶液质量的变化情况首先发生的反应,溶液质量是增加的,然后发生反应溶液质量是减小
的,说明锌先与氯化铜反应,然后是R与氯化铜反应,说明金属活动性 ,则A说法正确;
B、反应结束后过滤、滤渣中一定有Cu,可能有R,Zn一定没有,因为锌完全反应后,R才与氯化铜反应,
故B说法错误;
C、反应结束后过滤,若向滤渣中加入稀硫酸有气泡产生,则滤液一定无色是错误的,假如R是铁,铁与
硫酸反应生成氯化亚铁溶液是浅绿色的,故C说法错误。故选BC;
(2)设生成2g氢气,单独消耗镁质量为x,消耗铝质量为y
铜、银与盐酸不反应。
。
金属粉末组成镁;镁、铝、铜;镁、铝、银;镁、铝、铜、银;铝、铜;铝、银;铝、铜、银
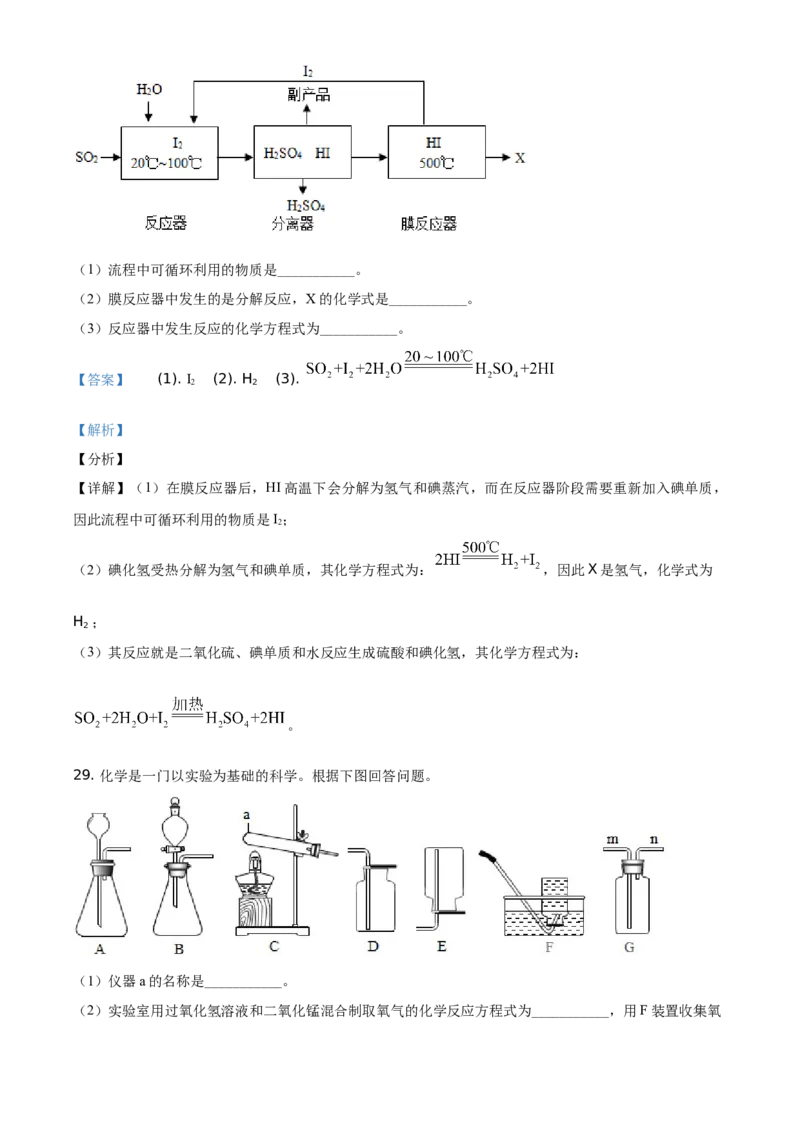
28. “垃圾是放错的资源”。碘循环工艺不仅能吸收SO ,减少环境污染,而且还可以得到仅含一种元素
2
的化工原料X,流程如下:(1)流程中可循环利用的物质是___________。
(2)膜反应器中发生的是分解反应,X的化学式是___________。
(3)反应器中发生反应的化学方程式为___________。
【答案】 (1). I (2). H (3).
2 2
【解析】
【分析】
【详解】(1)在膜反应器后,HI高温下会分解为氢气和碘蒸汽,而在反应器阶段需要重新加入碘单质,
因此流程中可循环利用的物质是I;
2
(2)碘化氢受热分解为氢气和碘单质,其化学方程式为: ,因此X是氢气,化学式为
H ;
2
(3)其反应就是二氧化硫、碘单质和水反应生成硫酸和碘化氢,其化学方程式为:
。
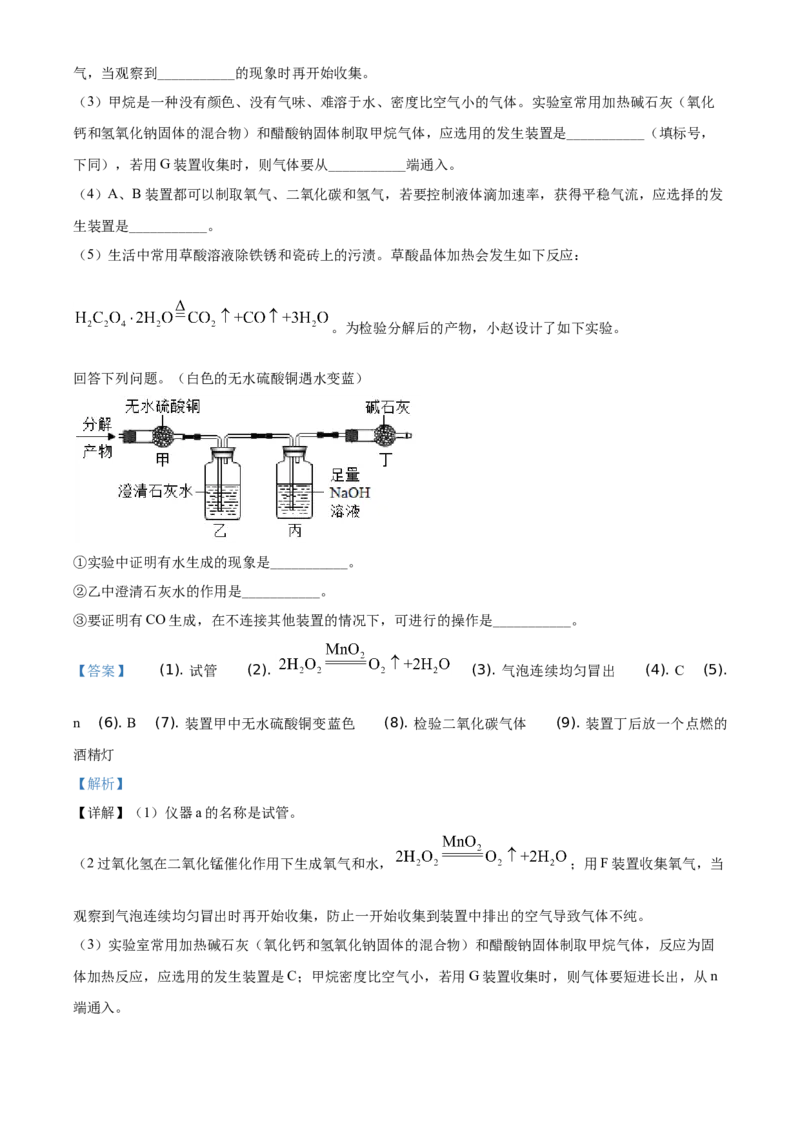
29. 化学是一门以实验为基础的科学。根据下图回答问题。
(1)仪器a的名称是___________。
(2)实验室用过氧化氢溶液和二氧化锰混合制取氧气的化学反应方程式为___________,用F装置收集氧气,当观察到___________的现象时再开始收集。
(3)甲烷是一种没有颜色、没有气味、难溶于水、密度比空气小的气体。实验室常用加热碱石灰(氧化
钙和氢氧化钠固体的混合物)和醋酸钠固体制取甲烷气体,应选用的发生装置是___________(填标号,
下同),若用G装置收集时,则气体要从___________端通入。
(4)A、B装置都可以制取氧气、二氧化碳和氢气,若要控制液体滴加速率,获得平稳气流,应选择的发
生装置是___________。
(5)生活中常用草酸溶液除铁锈和瓷砖上的污渍。草酸晶体加热会发生如下反应:
。为检验分解后的产物,小赵设计了如下实验。
回答下列问题。(白色的无水硫酸铜遇水变蓝)
①实验中证明有水生成的现象是___________。
②乙中澄清石灰水的作用是___________。
③要证明有CO生成,在不连接其他装置的情况下,可进行的操作是___________。
【答案】 (1). 试管 (2). (3). 气泡连续均匀冒出 (4). C (5).
n (6). B (7). 装置甲中无水硫酸铜变蓝色 (8). 检验二氧化碳气体 (9). 装置丁后放一个点燃的
酒精灯
【解析】
【详解】(1)仪器a的名称是试管。
(2过氧化氢在二氧化锰催化作用下生成氧气和水, ;用F装置收集氧气,当
观察到气泡连续均匀冒出时再开始收集,防止一开始收集到装置中排出的空气导致气体不纯。
(3)实验室常用加热碱石灰(氧化钙和氢氧化钠固体的混合物)和醋酸钠固体制取甲烷气体,反应为固
体加热反应,应选用的发生装置是C;甲烷密度比空气小,若用G装置收集时,则气体要短进长出,从n
端通入。(4)A、B装置都可以制取氧气、二氧化碳和氢气,若要控制液体滴加速率,获得平稳气流,应选择的发
生装置是B,装置B可以通过分液漏斗活塞控制液体的滴加速率来控制反应速率。
(5)①白色的无水硫酸铜遇水变蓝,实验中证明有水生成的现象是装置甲中无水硫酸铜变蓝色。
②二氧化碳能使澄清石灰水变浑浊,乙中澄清石灰水的作用是检验二氧化碳气体。
③一氧化碳具有可燃性,要证明有CO生成,在不连接其他装置的情况下,可进行的操作是在装置丁后放
一个点燃的酒精灯,尾气燃烧有淡蓝色火焰,说明存在一氧化碳。
30. 小英设计了探究SO 与AgNO 溶液反应的实验。将SO 通入质量分数为1.7%的AgNO 溶液中,反应
2 3 2 3
后过滤得到无色溶液A和白色沉淀B。对体系中有关物质性质分析得知沉淀B可能为Ag SO ,Ag SO 或
2 3 2 4
二者混合物。
【查阅资料】Ag SO 为白色固体,微溶于水
2 4
Ag SO 为白色固体,难溶于水,溶于过量的NaSO 溶液
2 3 2 3
【提出问题】白色沉淀B的成分是什么?
【猜想与假设】猜想一:仅有Ag SO 猜想二:仅有Ag SO 猜想三:___________
2 4 2 3
【实验探究】
实验操作 实验现象 结论
取少量溶液A于试管中,滴加足量Ba(NO ) 溶液 无明显现象 猜想___________成立
3 2
【实验结论】SO 与AgNO 溶液反应生成一种酸和沉淀B,反应的化学方程式是___________。
2 3
【拓展延伸】
①另取溶液A,滴加足量Ba(NO ) 溶液,无明显现象,再加入BaCl 溶液,产生白色沉淀,原因是
3 2 2
___________。
②向盛有少量AgNO 溶液的试管里滴入NaSO 溶液至过量,实验现象是___________。
3 2 3
【答案】 (1). Ag SO 、Ag SO (2). 二 (3). HO+SO +2AgNO = Ag SO ↓+2HNO (4). 溶液A
2 3 2 4 2 2 3 2 3 3
中含有银离子,加入氯化钡后,氯离子和银离子生成氯化银沉淀 (5). 开始生成白色沉淀,随着NaSO
2 3
溶液的不断加入沉淀溶解
【解析】
【详解】猜想与假设:对体系中有关物质性质分析得知沉淀 B可能为Ag SO ,Ag SO 或二者混合物。结
2 3 2 4
合猜想一、二可知,猜想三:Ag SO 、Ag SO
2 3 2 4
实验探究:硫酸根离子和钡离子反应生成硫酸钡白色沉淀,实验中无明显现象,说明溶液中不存在硫酸根
离子,故猜想一、三不成立,猜想二成立。
实验结论:由实验探究结论可知,沉淀B为Ag SO ,反应前后元素种类不变,则SO 与AgNO 溶液反应
2 3 2 3
生成一种酸为硝酸HNO,且反应物中还有水参与,故反应的化学方程式是HO+SO +2AgNO =
3 2 2 3
Ag SO ↓+2HNO 。
2 3 3拓展延伸:①氯离子和银离子生成不溶于酸的氯化银沉淀;另取溶液A,滴加足量Ba(NO ) 溶液,无明
3 2
显现象,再加入BaCl 溶液,产生白色沉淀,原因是溶液A中含有银离子,加入氯化钡后,氯离子和银离
2
子生成氯化银沉淀。
②已知:Ag SO 为白色固体,难溶于水,溶于过量的NaSO 溶液;向盛有少量AgNO 溶液的试管里滴入
2 3 2 3 3
NaSO 溶液至过量,实验现象是开始生成白色沉淀,随着NaSO 溶液的不断加入沉淀溶解。
2 3 2 3
31. 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中制备KClO 的化学反应方程式
3
为 。若用C1 与200g的KOH溶液恰好完全反应,反应后溶液质量
2
为221.3g。计算:
(1)参加反应的氯气的质量为___________g。
(2)所用KOH溶液中溶质的质量分数是多少?
【答案】(1)21.3g
(2)解:设KOH溶液中溶质的质量分数是x。
x=16.8%
答:参加反应氯气21.3g,所用KOH溶液中溶质的质量分数是16.8%。
【解析】
【分析】
【详解】(1)根据质量守恒可知,参加反应氯气质量221.3g-200g=21.3g;
(2)见答案。