文档内容
2024 届新高三开学摸底考试卷(湖南专用)
化 学
本卷满分100分,考试时间75分钟。
注意事项:
1.答卷前,考生务必将自己的姓名、考生号等填写在答题卡和试卷指定位置上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。如需改动,用橡
皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Fe 56 Cu 64 Ce 140
一、选择题:本题共 14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一
项是符合题目要求的。
1.湖南的美食主要有臭豆腐、油粑粑、糖油坨坨、烧辣椒皮蛋等。下列有关叙述错误的是
A.“臭豆腐”的主要成分是蛋白质,蛋白质属于天然高分子
B.“油粑粑”中的“油”为植物油,观察法可区别植物油和脂肪
C.“糖油坨坨”制作原料主要有葡萄糖、植物油和淀粉
D.“烧辣椒皮蛋”中皮蛋制作过程利用了蛋白质变性
【答案】C
【解析】A.豆腐制作原料是豆类,主要成分是蛋白质,蛋白质是天然高分子,A项正确;
B.植物油在常温下呈液态,而脂肪呈固态,可用观察法区别,B项正确;
C.生活中使用的糖主要成分是蔗糖,C项错误;
D.鸡蛋白在生石灰、盐等作用下发生了变性,D项正确。
故选C。
2.茵陈蒿有清热利湿,退黄的功效,《本草衍义》对茵陈蒿的使用有以下叙述:“方用山茵陈、山枙子
各三分,秦艽、升麻各四钱,末之。每用三钱,水四合,煎及二合,去滓,食后温服,以知为度。”在实
验室进行上述操作时,未用到的仪器是
A.蒸馏烧瓶 B.漏斗 C.研钵 D.量筒
【答案】A
【解析】“去滓”相当于过滤,需要用到漏斗;“末之”相当于粉碎,用到研钵;“水四合”用到量筒;
没有用到蒸馏烧瓶。故选A项。
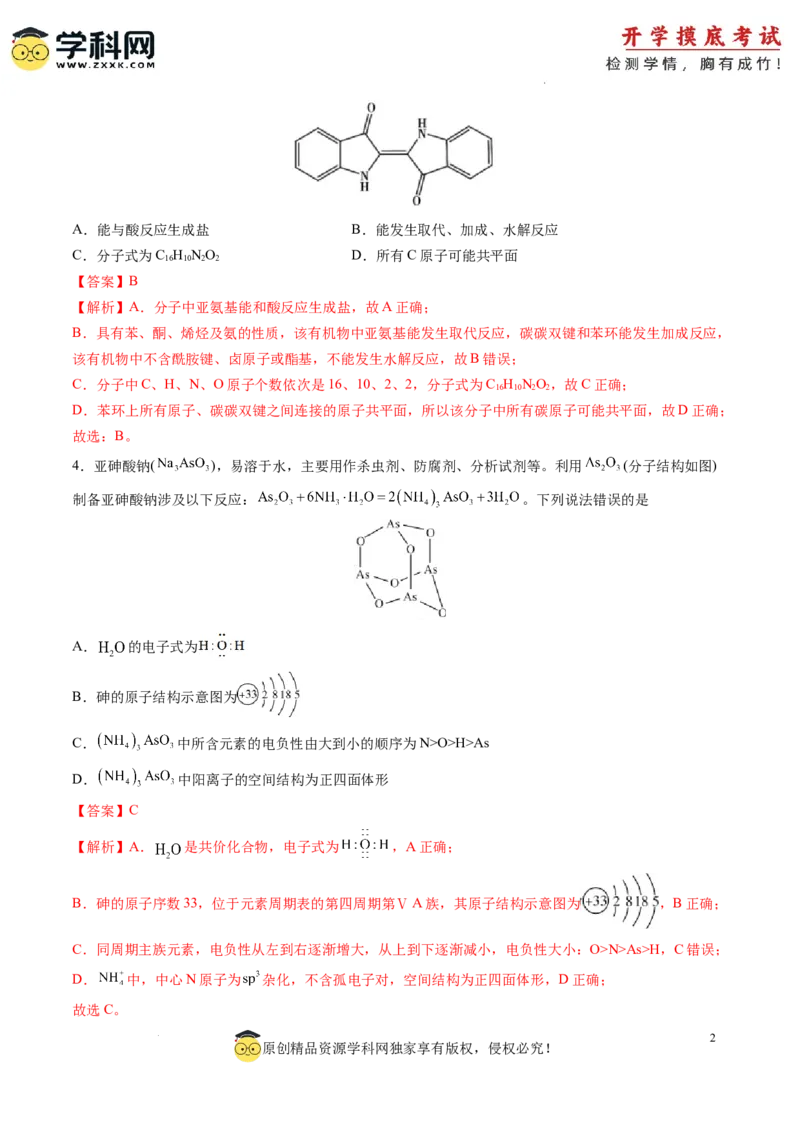
3.我国瑶族的一一个支系一蓝靛瑶族因穿着靛蓝染制成的土布而得名。靛蓝是一种染料,其分子结构如
图所示,下列有关靛蓝分子说法不正确的是
1
原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司A.能与酸反应生成盐 B.能发生取代、加成、水解反应
C.分子式为C H NO D.所有C原子可能共平面
16 10 2 2
【答案】B
【解析】A.分子中亚氨基能和酸反应生成盐,故A正确;
B.具有苯、酮、烯烃及氨的性质,该有机物中亚氨基能发生取代反应,碳碳双键和苯环能发生加成反应,
该有机物中不含酰胺键、卤原子或酯基,不能发生水解反应,故B错误;
C.分子中C、H、N、O原子个数依次是16、10、2、2,分子式为C H NO,故C正确;
16 10 2 2
D.苯环上所有原子、碳碳双键之间连接的原子共平面,所以该分子中所有碳原子可能共平面,故D正确;
故选:B。
4.亚砷酸钠( ),易溶于水,主要用作杀虫剂、防腐剂、分析试剂等。利用 (分子结构如图)
制备亚砷酸钠涉及以下反应: 。下列说法错误的是
A. 的电子式为
B.砷的原子结构示意图为
C. 中所含元素的电负性由大到小的顺序为N>O>H>As
D. 中阳离子的空间结构为正四面体形
【答案】C
【解析】A. 是共价化合物,电子式为 ,A正确;
B.砷的原子序数33,位于元素周期表的第四周期第ⅤA族,其原子结构示意图为 ,B正确;
C.同周期主族元素,电负性从左到右逐渐增大,从上到下逐渐减小,电负性大小:O>N>As>H,C错误;
D. 中,中心N原子为 杂化,不含孤电子对,空间结构为正四面体形,D正确;
故选C。
2
原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司5.下列离子反应方程式书写正确的是
A.向AgNO 溶液中滴加过量氨水:Ag++NH·H O=AgOH↓+
3 3 2
B.向Ca(ClO) 溶液中通入少量SO :SO +Ca2++2ClO-+H O=CaSO↓+2HClO
2 2 2 2 3
C.向NaHSO 溶液中滴加少量Ba(OH) 溶液:H++ +Ba2++OH-=BaSO ↓+H O
4 2 4 2
D.向甲苯中加入酸性高锰酸钾溶液:5 +6 +18H+→5 +6Mn2++14H O
2
【答案】D
【解析】A.向AgNO 溶液中加入过量的氨水的离子反应为Ag++2NH•H O═[Ag(NH )]++2H O,故A错误;
3 3 2 3 2 2
B.次氯酸能够氧化亚硫酸钙,向Ca(ClO) 溶液中通入少量SO 的离子反应为Ca2++3ClO-
2 2
+SO+H O═CaSO ↓+Cl-+2HClO,故B错误;
2 2 4
C.向NaHSO 溶液中滴加少量Ba(OH) 溶液,离子方程式为:2H++ +Ba2++2OH-=BaSO ↓+2H O,故C
4 2 4 2
错误;
D.甲苯被酸性高锰酸钾溶液氧化生成苯甲酸,同时该反应还生成硫酸钾、硫酸锰和水,反应方程式为:5
+6 +18H+→5 +6Mn2++14H O,故D正确;
2
故选D。
6.下列实验操作正确且能达到实验目的的是
A.图1模拟侯氏制碱法获得
B.图2用 溶液滴定未知浓度的醋酸溶液
C.图3用 溶液,探究温度对 化学平衡的影
响
D.图4探究苯酚和碳酸酸性相对强弱
【答案】C
【解析】A.氨气极易溶于水,直接通入溶液中会引起倒吸,故A不符合题意;
B.氢氧化钠为强碱,应该使用碱式滴定管,且指示剂应使用酚酞试液,故B不符合题意;
C. (蓝色) (黄色)) ,反应吸热,温度改变导致平衡移动使得溶液颜
色不同,能探究温度对化学平衡的影响,故C符合题意;
D.挥发的盐酸也会和苯酚钠生成苯酚,干扰实验,故D不符合题意;
3
原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司故答案选C。
7.某离子化合物中的阳离子结构模型如图。已知X、Y、Z为原子序数依次增大的短周期元素,Z的核外
成对电子数和未成对电子数之比为 。下列说法错误的是
A.X、Y、Z原子的电负性大小为Z>X>Y
B.1mol该阳离子所含的配位键数为2N (N 为阿伏加德罗常数的值)
A A
C.该阳离子可与水中的氢原子形成氢键
D.X分别能与Y、Z形成正四面体形的离子
【答案】C
【分析】X、Y、Z为原子序数依次增大的短周期元素,Z的核外成对电子数和未成对电子数之比为 ,
Z为N元素,X形成1个共价键,X是H元素;Y能形成4个共价键,其中2个为配位键,该阳离子带1个
单位正电荷,所以Y是B元素。
【解析】A.由题意可知,X、Y、Z分别为H、B、N,因此电负性: ,故A正确;
B.该阳离子中的磞原子分别与两个氮原子形成配位键,1mol该阳离子所含的配位键数为2N 故B正确;
A,
C.该阳离子中的氮原子没有孤电子对,不具备给电子能力,因此不能与水中的氢原子形成氢键,C错误;
D.H可分别与B、N形成 、 ,其中B、N分别为 杂化,其空间结构为正四面体形,故D正确;
故选C。
8.下列实验目的、实验操作及实验现象都正确的是
选项 实验目的 实验操作 实验现象
H 安静地燃烧,发出淡蓝色
A 验证Cl 支持燃烧 将点燃H 的导管伸入盛满Cl 的集气瓶中 2
2 2 2
火焰
探究晶体颗粒大小
把一小粒明矾晶体悬挂在40℃~50℃的饱和
B 与溶液冷却速度的 形成较大的明矾晶体
明矾溶液中,快速冷却
关系
探究H浓度对 取少量K CrO 溶液于试管中,向其中滴加 滴加稀硫酸后溶液由黄色变
2 4
C CrO2、CrO2相 一定量稀硫酸,观察现象;再滴加一定量 为橙色,再滴加NaOH溶
4 2 7
互转化的影响 NaOH溶液,观察现象 液,溶液又变为黄色
检验溴乙烷中含溴
D 加热溴乙烷与NaOH的混合液,然后滴加 有淡黄色沉淀生成
元素
4
原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司AgNO 溶液
3
【答案】C
【解析】A.将点燃H 的导管伸入盛满Cl 的集气瓶中,H 安静地燃烧,发出苍白色火焰,实验现象叙述
2 2 2
错误,A错误;
B.快速冷却会形成比较多的细小结晶颗粒,不会出现大颗粒结晶,实验操作错误,B错误;
C.取少量K CrO 溶液于试管中,向其中滴加一定量稀硫酸,H浓度增大,溶液黄色变为橙色,CrO2 转
2 4 4
化为CrO2 ,,再滴加一定量NaOH溶液,H浓度降低,溶液又变为黄色,CrO2 转化为CrO2
,C正确;
2 7 2 7 4
D.加热溴乙烷与NaOH的混合液时,为确保溴乙烷水解完全,NaOH应过量,故反应后混合液中含有未
反应的NaOH,需先加稀硝酸中和NaOH至溶液呈酸性,再滴加AgNO 溶液检验溴离子,实验操作错误,
3
D错误;
故选C。
9.科学家近年发明了一种新型光电催化装置,它能将葡萄糖和CO 转化为甲酸盐,如图所示。光照时,
2
光催化电极a产生电子(e-)和空穴(h+),图中的双极膜中间层中的HO会解离产生H+和OH-。
2
下列说法错误的是
A.光催化电极a的反应为C H O+12h++18OH-=6HCOO-+12H O
6 12 6 2
B.双极膜中间层中的H+在外电场作用下向催化电极b移动
C.理论上电路中转移4mole-时可生成2molHCOO-
D.阳极区和阴极区的pH均减小
【答案】C
【分析】科学家近年发明了一种新型光电催化装置,它能将葡萄糖和CO 转化为甲酸盐,光照时,光催化
2
电极a产生电子(e-)和空穴(h+),电子经过电源到达催化电极b处,则光催化电池a为阳极,催化电极b为阴
极,以此解答。
【解析】A.该装置可以将葡萄糖转化为甲酸盐,C H O 在电极a处得到空穴(h+)生成HCOO-,方程式为:
6 12 6
C H O+12h++18OH-=6HCOO-+12H O,故A正确;
6 12 6 2
B.电解池中阳离子向阴极移动,则双极膜中间层中的H+在外电场作用下向催化电极b移动,故B正确;
C.CO 在电极b处得到电子生成HCOO-,电极方程式为:CO+2e-+H O= HCOO-+OH-,理论上电路中转移
2 2 2
5
原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司4mole-时可以在催化电极b处得到2mol HCOO-,另外光催化电极a处得到2mol HCOO-,共可生成
4molHCOO-,故C错误;
D.光催化电极a处发生反应C H O+12h++18OH-=6HCOO-+12H O,氢氧根浓度减小,pH减小,电极b处
6 12 6 2
CO 转化为甲酸,然后甲酸和KHCO 溶液反应使溶液pH减小,故D正确;
2 3
故选C。
10.实验室利用环己酮和乙二醇反应可以制备环己酮缩乙二醇,反应原理及实验装置如下图所示:
下列有关说法错误的是
A.冷凝管可改用球形冷凝管
B.当观察到分水器中苯层液面高于支管口时,必须打开旋塞B将水放出
C.反应中加入苯的作用是作反应溶剂,同时与水形成共沸物便于蒸出水
D.当分水器中水层不再增多,说明制备实验已完成
【答案】B
【解析】A.冷凝管的作用是冷凝回流苯和水蒸气,改用球形冷疑管可提高冷凝效果,A正确;
B.当分水器中苯层液面高于支管口时,苯回流至圆底烧瓶并继续蒸馏,并不是必须打开旋塞B将水放出,
只有水层液面高于支管口时,才需放水,B错误;
C.装置中苯的作用是作反应溶剂,同时与水形成共沸物便于蒸出水,经冷凝管冷凝回流后进入分水器,
使水脱离反应体系,使平衡向正反应方向移动,提高环己酮缩乙二醇的产率,C正确;
D.当分水器中水层不再增多,说明该反应已不再生成水,因此反应完成,D正确;
故选B。
11.连二亚硫酸钠 俗称保险粉,有极强的还原性,易溶于水,在碱性介质中稳定。某科研小组
设计制备 的主要步骤如图所示:
下列说法错误的是
A.把锌粉制成水悬浊液,有利于提高反应物的利用率
B.为了提高 的生成速率,应使反应I在较高温度下进行
C.在保存“保险粉”时加入少量的 固体,其目的是提高“保险粉”的稳定性
6
原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司D. 久置空气中易被氧化,其氧化产物可能为 或
【答案】B
【分析】反应Ⅰ为2SO +Zn=ZnS O,反应Ⅱ为ZnS O 与NaOH发生复分解反应产生Zn(OH) 和NaSO。
2 2 4 2 4 2 2 2 4
【解析】A.反应Ⅰ中,将锌粉制成水浊液可增大接触面积提高反应物的利用率,A项正确;
B.温度较高SO 在水中的溶解度下降不利于反应Ⅰ,B项错误;
2
C.保险粉在碱性介质中稳定,NaCO 呈碱性加入后提高保险粉的稳定性,C项正确;
2 3
D.NaSO 中S为+3价可被O 氧化为NaHSO 或NaHSO,D项正确;
2 2 4 2 3 4
故选B。
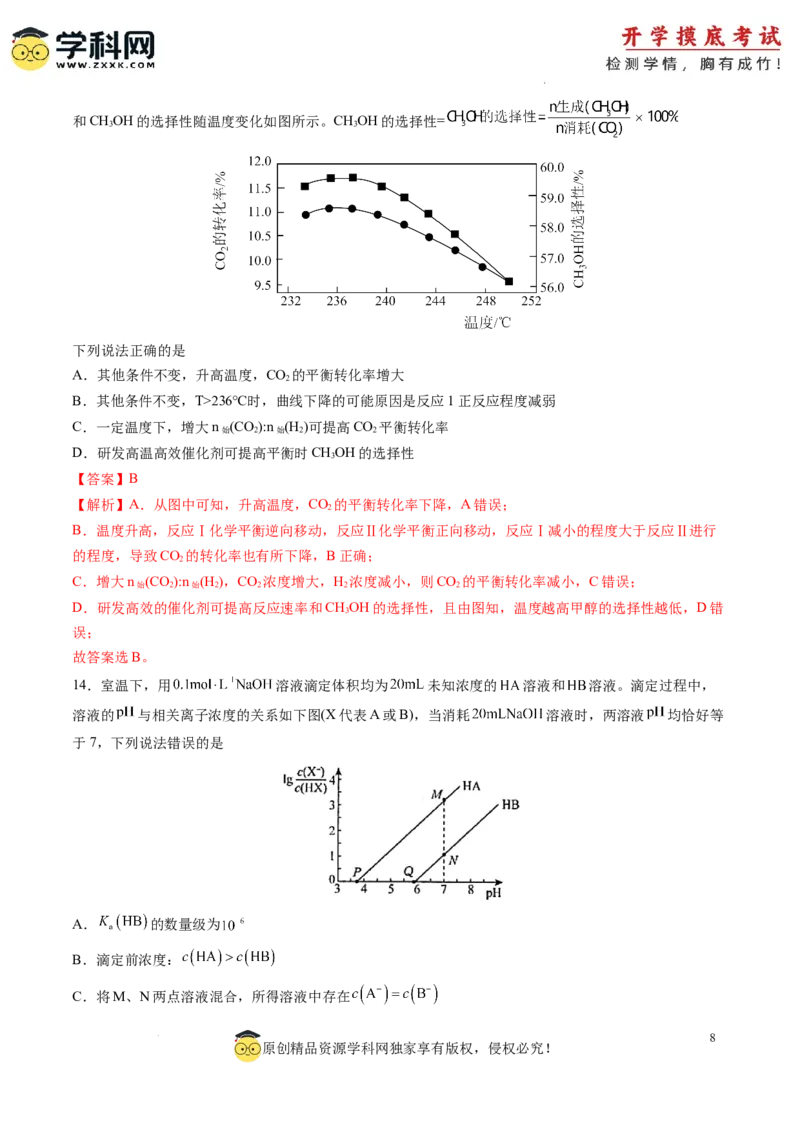
12.利用计算机技术测得在甲、乙两种催化剂作用下由正丁烷(g)制备1-丁烯(g)的反应历程如下,其中甲、
乙催化剂表面的物种均用*号标注,过渡态均用TS表示,下列说法中错误的是
A.选用催化剂甲时的最高能垒(活化能 )为1.95eV
B.选用催化剂乙时,相对能量从 的过程为正丁烷的吸附过程
C. 为吸热反应
D.若只从平均反应速率快慢角度考虑,生产中适宜选用催化剂乙
【答案】A
【解析】A.过渡态物质的总能量与反应物总能量的差值为活化能,由图可知,选用催化剂甲时的最高能
垒(活化能 )为选用催化剂甲时的最高能垒(活化能 )为1.29eV,A项错误;
B.由图可知,选用催化剂乙时,相对能量从 的过程为正丁烷的在催化剂表面的吸附过程,
B项正确;
C.生成物能量高于反应物的能量,则 为吸热反应,C项正确;
D.活化能越小反应越快,活化能越大反应越慢,若只从平均反应速率快慢角度考虑,生产中适宜选用催
化剂乙,其反应历程中活化能较小,D项正确。
故选A。
13.CO-H 催化重整可获得CHOH。其主要反应为
2 2 3
反应I: CO(g) + 3H(g) = CH OH(g) + H O(g) H=-53.7kJ·mol-1
2 2 3 2 1
反应II:CO(g) + H(g)= CO(g) + H O(g) H=+41kJ·mol-1
2 2 2 2 △
若仅考虑上述反应,在5.0 MPa、n (CO): n (H )=1:3时,原料按一定流速通过反应器,CO 的转化率
始 2△ 始 2 2
7
原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司和CHOH的选择性随温度变化如图所示。CHOH的选择性=
3 3
下列说法正确的是
A.其他条件不变,升高温度,CO 的平衡转化率增大
2
B.其他条件不变,T>236℃时,曲线下降的可能原因是反应1正反应程度减弱
C.一定温度下,增大n (CO):n (H )可提高CO 平衡转化率
始 2 始 2 2
D.研发高温高效催化剂可提高平衡时CHOH的选择性
3
【答案】B
【解析】A.从图中可知,升高温度,CO 的平衡转化率下降,A错误;
2
B.温度升高,反应Ⅰ化学平衡逆向移动,反应Ⅱ化学平衡正向移动,反应Ⅰ减小的程度大于反应Ⅱ进行
的程度,导致CO 的转化率也有所下降,B正确;
2
C.增大n (CO):n (H ),CO 浓度增大,H 浓度减小,则CO 的平衡转化率减小,C错误;
始 2 始 2 2 2 2
D.研发高效的催化剂可提高反应速率和CHOH的选择性,且由图知,温度越高甲醇的选择性越低,D错
3
误;
故答案选B。
14.室温下,用 溶液滴定体积均为 未知浓度的 溶液和 溶液。滴定过程中,
溶液的 与相关离子浓度的关系如下图(X代表A或B),当消耗 溶液时,两溶液 均恰好等
于7,下列说法错误的是
A. 的数量级为
B.滴定前浓度:
C.将M、N两点溶液混合,所得溶液中存在
8
原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司D.水的电离程度:
【答案】B
【解析】A.由图可知 时, 和 的电离平衡常数即等于此时溶液的 ,所以
的数量级为 ,A项正确;
B.由A选项可知,酸性:HA>HB;滴定至 时,所用 溶液体积相同,则酸的酸性越弱,浓度
越大,则滴定前浓度: ,B项错误;
C. 时,两溶液中均存在 、 ,将M、N两点溶液混合,所得溶液中也
存在 ,C项正确;
D. 越小,水的电离程度越弱,所以水的电离程度: ,D项正确;
答案选B。
二、非选择题:本题共4小题,共58分。
15.(14分)KMnO 在生产和生活中有着广泛用途,某化学小组在实验室制备KMnO 并探究其性质。
4 4
(一) KMnO 的制备,分步骤Ⅰ、Ⅱ两步进行。
4
步聚Ⅰ.先利用如图所示装置制备KMnO 。称取7.0gKOH(s)和5.0gKClO (s)放入容器A中,加热,待混
2 4 3
合物熔融后,加入5.0gMnO(s),待反应物干涸后,加大火焰强热4~8min,得墨绿色的锰酸钾。
2
(1)A可选用_______(填标号)。
①石英坩埚 ②瓷坩埚 ③铁坩埚
(2)实验中发生反应生成KMnO 的化学方程式为_______。
2 4
Ⅱ.由KMnO 制备KMnO 。已知:KMnO 易溶于水,水溶液呈墨绿色。主要过程如下:
2 4 4 2 4
①待A处物料冷却后,用20mL4%KOH溶液重复浸取,合并浸取液便得墨绿色的锰酸钾溶液。
②向滤液中通入足量CO,使KMnO 歧化为KMnO 和MnO ,过滤出生成的MnO 。
2 2 4 4 2 2
③再将滤液进行一系列处理,得KMnO 晶体。
4
(3)过程②向滤液中通入足量CO,可观察到的现象为_______;检验KMnO 歧化完全的实验方法是
2 2 4
_______。
(二) KMnO 的性质。已知:KMnO 具有强氧化性,可与草酸(H C O)反应:
4 4 2 2 4
2KMnO 5H C O + 3H SO K SO + 2MnSO + 10CO 8H O。某化学小组选用硫酸酸化的
4 2 2 4 2 4 2 4 4 2 2
0.05mol/L高锰酸钾溶液与草酸溶液反应,探究外界条件对化学反应速率的影响,进行了如下三组实验:
9
原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司[实验内容及记录的数据]
室温下,试管中所加试剂及其用量/mL
编 室温下溶液颜色褪至无色所
cmolL-1H C O 溶 0.05molL-1KMnO 溶 3molL-1稀硫
号 2 2 4 4 需时间/min
H O
2
液 液 酸
1 3.0 1.0 4.0 2.0 4.0
2 2.0 2.0 4.0 2.0 5.2
3 1.0 3.0 4.0 2.0 6.4
(4)配制250mL0.05molL1的高锰酸钾溶液肯定不需要的仪器是_______(填标号)。
a.蒸发皿 b.容量瓶 c.玻璃棒 d.烧杯 e.坩埚 f.胶头滳管
(5)为达到实验目的,HC O 溶液的物质的量浓度不低于_______。
2 2 4
(6)利用实验1中数据计算,0~4min内,用KMnO
的浓度变化表示的反应速率:KMnO _______。
4 4
【答案】(1)③(2分)
(2)6KOH3MnO KClO 3K MnO KCl3H O (2分)
2 3 2 4 2
(3)墨绿色溶液变为紫红色,同时有黑色固体生成(2分) 用玻璃棒蘸取溶液点到滤纸上,滤纸上只有
紫色而无绿色痕迹,则歧化完全(2分)
(4)ae(2分)
(5)0.5molL1 (2分)
(6)0.005molL1min1 (2分)
【解析】(1)由于加热后的熔融物中含有氢氧化钾,KOH既会与瓷坩埚中的成分Al O、SiO 等发生反应,
2 3 2
也会与石英坩埚中的成分SiO 反应,故仪器A可选用铁坩埚,故答案为:③;
2
(2)实验中发生反应生成KMnO 即KOH、KClO 和MnO 反应生成KMnO 、KCl和HO,根据氧化还
2 4 3 2 2 4 2
原反应配平可得,该反应的化学方程式为6KOH3MnO KClO 3K MnO KCl3H O,故答案为:
2 3 2 4 2
6KOH3MnO KClO 3K MnO KCl3H O;
2 3 2 4 2
(3)向滤液中通入足量CO,促使KMnO 发生歧化反应
2 4
3K MnO 2CO 2KMnO MnO 2K CO ,所以可观察到的现象为墨绿色溶液变为紫红色,同时
2 4 2 4 2 2 3
有黑色固体生成;通入CO 气体,使KMnO 歧化为KMnO 和MnO ,KMnO 在溶液中呈紫红色,可利用
2 2 4 4 2 4
层析法,通过产物的颜色检验KMnO 是否歧化完全,实验方法是用玻璃棒蘸取溶液点到滤纸上,根据层
2 4
析原理,滤纸上只有紫色而无绿色痕迹,则歧化完全,故答案为:墨绿色溶液变为紫红色,同时有黑色固
体生成;用玻璃棒蘸取溶液点到滤纸上,滤纸上只有紫色而无绿色痕迹,则歧化完全;
1
原创精品资源学科网独家享有版权,侵权必究!
0
学科网(北京)股份有限公司(4)用KMnO4固体配制250mL0.05molL1的高锰酸钾溶液需用用到的仪器有:天平、烧杯、玻璃棒、
250mL容量瓶和胶头滴管,故肯定不需要的仪器是ae,故答案为:ae;
(5)根据反应方程式可知,
2KMnO 5H C O + 3H SO K SO + 2MnSO + 10CO 8H O
4 2 2 4 2 4 2 4 4 2 2
2 5 ,解得c=0.5mol/L,故
0.05mol/L410-3L 110-3Lc
为达到实验目的,HC O 溶液的物质的量浓度不低于0.5mol/L,故答案为:0.5mol/L;
2 2 4
4mL×0.05mol/L
(6)利用实验1中数据计算,即混合后c(KMnO )= =0.02mol/L,0~4min内,用KMnO 的浓
4 10mL 4
Δc 0.02mol/L-0
度变化表示的反应速率:υKMnO = = = ,故答案为:
4 Δt 4min 0.005molL1min1
0.005molL1min1。
16.(14分)工业上以铬铁矿[主要成分为 ,含少量 、 杂质]为主要原料制备红矾钾
的工艺流程如图所示:
请回答下列问题:
(1)已知“高温连续焙烧”阶段 元素转化为 。
①焙烧时采取“多层逆流焙烧”,即将固体粉末从炉顶投料,氧气从炉底鼓入,这样做的优点为_______。
② 与纯碱反应的化学方程式为_______。
(2)滤液Ⅱ中发生反应的离子方程式为_______。
(3)一系列操作包括: 蒸发溶剂至_______,停止加热、_______抽滤、重结晶。
(4)生产过程中产生的 酸性废液可通过钡盐沉淀法处理,其过程为:先将 酸性废液碱化处
理,再加入 。废液需进行碱化处理的目的是_______[已知:
]。
(5)除了“一系列操作”中所得母液可循环利用外,上述流程中可循环利用的物质还有 、
_______(填化学式)。
【答案】(1)增大反应物接触面积,提高反应速率,从而提高原料的利用率(2分)
(2分)
1
原创精品资源学科网独家享有版权,侵权必究!
1
学科网(北京)股份有限公司(2) (2分)
(3)有晶膜出现(2分) 冷却至室温(2分)
(4)促进 转化为 , 浓度升高,有利于与 生成 沉淀(2分)
(5) (2分)
【分析】铬铁矿中加入NaCO、通入氧气,高温连续焙烧,Cr元素转化为 ,Fe转化为Fe O,Al O
2 3 2 3 2 3
与NaCO 反应生成NaAlO 同时生成二氧化碳,CuO不参与反应,水浸后Fe O、CuO不溶于水生成沉淀
2 3 2 2 3
过滤除去,滤液Ⅰ中含有NaAlO 和NaCrO,滤液Ⅰ通入CO 调节pH至8.3,此时NaAlO 与CO、HO
2 2 4 2 2 2 2
反应生成Al(OH) 沉淀除去,滤液Ⅱ中主要为NaCrO,往滤液Ⅱ中通入过量CO,NaCrO 与CO 反应生
3 2 4 2 2 4 2
成NaCr O 和NaHCO ,NaHCO 结晶析出,滤液Ⅲ中主要为NaCr O,滤液Ⅲ中加入KCl,再经过一系列
2 2 7 3 3 2 2 7
操作得到KCr O。
2 2 7
【解析】(1)①焙烧时固体粉末从炉顶投料,氧气从炉底鼓入,这样可以增大反应物的接触面积,提高
反应速率,从而提高原料的利用率。
②Al O 与纯碱反应生成NaAlO 和CO,化学方程式为 。
2 3 2 2
(2)滤液Ⅱ中NaCrO 与CO、HO反应生成NaCr O 和NaHCO ,碳酸氢钠在水中溶解度较小结晶析出,
2 4 2 2 2 2 7 3
因此该反应的离子方程式为 。
(3)从KCr O 溶液中得到KCr O 晶体,采用蒸发浓缩、冷却结晶,抽滤、重结晶的方式,50℃蒸发溶
2 2 7 2 2 7
剂至有晶膜出现,停止加热、冷却至室温,再抽滤重结晶得到KCr O 晶体。
2 2 7
(4)将KCr O 酸性废液碱化处理,促使 +H O 2 +2H+化学平衡正向移动,可使 转化
2 2 7 2
为 , 浓度升高,有利于与Ba2+反应生成BaCrO 沉淀。
4
(5)高温连续焙烧生成了CO,NaHCO 分解制NaCO 时也会生成CO,生成的CO 可用于与滤液Ⅰ中偏
2 3 2 3 2 2
铝酸钠反应,也可与滤液Ⅱ中 反应,因此上述流程中可循环利用的物质还有CO。
2
17.(15分)低碳烯烃是基础有机化工原料,工业上可利用合成气直接或间接制取。主要反应方程式如下。
间接制取低碳烯烃:CO(g)+2H(g) CHOH(l) H=-116kJ•mol-1
2 3 1
△
2CHOH(l) C H(g)+2HO(l) H=-35kJ•mol-1
3 2 4 2 2
△
直接制取低碳烯烃:2CO(g)+4H(g) C H(g)+2HO(g) H
2 2 4 2 3
△
回答下列问题:
(1)已知HO(g) HO(l) H=-44kJ•mol-1,则 H=______kJ/mol。
2 2 3
△ △
(2)将N、CO和H 以体积比为1:1:2充入密闭容器中直接制取乙烯,CO的平衡转化率与温度的关系如
2 2
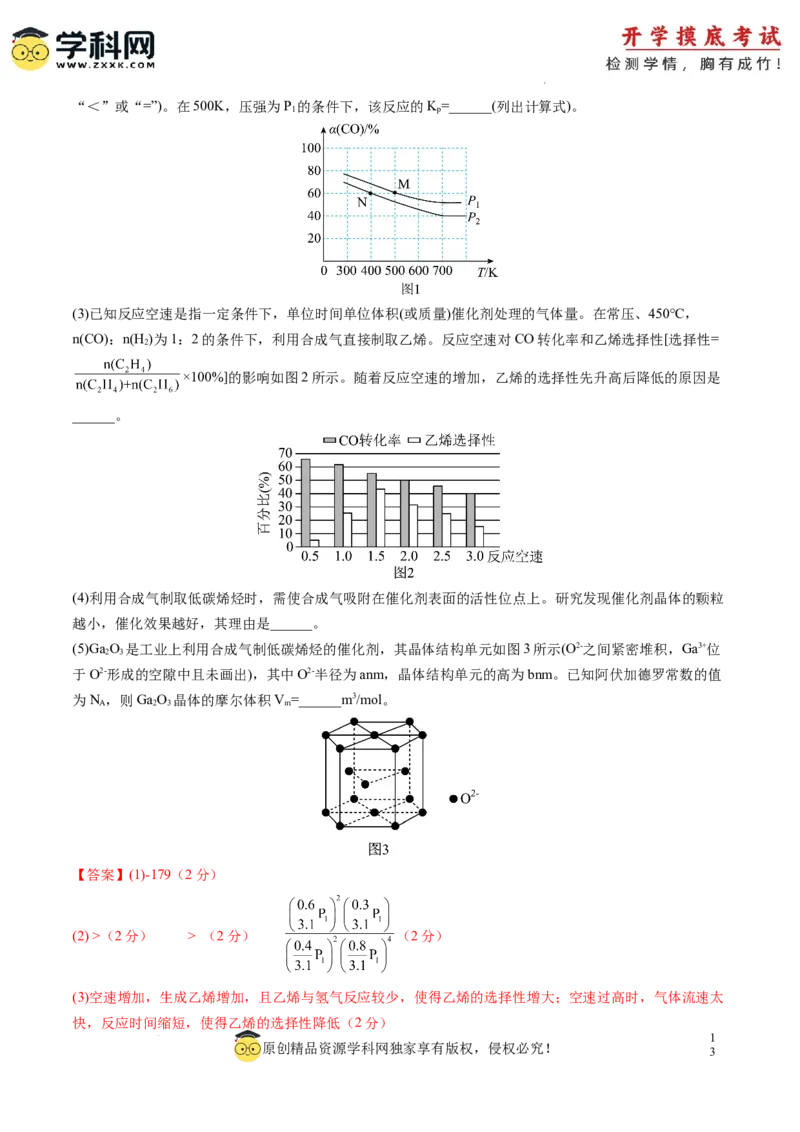
图1所示,则P______P(填“>”“<”或“=”),M点的正反应速率______N点的逆反应速率(填“>”
1 2
1
原创精品资源学科网独家享有版权,侵权必究!
2
学科网(北京)股份有限公司“<”或“=”)。在500K,压强为P 的条件下,该反应的K=______(列出计算式)。
1 p
(3)已知反应空速是指一定条件下,单位时间单位体积(或质量)催化剂处理的气体量。在常压、450℃,
n(CO):n(H )为1:2的条件下,利用合成气直接制取乙烯。反应空速对CO转化率和乙烯选择性[选择性=
2
×100%]的影响如图2所示。随着反应空速的增加,乙烯的选择性先升高后降低的原因是
______。
(4)利用合成气制取低碳烯烃时,需使合成气吸附在催化剂表面的活性位点上。研究发现催化剂晶体的颗粒
越小,催化效果越好,其理由是______。
(5)Ga O 是工业上利用合成气制低碳烯烃的催化剂,其晶体结构单元如图3所示(O2-之间紧密堆积,Ga3+位
2 3
于O2-形成的空隙中且未画出),其中O2-半径为anm,晶体结构单元的高为bnm。已知阿伏加德罗常数的值
为N ,则GaO 晶体的摩尔体积V =______m3/mol。
A 2 3 m
【答案】(1)-179(2分)
(2) >(2分) > (2分) (2分)
(3)空速增加,生成乙烯增加,且乙烯与氢气反应较少,使得乙烯的选择性增大;空速过高时,气体流速太
快,反应时间缩短,使得乙烯的选择性降低(2分)
1
原创精品资源学科网独家享有版权,侵权必究!
3
学科网(北京)股份有限公司(4)催化剂晶体的颗粒越小,催化剂的表面积越大,活性位点越大(2分)
(5) (3分)
【解析】(1)已知:
①CO(g)+2H(g) CHOH(l) H=-116kJ•mol-1
2 3 1
△
②2CHOH(l) C H(g)+2HO(l) H=-35kJ•mol-1
3 2 4 2 2
△
③HO(g) HO(l) H=-44kJ•mol-1
2 2
△
由盖斯定律可知,2×①+②-2×③得:2CO(g)+4H(g) C H(g)+2HO(g) H=2×(-116kJ•mol-1)+
2 2 4 2 3
(-35kJ•mol-1)-2× (-44kJ•mol-1)=-179kJ•mol-1; △
(2)制取乙烯反应为气体分子数减小的反应,相同条件下,增大压强,平衡正向移动,CO转化了增大,
故P>P ;温度越高反应速率越快,则M点的正反应速率>N点的正反应速率=N点的逆反应速率;
1 2
假设N、CO和H 投料分别为1mol、1mol、2mol,在500K,压强为P 的条件下,平衡时CO转化率为
2 2 1
60%,则反应CO0.6mol、氢气1.2mol、生成乙烯0.3mol、水0.6mol,平衡时一氧化碳0.4mol、氢气
0.8mol,总的物质的为0.4mol+0.8mol+0.3mol+0.6mol+1.0mol=3.1mol;则该反应的 ;
(3)随着反应空速的增加,乙烯的选择性先升高后降低的原因是:空速增加,生成乙烯增加,且乙烯与
氢气反应较少,使得乙烯的选择性增大;空速过高时,气体流速太快,反应时间缩短,使得乙烯的选择性
降低;
(4)催化剂晶体的颗粒越小,催化剂的表面积越大,活性位点越大,使得催化效果越好;
(5)根据“均摊法”,晶胞中含 个O,结合化学式可知,1个该晶胞含有2个GaO;
2 3
O2-半径为anm,则底面边长为2anm,晶体结构单元的高为bnm,则该晶胞体积为
,故GaO 晶体的摩尔体积V =
2 3 m
m3/mol。
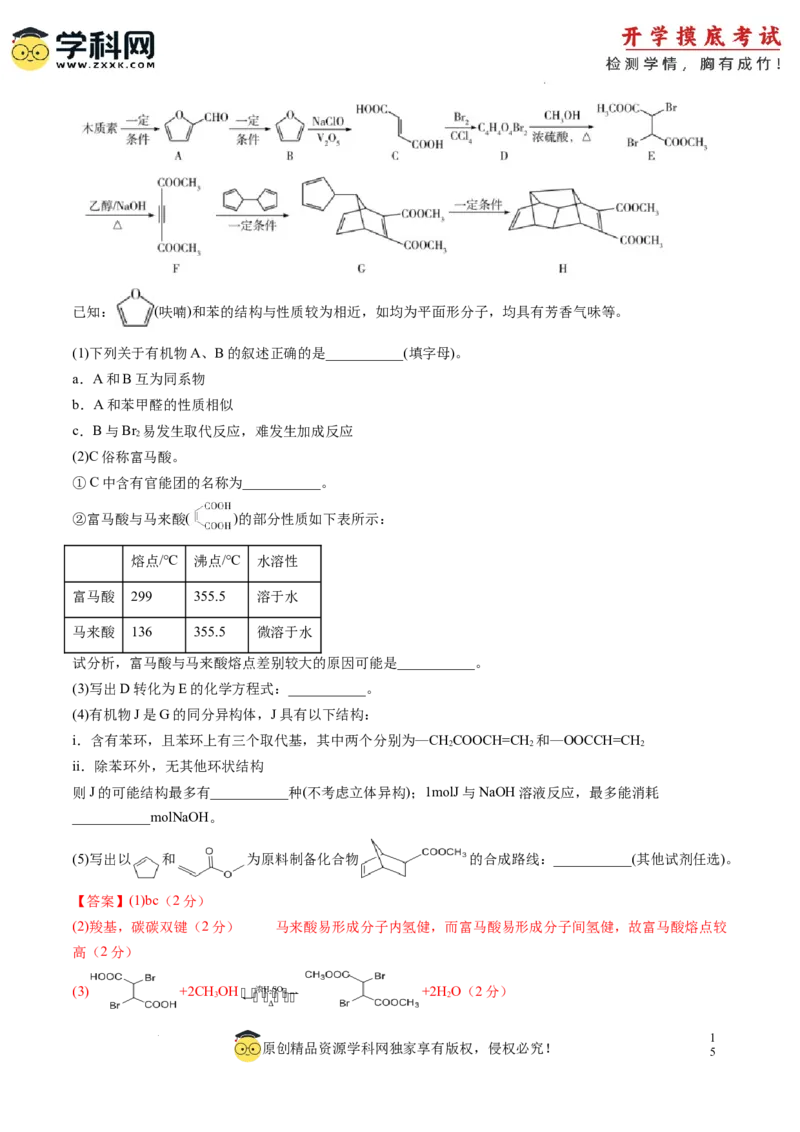
18.(15分)以可再生资源木质素为原料制备医药中间体(H)的路线如图所示:
1
原创精品资源学科网独家享有版权,侵权必究!
4
学科网(北京)股份有限公司已知: (呋喃)和苯的结构与性质较为相近,如均为平面形分子,均具有芳香气味等。
(1)下列关于有机物A、B的叙述正确的是___________(填字母)。
a.A和B互为同系物
b.A和苯甲醛的性质相似
c.B与Br 易发生取代反应,难发生加成反应
2
(2)C俗称富马酸。
①C中含有官能团的名称为___________。
②富马酸与马来酸( )的部分性质如下表所示:
熔点/℃ 沸点/℃ 水溶性
富马酸 299 355.5 溶于水
马来酸 136 355.5 微溶于水
试分析,富马酸与马来酸熔点差别较大的原因可能是___________。
(3)写出D转化为E的化学方程式:___________。
(4)有机物J是G的同分异构体,J具有以下结构:
i.含有苯环,且苯环上有三个取代基,其中两个分别为—CHCOOCH=CH 和—OOCCH=CH
2 2 2
ii.除苯环外,无其他环状结构
则J的可能结构最多有___________种(不考虑立体异构);1molJ与NaOH溶液反应,最多能消耗
___________molNaOH。
(5)写出以 和 为原料制备化合物 的合成路线:___________(其他试剂任选)。
【答案】(1)bc(2分)
(2)羧基,碳碳双键(2分) 马来酸易形成分子内氢健,而富马酸易形成分子间氢健,故富马酸熔点较
高(2分)
(3) +2CH 3 OH 浓H 2S O4 +2H 2 O(2分)
Δ
1
原创精品资源学科网独家享有版权,侵权必究!
5
学科网(北京)股份有限公司(4) 30(2分) 3(2分)
(5) NaOH乙醇溶液 (3分)
Br2 水
【分析】由有机物的转化关系可知,木质素一定条件下转化为 , 一定条件下转化为
, 一定条件下转化为 , 与溴的四氯化碳溶液发生加成反应生成
,则D为 ;浓硫酸作用下 与甲醇共热发生酯化反应生成
, 在氢氧化钠乙醇溶液中共热发生消去反应生成 ,一定条件
下 与 发生双烯合成生成 ,一定条件下 继
续发生双烯合成生成 。
【解析】(1)a.由结构简式可知,A和B分子含有的官能团不同,不是同类物质,不可能互为同系物,
故错误;
b.由呋喃和苯的结构与性质较为相近可知, 和苯甲醛的性质相似,故正确;
c.由呋喃和苯的结构与性质较为相近可知, 与溴易发生取代反应,难发生加成反应,故正确;
故选bc;
(2)①由分析可知,富马酸的结构简式为 ,官能团为碳碳双键和羧基,故答案为:羧基,
碳碳双键;
②由结构简式可知,马来酸易形成分子内氢健,而富马酸易形成分子间氢健,所以富马酸的分子间作用力
强于马来酸,熔点高于马来酸,故答案为:马来酸易形成分子内氢健,而富马酸易形成分子间氢健,故富
马酸熔点较高;
(3)由分析可知,D转化为E的反应为浓硫酸作用下 与甲醇共热发生酯化反应生成
和水,反应的化学方程式为 +2CH 3 OH 浓H 2S O4
Δ
+2H O;
2
(4)G的同分异构体J含有苯环,且苯环上有三个取代基,其中两个分别为—CHCOOCH=CH 和—
2 2
OOCCH=CH ,除苯环外,无其他环状结构说明J分子中还含有1个碳碳双键,则J的结构可以视作
2
1
原创精品资源学科网独家享有版权,侵权必究!
6
学科网(北京)股份有限公司CHCH=CH—、 、—CHCH=CH 分别取代了 、 、
3 2 2
分子中苯环上的氢原子,共有10×3=30种,J分子中含有的酯基能与氢氧化钠溶液反应,
则1molJ与氢氧化钠溶液反应,最多能消耗3mol氢氧化钠;
(5)由有机物的转化关系可知,以 和 为原料制备化合物 的合成步骤为
与溴水发生加成反应生成 , 在氢氧化钠乙醇溶液中共热发生消去反应生成 ,
与 发生双烯合成生成 ,合成路线为
NaOH乙醇溶液
Br2 水
。
1
原创精品资源学科网独家享有版权,侵权必究!
7
学科网(北京)股份有限公司1
原创精品资源学科网独家享有版权,侵权必究!
8
学科网(北京)股份有限公司