文档内容
专题 13 化学实验综合题
考点 三年考情(2022-2024) 命题趋势
◆无机物的制备:2024甘肃卷、2024湖南
卷、2024浙江卷6月、2024河北卷、2024
浙江卷1月、2023全国甲卷、2023山东
近几年高考卷中的综合实验题,考查的角
卷、2023浙江卷、2022全国甲卷、2022全
度有仪器的识别与应用,实验装置的作
国乙卷、2022湖北卷、2022山东卷、2022
用,实验操作的目的,物质的制备、除杂
海南卷、2022重庆卷、2022辽宁卷、2022
与分离,物质的性质探究与验证,实验现
江苏卷、2022浙江卷、2022天津卷
象的分析与描述,实验结论的评价与计算
◆有机物的制备与提纯:2024新课标卷、 等。主要题型包括无机物的制备、有机物
考点1 化学实 2024全国甲卷、2024黑吉辽卷、2023新课 的制备及分离提纯、物质性质的实验探
验综合题 标卷、2023辽宁卷 究、化学反应的实验探索等。物质的制备
◆物质性质与化学反应探究:2024广东 是高考实验综合题最常考的命题形式,但
卷、2024北京卷、2024江苏卷、2024湖北 物质性质的实验探究逐渐成为主流,这说
卷、2023广东卷、2023湖南卷、2023北京 明高考更加注重对实验过程及过程中所发
生的实验现象等的探索考查。另外,要注
卷、2023湖北卷、2022北京卷、2022福建
意的高考中,有机物的制备实验的考查可
卷、2022广东卷
能性也不低。
◆定量实验的设计与评价:2024安徽卷、
2024山东卷、2023全国乙卷、2022北京
卷、2022湖南卷、2022河北卷考法01 无机物的制备
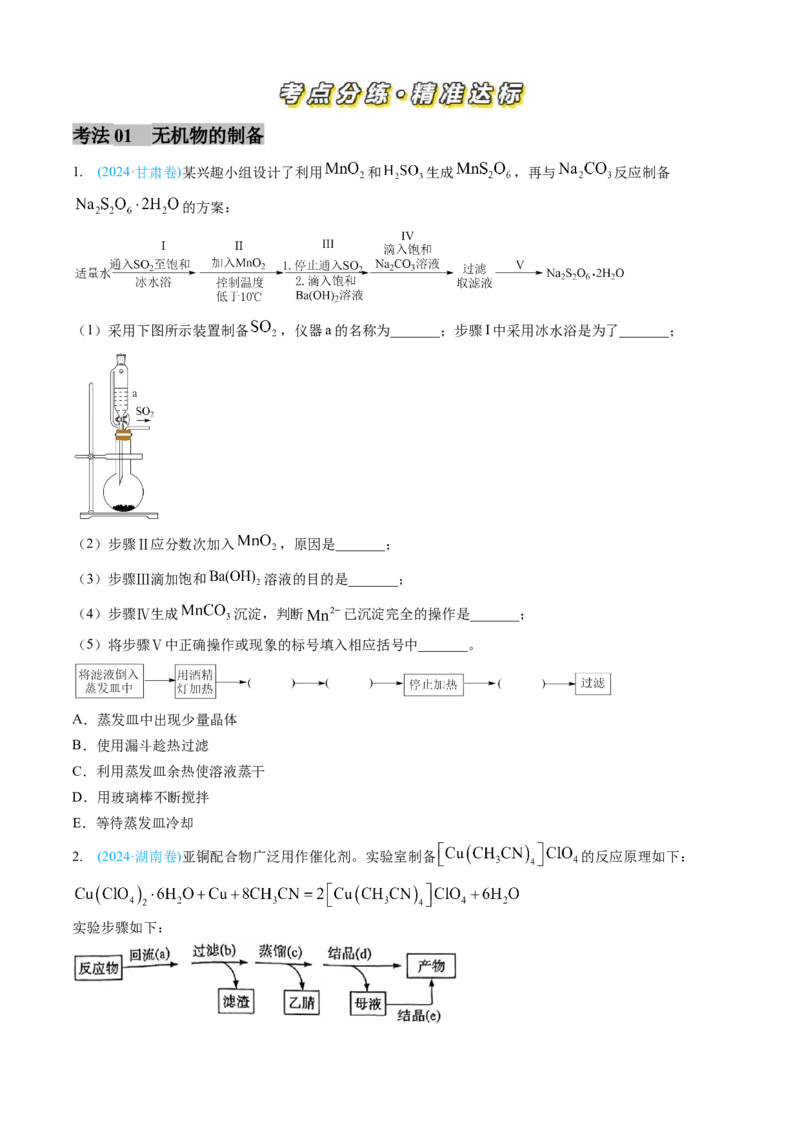
1. (2024·甘肃卷)某兴趣小组设计了利用 和 生成 ,再与 反应制备
的方案:
(1)采用下图所示装置制备 ,仪器a的名称为_______;步骤I中采用冰水浴是为了_______;
(2)步骤Ⅱ应分数次加入 ,原因是_______;
(3)步骤Ⅲ滴加饱和 溶液的目的是_______;
(4)步骤Ⅳ生成 沉淀,判断 已沉淀完全的操作是_______;
(5)将步骤Ⅴ中正确操作或现象的标号填入相应括号中_______。
A.蒸发皿中出现少量晶体
B.使用漏斗趁热过滤
C.利用蒸发皿余热使溶液蒸干
D.用玻璃棒不断搅拌
E.等待蒸发皿冷却
2. (2024·湖南卷)亚铜配合物广泛用作催化剂。实验室制备 的反应原理如下:
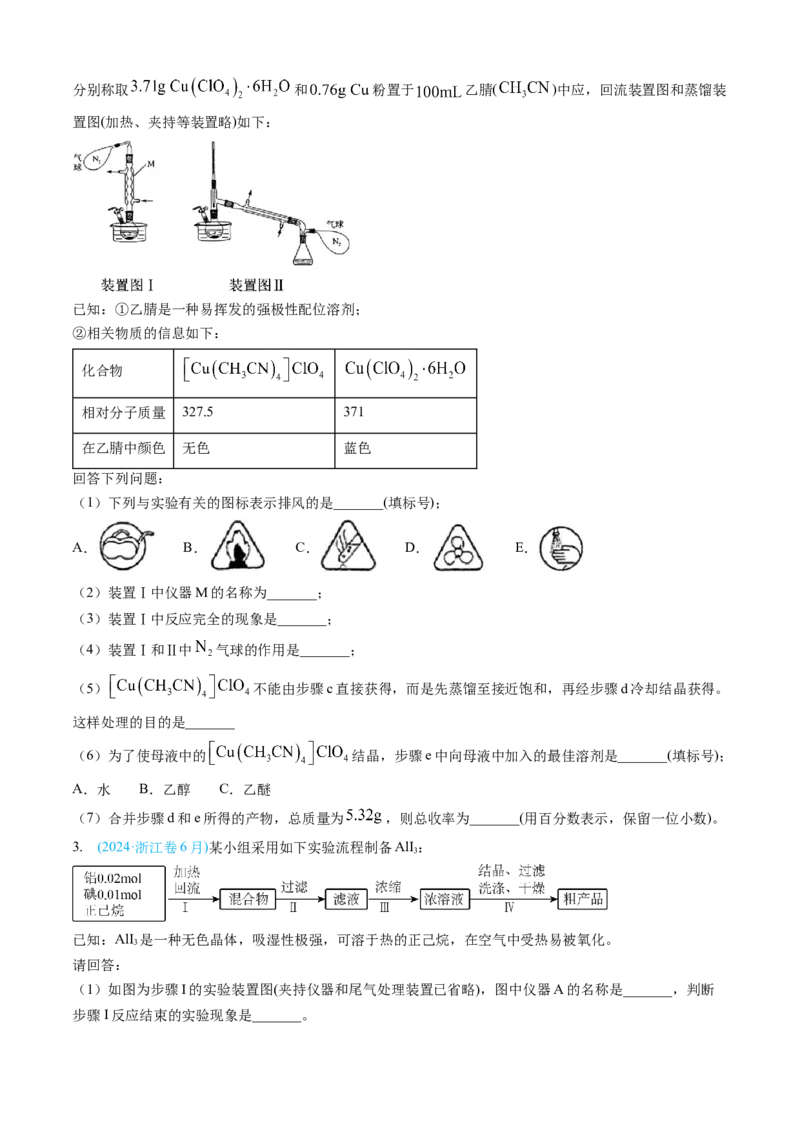
实验步骤如下:分别称取 和 粉置于 乙腈( )中应,回流装置图和蒸馏装
置图(加热、夹持等装置略)如下:
已知:①乙腈是一种易挥发的强极性配位溶剂;
②相关物质的信息如下:
化合物
相对分子质量 327.5 371
在乙腈中颜色 无色 蓝色
回答下列问题:
(1)下列与实验有关的图标表示排风的是_______(填标号);
A. B. C. D. E.
(2)装置Ⅰ中仪器M的名称为_______;
(3)装置Ⅰ中反应完全的现象是_______;
(4)装置Ⅰ和Ⅱ中 气球的作用是_______;
(5) 不能由步骤c直接获得,而是先蒸馏至接近饱和,再经步骤d冷却结晶获得。
这样处理的目的是_______
(6)为了使母液中的 结晶,步骤e中向母液中加入的最佳溶剂是_______(填标号);
A.水 B.乙醇 C.乙醚
(7)合并步骤d和e所得的产物,总质量为 ,则总收率为_______(用百分数表示,保留一位小数)。
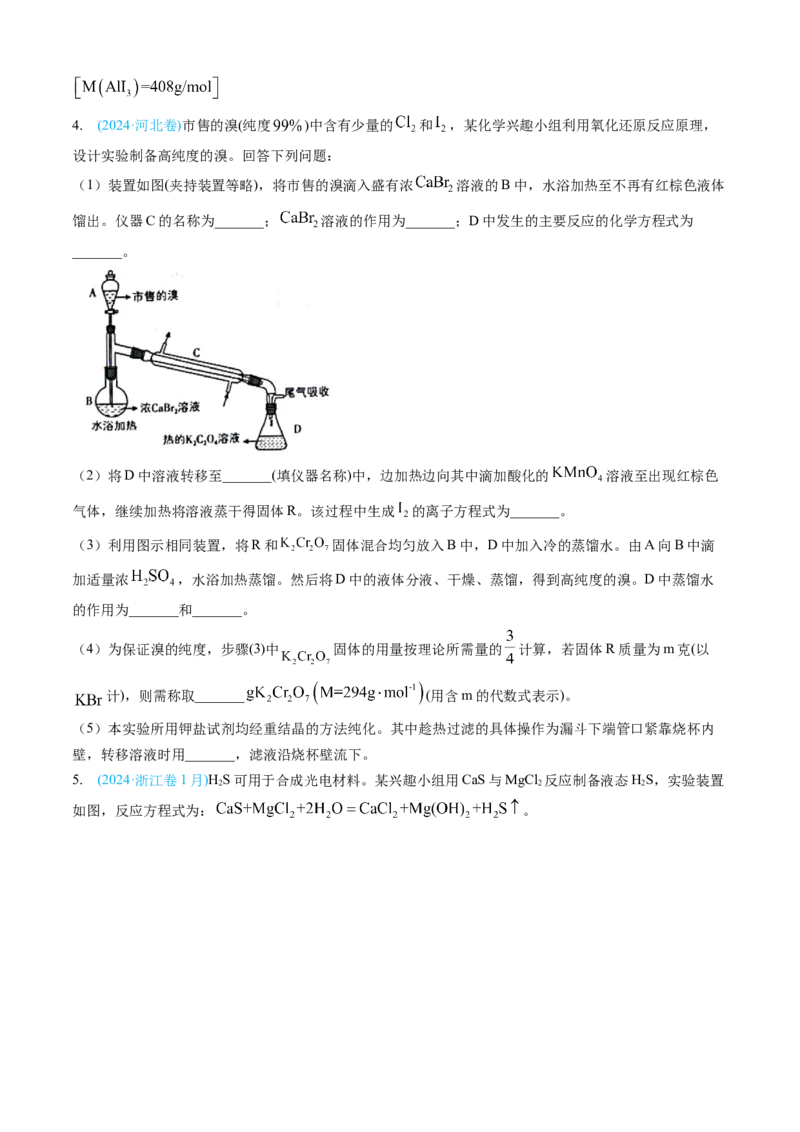
3. (2024·浙江卷6月)某小组采用如下实验流程制备AlI:
3
已知:AlI 是一种无色晶体,吸湿性极强,可溶于热的正己烷,在空气中受热易被氧化。
3
请回答:
(1)如图为步骤I的实验装置图(夹持仪器和尾气处理装置已省略),图中仪器A的名称是_______,判断
步骤I反应结束的实验现象是_______。(2)下列做法不正确的是_______。
A. 步骤I中,反应物和溶剂在使用前除水
B. 步骤I中,若控温加热器发生故障,改用酒精灯(配石棉网)加热
C. 步骤Ⅲ中,在通风橱中浓缩至蒸发皿内出现晶膜
D. 步骤Ⅳ中,使用冷的正己烷洗涤
(3)所得粗产品呈浅棕黄色,小组成员认为其中混有碘单质,请设计实验方案验证_______。
(4)纯化与分析:对粗产品纯化处理后得到产品,再采用银量法测定产品中 含量以确定纯度。滴定原
理为:先用过量 标准溶液沉淀 ,再以 标准溶液回滴剩余的 。已知:
难溶电解质 (黄色) (白色) (红色)
溶度积常数
①从下列选项中选择合适的操作补全测定步骤_______。
称取产品 ,用少量稀酸A溶解后转移至 容量瓶,加水定容得待测溶液。取滴定管检漏、
水洗→_______→装液、赶气泡、调液面、读数→用移液管准确移取 待测溶液加入锥形瓶
→_______→_______→加入稀酸B→用 标准溶液滴定→_______→读数。
a.润洗,从滴定管尖嘴放出液体
b.润洗,从滴定管上口倒出液体
c.滴加指示剂 溶液
d.滴加指示剂硫酸铁铵 溶液
e.准确移取 标准溶液加入锥形瓶
f.滴定至溶液呈浅红色
g.滴定至沉淀变白色
②加入稀酸B的作用是_______。
③三次滴定消耗 标准溶液的平均体积为 ,则产品纯度为_______。4. (2024·河北卷)市售的溴(纯度 )中含有少量的 和 ,某化学兴趣小组利用氧化还原反应原理,
设计实验制备高纯度的溴。回答下列问题:
(1)装置如图(夹持装置等略),将市售的溴滴入盛有浓 溶液的B中,水浴加热至不再有红棕色液体
馏出。仪器C的名称为_______; 溶液的作用为_______;D中发生的主要反应的化学方程式为
_______。
(2)将D中溶液转移至_______(填仪器名称)中,边加热边向其中滴加酸化的 溶液至出现红棕色
气体,继续加热将溶液蒸干得固体R。该过程中生成 的离子方程式为_______。
(3)利用图示相同装置,将R和 固体混合均匀放入B中,D中加入冷的蒸馏水。由A向B中滴
加适量浓 ,水浴加热蒸馏。然后将D中的液体分液、干燥、蒸馏,得到高纯度的溴。D中蒸馏水
的作用为_______和_______。
(4)为保证溴的纯度,步骤(3)中 固体的用量按理论所需量的 计算,若固体R质量为m克(以
计),则需称取_______ (用含m的代数式表示)。
(5)本实验所用钾盐试剂均经重结晶的方法纯化。其中趁热过滤的具体操作为漏斗下端管口紧靠烧杯内
壁,转移溶液时用_______,滤液沿烧杯壁流下。
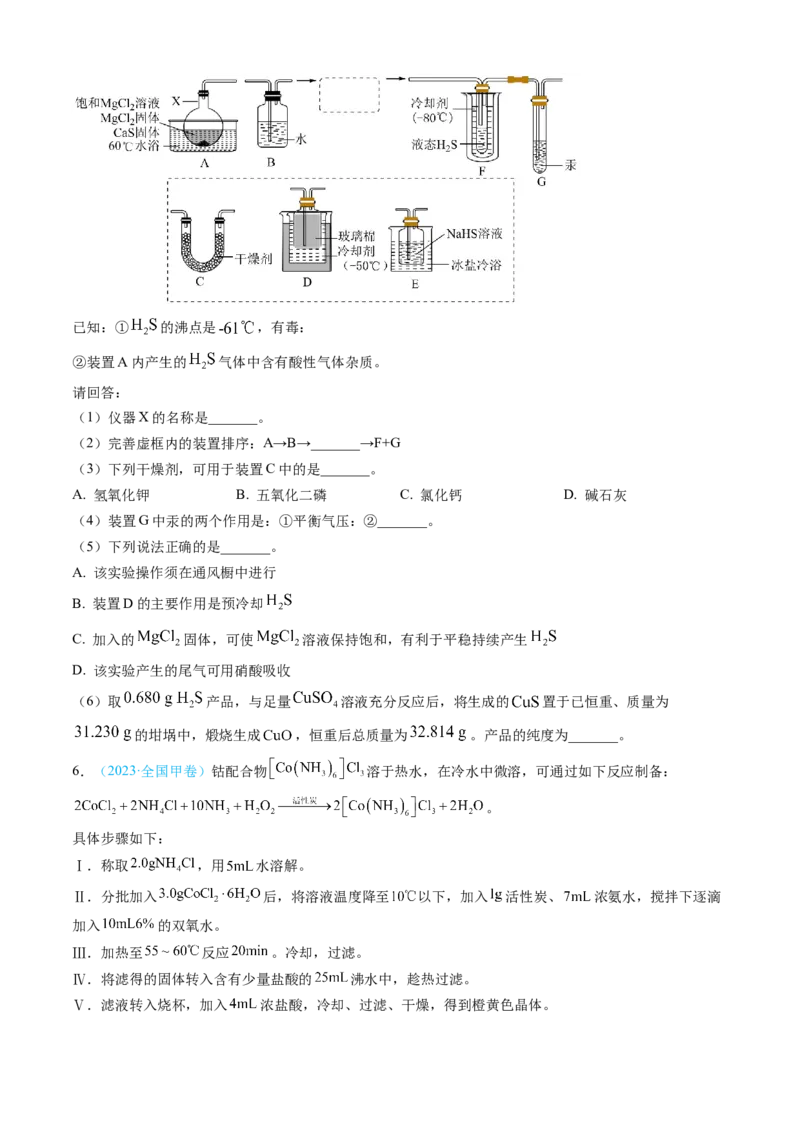
5. (2024·浙江卷1月)HS可用于合成光电材料。某兴趣小组用CaS与MgCl 反应制备液态HS,实验装置
2 2 2
如图,反应方程式为: 。已知:① 的沸点是 ,有毒:
②装置A内产生的 气体中含有酸性气体杂质。
请回答:
(1)仪器X的名称是_______。
(2)完善虚框内的装置排序:A→B→_______→F+G
(3)下列干燥剂,可用于装置C中的是_______。
A. 氢氧化钾 B. 五氧化二磷 C. 氯化钙 D. 碱石灰
(4)装置G中汞的两个作用是:①平衡气压:②_______。
(5)下列说法正确的是_______。
A. 该实验操作须在通风橱中进行
B. 装置D的主要作用是预冷却
C. 加入的 固体,可使 溶液保持饱和,有利于平稳持续产生
D. 该实验产生的尾气可用硝酸吸收
(6)取 产品,与足量 溶液充分反应后,将生成的 置于已恒重、质量为
的坩埚中,煅烧生成 ,恒重后总质量为 。产品的纯度为_______。
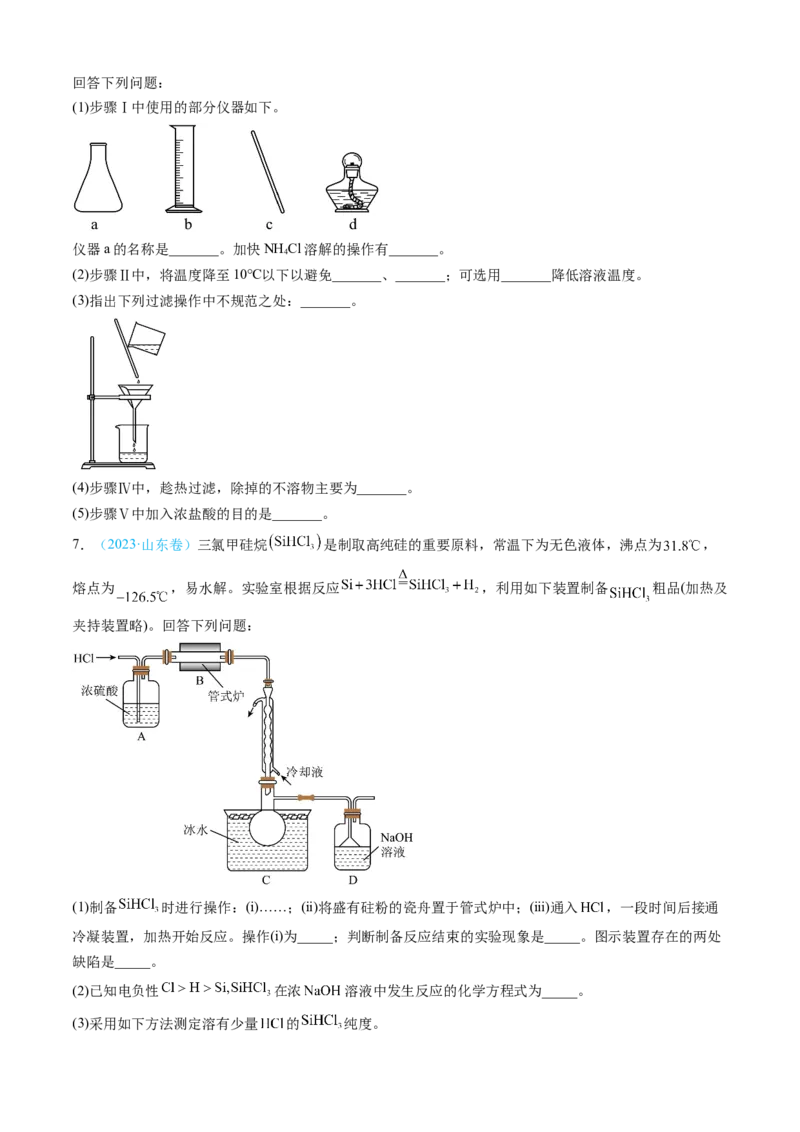
6.(2023·全国甲卷)钴配合物 溶于热水,在冷水中微溶,可通过如下反应制备:
。
具体步骤如下:
Ⅰ.称取 ,用 水溶解。
Ⅱ.分批加入 后,将溶液温度降至 以下,加入 活性炭、 浓氨水,搅拌下逐滴
加入 的双氧水。
Ⅲ.加热至 反应 。冷却,过滤。
Ⅳ.将滤得的固体转入含有少量盐酸的 沸水中,趁热过滤。
Ⅴ.滤液转入烧杯,加入 浓盐酸,冷却、过滤、干燥,得到橙黄色晶体。回答下列问题:
(1)步骤Ⅰ中使用的部分仪器如下。
仪器a的名称是_______。加快NH Cl溶解的操作有_______。
4
(2)步骤Ⅱ中,将温度降至10℃以下以避免_______、_______;可选用_______降低溶液温度。
(3)指出下列过滤操作中不规范之处:_______。
(4)步骤Ⅳ中,趁热过滤,除掉的不溶物主要为_______。
(5)步骤Ⅴ中加入浓盐酸的目的是_______。
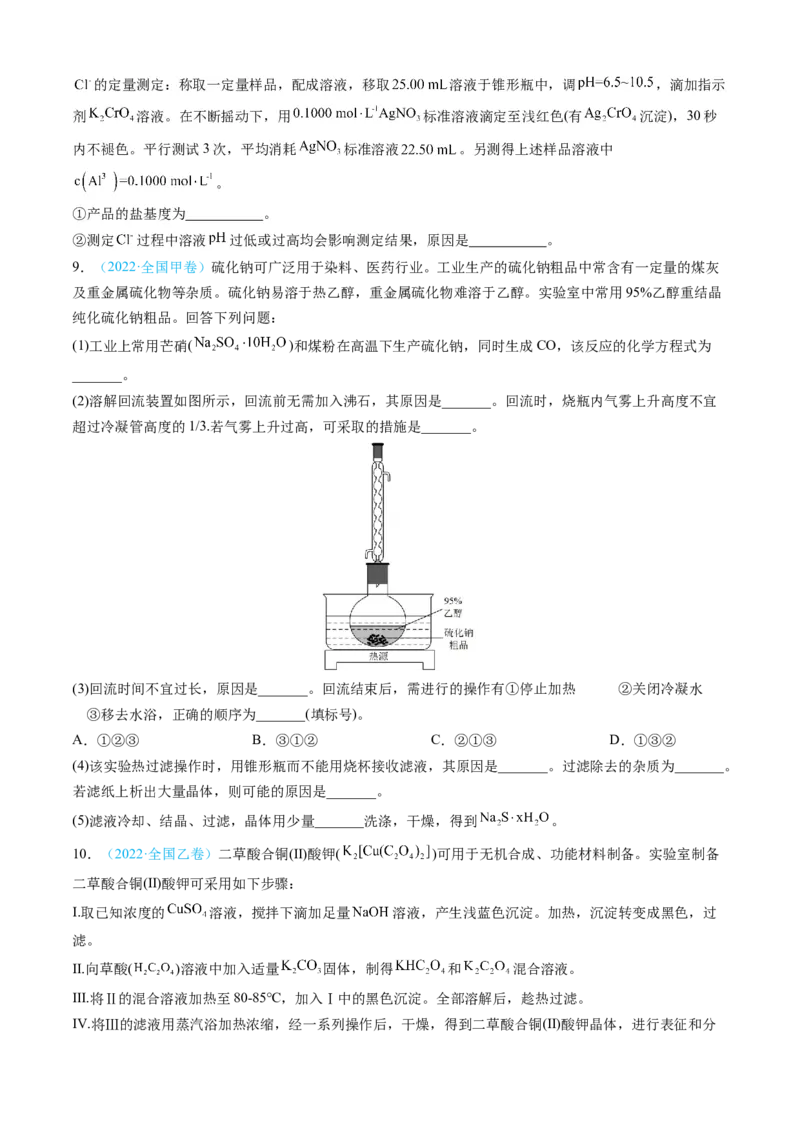
7.(2023·山东卷)三氯甲硅烷 是制取高纯硅的重要原料,常温下为无色液体,沸点为 ,
熔点为 ,易水解。实验室根据反应 ,利用如下装置制备 粗品(加热及
夹持装置略)。回答下列问题:
(1)制备 时进行操作:(ⅰ)……;(ⅱ)将盛有砫粉的瓷舟置于管式炉中;(ⅲ)通入 ,一段时间后接通
冷凝装置,加热开始反应。操作(ⅰ)为_____;判断制备反应结束的实验现象是_____。图示装置存在的两处
缺陷是_____。
(2)已知电负性 在浓 溶液中发生反应的化学方程式为_____。
(3)采用如下方法测定溶有少量 的 纯度。样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①_____,②_____(填操作名
称),③称量等操作,测得所得固体氧化物质量为 ,从下列仪器中选出①、②中需使用的仪器,依次为
_____(填标号)。测得样品纯度为_____(用含 、 的代数式表示)。
8.(2023·浙江卷)某研究小组用铝土矿为原料制备絮凝剂聚合氯化铝( )按如下流程
开展实验。
已知:①铝土矿主要成分为 ,含少量 和 。用 溶液溶解铝土矿过程中 转变为难
溶性的铝硅酸盐。
② 的絮凝效果可用盐基度衡量,盐基度
当盐基度为0.60~0.85时,絮凝效果较好。
请回答:
(1)步骤Ⅰ所得滤液中主要溶质的化学式是 。
(2)下列说法不正确的是___________。
A.步骤I,反应须在密闭耐高压容器中进行,以实现所需反应温度
B.步骤Ⅱ,滤液浓度较大时通入过量 有利于减少 沉淀中的杂质
C.步骤Ⅲ,为减少 吸附的杂质,洗涤时需对漏斗中的沉淀充分搅拌
D.步骤Ⅳ中控制 和 的投料比可控制产品盐基度
(3)步骤V采用如图所示的蒸汽浴加热,仪器A的名称是 ;步骤V不宜用酒精灯直接加热的原
因是 。
(4)测定产品的盐基度。的定量测定:称取一定量样品,配成溶液,移取 溶液于锥形瓶中,调 ,滴加指示
剂 溶液。在不断摇动下,用 标准溶液滴定至浅红色(有 沉淀),30秒
内不褪色。平行测试3次,平均消耗 标准溶液 。另测得上述样品溶液中
。
①产品的盐基度为 。
②测定 过程中溶液 过低或过高均会影响测定结果,原因是 。
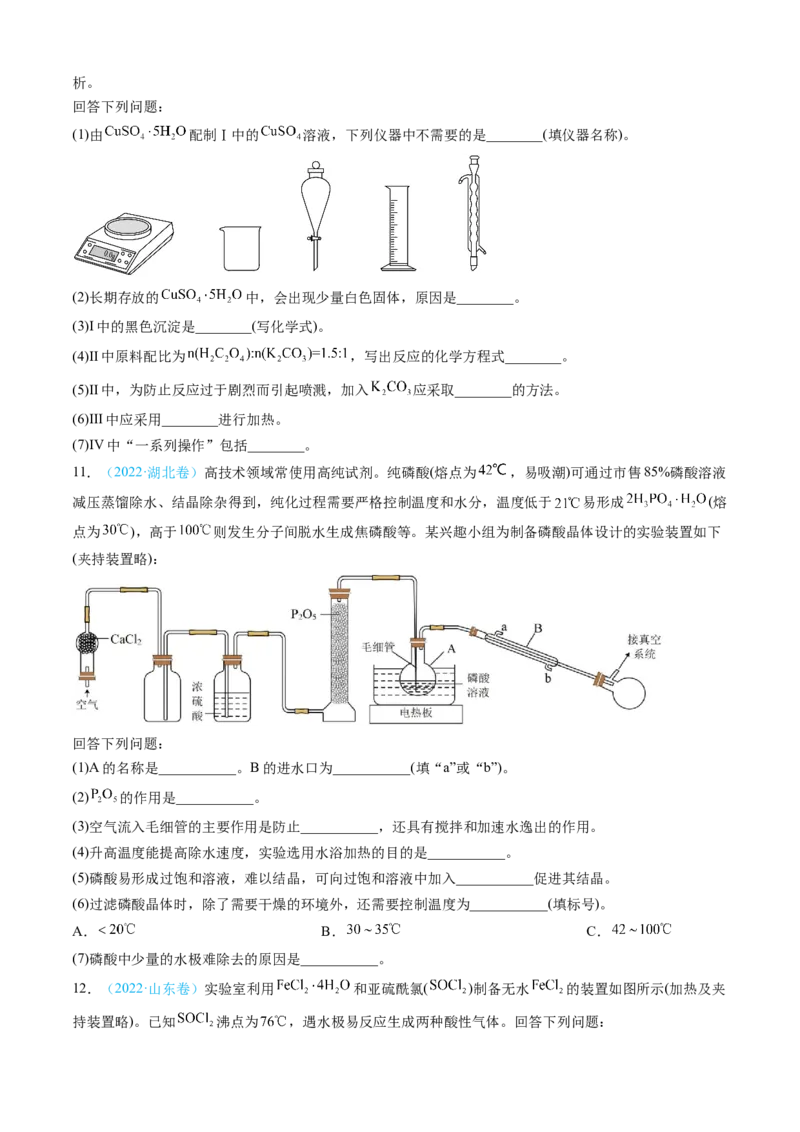
9.(2022·全国甲卷)硫化钠可广泛用于染料、医药行业。工业生产的硫化钠粗品中常含有一定量的煤灰
及重金属硫化物等杂质。硫化钠易溶于热乙醇,重金属硫化物难溶于乙醇。实验室中常用95%乙醇重结晶
纯化硫化钠粗品。回答下列问题:
(1)工业上常用芒硝( )和煤粉在高温下生产硫化钠,同时生成CO,该反应的化学方程式为
_______。
(2)溶解回流装置如图所示,回流前无需加入沸石,其原因是_______。回流时,烧瓶内气雾上升高度不宜
超过冷凝管高度的1/3.若气雾上升过高,可采取的措施是_______。
(3)回流时间不宜过长,原因是_______。回流结束后,需进行的操作有①停止加热 ②关闭冷凝水
③移去水浴,正确的顺序为_______(填标号)。
A.①②③ B.③①② C.②①③ D.①③②
(4)该实验热过滤操作时,用锥形瓶而不能用烧杯接收滤液,其原因是_______。过滤除去的杂质为_______。
若滤纸上析出大量晶体,则可能的原因是_______。
(5)滤液冷却、结晶、过滤,晶体用少量_______洗涤,干燥,得到 。
10.(2022·全国乙卷)二草酸合铜(Ⅱ)酸钾( )可用于无机合成、功能材料制备。实验室制备
二草酸合铜(Ⅱ)酸钾可采用如下步骤:
Ⅰ.取已知浓度的 溶液,搅拌下滴加足量 溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过
滤。
Ⅱ.向草酸( )溶液中加入适量 固体,制得 和 混合溶液。
Ⅲ.将Ⅱ的混合溶液加热至80-85℃,加入Ⅰ中的黑色沉淀。全部溶解后,趁热过滤。
Ⅳ.将Ⅲ的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(Ⅱ)酸钾晶体,进行表征和分析。
回答下列问题:
(1)由 配制Ⅰ中的 溶液,下列仪器中不需要的是________(填仪器名称)。
(2)长期存放的 中,会出现少量白色固体,原因是________。
(3)Ⅰ中的黑色沉淀是________(写化学式)。
(4)Ⅱ中原料配比为 ,写出反应的化学方程式________。
(5)Ⅱ中,为防止反应过于剧烈而引起喷溅,加入 应采取________的方法。
(6)Ⅲ中应采用________进行加热。
(7)Ⅳ中“一系列操作”包括________。
11.(2022·湖北卷)高技术领域常使用高纯试剂。纯磷酸(熔点为 ,易吸潮)可通过市售85%磷酸溶液
减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于 易形成 (熔
点为 ),高于 则发生分子间脱水生成焦磷酸等。某兴趣小组为制备磷酸晶体设计的实验装置如下
(夹持装置略):
回答下列问题:
(1)A的名称是___________。B的进水口为___________(填“a”或“b”)。
(2) 的作用是___________。
(3)空气流入毛细管的主要作用是防止___________,还具有搅拌和加速水逸出的作用。
(4)升高温度能提高除水速度,实验选用水浴加热的目的是___________。
(5)磷酸易形成过饱和溶液,难以结晶,可向过饱和溶液中加入___________促进其结晶。
(6)过滤磷酸晶体时,除了需要干燥的环境外,还需要控制温度为___________(填标号)。
A. B. C.
(7)磷酸中少量的水极难除去的原因是___________。
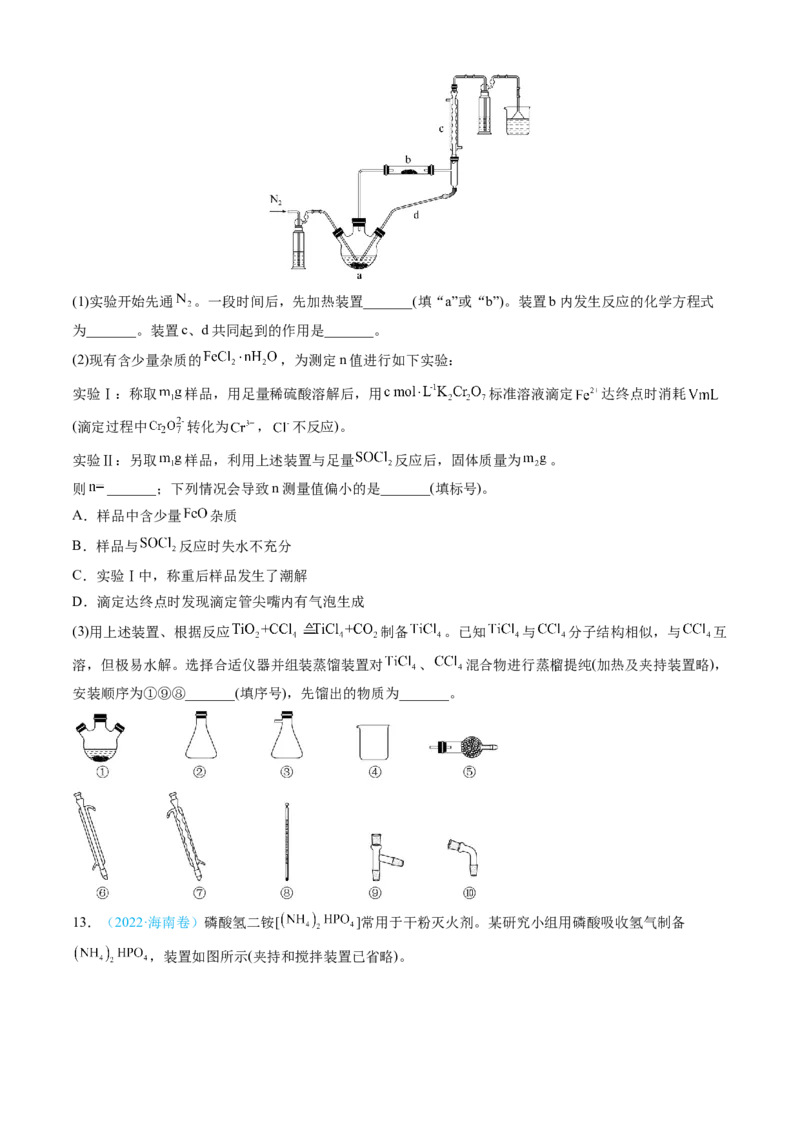
12.(2022·山东卷)实验室利用 和亚硫酰氯( )制备无水 的装置如图所示(加热及夹
持装置略)。已知 沸点为 ,遇水极易反应生成两种酸性气体。回答下列问题:(1)实验开始先通 。一段时间后,先加热装置_______(填“a”或“b”)。装置b内发生反应的化学方程式
为_______。装置c、d共同起到的作用是_______。
(2)现有含少量杂质的 ,为测定n值进行如下实验:
实验Ⅰ:称取 样品,用足量稀硫酸溶解后,用 标准溶液滴定 达终点时消耗
(滴定过程中 转化为 , 不反应)。
实验Ⅱ:另取 样品,利用上述装置与足量 反应后,固体质量为 。
则 _______;下列情况会导致n测量值偏小的是_______(填标号)。
A.样品中含少量 杂质
B.样品与 反应时失水不充分
C.实验Ⅰ中,称重后样品发生了潮解
D.滴定达终点时发现滴定管尖嘴内有气泡生成
(3)用上述装置、根据反应 制备 。已知 与 分子结构相似,与 互
溶,但极易水解。选择合适仪器并组装蒸馏装置对 、 混合物进行蒸榴提纯(加热及夹持装置略),
安装顺序为①⑨⑧_______(填序号),先馏出的物质为_______。
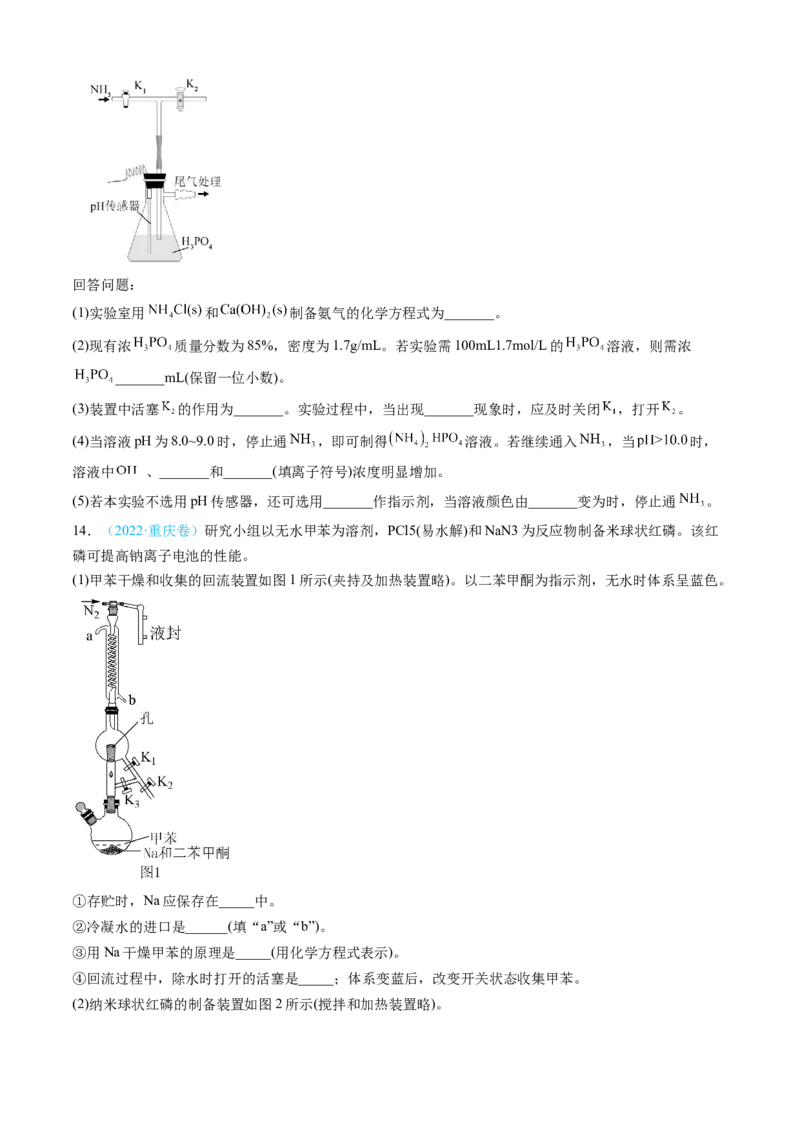
13.(2022·海南卷)磷酸氢二铵[ ]常用于干粉灭火剂。某研究小组用磷酸吸收氢气制备
,装置如图所示(夹持和搅拌装置已省略)。回答问题:
(1)实验室用 和 制备氨气的化学方程式为_______。
(2)现有浓 质量分数为85%,密度为1.7g/mL。若实验需100mL1.7mol/L的 溶液,则需浓
_______mL(保留一位小数)。
(3)装置中活塞 的作用为_______。实验过程中,当出现_______现象时,应及时关闭 ,打开 。
(4)当溶液pH为8.0~9.0时,停止通 ,即可制得 溶液。若继续通入 ,当 时,
溶液中 、_______和_______(填离子符号)浓度明显增加。
(5)若本实验不选用pH传感器,还可选用_______作指示剂,当溶液颜色由_______变为时,停止通 。
14.(2022·重庆卷)研究小组以无水甲苯为溶剂,PCl5(易水解)和NaN3为反应物制备米球状红磷。该红
磷可提高钠离子电池的性能。
(1)甲苯干燥和收集的回流装置如图1所示(夹持及加热装置略)。以二苯甲酮为指示剂,无水时体系呈蓝色。
①存贮时,Na应保存在_____中。
②冷凝水的进口是______(填“a”或“b”)。
③用Na干燥甲苯的原理是_____(用化学方程式表示)。
④回流过程中,除水时打开的活塞是_____;体系变蓝后,改变开关状态收集甲苯。
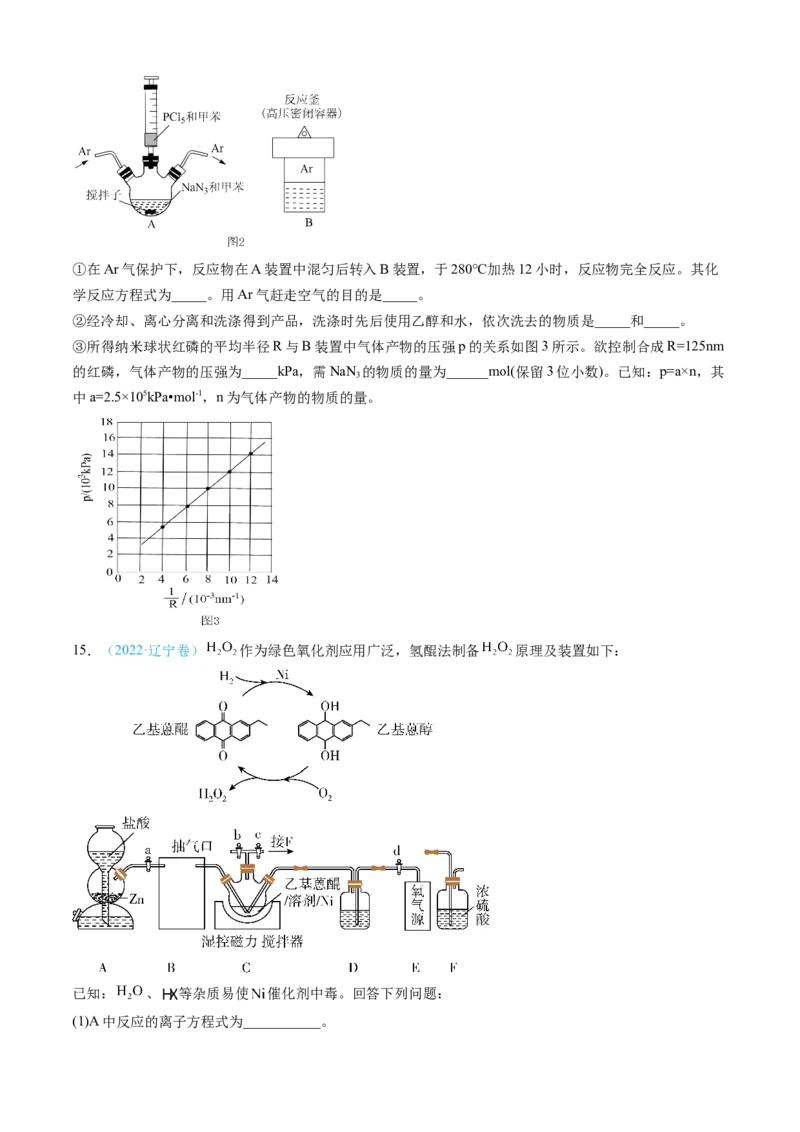
(2)纳米球状红磷的制备装置如图2所示(搅拌和加热装置略)。①在Ar气保护下,反应物在A装置中混匀后转入B装置,于280℃加热12小时,反应物完全反应。其化
学反应方程式为_____。用Ar气赶走空气的目的是_____。
②经冷却、离心分离和洗涤得到产品,洗涤时先后使用乙醇和水,依次洗去的物质是_____和_____。
③所得纳米球状红磷的平均半径R与B装置中气体产物的压强p的关系如图3所示。欲控制合成R=125nm
的红磷,气体产物的压强为_____kPa,需NaN 的物质的量为______mol(保留3位小数)。已知:p=a×n,其
3
中a=2.5×105kPa•mol-1,n为气体产物的物质的量。
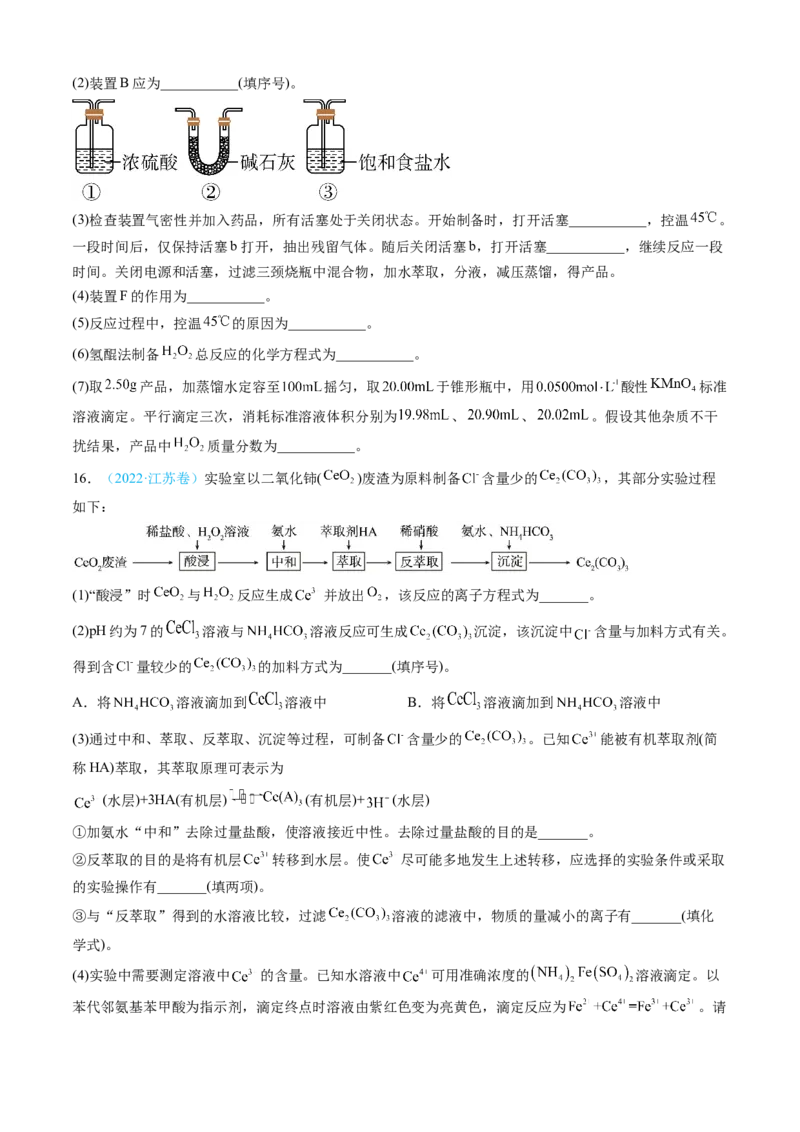
15.(2022·辽宁卷) 作为绿色氧化剂应用广泛,氢醌法制备 原理及装置如下:
已知: 、 等杂质易使 催化剂中毒。回答下列问题:
(1)A中反应的离子方程式为___________。(2)装置B应为___________(填序号)。
(3)检查装置气密性并加入药品,所有活塞处于关闭状态。开始制备时,打开活塞___________,控温 。
一段时间后,仅保持活塞b打开,抽出残留气体。随后关闭活塞b,打开活塞___________,继续反应一段
时间。关闭电源和活塞,过滤三颈烧瓶中混合物,加水萃取,分液,减压蒸馏,得产品。
(4)装置F的作用为___________。
(5)反应过程中,控温 的原因为___________。
(6)氢醌法制备 总反应的化学方程式为___________。
(7)取 产品,加蒸馏水定容至 摇匀,取 于锥形瓶中,用 酸性 标准
溶液滴定。平行滴定三次,消耗标准溶液体积分别为 、 、 。假设其他杂质不干
扰结果,产品中 质量分数为___________。
16.(2022·江苏卷)实验室以二氧化铈( )废渣为原料制备 含量少的 ,其部分实验过程
如下:
(1)“酸浸”时 与 反应生成 并放出 ,该反应的离子方程式为_______。
(2)pH约为7的 溶液与 溶液反应可生成 沉淀,该沉淀中 含量与加料方式有关。
得到含 量较少的 的加料方式为_______(填序号)。
A.将 溶液滴加到 溶液中 B.将 溶液滴加到 溶液中
(3)通过中和、萃取、反萃取、沉淀等过程,可制备 含量少的 。已知 能被有机萃取剂(简
称HA)萃取,其萃取原理可表示为
(水层)+3HA(有机层) (有机层)+ (水层)
①加氨水“中和”去除过量盐酸,使溶液接近中性。去除过量盐酸的目的是_______。
②反萃取的目的是将有机层 转移到水层。使 尽可能多地发生上述转移,应选择的实验条件或采取
的实验操作有_______(填两项)。
③与“反萃取”得到的水溶液比较,过滤 溶液的滤液中,物质的量减小的离子有_______(填化
学式)。
(4)实验中需要测定溶液中 的含量。已知水溶液中 可用准确浓度的 溶液滴定。以
苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为 。请补充完整实验方案:①准确量取 溶液[ 约为 ],加氧化剂将 完全氧化并
去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到 容量瓶中后定容;②按规定操作分别将
和待测 溶液装入如图所示的滴定管中:③_______。
17.(2022·浙江卷)氨基钠( )是重要的化学试剂,实验室可用下图装置(夹持、搅拌、尾气处理装
置已省略)制备。
简要步骤如下:
Ⅰ.在瓶A中加入 液氨和 ,通入氨气排尽密闭体系中空气,搅拌。
Ⅱ.加入5g钠粒,反应,得 粒状沉积物。
Ⅲ.除去液氨,得产品 。
已知: 几乎不溶于液氨,易与水、氧气等反应。
请回答:
(1) 的作用是 ;装置B的作用是 。
(2)步骤Ⅰ,为判断密闭体系中空气是否排尽,请设计方案 。
(3)步骤Ⅱ,反应速率应保持在液氨微沸为宜。为防止速率偏大,可采取的措施有 。
(4)下列说法不正确的是_______。
A.步骤Ⅰ中,搅拌的目的是使 均匀地分散在液氨中B.步骤Ⅱ中,为判断反应是否已完成,可在N处点火,如无火焰,则反应已完成
C.步骤Ⅲ中,为避免污染,应在通风橱内抽滤除去液氨,得到产品
D.产品 应密封保存于充满干燥氮气的瓶中
(5)产品分析:假设 是产品 的唯一杂质,可采用如下方法测定产品 纯度。从下列选项
中选择最佳操作并排序 。
准确称取产品 计算
a.准确加入过量的水
b.准确加入过量的 标准溶液
c.准确加入过量的 标准溶液
d.滴加甲基红指示剂(变色的 范围4.4~6.2)
e.滴加石蕊指示剂(变色的 范围4.5~8.3)
f.滴加酚酞指示剂(变色的 范围8.2~10.0)
g.用 标准溶液滴定
h.用 标准溶液滴定
i.用 标准溶液滴定
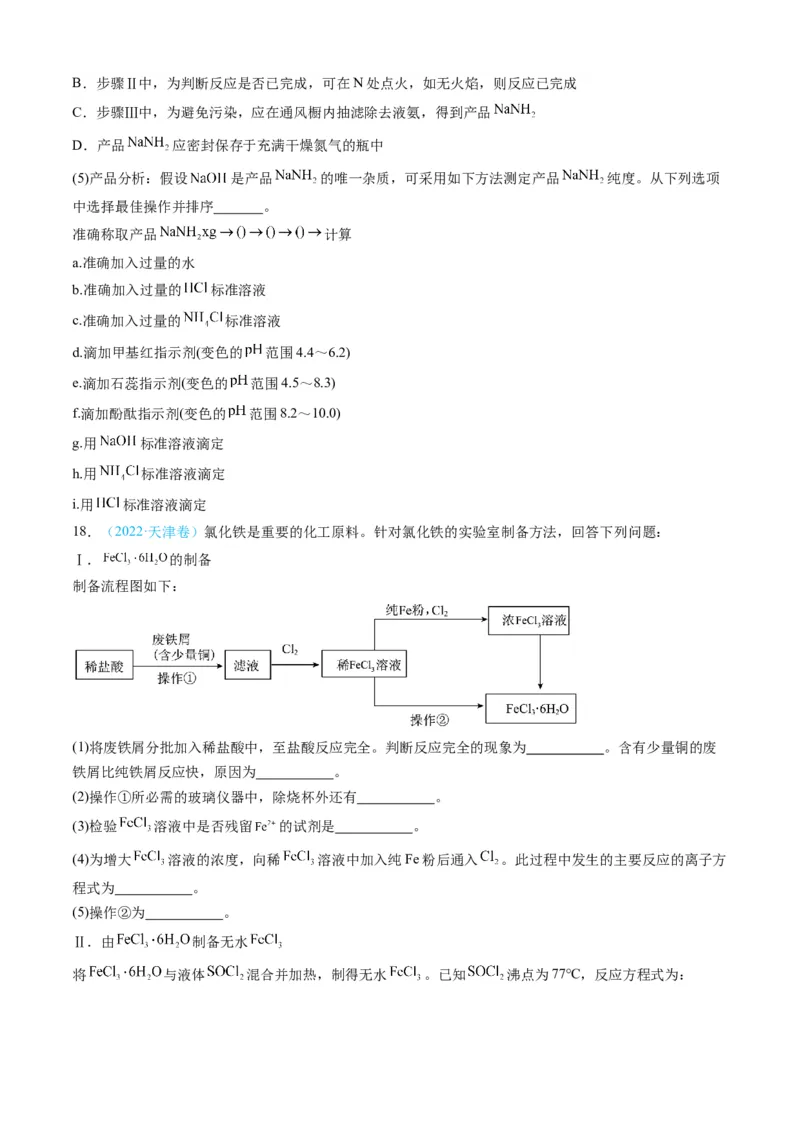
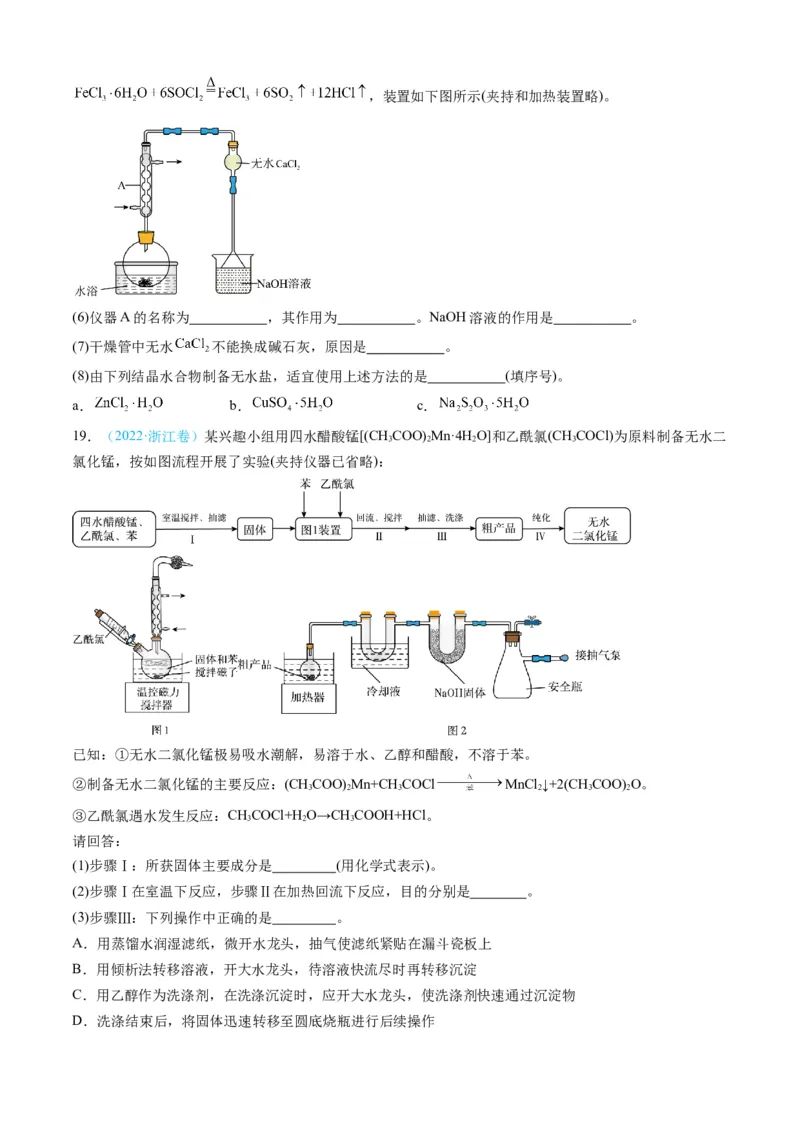
18.(2022·天津卷)氯化铁是重要的化工原料。针对氯化铁的实验室制备方法,回答下列问题:
Ⅰ. 的制备
制备流程图如下:
(1)将废铁屑分批加入稀盐酸中,至盐酸反应完全。判断反应完全的现象为 。含有少量铜的废
铁屑比纯铁屑反应快,原因为 。
(2)操作①所必需的玻璃仪器中,除烧杯外还有 。
(3)检验 溶液中是否残留 的试剂是 。
(4)为增大 溶液的浓度,向稀 溶液中加入纯Fe粉后通入 。此过程中发生的主要反应的离子方
程式为 。
(5)操作②为 。
Ⅱ.由 制备无水
将 与液体 混合并加热,制得无水 。已知 沸点为77℃,反应方程式为:,装置如下图所示(夹持和加热装置略)。
(6)仪器A的名称为 ,其作用为 。NaOH溶液的作用是 。
(7)干燥管中无水 不能换成碱石灰,原因是 。
(8)由下列结晶水合物制备无水盐,适宜使用上述方法的是 (填序号)。
a. b. c.
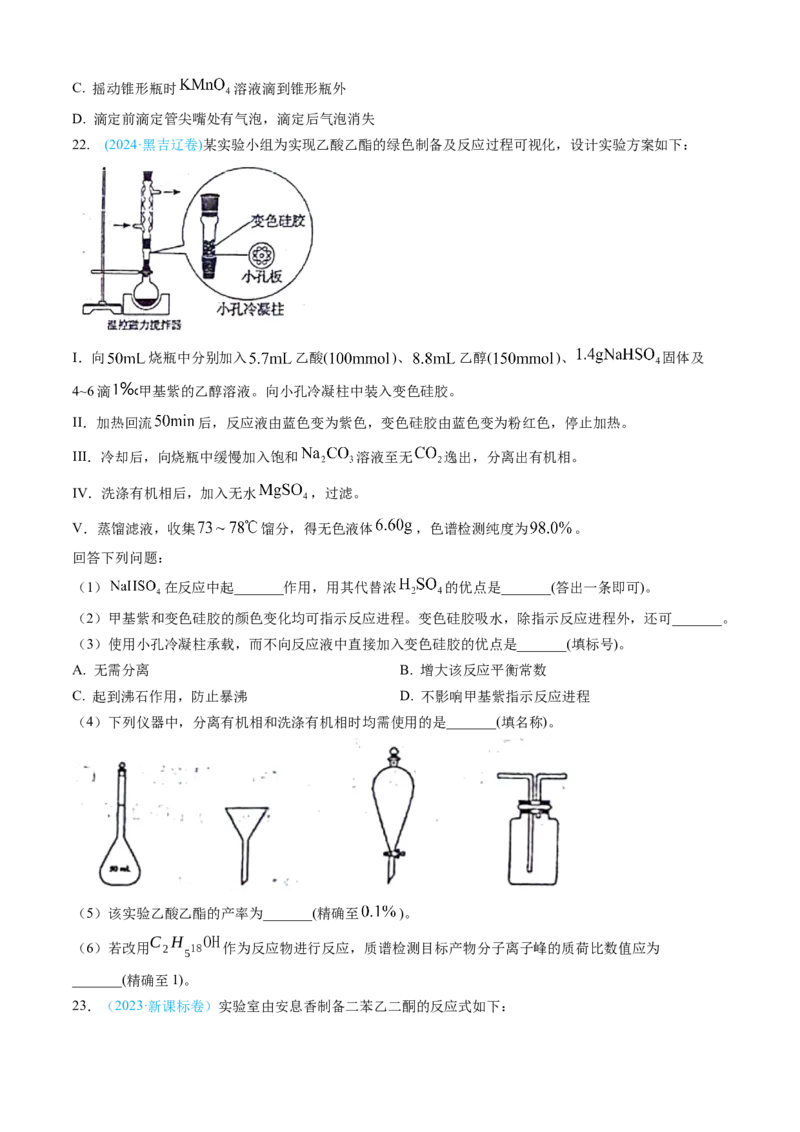
19.(2022·浙江卷)某兴趣小组用四水醋酸锰[(CH COO) Mn·4H O]和乙酰氯(CHCOCl)为原料制备无水二
3 2 2 3
氯化锰,按如图流程开展了实验(夹持仪器已省略):
已知:①无水二氯化锰极易吸水潮解,易溶于水、乙醇和醋酸,不溶于苯。
②制备无水二氯化锰的主要反应:(CHCOO) Mn+CHCOCl MnCl ↓+2(CH COO) O。
3 2 3 2 3 2
③乙酰氯遇水发生反应:CHCOCl+H O→CH COOH+HCl。
3 2 3
请回答:
(1)步骤Ⅰ:所获固体主要成分是 (用化学式表示)。
(2)步骤Ⅰ在室温下反应,步骤Ⅱ在加热回流下反应,目的分别是 。
(3)步骤Ⅲ:下列操作中正确的是 。
A.用蒸馏水润湿滤纸,微开水龙头,抽气使滤纸紧贴在漏斗瓷板上
B.用倾析法转移溶液,开大水龙头,待溶液快流尽时再转移沉淀
C.用乙醇作为洗涤剂,在洗涤沉淀时,应开大水龙头,使洗涤剂快速通过沉淀物
D.洗涤结束后,将固体迅速转移至圆底烧瓶进行后续操作(4)步骤Ⅳ:①将装有粗产品的圆底烧瓶接到纯化装置(图2)上,打开安全瓶上旋塞,打开抽气泵,关闭安
全瓶上旋塞,开启加热器,进行纯化。请给出纯化完成后的操作排序: 。
纯化完成→(_____)→(_____)→(_____)→(_____)→将产品转至干燥器中保存
a.拔出圆底烧瓶的瓶塞
b.关闭抽气泵
c.关闭加热器,待烧瓶冷却至室温
d.打开安全瓶上旋塞
②图2装置中U形管内NaOH固体的作用是 。
(5)用滴定分析法确定产品纯度。甲同学通过测定产品中锰元素的含量确定纯度;乙同学通过测定产品中氯
元素的含量确定纯度。合理的是 (填“甲”或“乙”)同学的方法。
考法02 有机物的的制备与提纯
20. (2024·新课标卷)吡咯类化合物在导电聚合物、化学传感器及药物制剂上有着广泛应用。一种合成1-(4-
甲氧基苯基)-2,5-二甲基吡咯(用吡咯X表示) 反的应和方法如下:
实验装置如图所示,将100 mmol己-2,5-二酮(熔点:-5.5℃,密度: )与100 mmol 4-甲氧基
苯胺(熔点:57℃)放入①中,搅拌。
待反应完成后,加入50%的乙醇溶液,析出浅棕色固体。加热至65℃,至固体溶解,加入脱色剂,回流
20 min,趁热过滤。滤液静置至室温,冰水浴冷却,有大量白色固体析出。经过滤、洗涤、干燥得到产品。
回答下列问题:
(1)量取己-2,5-二酮应使用的仪器为_______(填名称)。
(2)仪器①用铁夹固定在③上,③的名称是_______;仪器②的名称是_______。
(3)“搅拌”的作用是_______。
(4)“加热”方式为_______。
(5)使用的“脱色剂”是_______。
(6)“趁热过滤”的目的是_______;用_______洗涤白色固体。(7)若需进一步提纯产品,可采用的方法是_______。
21. (2024·全国甲卷) (俗称过氧化脲)是一种消毒剂,实验室中可用尿素与过氧化氢制取,
反应方程式如下:
(一)过氧化脲的合成
烧杯中分别加入 、 蒸馏水和 尿素,搅拌溶解。 下反
应 ,冷却结晶、过滤、干燥,得白色针状晶体 。
(二)过氧化脲性质检测
I.过氧化脲溶液用稀 酸化后,滴加 溶液,紫红色消失。
Ⅱ.过氧化脲溶液用稀 酸化后,加入 溶液和四氯化碳,振荡,静置。
(三)产品纯度测定
溶液配制:称取一定量产品,用蒸馏水溶解后配制成 溶液。
滴定分析:量取 过氧化脲溶液至锥形瓶中,加入一定量稀 ,用准确浓度的 溶液
滴定至微红色,记录滴定体积,计算纯度。
回答下列问题:
(1)过滤中使用到的玻璃仪器有_____(写出两种即可)。
(2)过氧化脲的产率为_____。
(3)性质检测Ⅱ中的现象为_____。性质检则I和Ⅱ分别说明过氧化脲具有的性质是_____。
(4)下图为“溶液配制” 的部分过程,操作a应重复3次,目的是_____,定容后还需要的操作为_____。
(5)“滴定分析”步骤中,下列操作错误的是_____(填标号)。
A. 溶液置于酸式滴定管中
B. 用量筒量取 过氧化脲溶液
C. 滴定近终点时,用洗瓶冲洗锥形瓶内壁
D. 锥形瓶内溶液变色后,立即记录滴定管液面刻度
(6)以下操作导致氧化脲纯度测定结果偏低的是_____(填标号)。
A. 容量瓶中液面超过刻度线
B. 滴定管水洗后未用 溶液润洗C. 摇动锥形瓶时 溶液滴到锥形瓶外
D. 滴定前滴定管尖嘴处有气泡,滴定后气泡消失
22. (2024·黑吉辽卷)某实验小组为实现乙酸乙酯的绿色制备及反应过程可视化,设计实验方案如下:
I.向 烧瓶中分别加入 乙酸( )、 乙醇( )、 固体及
4~6滴 甲基紫的乙醇溶液。向小孔冷凝柱中装入变色硅胶。
II.加热回流 后,反应液由蓝色变为紫色,变色硅胶由蓝色变为粉红色,停止加热。
III.冷却后,向烧瓶中缓慢加入饱和 溶液至无 逸出,分离出有机相。
IV.洗涤有机相后,加入无水 ,过滤。
V.蒸馏滤液,收集 馏分,得无色液体 ,色谱检测纯度为 。
回答下列问题:
(1) 在反应中起_______作用,用其代替浓 的优点是_______(答出一条即可)。
(2)甲基紫和变色硅胶的颜色变化均可指示反应进程。变色硅胶吸水,除指示反应进程外,还可_______。
(3)使用小孔冷凝柱承载,而不向反应液中直接加入变色硅胶的优点是_______(填标号)。
A. 无需分离 B. 增大该反应平衡常数
C. 起到沸石作用,防止暴沸 D. 不影响甲基紫指示反应进程
(4)下列仪器中,分离有机相和洗涤有机相时均需使用的是_______(填名称)。
(5)该实验乙酸乙酯的产率为_______(精确至 )。
C H OH
(6)若改用 2 18 作为反应物进行反应,质谱检测目标产物分子离子峰的质荷比数值应为
5
_______(精确至1)。
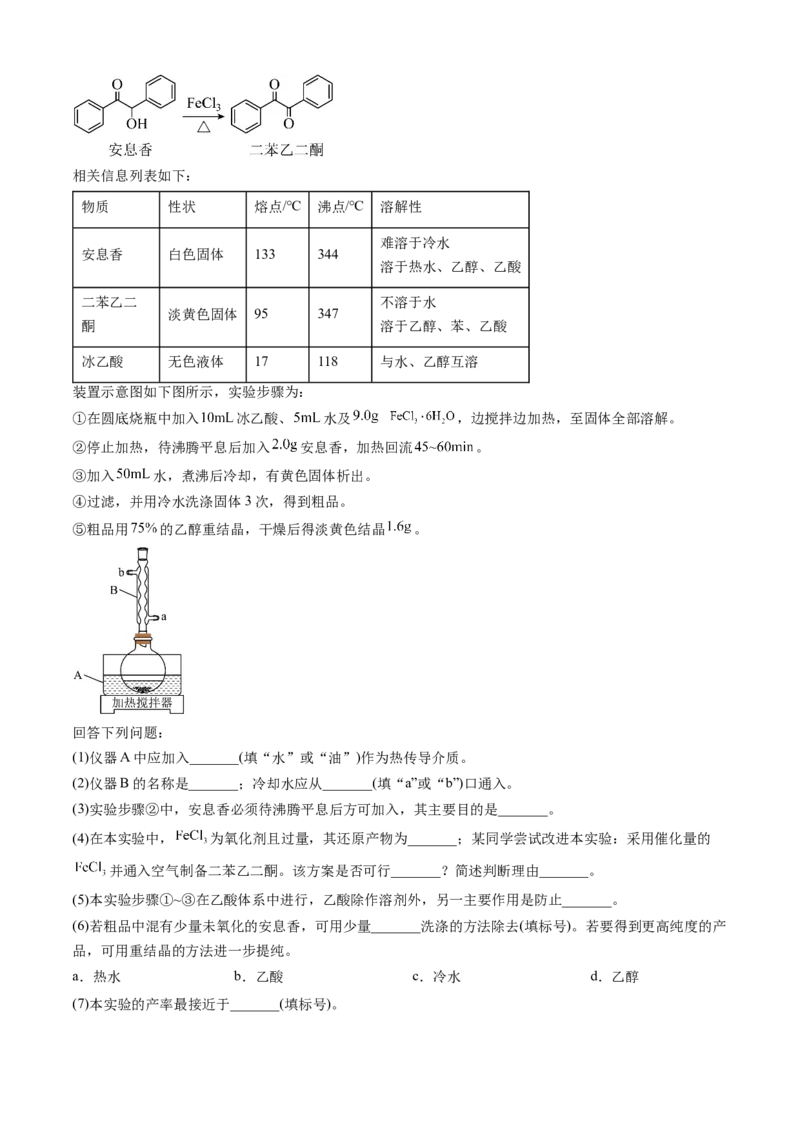
23.(2023·新课标卷)实验室由安息香制备二苯乙二酮的反应式如下:相关信息列表如下:
物质 性状 熔点/℃ 沸点/℃ 溶解性
难溶于冷水
安息香 白色固体 133 344
溶于热水、乙醇、乙酸
二苯乙二 不溶于水
淡黄色固体 95 347
酮 溶于乙醇、苯、乙酸
冰乙酸 无色液体 17 118 与水、乙醇互溶
装置示意图如下图所示,实验步骤为:
①在圆底烧瓶中加入 冰乙酸、 水及 ,边搅拌边加热,至固体全部溶解。
②停止加热,待沸腾平息后加入 安息香,加热回流 。
③加入 水,煮沸后冷却,有黄色固体析出。
④过滤,并用冷水洗涤固体3次,得到粗品。
⑤粗品用 的乙醇重结晶,干燥后得淡黄色结晶 。
回答下列问题:
(1)仪器A中应加入_______(填“水”或“油”)作为热传导介质。
(2)仪器B的名称是_______;冷却水应从_______(填“a”或“b”)口通入。
(3)实验步骤②中,安息香必须待沸腾平息后方可加入,其主要目的是_______。
(4)在本实验中, 为氧化剂且过量,其还原产物为_______;某同学尝试改进本实验:采用催化量的
并通入空气制备二苯乙二酮。该方案是否可行_______?简述判断理由_______。
(5)本实验步骤①~③在乙酸体系中进行,乙酸除作溶剂外,另一主要作用是防止_______。
(6)若粗品中混有少量未氧化的安息香,可用少量_______洗涤的方法除去(填标号)。若要得到更高纯度的产
品,可用重结晶的方法进一步提纯。
a.热水 b.乙酸 c.冷水 d.乙醇
(7)本实验的产率最接近于_______(填标号)。a. b. c. d.
24.(2023·辽宁卷)2—噻吩乙醇( )是抗血栓药物氯吡格雷的重要中间体,其制备方法如下:
Ⅰ.制钠砂。向烧瓶中加入 液体A和 金属钠,加热至钠熔化后,盖紧塞子,振荡至大量微小
钠珠出现。
Ⅱ.制噻吩钠。降温至 ,加入 噻吩,反应至钠砂消失。
Ⅲ.制噻吩乙醇钠。降温至 ,加入稍过量的环氧乙烷的四氢呋喃溶液,反应 。
Ⅳ.水解。恢复室温,加入 水,搅拌 ;加盐酸调 至4~6,继续反应 ,分液;用水洗涤有
机相,二次分液。
Ⅴ.分离。向有机相中加入无水 ,静置,过滤,对滤液进行蒸馏,蒸出四氢呋喃、噻吩和液体A
后,得到产品 。
回答下列问题:
(1)步骤Ⅰ中液体A可以选择_______。
a.乙醇 b.水 c.甲苯 d.液氨
(2)噻吩沸点低于吡咯( )的原因是_______。
(3)步骤Ⅱ的化学方程式为_______。
(4)步骤Ⅲ中反应放热,为防止温度过高引发副反应,加入环氧乙烷溶液的方法是_______。
(5)步骤Ⅳ中用盐酸调节 的目的是_______。
(6)下列仪器在步骤Ⅴ中无需使用的是_______(填名称):无水 的作用为_______。
(7)产品的产率为_______(用 计算,精确至0.1%)。
考法03 物质性质与化学反应探究
25. (2024·广东卷)含硫物质种类繁多,在一定条件下可相互转化。
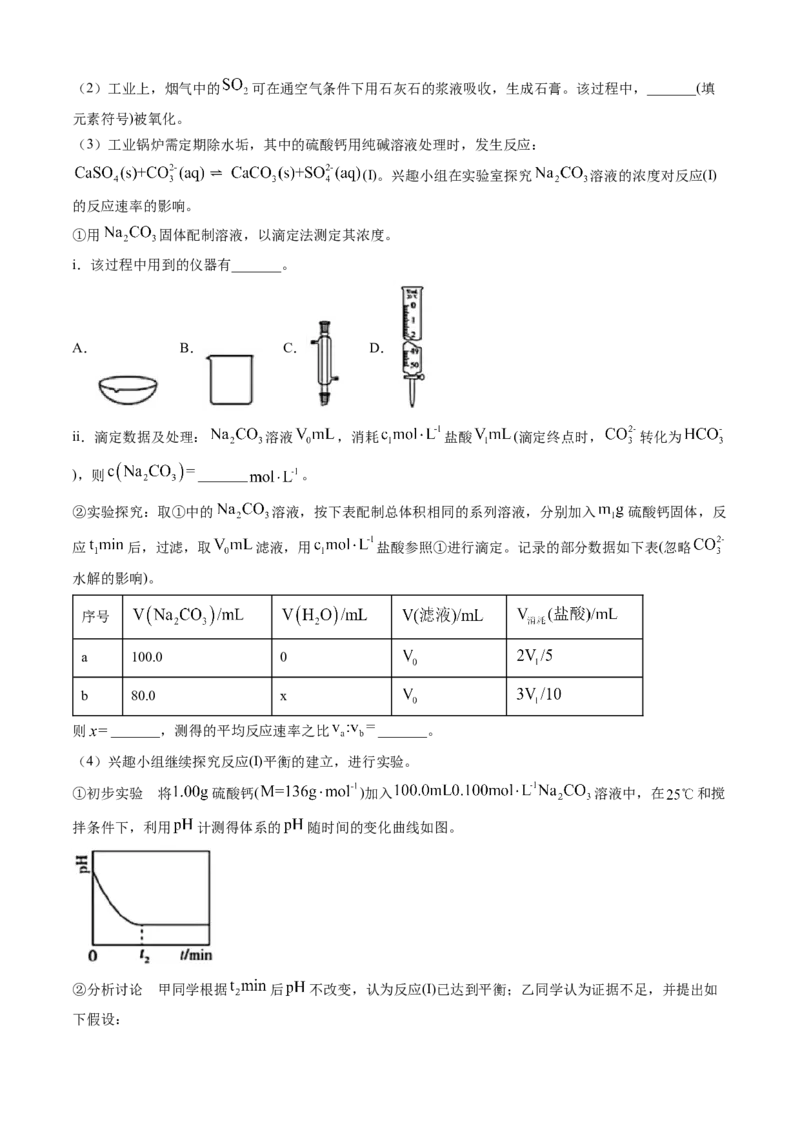
(1)实验室中,浓硫酸与铜丝反应,所产生的尾气可用_______(填化学式)溶液吸收。(2)工业上,烟气中的 可在通空气条件下用石灰石的浆液吸收,生成石膏。该过程中,_______(填
元素符号)被氧化。
(3)工业锅炉需定期除水垢,其中的硫酸钙用纯碱溶液处理时,发生反应:
(Ⅰ)。兴趣小组在实验室探究 溶液的浓度对反应(Ⅰ)
的反应速率的影响。
①用 固体配制溶液,以滴定法测定其浓度。
i.该过程中用到的仪器有_______。
A. B. C. D.
ii.滴定数据及处理: 溶液 ,消耗 盐酸 (滴定终点时, 转化为
),则 _______ 。
②实验探究:取①中的 溶液,按下表配制总体积相同的系列溶液,分别加入 硫酸钙固体,反
应 后,过滤,取 滤液,用 盐酸参照①进行滴定。记录的部分数据如下表(忽略
水解的影响)。
序号
a 100.0 0
b 80.0 x
则 _______,测得的平均反应速率之比 _______。
(4)兴趣小组继续探究反应(Ⅰ)平衡的建立,进行实验。
①初步实验 将 硫酸钙( )加入 溶液中,在 和搅
拌条件下,利用 计测得体系的 随时间的变化曲线如图。
②分析讨论 甲同学根据 后 不改变,认为反应(Ⅰ)已达到平衡;乙同学认为证据不足,并提出如
下假设:假设1 硫酸钙固体已完全消耗;
假设2 硫酸钙固体有剩余,但被碳酸钙沉淀包裹。
③验证假设,乙同学设计如下方案,进行实验。
步骤 现象
ⅰ.将①实验中的反应混合物进行固液分离 /
ⅱ.取少量分离出的沉淀置于试管中,滴加_______ _______,沉淀完全溶解
ⅲ.继续向ⅱ的试管中滴加_______ 无白色沉淀生成
④实验小结 假设1成立,假设2不成立。①实验中反应(Ⅰ)平衡未建立。
⑤优化方案、建立平衡 写出优化的实验方案,并给出反应(Ⅰ)平衡已建立的判断依据:_______。
26.(2024·北京卷)某小组同学向 的 的 溶液中分别加入过量的 粉、 粉和
粉,探究溶液中氧化剂的微粒及其还原产物。
(1)理论分析
依据金属活动性顺序, 中可将 还原为 的金属是_________。
(2)实验验证
实验 金属 操作、现象及产物
I 过量 一段时间后,溶液逐渐变为蓝绿色,固体中未检测到 单质
一段时间后有气泡产生,反应缓慢, 逐渐增大,产生了大量红褐色沉淀后,无气泡
II 过量
冒出,此时溶液 为3~4,取出固体,固体中未检测到 单质
有大量气泡产:生,反应剧烈, 逐渐增大,产生了大量红褐色沉淀后,持续产生大
III
过量
量气泡,当溶液 为3~4时,取出固体,固体中检测到 单质
①分别取实验I、Ⅱ、Ⅲ中的少量溶液,滴加 溶液,证明都有 生成,依据的现象是
___________________________.
②实验Ⅱ、Ⅲ都有红褐色沉淀生成,用平衡移动原理解释原因___________________________.
③对实验Ⅱ未检测到 单质进行分析及探究。
i.a.甲认为实验Ⅱ中,当 、 浓度较大时,即使 与 反应置换出少量 , 也会被 、
消耗。写出 与 、 反应的离子方程式___________________________.
b.乙认为在 为3~4的溶液中即便生成 也会被 消耗。设计实验__________________(填实验操
作和现象)。
证实了此条件下可忽略 对 的消耗。
c.丙认为产生的红褐色沉淀包裹在 粉上,阻碍了 与 的反应。实验证实了 粉被包裹。
i.查阅资料: 开始沉淀的 约为1.2,完全沉淀的 约为3。
结合a、b和c,重新做实验Ⅱ,当溶液 为3~4时,不取出固体,向固-液混合物中持续加入盐酸,控制,__________________ (填实验操作和现象),待 为3~4时,取出固体,固体中检测到
单质。
(3)对比实验Ⅱ和Ⅲ,解释实验Ⅲ的固体中检测到 单质的原因__________________。
27. (2024·江苏卷)贵金属银应用广泛。Ag与稀 制得 ,常用于循环处理高氯废水。
(1)沉淀 。在高氯水样中加入 使 浓度约为 ,当滴加 溶液至
开始产生 沉淀(忽略滴加过程的体积增加),此时溶液中 浓度约为_______ 。[已知:
, ]
(2)还原 。在 沉淀中埋入铁圈并压实,加入足量 盐酸后静置,充分反应得到
Ag。
①铁将 转化为单质Ag的化学方程式为_______。
②不与铁圈直接接触的 也能转化为Ag的原因是_______。
③为判断 是否完全转化,补充完整实验方案:取出铁圈,搅拌均匀,取少量混合物过滤,
_______[实验中必须使用的试剂和设备:稀 、 溶液,通风设备]
(3)Ag的抗菌性能。纳米Ag表面能产生 杀死细菌(如图所示),其抗菌性能受溶解氧浓度影响。
①纳米Ag溶解产生 的离子方程式为_______。
②实验表明溶解氧浓度过高,纳米Ag的抗菌性能下降,主要原因是_______。
28. (2024·湖北卷)学习小组为探究 、 能否催化 的分解及相关性质,室温下进行了实验
I~Ⅳ。
实验I 实验Ⅱ 实验Ⅲ溶液变为红色,伴有气泡 溶液变为墨绿色,并持续产生能使带火星
无明显变化
产生 木条复燃的气体
已知: 为粉红色、 为蓝色、 为红色、 为墨
绿色。回答下列问题:
(1)配制 的 溶液,需要用到下列仪器中的_______(填标号)。
a. b. c. d.
(2)实验I表明 _______(填“能”或“不能”)催化 的分解。实验Ⅱ中 大大
过量的原因是_______。实验Ⅲ初步表明 能催化 的分解,写出 在实验Ⅲ中所发
生反应的离子方程式_______、_______。
(3)实验I表明,反应 难以正向进行,利用
化学平衡移动原理,分析 、 分别与 配位后,正向反应能够进行的原因_______。
实验Ⅳ:
(4)实验Ⅳ中,A到B溶液变为蓝色,并产生气体;B到C溶液变为粉红色,并产生气体。从A到C所
产生的气体的分子式分别为_______、_______。
29.(2023·广东卷)化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装
置测量反应前后体系温度变化,用公式 计算获得。
(1)盐酸浓度的测定:移取 待测液,加入指示剂,用 溶液滴定至终点,消耗
溶液 。
①上述滴定操作用到的仪器有 。A. B. C.
D.
②该盐酸浓度为 。
(2)热量的测定:取上述 溶液和盐酸各 进行反应,测得反应前后体系的温度值( )分别为
,则该过程放出的热量为 (c和 分别取 和 ,忽略水以外各物
质吸收的热量,下同)。
(3)借鉴(2)的方法,甲同学测量放热反应 的焓变 (忽略温度对焓变的
影响,下同)。实验结果见下表。
体系温度/
序号 反应试剂
反应
反应后
前
i 粉 a b
溶液
ii a c
粉
①温度:b c(填“>”“<”或“=”)。
② (选择表中一组数据计算)。结果表明,该方法可行。
(4)乙同学也借鉴(2)的方法,测量反应 的焓变。
查阅资料:配制 溶液时需加入酸。加酸的目的是 。
提出猜想: 粉与 溶液混合,在反应A进行的过程中,可能存在 粉和酸的反应。
验证猜想:用 试纸测得 溶液的 不大于1;向少量 溶液中加入 粉,溶液颜色变
浅的同时有气泡冒出,说明存在反应A和 (用离子方程式表示)。
实验小结:猜想成立,不能直接测反应A的焓变。
教师指导:鉴于以上问题,特别是气体生成带来的干扰,需要设计出实验过程中无气体生成的实验方案。优化设计:乙同学根据相关原理,重新设计了优化的实验方案,获得了反应A的焓变。该方案为
。
(5)化学能可转化为热能,写出其在生产或生活中的一种应用 。
30.(2023·湖南卷)金属 对 有强吸附作用,被广泛用于硝基或羰基等不饱和基团的催化氢化反应,
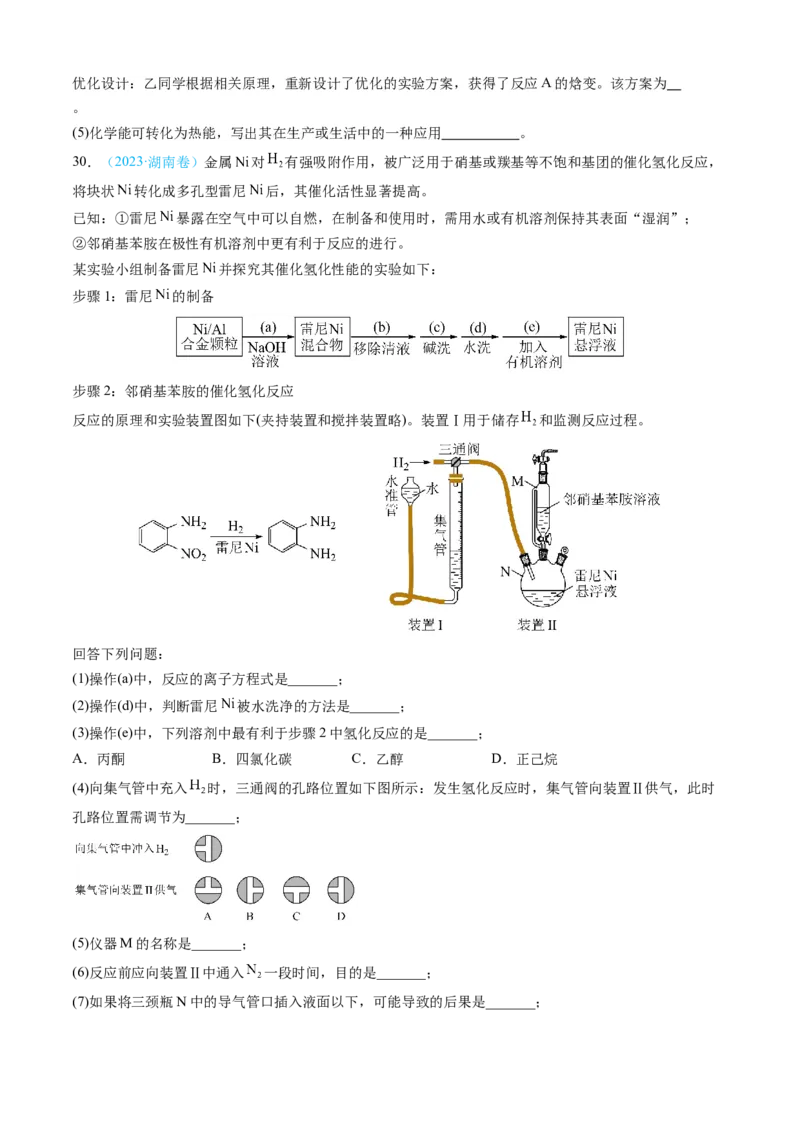
将块状 转化成多孔型雷尼 后,其催化活性显著提高。
已知:①雷尼 暴露在空气中可以自燃,在制备和使用时,需用水或有机溶剂保持其表面“湿润”;
②邻硝基苯胺在极性有机溶剂中更有利于反应的进行。
某实验小组制备雷尼 并探究其催化氢化性能的实验如下:
步骤1:雷尼 的制备
步骤2:邻硝基苯胺的催化氢化反应
反应的原理和实验装置图如下(夹持装置和搅拌装置略)。装置Ⅰ用于储存 和监测反应过程。
回答下列问题:
(1)操作(a)中,反应的离子方程式是_______;
(2)操作(d)中,判断雷尼 被水洗净的方法是_______;
(3)操作(e)中,下列溶剂中最有利于步骤2中氢化反应的是_______;
A.丙酮 B.四氯化碳 C.乙醇 D.正己烷
(4)向集气管中充入 时,三通阀的孔路位置如下图所示:发生氢化反应时,集气管向装置Ⅱ供气,此时
孔路位置需调节为_______;
(5)仪器M的名称是_______;
(6)反应前应向装置Ⅱ中通入 一段时间,目的是_______;
(7)如果将三颈瓶N中的导气管口插入液面以下,可能导致的后果是_______;(8)判断氢化反应完全的现象是_______。
31.(2023·北京卷)资料显示, 可以将 氧化为 。某小组同学设计实验探究 被 氧化的产物及
铜元素的价态。
已知: 易溶于 溶液,发生反应 (红棕色); 和 氧化性几乎相同。
I.将等体积的 溶液加入到 铜粉和 的固体混合物中,振荡。
实验记录如下:
实验现象
实验 极少量 溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液
Ⅰ 仍为淡红色
实验 部分 溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍
Ⅱ 为红棕色
实验 完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红
Ⅲ 棕色
(1)初始阶段, 被氧化的反应速率:实验Ⅰ__________(填“>”“<”或“=”)实验Ⅱ。
(2)实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有 (蓝色)或 (无色),进行以下
实验探究:
步骤a.取实验Ⅲ的深红棕色溶液,加入 ,多次萃取、分液。
步骤b.取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
ⅰ.步骤a的目的是_____________________。
ⅱ.查阅资料, , (无色)容易被空气氧化。用离子方程式解释步骤
的溶液中发生的变化:______________。
(3)结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是 ,实验Ⅰ中铜被氧化的化学方程式是
____________________。分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓 溶液,
__________(填实验现象),观察到少量红色的铜。分析铜未完全反应的原因是____________________。
(4)上述实验结果, 仅将 氧化为 价。在隔绝空气的条件下进行电化学实验,证实了 能将 氧化为
。装置如图所示, 分别是_____________。
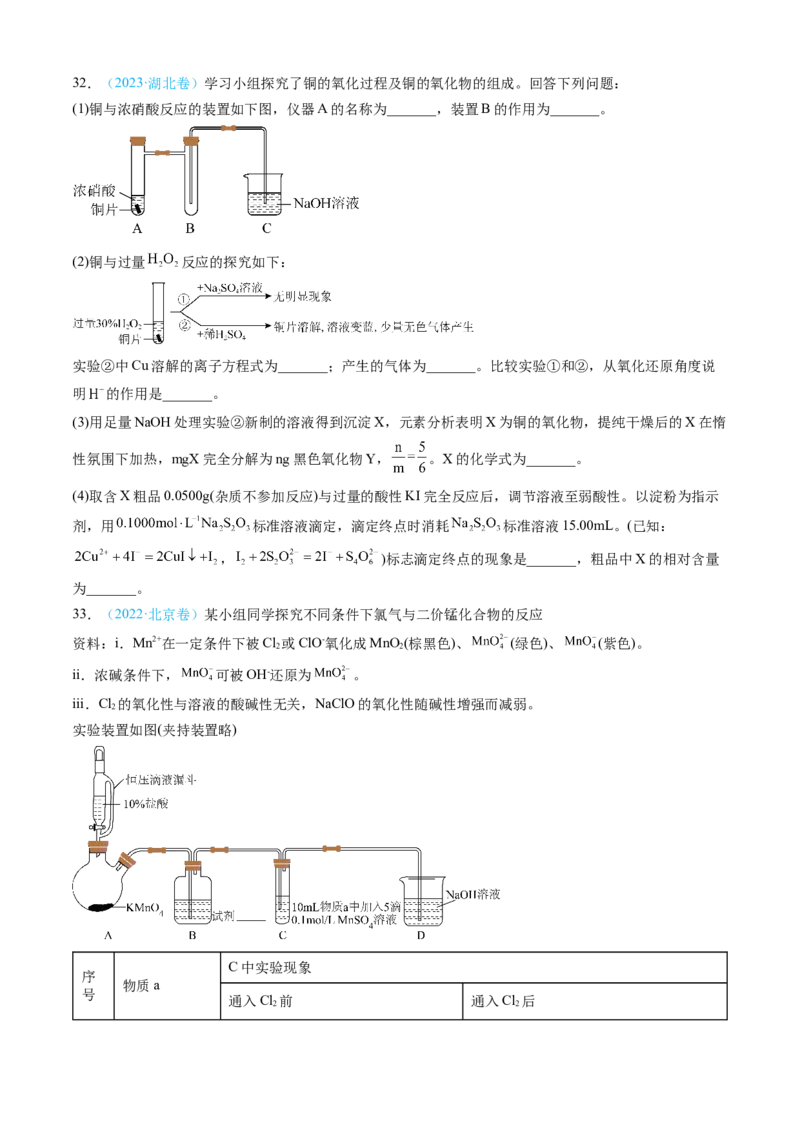
(5)运用氧化还原反应规律,分析在上述实验中 被 氧化的产物中价态不同的原因:_________。32.(2023·湖北卷)学习小组探究了铜的氧化过程及铜的氧化物的组成。回答下列问题:
(1)铜与浓硝酸反应的装置如下图,仪器A的名称为_______,装置B的作用为_______。
(2)铜与过量 反应的探究如下:
实验②中Cu溶解的离子方程式为_______;产生的气体为_______。比较实验①和②,从氧化还原角度说
明 的作用是_______。
(3)用足量NaOH处理实验②新制的溶液得到沉淀X,元素分析表明X为铜的氧化物,提纯干燥后的X在惰
性氛围下加热,mgX完全分解为ng黑色氧化物Y, 。X的化学式为_______。
(4)取含X粗品0.0500g(杂质不参加反应)与过量的酸性KI完全反应后,调节溶液至弱酸性。以淀粉为指示
剂,用 标准溶液滴定,滴定终点时消耗 标准溶液15.00mL。(已知:
, )标志滴定终点的现象是_______,粗品中X的相对含量
为_______。
33.(2022·北京卷)某小组同学探究不同条件下氯气与二价锰化合物的反应
资料:i.Mn2+在一定条件下被Cl 或ClO-氧化成MnO (棕黑色)、 (绿色)、 (紫色)。
2 2
ii.浓碱条件下, 可被OH-还原为 。
iii.Cl 的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
2
实验装置如图(夹持装置略)
C中实验现象
序
物质a
号
通入Cl 前 通入Cl 后
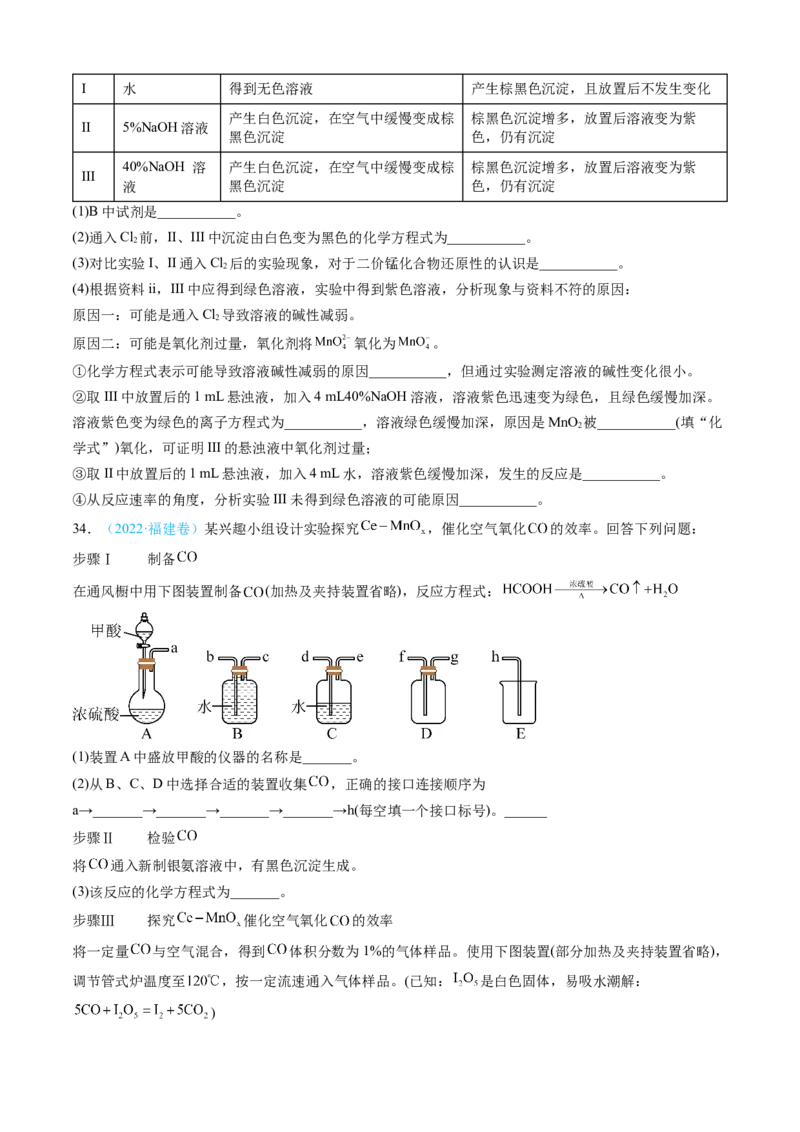
2 2I 水 得到无色溶液 产生棕黑色沉淀,且放置后不发生变化
产生白色沉淀,在空气中缓慢变成棕 棕黑色沉淀增多,放置后溶液变为紫
II 5%NaOH溶液
黑色沉淀 色,仍有沉淀
40%NaOH 溶 产生白色沉淀,在空气中缓慢变成棕 棕黑色沉淀增多,放置后溶液变为紫
III
液 黑色沉淀 色,仍有沉淀
(1)B中试剂是___________。
(2)通入Cl 前,II、III中沉淀由白色变为黑色的化学方程式为___________。
2
(3)对比实验I、II通入Cl 后的实验现象,对于二价锰化合物还原性的认识是___________。
2
(4)根据资料ii,III中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl 导致溶液的碱性减弱。
2
原因二:可能是氧化剂过量,氧化剂将 氧化为 。
①化学方程式表示可能导致溶液碱性减弱的原因___________,但通过实验测定溶液的碱性变化很小。
②取III中放置后的1 mL悬浊液,加入4 mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。
溶液紫色变为绿色的离子方程式为___________,溶液绿色缓慢加深,原因是MnO 被___________(填“化
2
学式”)氧化,可证明III的悬浊液中氧化剂过量;
③取II中放置后的1 mL悬浊液,加入4 mL水,溶液紫色缓慢加深,发生的反应是___________。
④从反应速率的角度,分析实验III未得到绿色溶液的可能原因___________。
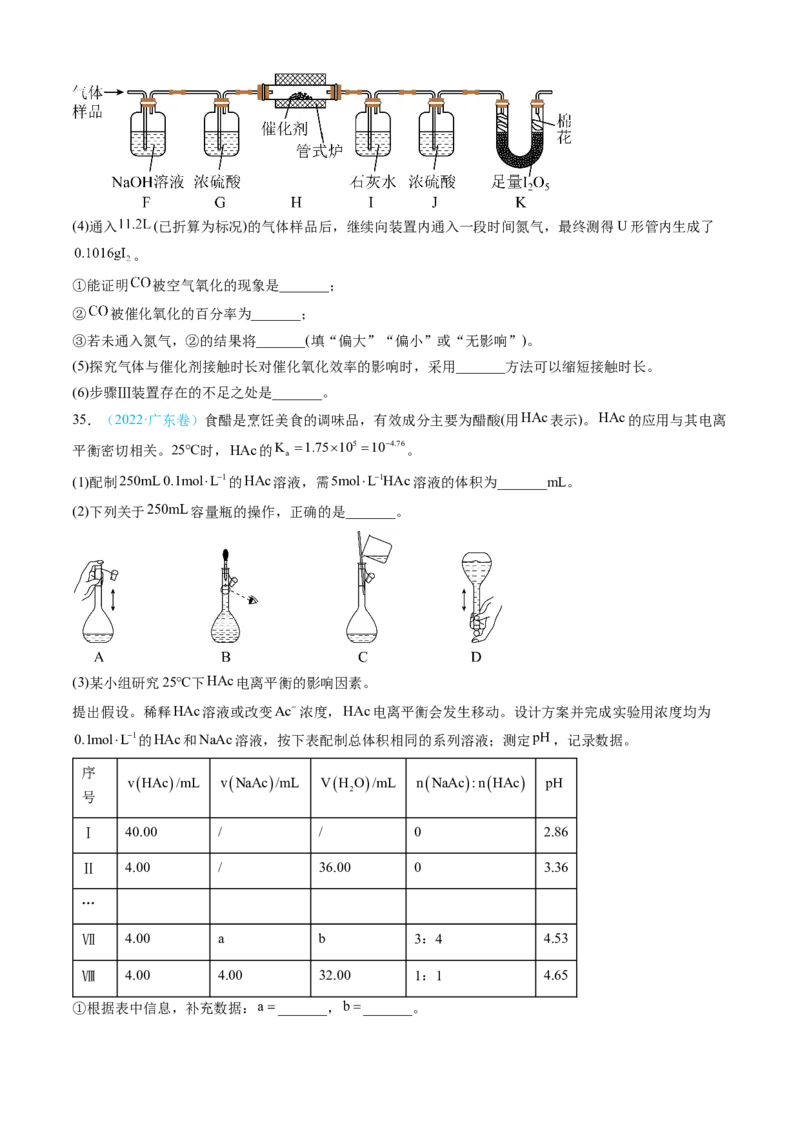
34.(2022·福建卷)某兴趣小组设计实验探究 ,催化空气氧化 的效率。回答下列问题:
步骤Ⅰ 制备
在通风橱中用下图装置制备 (加热及夹持装置省略),反应方程式:
(1)装置A中盛放甲酸的仪器的名称是_______。
(2)从B、C、D中选择合适的装置收集 ,正确的接口连接顺序为
a→_______→_______→_______→_______→h(每空填一个接口标号)。______
步骤Ⅱ 检验
将 通入新制银氨溶液中,有黑色沉淀生成。
(3)该反应的化学方程式为_______。
步骤Ⅲ 探究 催化空气氧化 的效率
将一定量 与空气混合,得到 体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),
调节管式炉温度至 ,按一定流速通入气体样品。(已知: 是白色固体,易吸水潮解:
)(4)通入 (已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了
。
①能证明 被空气氧化的现象是_______;
② 被催化氧化的百分率为_______;
③若未通入氮气,②的结果将_______(填“偏大”“偏小”或“无影响”)。
(5)探究气体与催化剂接触时长对催化氧化效率的影响时,采用_______方法可以缩短接触时长。
(6)步骤Ⅲ装置存在的不足之处是_______。
35.(2022·广东卷)食醋是烹饪美食的调味品,有效成分主要为醋酸(用HAc表示)。HAc的应用与其电离
平衡密切相关。25℃时,HAc的K 1.75105 104.76。
a
(1)配制250mL 0.1molL1的HAc溶液,需5molL1HAc溶液的体积为_______mL。
(2)下列关于250mL容量瓶的操作,正确的是_______。
(3)某小组研究25℃下HAc电离平衡的影响因素。
提出假设。稀释HAc溶液或改变Ac浓度,HAc电离平衡会发生移动。设计方案并完成实验用浓度均为
0.1molL1的HAc和NaAc溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。
序
vHAc/mL vNaAc/mL VH O/mL nNaAc:nHAc pH
2
号
Ⅰ 40.00 / / 0 2.86
Ⅱ 4.00 / 36.00 0 3.36
…
Ⅶ 4.00 a b 3:4 4.53
Ⅷ 4.00 4.00 32.00 1:1 4.65
①根据表中信息,补充数据:a_______,b_______。②由实验Ⅰ和Ⅱ可知,稀释HAc溶液,电离平衡_______(填”正”或”逆”)
向移动;结合表中数据,给出判断理由:_______。
③由实验Ⅱ~VIII可知,增大Ac浓度,HAc电离平衡逆向移动。
实验结论假设成立。
nNaAc
(4)小组分析上表数据发现:随着 nHAc 的增加, c H+的值逐渐接近 HAc 的 K 。
a
nNaAc
查阅资料获悉:一定条件下,按
nHAc
1配制的溶液中,
c
H+的值等于
HAc
的
K
。
a
对比数据发现,实验VIII中pH4.65与资料数据K 104.76 存在一定差异;推测可能由物质浓度准确程度
a
不够引起,故先准确测定HAc溶液的浓度再验证。
①移取20.00mLHAc溶液,加入2滴酚酞溶液,用0.1000molL1NaOH溶液滴定至终点,消耗体积为
22.08mL,则该HAc溶液的浓度为_______molL1。在答题卡虚线框中,画出上述过程的滴定曲线示意图
并标注滴定终点_______。
②用上述HAc溶液和0.1000molL1NaOH溶液,配制等物质的量的HAc与NaAc混合溶液,测定pH,结果
与资料数据相符。
(5)小组进一步提出:如果只有浓度均约为0.1molL1的HAc和NaOH溶液,如何准确测定HAc的K ?小
a
组同学设计方案并进行实验。请完成下表中Ⅱ的内容。
Ⅰ 移取20.00mLHAc溶液,用NaOH溶液滴定至终点,消耗NaOH溶液 V
1
mL
Ⅱ _______,测得溶液的pH为4.76
实验总结 得到的结果与资料数据相符,方案可行。
(6)根据K 可以判断弱酸的酸性强弱。写出一种无机弱酸及其用途_______。
a
考法04 定量实验的设计与评价
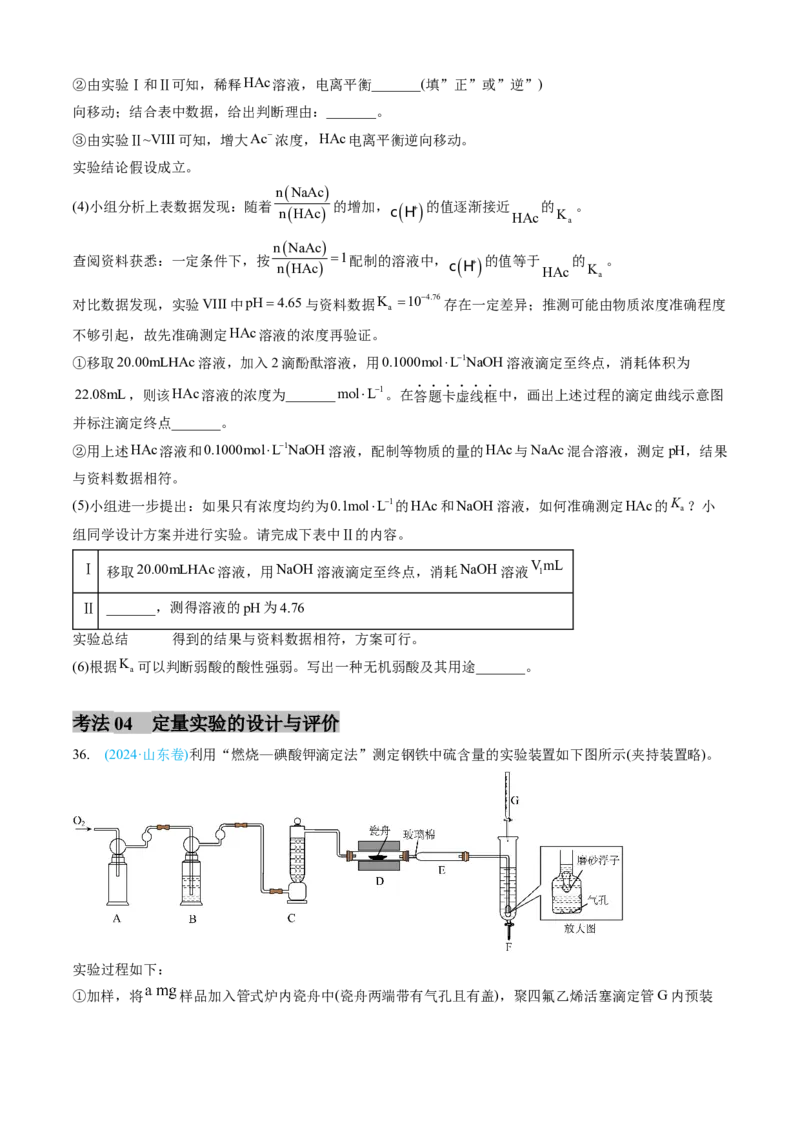
36. (2024·山东卷)利用“燃烧—碘酸钾滴定法”测定钢铁中硫含量的实验装置如下图所示(夹持装置略)。
实验过程如下:
①加样,将 样品加入管式炉内瓷舟中(瓷舟两端带有气孔且有盖),聚四氟乙烯活塞滴定管G内预装略小于 的 碱性标准溶液,吸收管F内盛有盐酸酸化的淀粉水溶液。向F内滴入适
量 碱性标准溶液,发生反应: ,使溶液显浅蓝色。
②燃烧:按一定流速通入 ,一段时间后,加热并使样品燃烧。
③滴定:当F内溶液浅蓝色消退时(发生反应: ),立即用 碱性标准溶
液滴定至浅蓝色复现。随 不断进入F,滴定过程中溶液颜色“消退-变蓝”不断变换,直至终点。
回答下列问题:
(1)取 的碱性溶液和一定量的 固体,配制 碱性标准溶液,
下列仪器必须用到的是_______(填标号)。
A. 玻璃棒 B. 锥形瓶 C. 容量瓶 D. 胶头滴管
(2)装置B和C的作用是充分干燥 ,B中的试剂为_______。装置F中通气管末端多孔玻璃泡内置一
密度小于水的磨砂浮子(见放大图),目的是_______。
(3)该滴定实验达终点的现象是_______;滴定消耗 碱性标准溶液 ,样品中硫的质量分数是
_______(用代数式表示)。
(4)若装置D中瓷舟未加盖,会因燃烧时产生粉尘而促进 的生成,粉尘在该过程中的作用是_______;
若装置E冷却气体不充分,可能导致测定结果偏大,原因是_______;若滴定过程中,有少量 不经
直接将 氧化成 ,测定结果会_______(填“偏大”“偏小”或“不变”)。
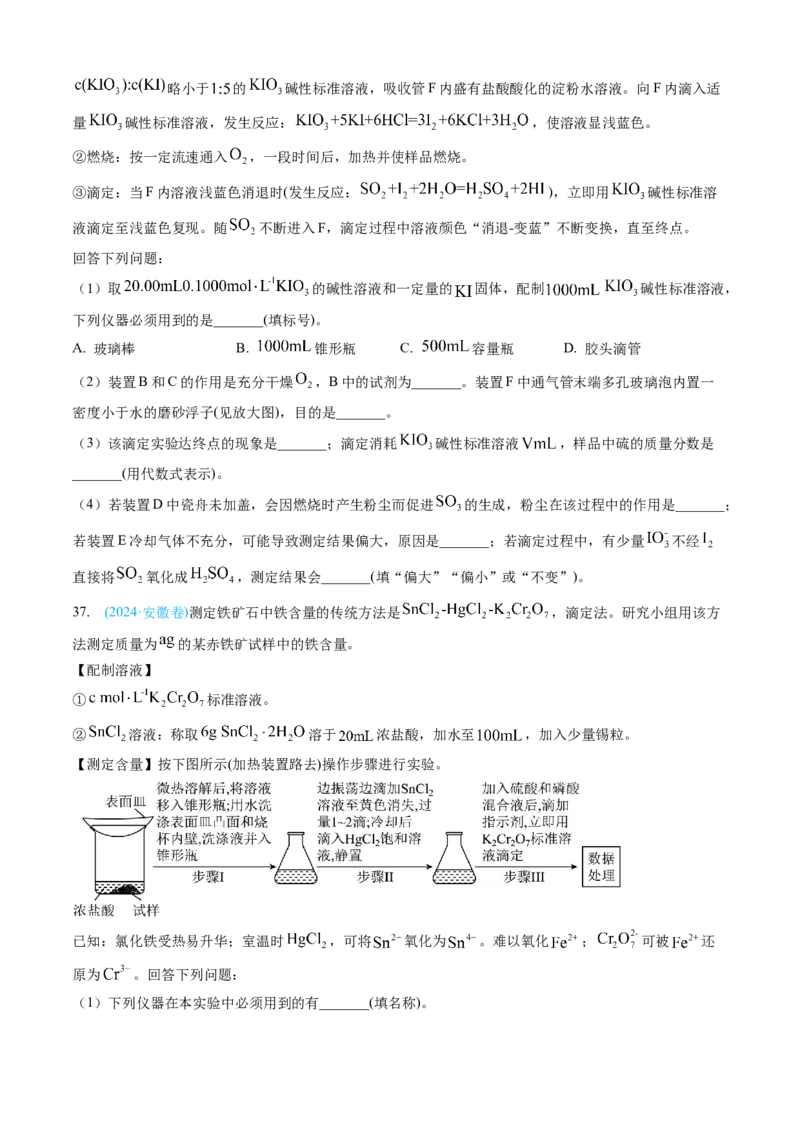
37. (2024·安徽卷)测定铁矿石中铁含量的传统方法是 ,滴定法。研究小组用该方
法测定质量为 的某赤铁矿试样中的铁含量。
【配制溶液】
① 标准溶液。
② 溶液:称取 溶于 浓盐酸,加水至 ,加入少量锡粒。
【测定含量】按下图所示(加热装置路去)操作步骤进行实验。
已知:氯化铁受热易升华;室温时 ,可将 氧化为 。难以氧化 ; 可被 还
原为 。回答下列问题:
(1)下列仪器在本实验中必须用到的有_______(填名称)。(2)结合离子方程式解释配制 溶液时加入锡粒的原因:_______。
(3)步骤I中“微热”的原因是_______。
(4)步琛Ⅲ中,若未“立即滴定”,则会导致测定的铁含量_______(填“偏大”“偏小”或“不变”)。
(5)若消耗 标准溶液 ,则 试样中 的质量分数为_______(用含a、c、V的
代数式表示)。
(6) 滴定法也可测定铁的含量,其主要原理是利用 和 将铁矿石试样中
还原为 ,再用 标准溶液滴定。
①从环保角度分析,该方法相比于 ,滴定法的优点是_______。
②为探究 溶液滴定时, 在不同酸度下对 测定结果的影响,分别向下列溶液中加入1滴
溶液,现象如下表:
溶液 现象
空白实验 溶液 试剂X 紫红色不褪去
实验I 溶液 硫酸 紫红色不褪去
实验ⅱ 溶液 硫酸 紫红色明显变浅
表中试剂X为_______;根据该实验可得出的结论是_______。
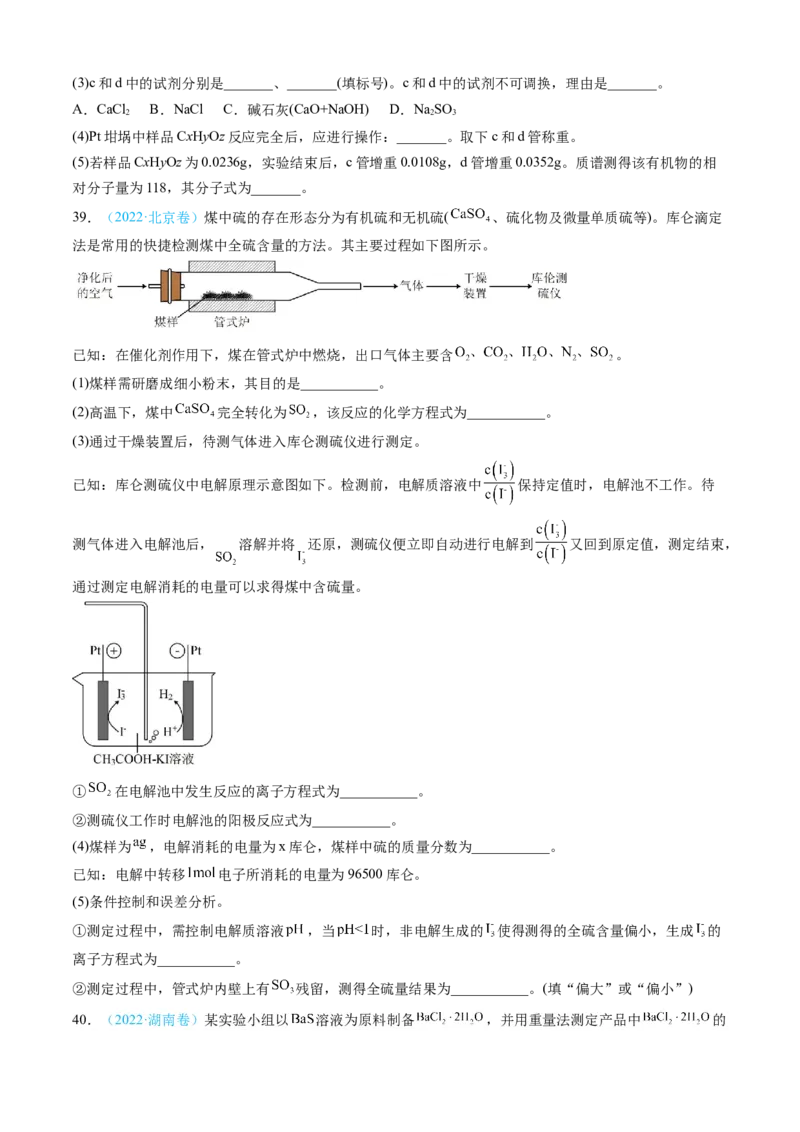
38.(2023·全国乙卷)元素分析是有机化合物的表征手段之一。按下图实验装置(部分装置略)对有机化合
物进行C、H元素分析。
回答下列问题:
(1)将装有样品的Pt坩埚和CuO放入石英管中,先_______,而后将已称重的U型管c、d与石英管连接,
检查_______。依次点燃煤气灯_______,进行实验。
(2)O 的作用有_______。CuO的作用是_______(举1例,用化学方程式表示)。
2(3)c和d中的试剂分别是_______、_______(填标号)。c和d中的试剂不可调换,理由是_______。
A.CaCl B.NaCl C.碱石灰(CaO+NaOH) D.NaSO
2 2 3
(4)Pt坩埚中样品CxHyOz反应完全后,应进行操作:_______。取下c和d管称重。
(5)若样品CxHyOz为0.0236g,实验结束后,c管增重0.0108g,d管增重0.0352g。质谱测得该有机物的相
对分子量为118,其分子式为_______。
39.(2022·北京卷)煤中硫的存在形态分为有机硫和无机硫( 、硫化物及微量单质硫等)。库仑滴定
法是常用的快捷检测煤中全硫含量的方法。其主要过程如下图所示。
已知:在催化剂作用下,煤在管式炉中燃烧,出口气体主要含 。
(1)煤样需研磨成细小粉末,其目的是___________。
(2)高温下,煤中 完全转化为 ,该反应的化学方程式为___________。
(3)通过干燥装置后,待测气体进入库仑测硫仪进行测定。
已知:库仑测硫仪中电解原理示意图如下。检测前,电解质溶液中 保持定值时,电解池不工作。待
测气体进入电解池后, 溶解并将 还原,测硫仪便立即自动进行电解到 又回到原定值,测定结束,
通过测定电解消耗的电量可以求得煤中含硫量。
① 在电解池中发生反应的离子方程式为___________。
②测硫仪工作时电解池的阳极反应式为___________。
(4)煤样为 ,电解消耗的电量为x库仑,煤样中硫的质量分数为___________。
已知:电解中转移 电子所消耗的电量为96500库仑。
(5)条件控制和误差分析。
①测定过程中,需控制电解质溶液 ,当 时,非电解生成的 使得测得的全硫含量偏小,生成 的
离子方程式为___________。
②测定过程中,管式炉内壁上有 残留,测得全硫量结果为___________。(填“偏大”或“偏小”)
40.(2022·湖南卷)某实验小组以 溶液为原料制备 ,并用重量法测定产品中 的含量。设计了如下实验方案:
可选用试剂: 晶体、 溶液、浓 、稀 、 溶液、蒸馏水
步骤1. 的制备
按如图所示装置进行实验,得到 溶液,经一系列步骤获得 产品。
步骤2,产品中 的含量测定
①称取产品 ,用 水溶解,酸化,加热至近沸;
②在不断搅拌下,向①所得溶液逐滴加入热的 溶液,
③沉淀完全后, 水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为 。
回答下列问题:
(1)Ⅰ是制取 气体的装置,在试剂a过量并微热时,发生主要反应的化学方程式为 ;
(2)Ⅰ中b仪器的作用是 ;Ⅲ中的试剂应选用 ;
(3)在沉淀过程中,某同学在加入一定量热的 溶液后,认为沉淀已经完全,判断沉淀已完全的方法是
;
(4)沉淀过程中需加入过量的 溶液,原因是 ;
(5)在过滤操作中,下列仪器不需要用到的是 (填名称);
(6)产品中 的质量分数为 (保留三位有效数字)。
41.(2022·河北卷)某研究小组为了更准确检测香菇中添加剂亚硫酸盐的含量,设计实验如下:①三颈烧瓶中加入 香菇样品和 水;锥形瓶中加入 水、 淀粉溶液,并预加
的碘标准溶液,搅拌。
②以 流速通氮气,再加入过量磷酸,加热并保持微沸,同时用碘标准溶液滴定,至终点时滴定
消耗了 碘标准溶液。
③做空白实验,消耗了 碘标准溶液。
④用适量 替代香菇样品,重复上述步骤,测得 的平均回收率为95%。
已知: ,
回答下列问题:
(1)装置图中仪器a、b的名称分别为 、 。
(2)三颈烧瓶适宜的规格为 (填标号)。
A. B. C.
(3)解释加入 ,能够生成 的原因: 。
(4)滴定管在使用前需要 、洗涤、润洗;滴定终点时溶液的颜色为 ;滴定反应的离子方程式
为 。
(5)若先加磷酸再通氮气,会使测定结果 (填“偏高”“偏低”或“无影响”)。
(6)该样品中亚硫酸盐含量为 (以 计,结果保留三位有效数字)。