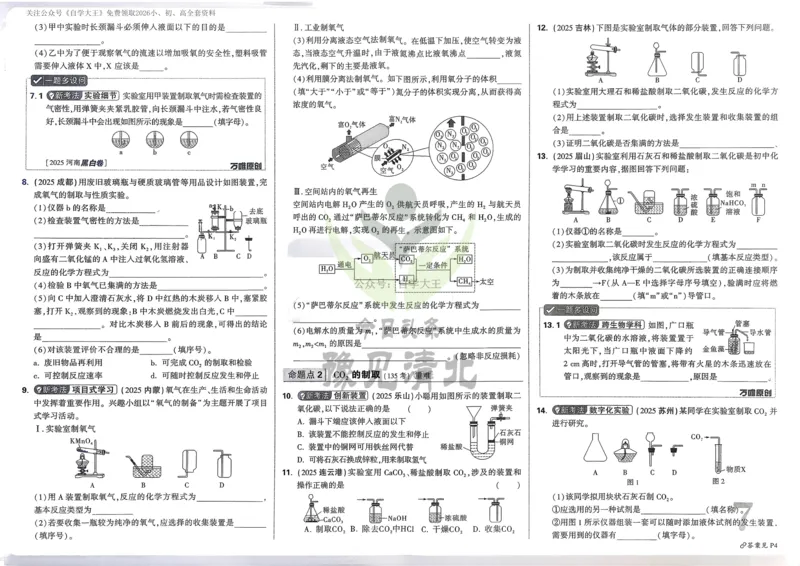
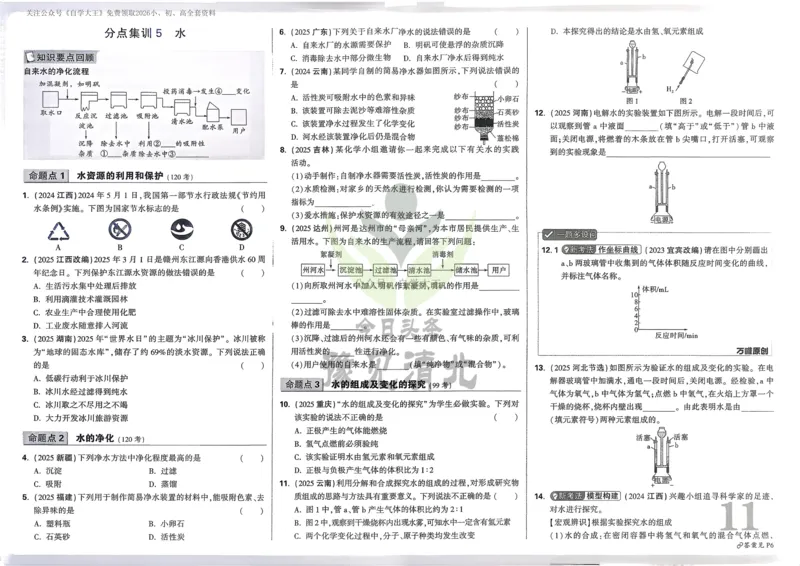
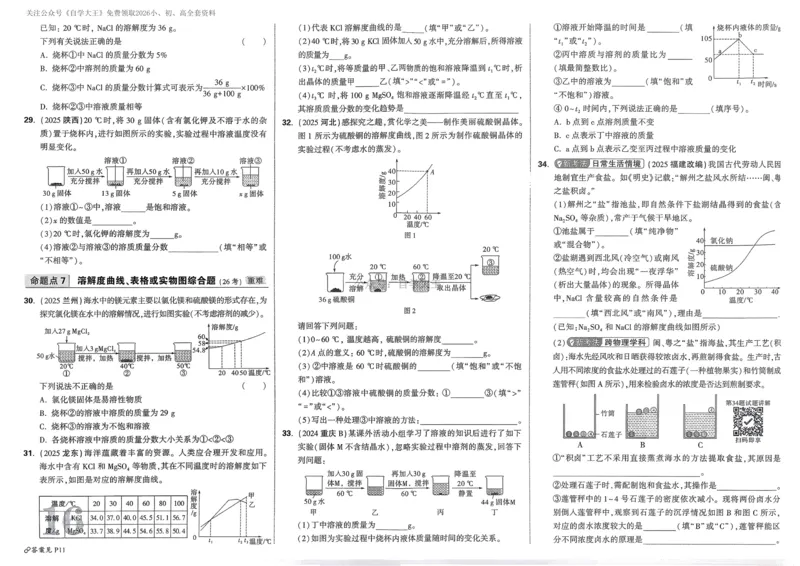
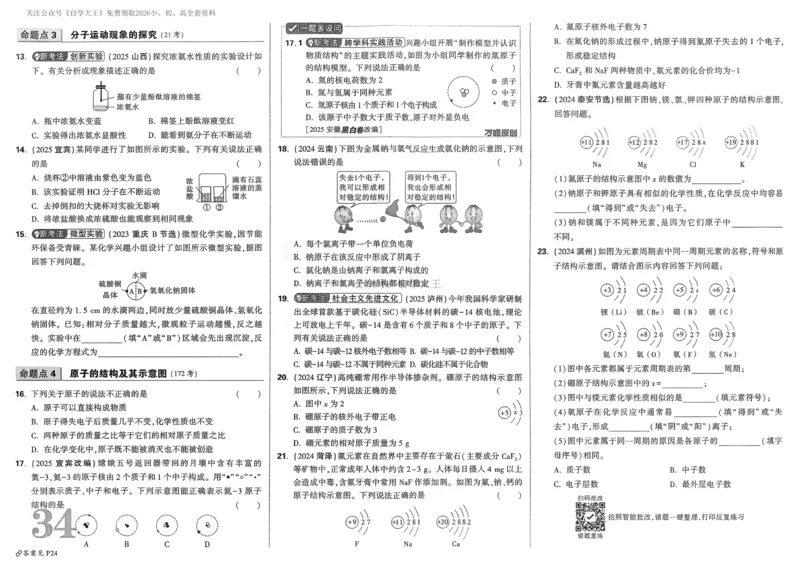
文档内容
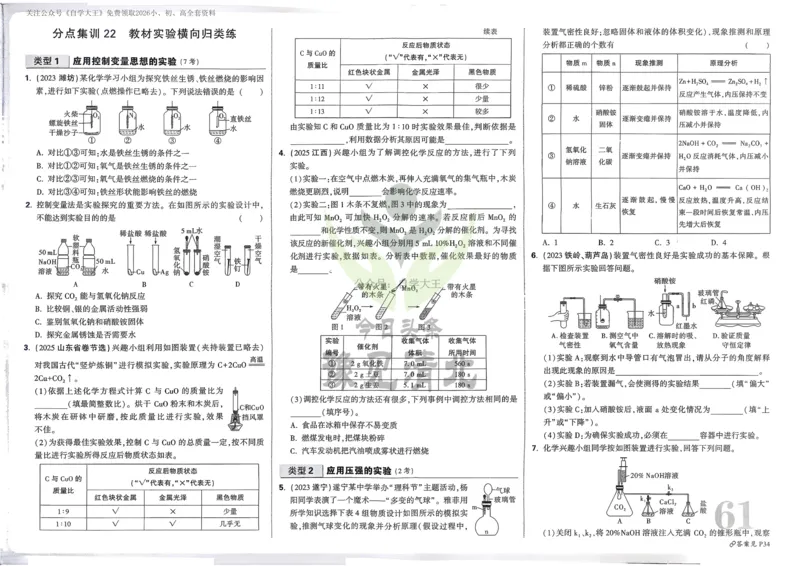
2023—2024 学年度下期高二年级 6 月阶段性测试
化学试卷
考试时间:75 分钟 总分:100 分
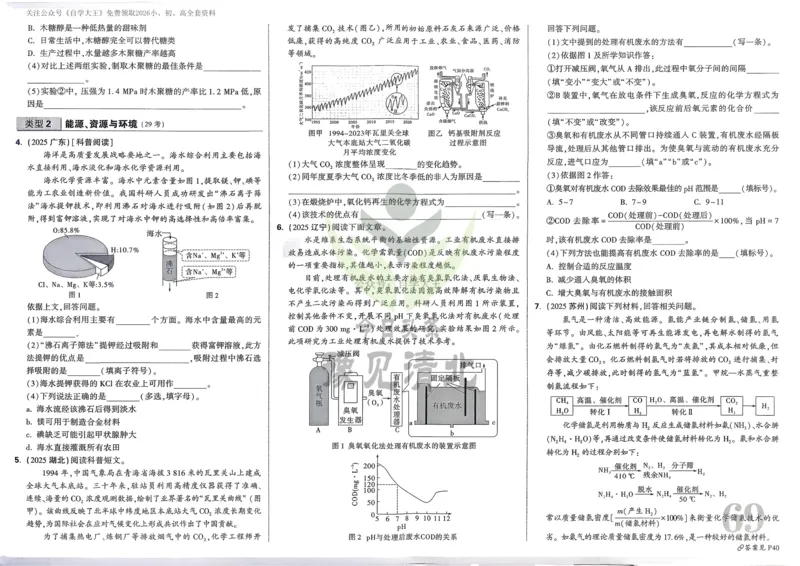
可能用到的相对原子质量:H-1 C-12 O-16 Mg-24 Fe-56
一、选择题:本题共14小题,每题3分,共42分。每小题只有一个选项符合题目要求。
1.日常生活中的化学物质无处不在,下列说法错误的是
A.冠醚有不同大小的空穴,可以适配不同大小的碱金属离子
B.低温石英具有手性,被广泛用作压电材料,如制作石英手表
C.福尔马林具有杀菌、防腐性能,可用于食物的防腐和消毒
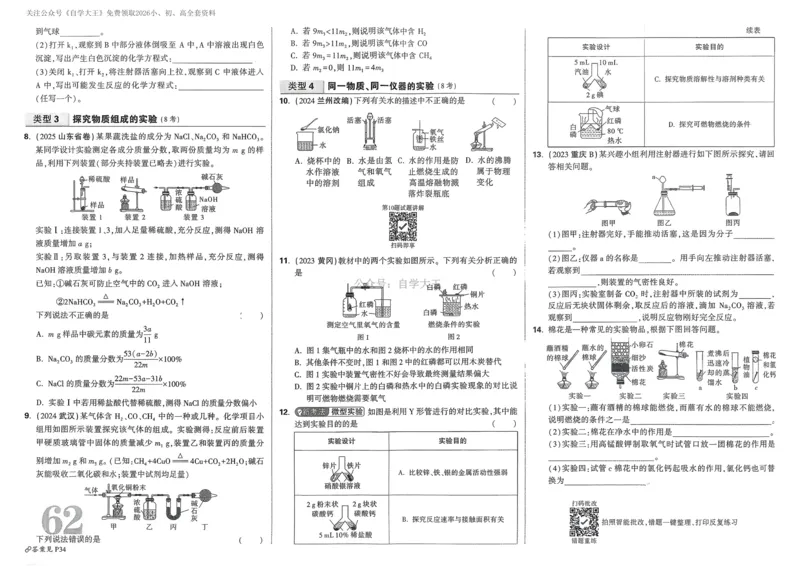
D.甲酸在工业上可用作还原剂,也是合成医药、农药等的原料
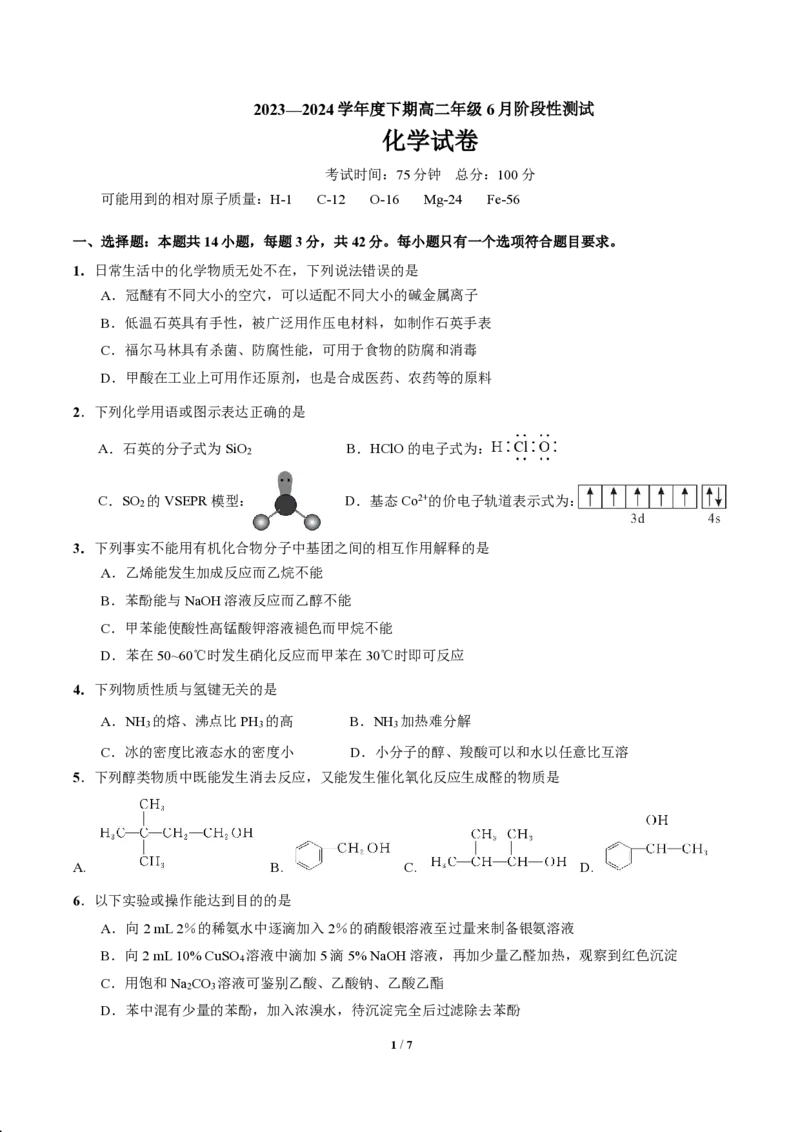
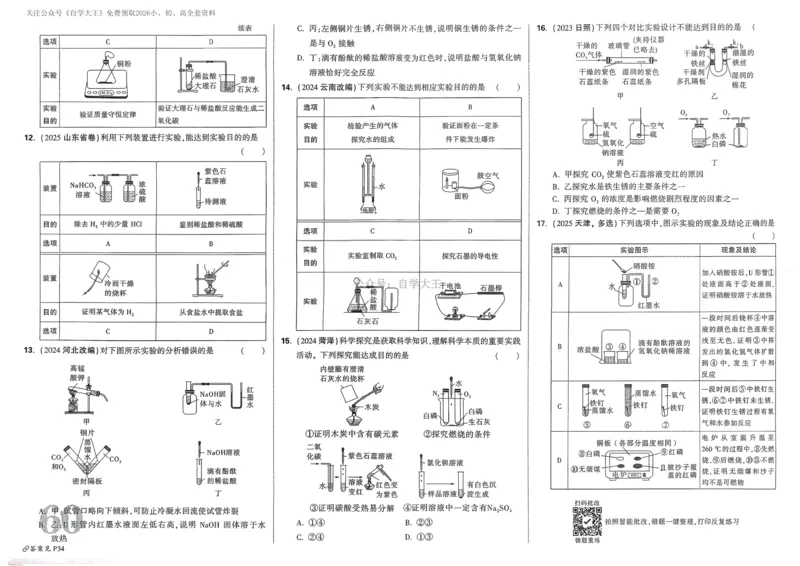
2.下列化学用语或图示表达正确的是
A.石英的分子式为SiO B.HClO的电子式为:
2
C.SO 的VSEPR模型: D.基态Co2+的价电子轨道表示式为:
2
3.下列事实不能用有机化合物分子中基团之间的相互作用解释的是
A.乙烯能发生加成反应而乙烷不能
B.苯酚能与NaOH溶液反应而乙醇不能
C.甲苯能使酸性高锰酸钾溶液褪色而甲烷不能
D.苯在50~60℃时发生硝化反应而甲苯在30℃时即可反应
4.下列物质性质与氢键无关的是
A.NH 的熔、沸点比PH 的高 B.NH 加热难分解
3 3 3
C.冰的密度比液态水的密度小 D.小分子的醇、羧酸可以和水以任意比互溶
5.下列醇类物质中既能发生消去反应,又能发生催化氧化反应生成醛的物质是
A. B. C. D.
6.以下实验或操作能达到目的的是
A.向2 mL 2%的稀氨水中逐滴加入2%的硝酸银溶液至过量来制备银氨溶液
B.向2 mL 10% CuSO 溶液中滴加5滴5% NaOH溶液,再加少量乙醛加热,观察到红色沉淀
4
C.用饱和Na CO 溶液可鉴别乙酸、乙酸钠、乙酸乙酯
2 3
D.苯中混有少量的苯酚,加入浓溴水,待沉淀完全后过滤除去苯酚
1 / 7
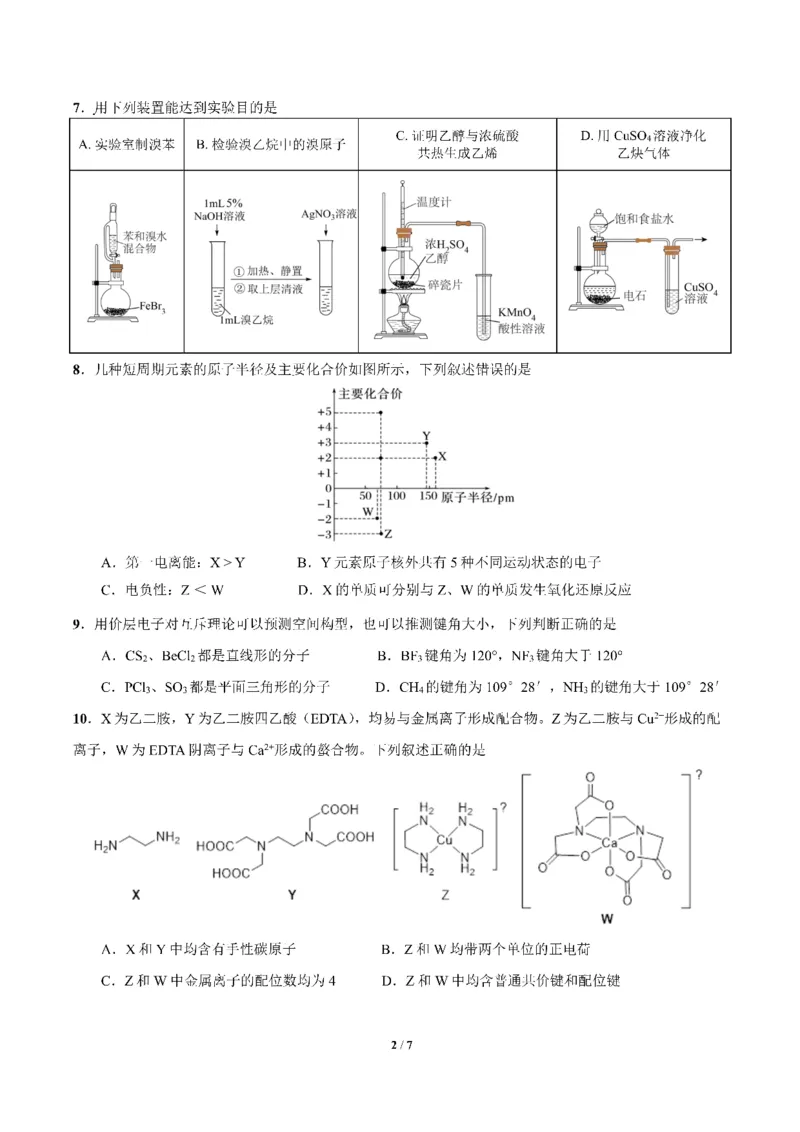
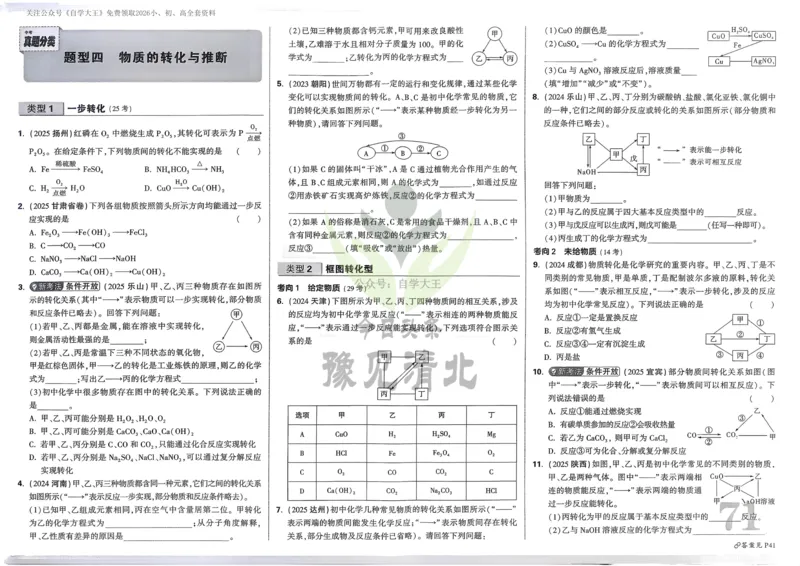
{#{QQABCQCUggAgAIJAAAgCQw2gCEIQkBACCQgGxAAMIAABgQNABAA=}#}{#{QQABCQCUggAgAIJAAAgCQw2gCEIQkBACCQgGxAAMIAABgQNABAA=}#}11.某稀磁半导体的晶胞结构如图所示。该晶体可看作Zn2+作面心立方最密堆积,Li+、As3-填入其中空
隙,已知该晶胞的晶胞参数为a pm,下列描述错误的是
A.该物质的化学式为LiZnAs
B.与Li+距离最近且相同的Li+有12个
C.Li+填入Zn2+围成的正八面体空隙,填隙率为100%
D.As3-填在Zn2+围成的正四面体空隙中,二者的最近核间距为√3
𝑎 pm
8
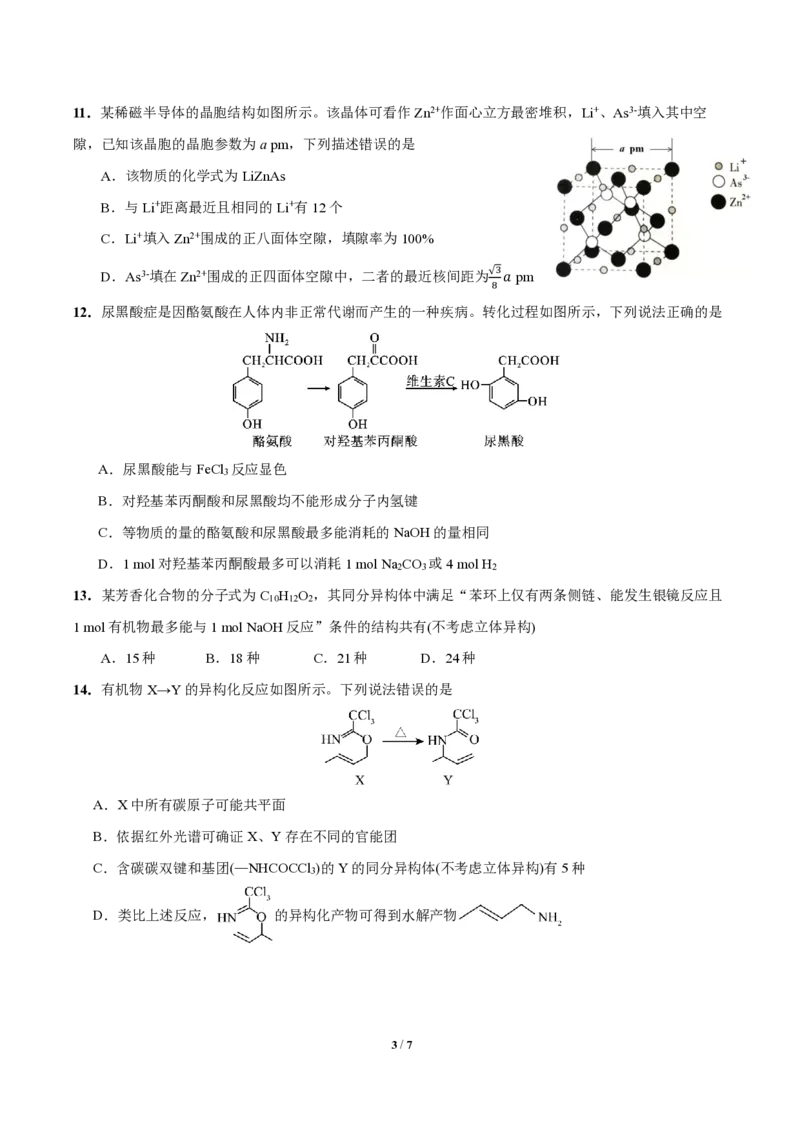
12.尿黑酸症是因酪氨酸在人体内非正常代谢而产生的一种疾病。转化过程如图所示,下列说法正确的是
A.尿黑酸能与FeCl 反应显色
3
B.对羟基苯丙酮酸和尿黑酸均不能形成分子内氢键
C.等物质的量的酪氨酸和尿黑酸最多能消耗的NaOH的量相同
D.1 mol对羟基苯丙酮酸最多可以消耗1 mol Na CO 或4 mol H
2 3 2
13.某芳香化合物的分子式为C H O ,其同分异构体中满足“苯环上仅有两条侧链、能发生银镜反应且
10 12 2
1 mol有机物最多能与1 mol NaOH反应”条件的结构共有(不考虑立体异构)
A.15种 B.18种 C.21种 D.24种
14.有机物X→Y的异构化反应如图所示。下列说法错误的是
A.X中所有碳原子可能共平面
B.依据红外光谱可确证X、Y存在不同的官能团
C.含碳碳双键和基团(—NHCOCCl )的Y的同分异构体(不考虑立体异构)有5种
3
D.类比上述反应, 的异构化产物可得到水解产物
3 / 7
{#{QQABCQCUggAgAIJAAAgCQw2gCEIQkBACCQgGxAAMIAABgQNABAA=}#}二、非选择题:本题共4小题,共58分。
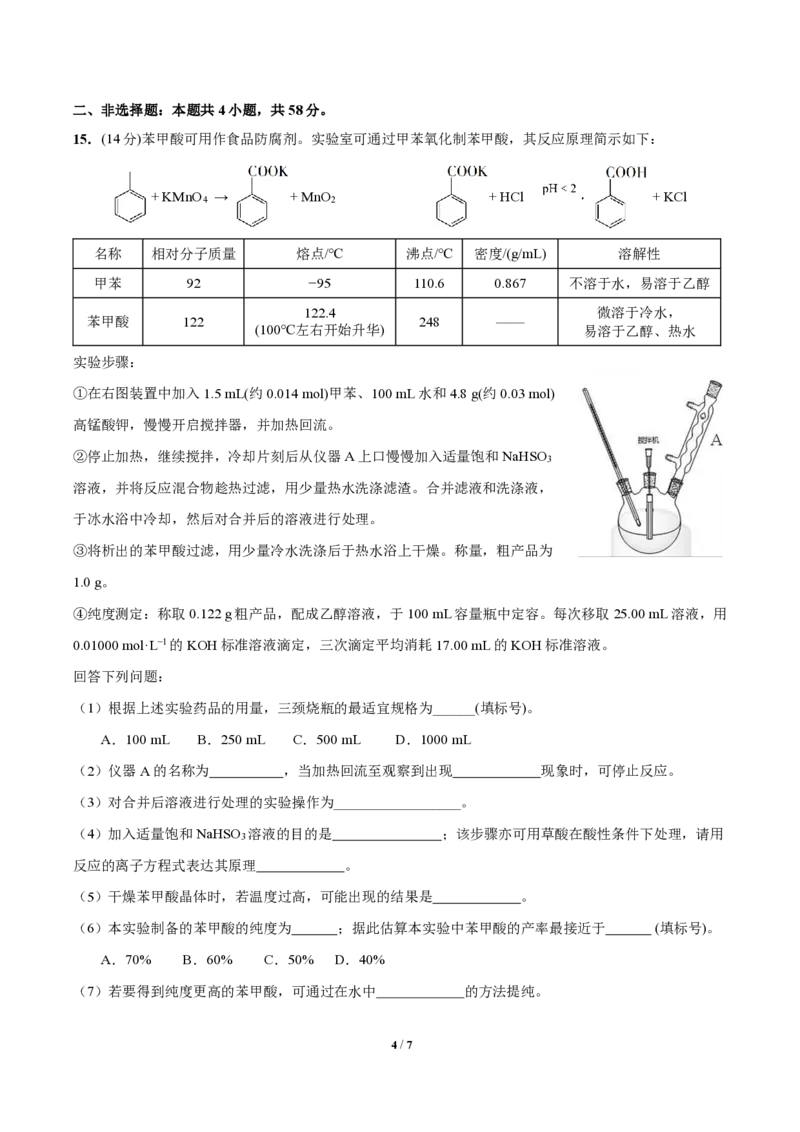
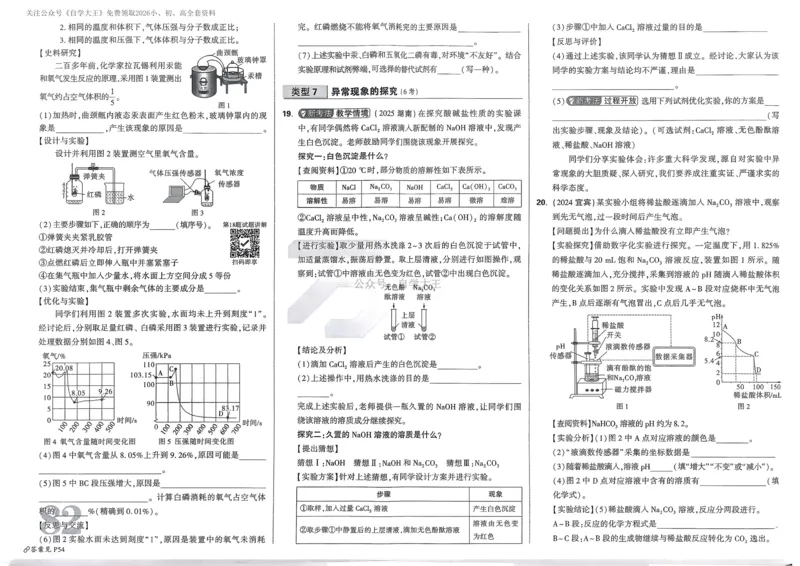
15.(14分)苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
+ KMnO → + MnO + HCl + KCl
4 2
名称 相对分子质量 熔点/℃ 沸点/℃ 密度/(g/mL) 溶解性
甲苯 92 −95 110.6 0.867 不溶于水,易溶于乙醇
122.4 微溶于冷水,
苯甲酸 122 248 ——
(100℃左右开始升华) 易溶于乙醇、热水
实验步骤:
①在右图装置中加入1.5 mL(约0.014 mol)甲苯、100 mL水和4.8 g(约0.03 mol)
高锰酸钾,慢慢开启搅拌器,并加热回流。
②停止加热,继续搅拌,冷却片刻后从仪器A上口慢慢加入适量饱和NaHSO
3
溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,
于冰水浴中冷却,然后对合并后的溶液进行处理。
③将析出的苯甲酸过滤,用少量冷水洗涤后于热水浴上干燥。称量,粗产品为
1.0 g。
④纯度测定:称取0.122 g粗产品,配成乙醇溶液,于100 mL容量瓶中定容。每次移取25.00 mL溶液,用
0.01000 mol·L−1的KOH标准溶液滴定,三次滴定平均消耗17.00 mL的KOH标准溶液。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为______(填标号)。
A.100 mL B.250 mL C.500 mL D.1000 mL
(2)仪器A的名称为 ,当加热回流至观察到出现 现象时,可停止反应。
(3)对合并后溶液进行处理的实验操作为__________________。
(4)加入适量饱和NaHSO 溶液的目的是 ;该步骤亦可用草酸在酸性条件下处理,请用
3
反应的离子方程式表达其原理 。
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是 。
(6)本实验制备的苯甲酸的纯度为 ;据此估算本实验中苯甲酸的产率最接近于 (填标号)。
A.70% B.60% C.50% D.40%
(7)若要得到纯度更高的苯甲酸,可通过在水中 的方法提纯。
4 / 7
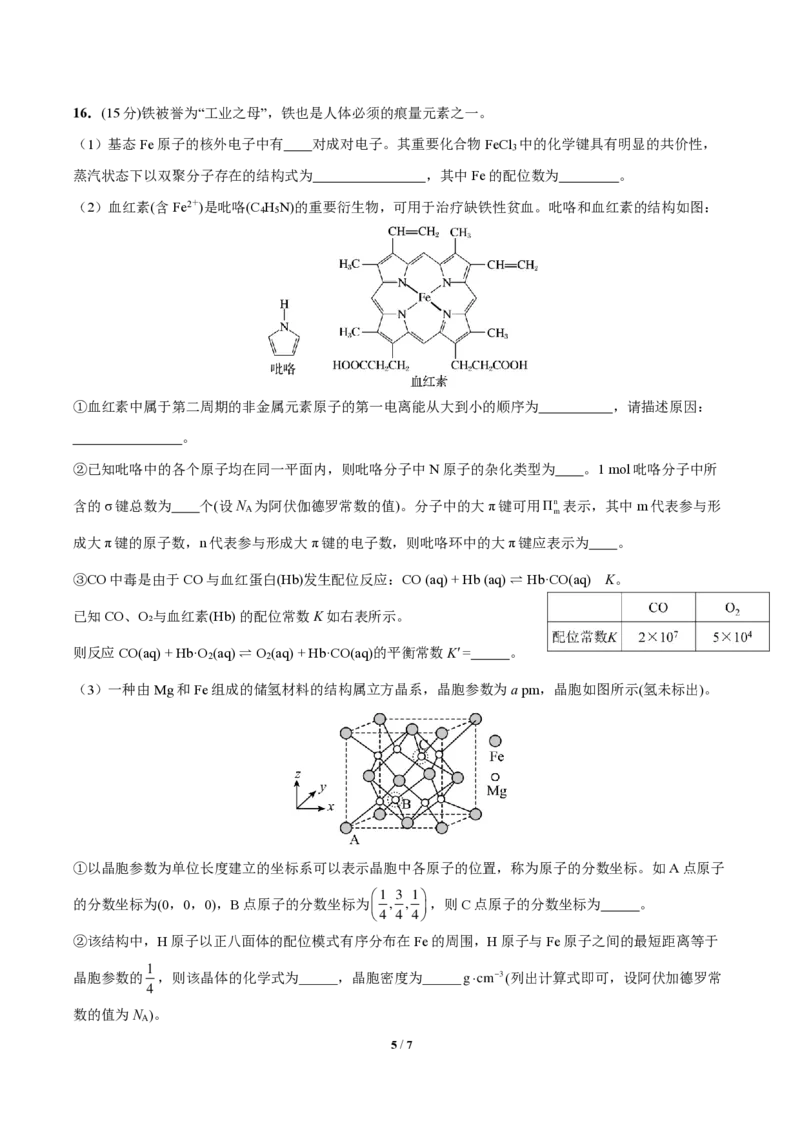
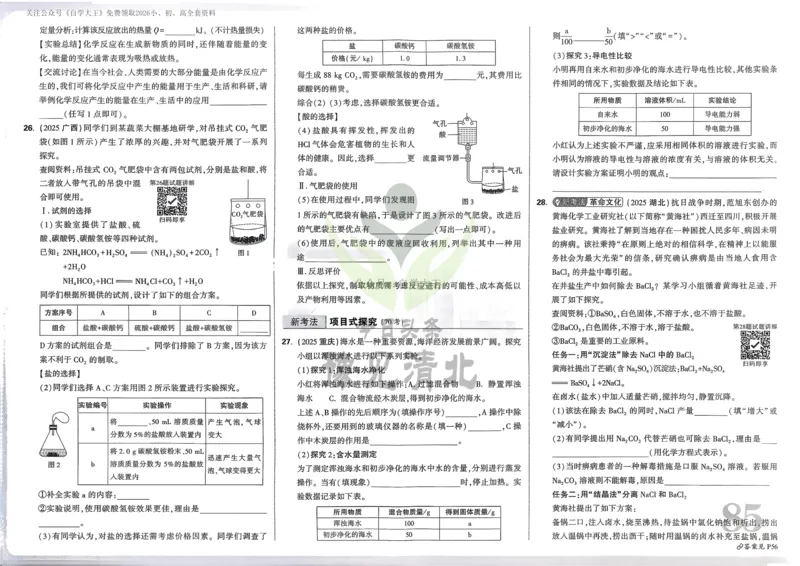
{#{QQABCQCUggAgAIJAAAgCQw2gCEIQkBACCQgGxAAMIAABgQNABAA=}#}16.(15分)铁被誉为“工业之母”,铁也是人体必须的痕量元素之一。
(1)基态Fe原子的核外电子中有 对成对电子。其重要化合物FeCl 中的化学键具有明显的共价性,
3
蒸汽状态下以双聚分子存在的结构式为 ,其中Fe的配位数为 。
(2)血红素(含Fe2+)是吡咯(C H N)的重要衍生物,可用于治疗缺铁性贫血。吡咯和血红素的结构如图:
4 5
①血红素中属于第二周期的非金属元素原子的第一电离能从大到小的顺序为 ,请描述原因:
。
②已知吡咯中的各个原子均在同一平面内,则吡咯分子中N原子的杂化类型为 。1 mol吡咯分子中所
含的σ键总数为 个(设N 为阿伏伽德罗常数的值)。分子中的大π键可用
A
5 / 7
Π nm 表示,其中m代表参与形
成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为 。
③CO中毒是由于CO与血红蛋白(Hb)发生配位反应:CO (aq) + Hb (aq) ⇌ Hb·CO(aq) K。
已知CO、O₂与血红素(Hb) 的配位常数K如右表所示。
则反应CO(aq) + Hb·O 2 (aq) ⇌ O 2 (aq) + Hb·CO(aq)的平衡常数K' = 。
(3)一种由Mg和Fe组成的储氢材料的结构属立方晶系,晶胞参数为a pm,晶胞如图所示(氢未标出)。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。如A点原子
1 3 1
的分数坐标为(0,0,0),B点原子的分数坐标为 , , ,则C点原子的分数坐标为 。
4 4 4
②该结构中,H原子以正八面体的配位模式有序分布在Fe的周围,H原子与Fe原子之间的最短距离等于
1
晶胞参数的 ,则该晶体的化学式为 ,晶胞密度为 gcm−3(列出计算式即可,设阿伏加德罗常
4
数的值为N )。
A
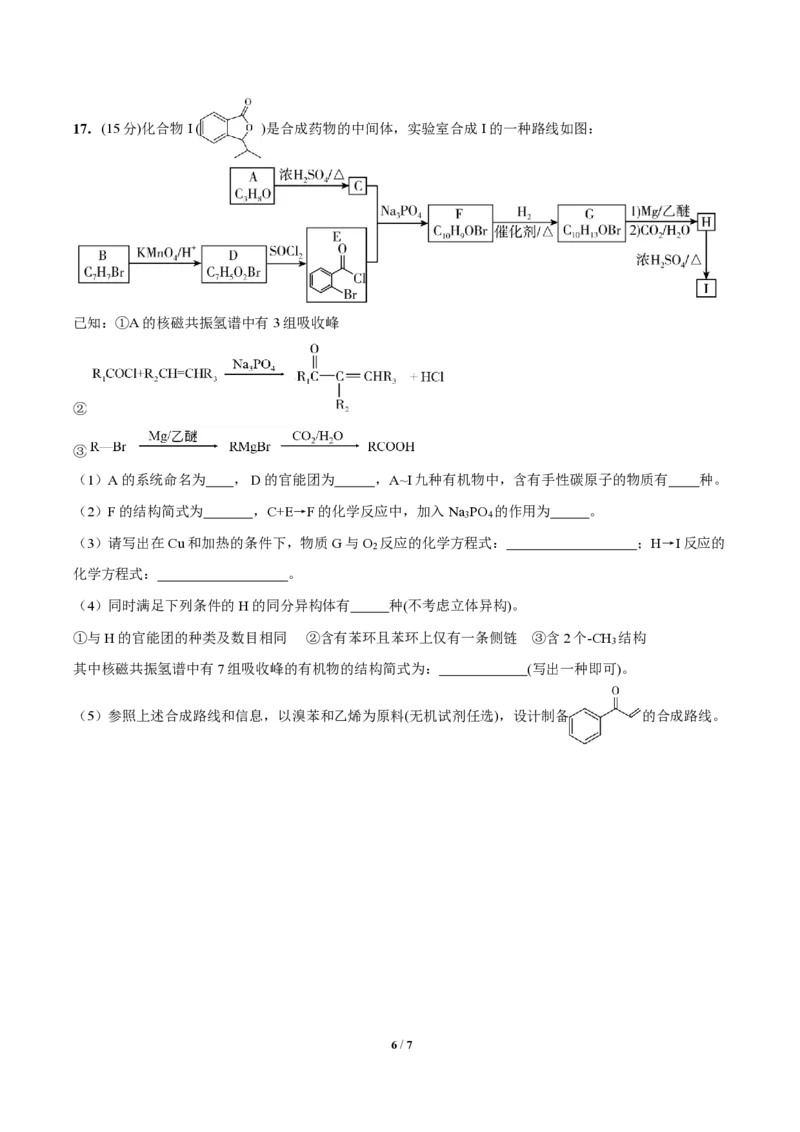
{#{QQABCQCUggAgAIJAAAgCQw2gCEIQkBACCQgGxAAMIAABgQNABAA=}#}17.(15分)化合物I ( )是合成药物的中间体,实验室合成I的一种路线如图:
已知:①A的核磁共振氢谱中有3组吸收峰
②
③
(1)A的系统命名为 , D的官能团为 ,A⁓I九种有机物中,含有手性碳原子的物质有 种。
(2)F的结构简式为 ,C+E→F的化学反应中,加入Na PO 的作用为 。
3 4
(3)请写出在Cu和加热的条件下,物质G与O 反应的化学方程式: ;H→I反应的
2
化学方程式: 。
(4)同时满足下列条件的H的同分异构体有 种(不考虑立体异构)。
①与H的官能团的种类及数目相同 ②含有苯环且苯环上仅有一条侧链 ③含2个-CH 结构
3
其中核磁共振氢谱中有7组吸收峰的有机物的结构简式为: (写出一种即可)。
(5)参照上述合成路线和信息,以溴苯和乙烯为原料(无机试剂任选),设计制备 的合成路线。
6 / 7
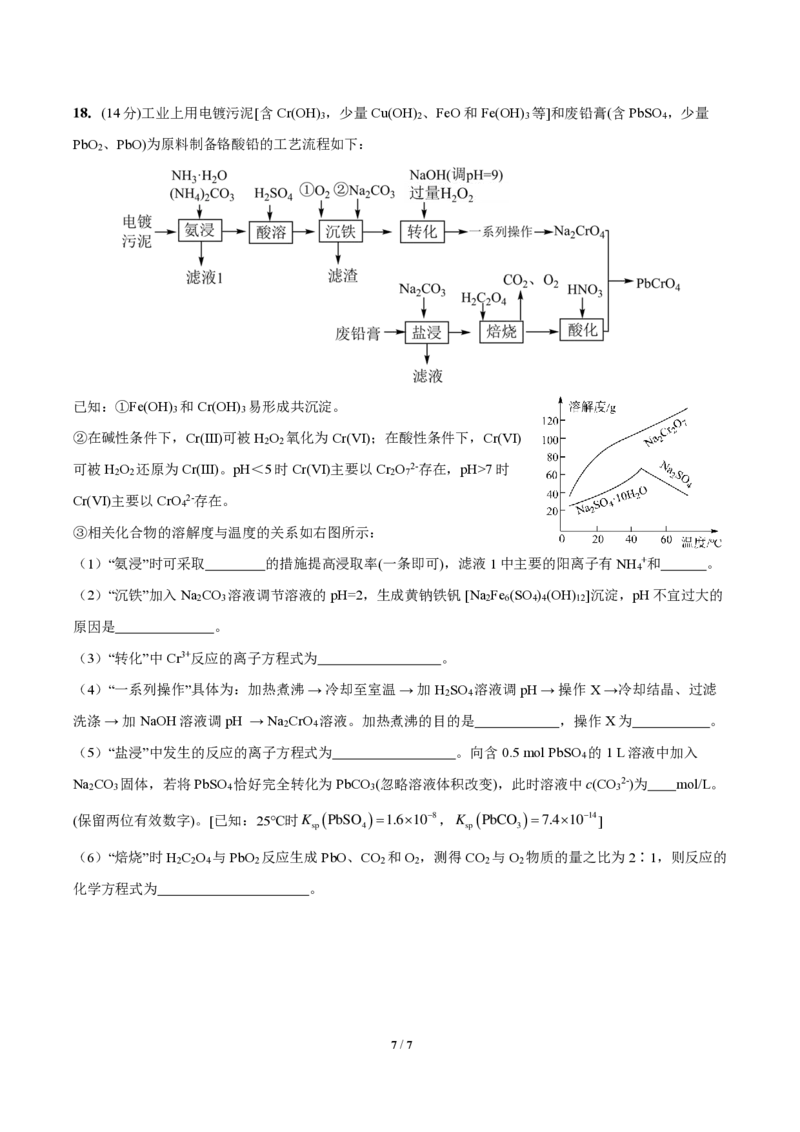
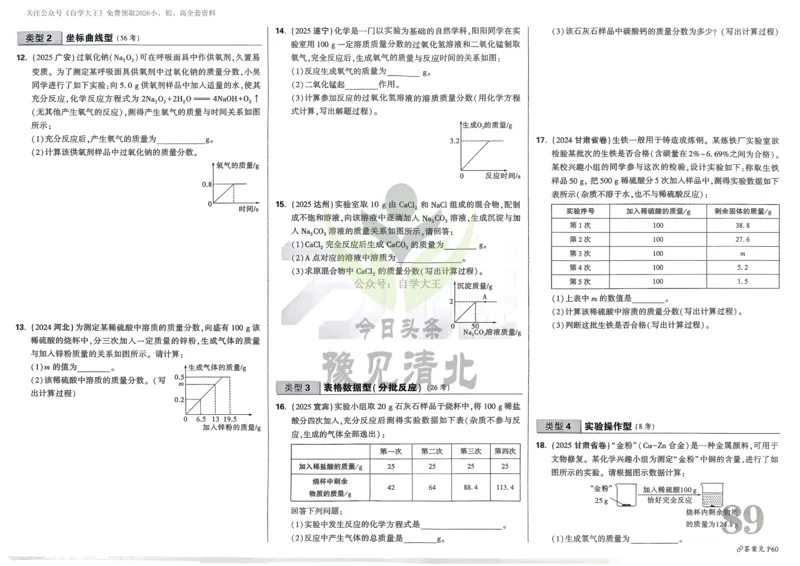
{#{QQABCQCUggAgAIJAAAgCQw2gCEIQkBACCQgGxAAMIAABgQNABAA=}#}18.(14分)工业上用电镀污泥[含Cr(OH) ,少量Cu(OH) 、FeO和Fe(OH) 等]和废铅膏(含PbSO ,少量
3 2 3 4
PbO 、PbO)为原料制备铬酸铅的工艺流程如下:
2
已知:①Fe(OH) 和Cr(OH) 易形成共沉淀。
3 3
②在碱性条件下,Cr(Ⅲ)可被H O 氧化为Cr(Ⅵ);在酸性条件下,Cr(Ⅵ)
2 2
可被H O 还原为Cr(Ⅲ)。pH<5时Cr(Ⅵ)主要以Cr O 2-存在,pH>7时
2 2 2 7
Cr(Ⅵ)主要以CrO 2-存在。
4
③相关化合物的溶解度与温度的关系如右图所示:
(1)“氨浸”时可采取 的措施提高浸取率(一条即可),滤液1中主要的阳离子有NH +和 。
4
(2)“沉铁”加入Na CO 溶液调节溶液的pH=2,生成黄钠铁钒 [Na Fe (SO ) (OH) ]沉淀,pH不宜过大的
2 3 2 6 4 4 12
原因是 。
(3)“转化”中Cr3+反应的离子方程式为 。
(4)“一系列操作”具体为:加热煮沸 → 冷却至室温 → 加H SO 溶液调pH → 操作X →冷却结晶、过滤
2 4
洗涤 → 加NaOH溶液调pH → Na CrO 溶液。加热煮沸的目的是 ,操作X为 。
2 4
(5)“盐浸”中发生的反应的离子方程式为 。向含0.5 mol PbSO 的1 L溶液中加入
4
Na CO 固体,若将PbSO 恰好完全转化为PbCO (忽略溶液体积改变),此时溶液中c(CO 2-)为 mol/L。
2 3 4 3 3
(保留两位有效数字)。[已知:25℃时K (PbSO )=1.610−8,K (PbCO )=7.410−14]
sp 4 sp 3
(6)“焙烧”时H C O 与PbO 反应生成PbO、CO 和O ,测得CO 与O 物质的量之比为2∶1,则反应的
2 2 4 2 2 2 2 2
化学方程式为 。
7 / 7
{#{QQABCQCUggAgAIJAAAgCQw2gCEIQkBACCQgGxAAMIAABgQNABAA=}#}