文档内容
2023 学年第二学期高二化学学科测试卷(五)
本试题卷分选择题和非选择题两部分,满分100分,考试时间90分钟。
命题 钟利娟 审题 郝玲巧
可能用到的相对原子质量:
H1C12N14O16Na23Mg24Al27Si28S32Cl35.5K39Ca40Mn55Fe56Cu64Zn65I127Ba137
第Ⅰ卷
一、单项选择题:共16题,每题3分,共48分。每题只有一个选项最符合题意。
1.下列含有离子键的食品添加剂是
A.CH COOH B.SO C.ZnSO D.C H O (葡萄糖)
3 2 4 6 12 6
2.下列化学用语正确的是
❑ Ti
22
A.基态 原子的轨道表示式:
H σ
2
B.用电子云轮廓图表示 中的 键形成的示意图:
C.CO2−的空间结构为三角锥形
3
D.2-甲基-1-丁醇的键线式:
3.SO 常用作葡萄酒添加剂,可有效抑制霉菌的繁殖。下列说法不正确的是
2
A.常温下,SO 饱和溶液的pH小于5.6
2
B.SO 具有漂白性,将SO 的水溶液滴到蓝色石蕊试纸上,试纸先变红后褪色
2 2
C.可用酸性高锰酸钾溶液来测定空气中SO 的含量,利用了SO 的还原性
2 2
D.SO 通入足量Ba(NO ) 溶液中可生成不溶于盐酸的白色沉淀
2 3 2
4.下列物质的结构或性质不能解释其用途的是
选项 结构或性质 用途
A 植物油可加氢硬化 植物油可制肥皂
B Al3+水解生成Al(OH) 胶体 明矾可作净水剂
3
C 碳酸氢铵、碳酸氢钠易分解产生气体 碳酸氢铵、碳酸氢钠可作食品膨松剂
D 聚丙烯酸钠中含有亲水基团 聚丙烯酸钠可作高分子吸水材料
5.FeS 与C按一定比例,在有限量的空气中缓慢燃烧,结果可得到硫磺,过程为:
2
3FeS +12C+8O =Fe O +12CO+6S。下列有关说法不正确的是
2 2 3 4
A.FeS 晶体中存在非极性共价键 B.当有6molC参加反应时,共转移16mol电子
2
C.Fe O 既是氧化产物又是还原产物 D.当有3molS生成时,有4molO 被焦炭还原
3 4 2
6.下列分子或离子能和指定分散系稳定大量共存的一组是
A.银氨溶液:Na+ 、K+ 、H+ 、NH+ B.硫酸溶液:Al3+ 、Fe2+ 、NH+ 、I−
4 4
C.Fe(OH) 胶体:NH+ 、K+ 、S2−、Br− D.KMnO 溶液:H+ 、Na+ 、SO2−、葡萄糖
3 4 4 4
7.N 为阿伏加德罗常数的值,下列说法正确的是
A
A.1mo1Na[Au(CN) ]中含σ键数目为6N
2 A
B.标准状况下,22.4LCH 和44.8LCl 在光照下充分反应后的分子数为3N
4 2 A
第 1 页
学科网(北京)股份有限公司C.2L1.0mo1⋅L−1AlCl 溶液中,Al3+的数目为2N
3 A
D.电解精炼粗铜时,阳极质量减少6.4g,外电路中通过电子的数目为0.2N
A
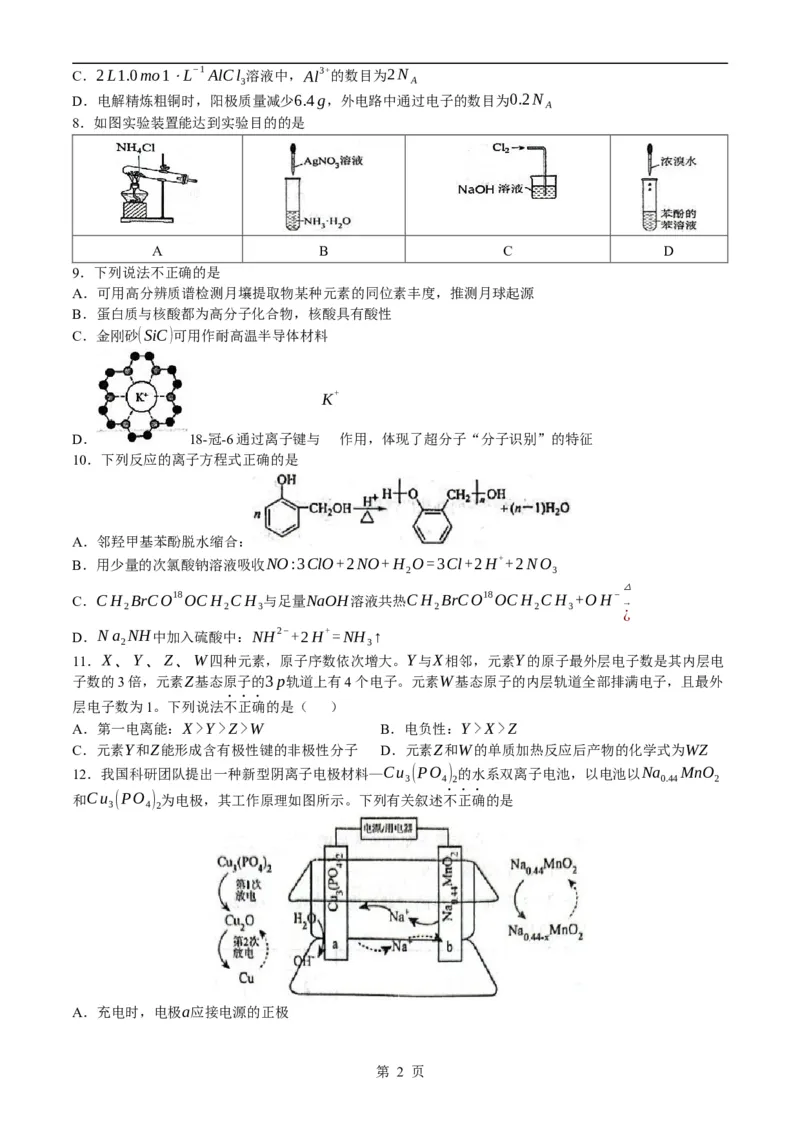
8.如图实验装置能达到实验目的的是
A B C D
9.下列说法不正确的是
A.可用高分辨质谱检测月壤提取物某种元素的同位素丰度,推测月球起源
B.蛋白质与核酸都为高分子化合物,核酸具有酸性
C.金刚砂(SiC)可用作耐高温半导体材料
K+
D. 18-冠-6通过离子键与 作用,体现了超分子“分子识别”的特征
10.下列反应的离子方程式正确的是
A.邻羟甲基苯酚脱水缩合:
B.用少量的次氯酸钠溶液吸收NO:3ClO+2NO+H O=3Cl+2H++2NO
2 3
△
C.CH
2
BrCO18OCH
2
CH
3
与足量NaOH溶液共热CH
2
BrCO18OCH
2
CH
3
+OH−
→
¿
D.Na NH中加入硫酸中:NH2−+2H+=NH ↑
2 3
11.X、Y、Z、W四种元素,原子序数依次增大。Y与X相邻,元素Y的原子最外层电子数是其内层电
子数的3倍,元素Z基态原子的3p轨道上有4个电子。元素W基态原子的内层轨道全部排满电子,且最外
层电子数为1。下列说法不正确的是( )
A.第一电离能:X>Y>Z>W B.电负性:Y>X>Z
C.元素Y和Z能形成含有极性键的非极性分子 D.元素Z和W的单质加热反应后产物的化学式为WZ
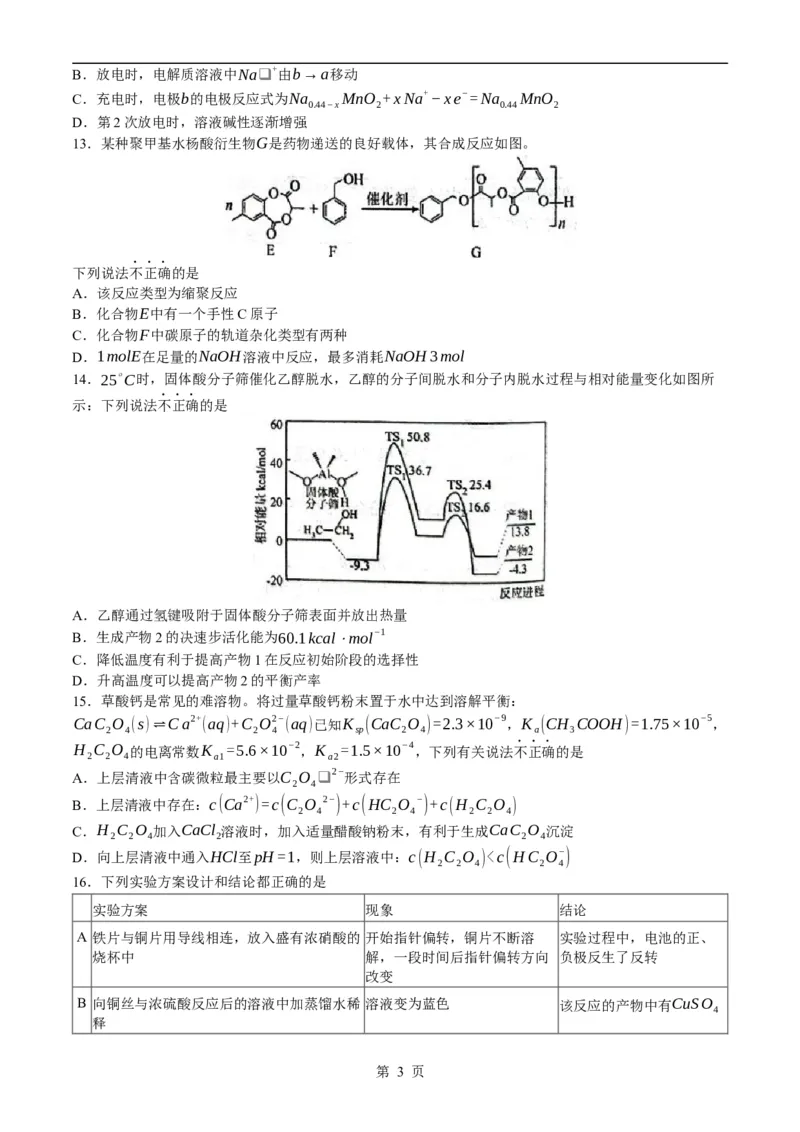
12.我国科研团队提出一种新型阴离子电极材料—Cu (PO ) 的水系双离子电池,以电池以Na MnO
3 4 2 0.44 2
和Cu (PO ) 为电极,其工作原理如图所示。下列有关叙述不正确的是
3 4 2
A.充电时,电极a应接电源的正极
第 2 页
学科网(北京)股份有限公司B.放电时,电解质溶液中Na❑ +由b→a移动
C.充电时,电极b的电极反应式为Na MnO +xNa+−xe−=Na MnO
0.44−x 2 0.44 2
D.第2次放电时,溶液碱性逐渐增强
13.某种聚甲基水杨酸衍生物G是药物递送的良好载体,其合成反应如图。
下列说法不正确的是
A.该反应类型为缩聚反应
B.化合物E中有一个手性C原子
C.化合物F中碳原子的轨道杂化类型有两种
D.1molE在足量的NaOH溶液中反应,最多消耗NaOH3mol
14.25∘C时,固体酸分子筛催化乙醇脱水,乙醇的分子间脱水和分子内脱水过程与相对能量变化如图所
示:下列说法不正确的是
A.乙醇通过氢键吸附于固体酸分子筛表面并放出热量
B.生成产物2的决速步活化能为60.1kcal⋅mol−1
C.降低温度有利于提高产物1在反应初始阶段的选择性
D.升高温度可以提高产物2的平衡产率
15.草酸钙是常见的难溶物。将过量草酸钙粉末置于水中达到溶解平衡:
CaC O (s)⇌Ca2+ (aq)+C O2−(aq)已知K (CaC O )=2.3×10−9 ,K (CH COOH)=1.75×10−5 ,
2 4 2 4 sp 2 4 a 3
H C O 的电离常数K =5.6×10−2 ,K =1.5×10−4 ,下列有关说法不正确的是
2 2 4 a1 a2
A.上层清液中含碳微粒最主要以C O ❑ 2−形式存在
2 4
B.上层清液中存在:c(Ca2+)=c(C O 2−)+c(HC O −)+c(H C O )
2 4 2 4 2 2 4
C.H C O 加入CaCl 溶液时,加入适量醋酸钠粉末,有利于生成CaC O 沉淀
2 2 4 2 2 4
D.向上层清液中通入HCl至pH=1,则上层溶液中:c(H C O )CuSO
空气中
4 4
第Ⅱ卷
二、非选择题:共5题,共52分。
17.(10分)Cr、Zn、Sn的含氧化合物、含硫化合物在工农业生产、生活和科研中有着广泛的应用。
回答下列问题:
(1)基态Sn原子简化核外电子排布式 。
(2)基态S原子的空间运动状态有 种。
Zn元素在元素周期表中属于 区(填“s”、“d”、“ds”或“p”)。
(3)下列说法正确的是 ;
A.Cr与Zn相比,第二电离能与第一电离能差值(绝对值)更大的是Cr
B.SnCl 的VSEPR模型为四面体 C.键角H S>H O
3 2 2
D.化学键中离子键成分的百分数:ZnF >ZnBr
2 2
(4)硫酸分子的结构式如图,氨基磺酸(H NSO H)是硫酸分子的一个羟基被氨基取代而形成的无机固
2 3
体酸,经测定该化合物熔、沸点明显高于相对分子质量接近的分子晶体,请解释原因
。
(5)ZnO存在多种晶体结构,其中纤锌矿型和闪锌矿型是最常见的晶体结构,如图为这两种晶体的局部
结构。
六边纤锌矿中Zn❑ 2+的配位数为 ,立方闪锌矿型中Zn❑ 2+填入O❑ 2所形成的“正四面体”空
隙中,闪锌矿晶胞中含有 个“正四面体”空隙。
18.(10分)氯及其部分化合物相关转化如图:
第 4 页
学科网(北京)股份有限公司请回答:
(1)化合物C的分子为S Cl ,各原子最外层均达8电子稳定结构,C与水反应有沉淀和无色刺激性气体
2 2
产生,写出C与水反应的化学反应方程式: 。
(2)下列有关流程中的说法正确的是 。
A.工业上采用软锰矿(主要成分是MnO )与浓盐酸混合加热制备Cl
2 2
B.步骤④中以惰性电极电解制备NaClO 时,另一电极上产生H
4 2
C.混合物A、B的物质的量之比可以是1:5
D.和1.2-二氯乙烯相似,N Cl 分子也存在顺反异构
2 2
NaClO HClO HClO
4 4 4
(3) 与浓硫酸反应可得 ( ); 在液态时存在八元环状结构的双聚体,请
画出环状(HClO ) 的结构式: 。
4 2
Cl
2
(4)工业上利用过量的氨气、 、和乙醛进行气相反应合成异肼 然后使其水解得到肼
(N H ):理论上生成1mol的肼需要消耗Cl mol。
2 4 2
比较相同温度下,同浓度的N H Cl溶液和N H Cl 溶液的pH大小,N H Cl N H Cl 。
2 5 2 6 2 2 5 2 6 2
(填大于、小于、等于或不能确定)
(5)设计实验证明N H 的碱性比N H 强 。
3 2 4
19.(10分)低碳烯烃(乙烯、丙烯等)作为化学工业重要基本有机化工原料,在现代石油和化学工业中
起着举足轻重的作用。碘甲烷(CH I)热裂解制低碳烯烃的主要反应有:
3
反应Ⅰ 2CH I(g)⇌C H (g)+2HI(g)ΔH
3 2 4 1
反应Ⅱ 3C H (g)⇌2C H (g)ΔH
2 4 3 6 2
反应Ⅲ 2C H (g)⇌C H (g)ΔH
2 4 4 8 3
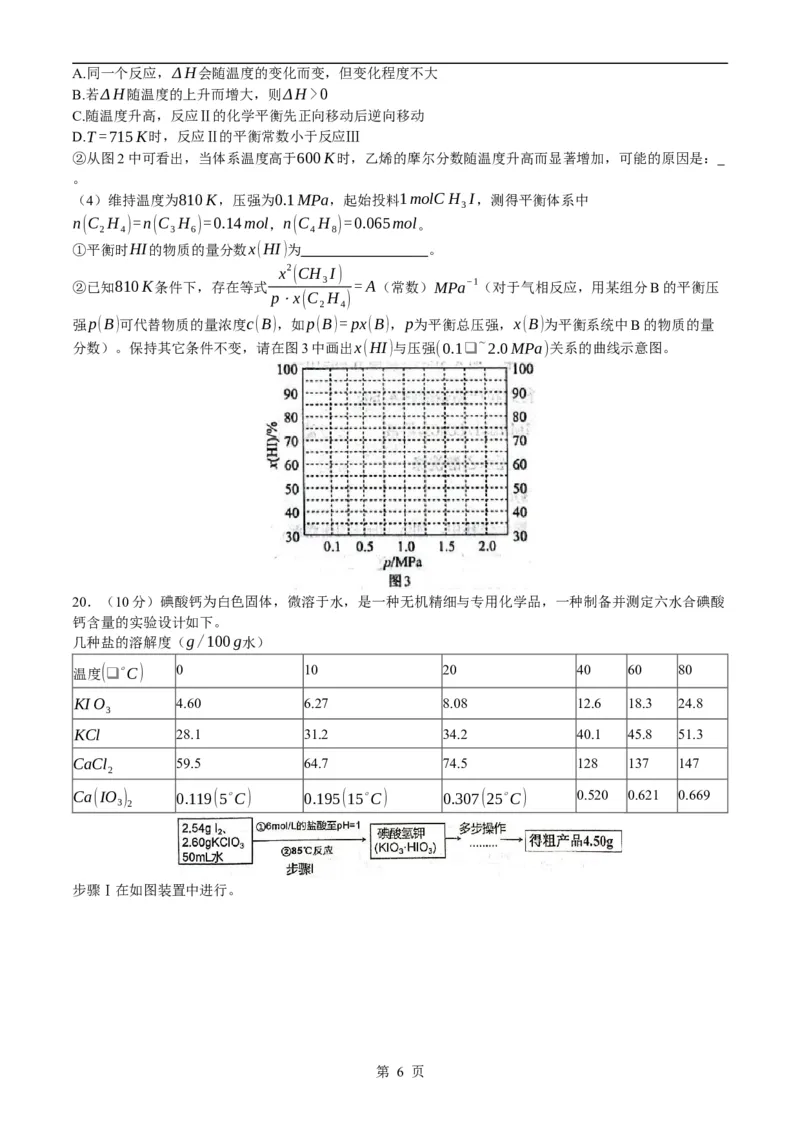
(1)反应Ⅰ、Ⅱ、Ⅲ的ΔH随温度的变化如图1所示。298K下,ΔH = kJ⋅mol−1。
1
(2)针对反应Ⅰ,既能加快反应速率又能提高碘甲烷的平衡转化率的条件有 。
A.高压 B.高温 C.移去HI D.催化剂
(3)利用计算机模拟反应过程。一定压强条件下,测定反应温度对碘甲烷热裂解制低碳烯烃平衡体系中
乙烯、丙烯和丁烯组成的影响如图2所示。结合图1、图2,回答下列问题:
①下列有关说法正确的是 。
第 5 页
学科网(北京)股份有限公司A.同一个反应,ΔH会随温度的变化而变,但变化程度不大
B.若ΔH随温度的上升而增大,则ΔH>0
C.随温度升高,反应Ⅱ的化学平衡先正向移动后逆向移动
D.T=715K时,反应Ⅱ的平衡常数小于反应Ⅲ
②从图2中可看出,当体系温度高于600K时,乙烯的摩尔分数随温度升高而显著增加,可能的原因是:
。
(4)维持温度为810K,压强为0.1MPa,起始投料1molCH I,测得平衡体系中
3
n(C H )=n(C H )=0.14mol,n(C H )=0.065mol。
2 4 3 6 4 8
①平衡时HI的物质的量分数x(HI)为 。
x2 (CH I)
②已知810K条件下,存在等式 3 =A(常数)MPa−1(对于气相反应,用某组分B的平衡压
p⋅x(C H )
2 4
强p(B)可代替物质的量浓度c(B),如p(B)=px(B),p为平衡总压强,x(B)为平衡系统中B的物质的量
分数)。保持其它条件不变,请在图3中画出x(HI)与压强(0.1❑∼2.0MPa)关系的曲线示意图。
20.(10分)碘酸钙为白色固体,微溶于水,是一种无机精细与专用化学品,一种制备并测定六水合碘酸
钙含量的实验设计如下。
几种盐的溶解度(g/100g水)
温度(❑∘C) 0 10 20 40 60 80
KIO 4.60 6.27 8.08 12.6 18.3 24.8
3
KCl 28.1 31.2 34.2 40.1 45.8 51.3
CaCl 59.5 64.7 74.5 128 137 147
2
Ca(IO ) 0.119(5∘C) 0.195(15∘C) 0.307(25∘C) 0.520 0.621 0.669
3 2
步骤Ⅰ在如图装置中进行。
第 6 页
学科网(北京)股份有限公司(1)写仪器d的名称 。
步骤Ⅰ中有黄绿色气体产生,则制备KIO ⋅HIO ;反应的化学方程式为 。
3 3
(2)下列说法正确的是 。
A.步骤Ⅰ中滴加盐酸时,要先打开①,再打开②
B.冷凝水从a口进,b口出
C.d中可以装无水CaCl
2
D.步骤Ⅰ中测pH的操作:将③打开,用洁净的玻璃棒蘸取少量反应液,滴在pH试纸中间,再和比色卡比
色,读数
(3)步骤Ⅰ中控制温度85∘C左右的原因是 。
多步操作有以下步骤,请选择合适的操作并排序完成实验 。
将步骤Ⅰ反应后的溶液转入烧杯中,加入KOH溶液调节pH=10→()→()→()→()→()→干燥得到粗
产品碘酸钙4.50g
a.冰水冷却 b.滴加1mL1mol/LCaCl 溶液 c.过滤 d.用冰水洗涤
2
e.用乙醇和水混合液洗涤 f.无水乙醇洗涤
(4)产品中碘酸钙晶体含量测定
①准确称取1.200g粗产品,置于烧杯中,加入20mLHClO 溶解样品,转移到250mL容量瓶中定容。量
4
取25.00mL溶液于碘量瓶中,加入稍过量的KI,充分反应后,加入2滴淀粉溶液,然后用
0.1000mo1/lna S O 标准溶液滴定,滴定前读数为0.02ml,滴定终点读数为25.26mL。
2 2 3
②空白实验:不取产品,其余试剂用量和步骤相同,消耗0.04mLNa S O 标准溶液。
2 2 3
已知:Ca(IO ) +2HClO =2HIO +Ca(ClO ) ,IO−+5I−+6H+=3I +3H O,
3 2 4 3 4 2 3 2 2
I +2S O2−=2I−+S O2−
2 2 3 4 6
碘酸钙晶体中Ca(IO ) ⋅6H O(相对分子质量为498)的纯度为 (计算结果保留两位小
3 2 2
数)。该测定实验中,少了一个很关键的步骤是
。
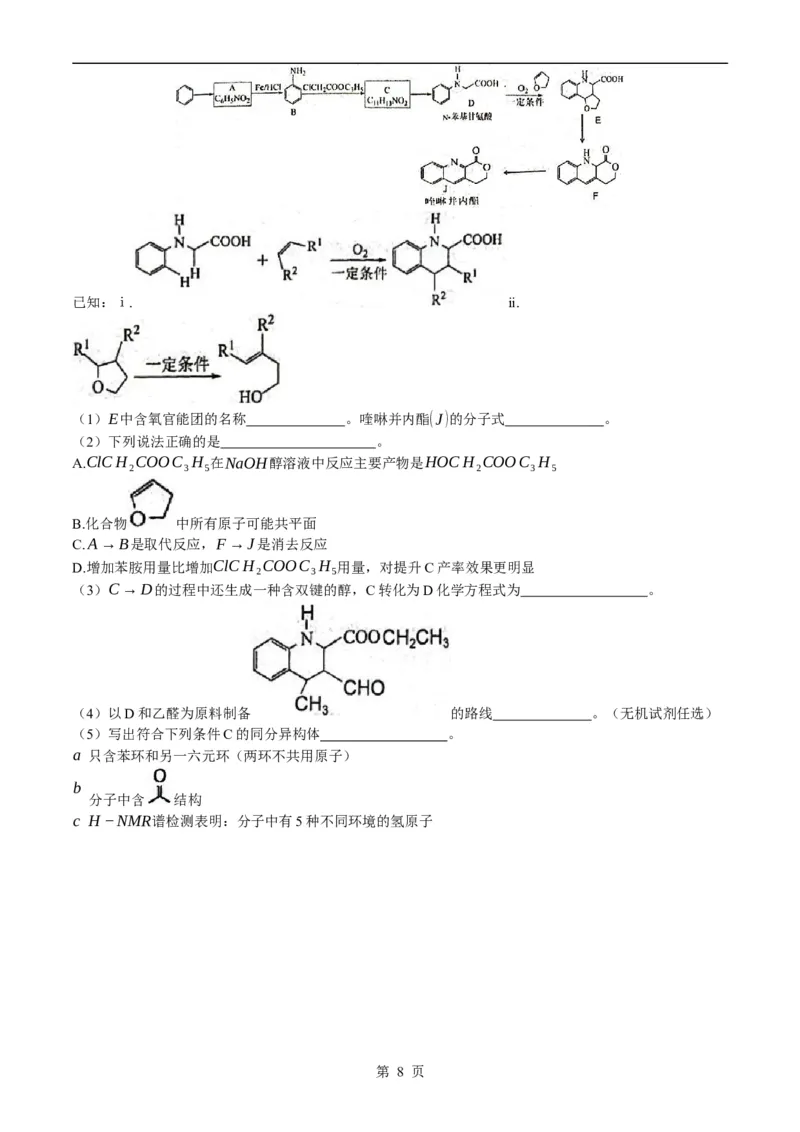
21.(10分)某研究小组按如图路线实现了喹啉并内酯(J)的高选择性制备,合成路线如图。
第 7 页
学科网(北京)股份有限公司已知:ⅰ. ⅱ.
(1)E中含氧官能团的名称 。喹啉并内酯(J)的分子式 。
(2)下列说法正确的是 。
A.ClCH COOC H 在NaOH醇溶液中反应主要产物是HOCH COOC H
2 3 5 2 3 5
B.化合物 中所有原子可能共平面
C.A→B是取代反应,F→J是消去反应
D.增加苯胺用量比增加ClCH COOC H 用量,对提升C产率效果更明显
2 3 5
(3)C→D的过程中还生成一种含双键的醇,C转化为D化学方程式为 。
(4)以D和乙醛为原料制备 的路线 。(无机试剂任选)
(5)写出符合下列条件C的同分异构体 。
a 只含苯环和另一六元环(两环不共用原子)
b
分子中含 结构
c H−NMR谱检测表明:分子中有5种不同环境的氢原子
第 8 页
学科网(北京)股份有限公司