文档内容
第一节 硫及其化合物--2022-2023学年吕梁市贺昌中学高中
化学课时训练
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.盛放浓硫酸的试剂瓶贴图中最合适的标志是
A. B. C. D.
2.下列物质中,S元素的化合价最高的是
A. B. C. D.
3.下列实验对应的实验现象错误的是
选
实验 含氯物质 试剂a 现象
项
FeCl 溶
A 2 KMnO 溶液 紫红色退去
液 4
NaHCO 溶
B 新制氯水 3 产生无色气体
液
C 84消毒液 NaSO 溶液 产生刺激性气味气体
2 3
产生刺激性气味气体和淡黄色
D 稀盐酸 NaSO 溶液
2 2 3 浑浊
A.A B.B C.C D.D
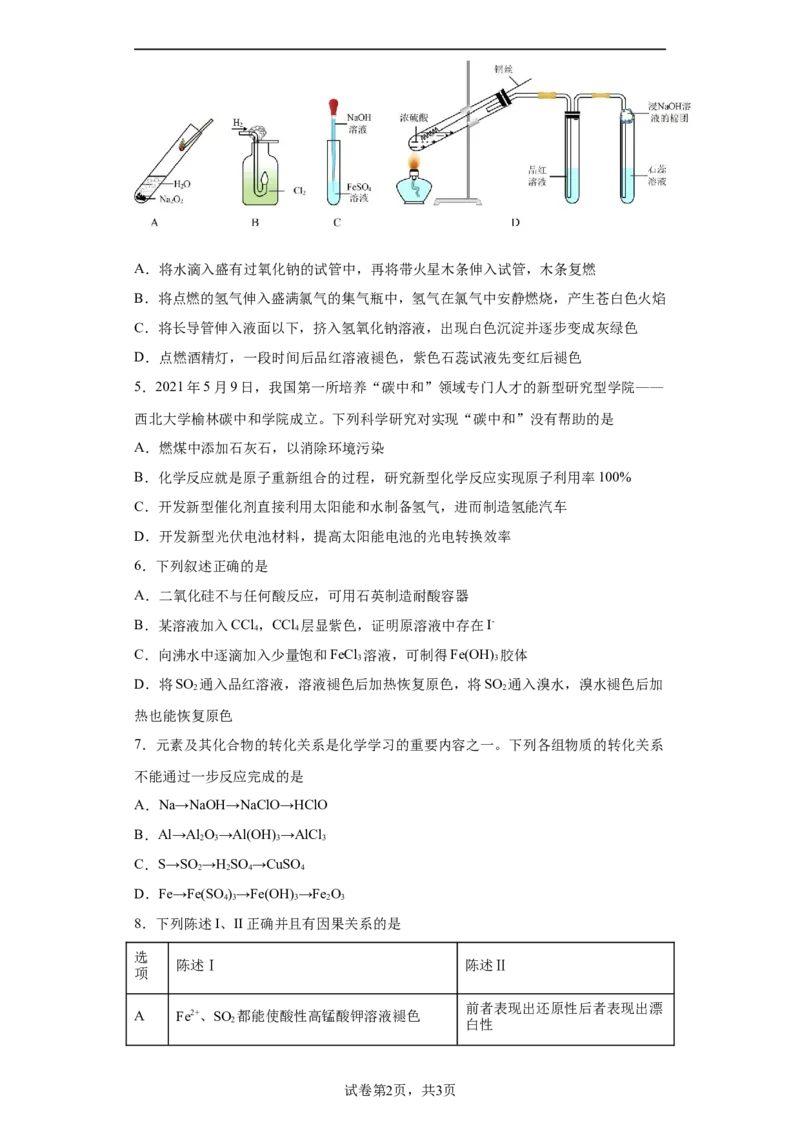
4.下列操作或对应的现象描述不正确的是A.将水滴入盛有过氧化钠的试管中,再将带火星木条伸入试管,木条复燃
B.将点燃的氢气伸入盛满氯气的集气瓶中,氢气在氯气中安静燃烧,产生苍白色火焰
C.将长导管伸入液面以下,挤入氢氧化钠溶液,出现白色沉淀并逐步变成灰绿色
D.点燃酒精灯,一段时间后品红溶液褪色,紫色石蕊试液先变红后褪色
5.2021年5月9日,我国第一所培养“碳中和”领域专门人才的新型研究型学院——
西北大学榆林碳中和学院成立。下列科学研究对实现“碳中和”没有帮助的是
A.燃煤中添加石灰石,以消除环境污染
B.化学反应就是原子重新组合的过程,研究新型化学反应实现原子利用率100%
C.开发新型催化剂直接利用太阳能和水制备氢气,进而制造氢能汽车
D.开发新型光伏电池材料,提高太阳能电池的光电转换效率
6.下列叙述正确的是
A.二氧化硅不与任何酸反应,可用石英制造耐酸容器
B.某溶液加入CCl ,CCl 层显紫色,证明原溶液中存在I-
4 4
C.向沸水中逐滴加入少量饱和FeCl 溶液,可制得Fe(OH) 胶体
3 3
D.将SO 通入品红溶液,溶液褪色后加热恢复原色,将SO 通入溴水,溴水褪色后加
2 2
热也能恢复原色
7.元素及其化合物的转化关系是化学学习的重要内容之一。下列各组物质的转化关系
不能通过一步反应完成的是
A.Na→NaOH→NaClO→HClO
B.Al→Al O→Al(OH) →AlCl
2 3 3 3
C.S→SO →HSO →CuSO
2 2 4 4
D.Fe→Fe(SO )→Fe(OH) →Fe O
4 3 3 2 3
8.下列陈述I、II正确并且有因果关系的是
选
陈述Ⅰ 陈述Ⅱ
项
前者表现出还原性后者表现出漂
A Fe2+、SO 都能使酸性高锰酸钾溶液褪色
2 白性
试卷第2页,共3页B 纯银器表面在空气中渐渐变暗 发生了化学腐蚀
C SO 能与次氯酸及碱反应 SO 是两性氧化物
2 2
BaSO 饱和溶液中加入饱和NaCO 溶液有白 说明Ksp(BaSO )大于
D 4 2 3 4
色沉淀 Ksp(BaCO )
3
A.A B.B C.C D.D
9.一定条件下,下列各组物质能一步实现如图转化关系的是
选项 X Y Z W
A Al Al O NaAlO Al(OH)
2 3 2 3
B Fe O Fe FeCl FeCl
3 4 2 3
C HSO SO S SO
2 4 2 3
D NH N NO NO
3 2 2
A.A B.B C.C D.D
10.下列有关硫及其化合物的说法中正确的是
A.浓硫酸与灼热的炭反应,体现了浓硫酸的强氧化性和酸性
B.浓硫酸具有吸水性,可做干燥剂,不能干燥 NH 、 HS等气体
3 2
C.SO 和 Cl 均可使品红溶液褪色,但将溶有 SO 的品红溶液加热后又恢复红色,
2 2 2
说明 SO 的氧化性没有 Cl 强
2 2
D.以 FeS和稀硫酸反应制HS气体为氧化还原反应
2
11.如图是某元素的价类二维图。其中A是一种酸式盐,E的相对分子质量比D的相
对分子质量大16,当x为一种强酸时,有如下转化关系。下列说法不正确的是
A.物质A、B、C、D、E、F中均含有硫元素
B.物质D可以使石蕊溶液先变红后褪色C.物质C可在纯氧中燃烧,火焰呈蓝紫色
D.物质F的浓溶液可以用铁制容器盛放
12.1912年E.Beckmann冰点降低法获得了黄色的正交α—型硫元素的一种同素异形
体S 分子。1891年,M.R.Engel首次制得了一种菱形的ε—硫,后来证明含有S 分
8 6
子。下列说法正确的是( )
A.S 和S 分子分别与铜粉反应,所得产物可能均为CuS
6 8
B.推测NaS 可能是一种复合分子材料
2 8
C.S 和S 分子分别与过量的氧气反应可以得到SO
6 8 3
D.等质量的S 和S 分子分别与足量的KOH反应,消耗KOH的物质的量相同
6 8
二、填空题
13.某研究小组探究SO 和 溶液的反应。
2
请回答:
(1)装置A中反应的化学方程式是_______。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是_______。
(3)装置B中产生了白色沉淀,其成分是_______,说明SO 具有_______性。
2
(4)SO 易被 氧化,写出装置B中反应的离子方程式_______。证明该反应发生需进
2
一步确认生成的新物质,其实验操作及现象是_______。
14.完成下列问题
(1)①液态氧 ②硝酸钾溶液 ③胆矾晶体④干冰 ⑤生石灰 ⑥金刚石 ⑦纯碱
⑧甲烷 ⑨熟石灰⑩食盐水 石灰水 KClO HSO 碱式碳酸铜
3 2 4
[Cu (OH) CO] 硫酸氢钠。⑪其中属于混⑫合物的有___⑬____,属于正⑭盐的是_______;
2 2 3
⑮
试卷第4页,共3页属于酸的有_______,属于碱的是_______;属于氧化物的是_______;属于单质的是
_______。
(2)用洁净的烧杯取25 mL蒸馏水,加热至沸腾,向烧杯中逐滴加入FeCl 饱和溶液,
3
加热煮沸至液体呈红褐色,停止加热,得到的分散系称为_______ ,要证明该分散系
的实验方法是_______ 。
(3)分类方法应用广泛,属于同一类的物质具有相似性,在生活和学习中,使用分类的
方法处理问题可以做到举一反三,还可以做到由此及彼的效果。
①CO、SiO、SO 、SO 都属于酸性氧化物,由CO+Ca(OH) =CaCO ↓+H O,可得出
2 2 2 3 2 2 3 2
SO 与NaOH反应的化学方程式为_______。
3
②NaHCO 、NaHSO、NaHS都属于非强酸形成的酸式盐,由
3 3
NaHCO +HCl=NaCl+H O+CO↑、NaHCO +NaOH=Na CO+H O,完成NaHS分别与
3 2 2 3 2 3 2
HCl、NaOH反应的化学方程式_______、_______。
三、实验题
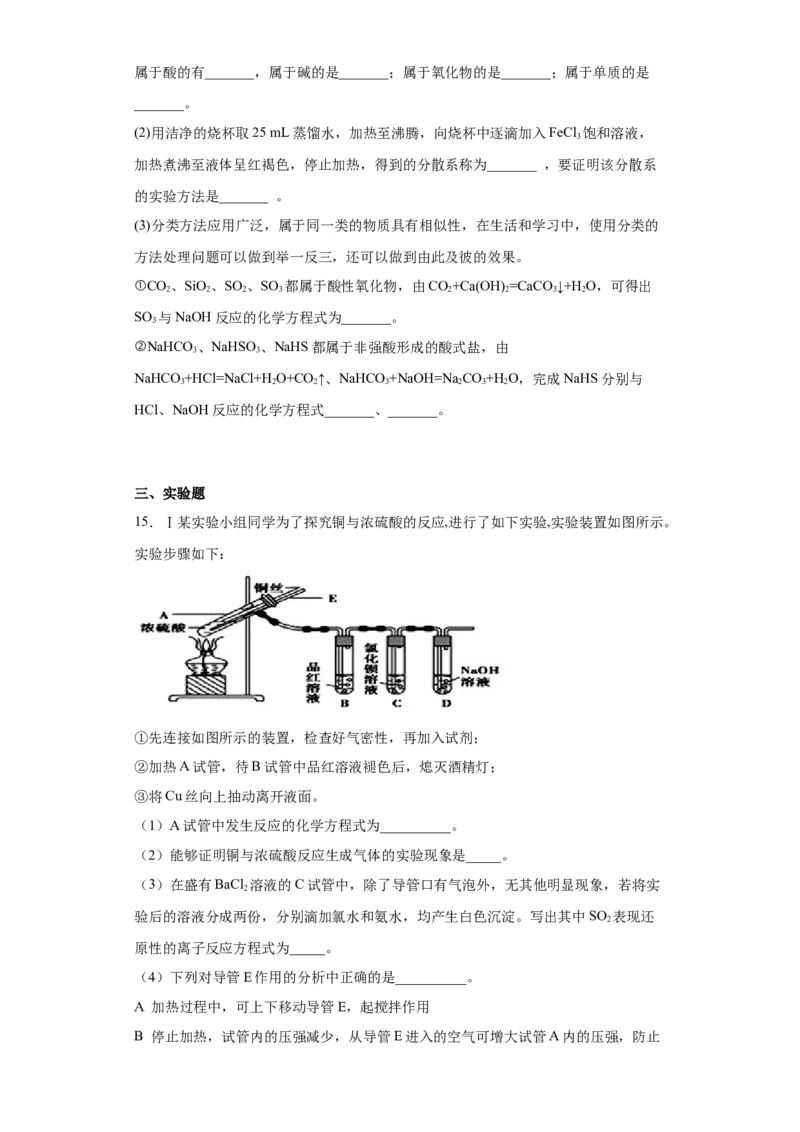
15.Ⅰ某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示。
实验步骤如下:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液褪色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面。
(1)A试管中发生反应的化学方程式为__________。
(2)能够证明铜与浓硫酸反应生成气体的实验现象是_____。
(3)在盛有BaCl 溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将实
2
验后的溶液分成两份,分别滴加氯水和氨水,均产生白色沉淀。写出其中SO 表现还
2
原性的离子反应方程式为_____。
(4)下列对导管E作用的分析中正确的是__________。
A 加热过程中,可上下移动导管E,起搅拌作用
B 停止加热,试管内的压强减少,从导管E进入的空气可增大试管A内的压强,防止倒吸
C 停止反应,撤装置之前往导管E中通入空气,可排出装置内的SO 气体,防止其污
2
染环境
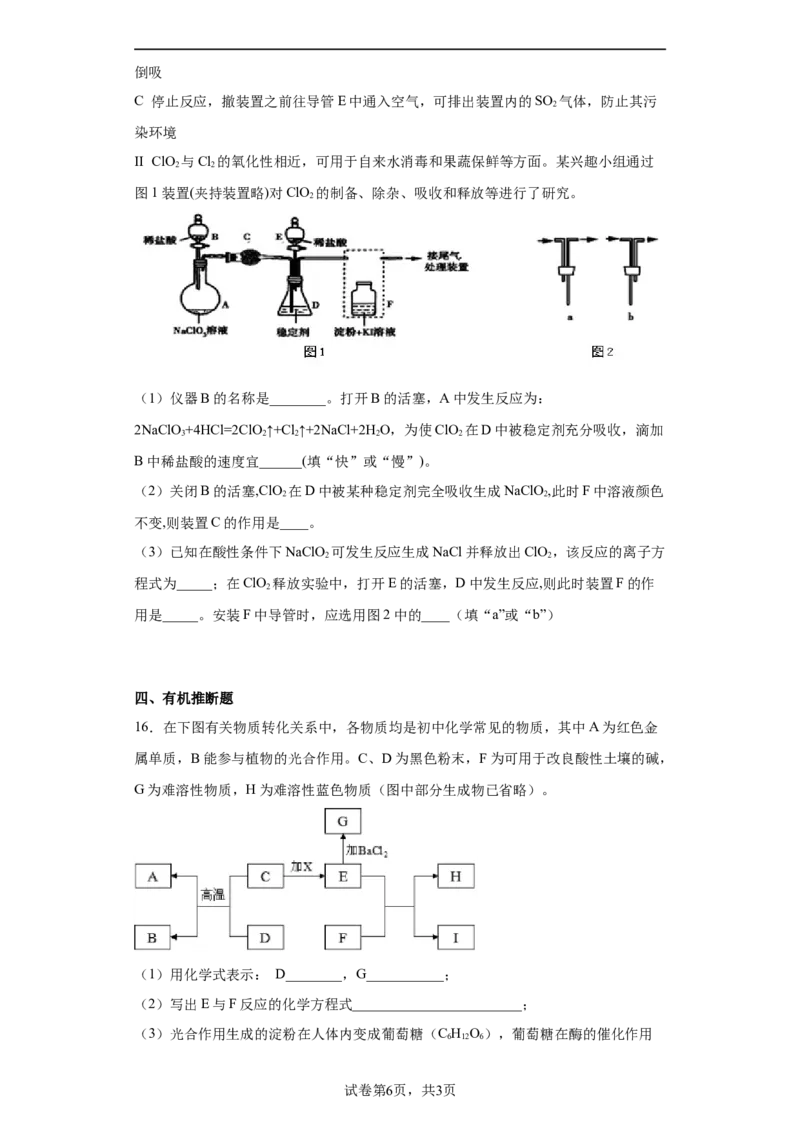
II ClO 与Cl 的氧化性相近,可用于自来水消毒和果蔬保鲜等方面。某兴趣小组通过
2 2
图1装置(夹持装置略)对ClO 的制备、除杂、吸收和释放等进行了研究。
2
(1)仪器B的名称是________。打开B的活塞,A中发生反应为:
2NaClO+4HCl=2ClO ↑+Cl↑+2NaCl+2HO,为使ClO 在D中被稳定剂充分吸收,滴加
3 2 2 2 2
B中稀盐酸的速度宜______(填“快”或“慢”)。
(2)关闭B的活塞,ClO 在D中被某种稳定剂完全吸收生成NaClO,此时F中溶液颜色
2 2
不变,则装置C的作用是____。
(3)已知在酸性条件下NaClO 可发生反应生成NaCl并释放出ClO ,该反应的离子方
2 2
程式为_____;在ClO 释放实验中,打开E的活塞,D中发生反应,则此时装置F的作
2
用是_____。安装F中导管时,应选用图2中的____(填“a”或“b”)
四、有机推断题
16.在下图有关物质转化关系中,各物质均是初中化学常见的物质,其中A为红色金
属单质,B能参与植物的光合作用。C、D为黑色粉末,F为可用于改良酸性土壤的碱,
G为难溶性物质,H为难溶性蓝色物质(图中部分生成物已省略)。
(1)用化学式表示: D________,G___________;
(2)写出E与F反应的化学方程式________________________;
(3)光合作用生成的淀粉在人体内变成葡萄糖(C H O),葡萄糖在酶的催化作用
6 12 6
试卷第6页,共3页下发生缓慢氧化,同时放出热量,写出葡萄糖发生缓慢氧化反应的化学方程式
______________。参考答案:
1.D
【详解】浓硫酸具有强烈的腐蚀性,所以属于腐蚀性药品,合理选项是D。
2.A
【详解】A.SO 中硫元素的化合价为+6价,A符合题意;
3
B.HS中硫元素的化合价为-2价,B不符合题意;
2
C. 中硫元素的化合价为+4价,C不符合题意;
D.NaHSO 中硫元素的化合价为+4价,D不符合题意;
3
故答案为:A。
3.C
【详解】A.FeCl 具有还原性,KMnO 具有氧化性,两者发生氧化还原反应生成MnCl ,
2 4 2
KMnO 溶液的紫红色褪去,故A正确;
4
B.新制氯水含有H+,与NaHCO 溶液反应可产生二氧化碳气体,故B正确;
3
C.84消毒液有效成分为NaClO,具有强氧化性,而NaSO 具有还原性,两者反应生成
2 3
NaSO 和NaCl,无氯气生成,即不产生刺激性气味气体,故C错误;
2 4
D.NaSO 中S为+2价,处于中间价态,加入稀盐酸发生歧化反应生成S和SO ,即产生
2 2 3 2
刺激性气味气体和淡黄色浑浊,故D正确;
故选:C。
4.D
【详解】A.过氧化钠与水反应产生氧气,能使带火星木条复燃,故A正确;
B.氢气和氯气燃烧产生苍白色火焰,故B正确;
C.硫酸亚铁与NaOH反应生成白色的Fe(OH) 沉淀,后沉淀逐渐变氧化成灰绿色,故C正
2
确;
D.铜与浓硫酸在加热条件下生成SO 气体,该气体只能漂白有机色素,能使品红溶液褪
2
色,其水溶液具有酸性,只能使紫色石蕊试液变红,不能褪色,故D错误;
故选:D。
5.A
【详解】A.石灰石在高温下分解生成氧化钙,可结合煤燃烧产生的二氧化硫,对碳的排
放无影响,故A正确;
B.化学反应实现原子利用率100%,可减少副产物的排放,故B错;
C.利用太阳能和水制备氢气,再利用氢能做清洁能源,产物只含水,不排放二氧化碳,同时减少对化石能源的依赖,对“碳中和”有帮助,故C错;
D.提高光电转化效率可产生更多的电能,对“碳中和”有帮助,故D错;
答案选A。
6.C
【详解】A.二氧化硅能和HF反应,所以不能盛装氢氟酸溶液,故A错误;
B. I 的溶液呈紫色,所以某溶液加入CCl ,CCl 层显紫色,证明原溶液中存在I,故B错
2 4 4 2
误;
C.向沸水中逐滴加入少量饱和FeCl 溶液,可制得Fe(OH) 胶体,故C正确;
3 3
D.将SO 通入品红溶液,溶液褪色后加热恢复原色,因为溴水具有强氧化性,能氧化
2
SO ,所以将SO 通入溴水,溴水褪色后加热也不能恢复原色,故D错误;
2 2
故答案:C。
7.B
【详解】A Na→NaOH→NaClO→HClO中反应方程式分别为:2Na+2HO=2NaOH+H ↑、
2 2
Cl+2NaOH=NaCl+NaClO+H O、HCl+NaClO=NaCl+HClO所以能一步实现,A不符题意;
2 2
B.Al O 和水不能反应,所以不能一步生成Al(OH) ,B符合题意;
2 3 3
C.S→SO →HSO →CuSO 可以通过S SO HSO CuSO 实现各物质的一步转
2 2 4 4 2 2 4 4
化,C不符题意;
D.Fe→Fe(SO )→Fe(OH) →Fe O 中反应方程式分别为:2Fe+6H SO (浓)
4 3 3 2 3 2 4
Fe (SO )+3SO↑+6H O、Fe (SO )+6NaOH=2Fe(OH) ↓+3Na SO 、2Fe(OH)
2 4 3 2 2 2 4 3 3 2 4 3
Fe O+3H O,所以能一步实现,D不符题意。
2 3 2
答案选B。
8.B
【详解】A、二氧化硫和高锰酸钾溶液反应是利用二氧化硫的还原性,二氧化硫漂白性是
和有机色素结合为无色物质;亚铁离子和高锰酸钾溶液反应表现亚铁离子的还原性,故A
错误;
B、由于空气中存在极少量O,可将Ag氧化为AgO,表面变暗;同时,空气中有时会存
3
答案第2页,共2页在痕量HS气体,与银生成黑色AgS,表面变暗;纯银器表面在空气中因化学腐蚀渐渐变
2
暗,故B正确;
C、SO 能与次氯酸反应是次氯酸根离子的强氧化性和二氧化硫的还原性。SO 是酸性氧化
2 2
物能和碱反应,故C错误;
D、BaSO 饱和溶液中加入饱和NaCO 溶液有白色沉淀,是因为碳酸根离子浓度大,和钡
4 2 3
离子浓度乘积大于碳酸钡的Ksp,而实际上Ksp(BaSO )小于Ksp(BaCO ),故D错误;
4 3
答案选B。
9.B
【详解】A.铝与氧气反应能生成氧化铝,氧化铝能与氢氧化钠溶液反应生成偏铝酸铵,
但氧化铝不能一步转化成氢氧化铝,A错误;
B.四氧化三铁被氢气还原为铁,铁与盐酸反应生成氯化亚铁,氯化亚铁与氯气反应生成
氯化铁,氯化铁与铁反应生成氯化亚铁,而铁可以与氯气反应生成氯化铁,B正确;
C.浓硫酸与铜反应生成二氧化硫,二氧化硫与硫化氢反应生成硫单质,但硫单质不能一
步转化成三氧化硫,C错误;
D.氨气与二氧化氮反应生成氮气,氮气与氧气高温生成一氧化氮,一氧化氮与氧气反应
生成二氧化氮,二氧化氮与水反应生成一氧化氮,但氮气不能一步转化成二氧化氮,D错
误;
答案选B。
10.B
【详解】A.浓硫酸与灼热的炭反应,炭被氧化成 ,浓硫酸被还原成SO ,体现了硫酸
2
的强氧化性,但是反应产物中没有硫酸盐,因此无法体现硫酸的酸性,A项错误;
B.由于浓硫酸具有酸性和强氧化性,浓硫酸不能干燥碱性气体(如NH )和还原性气体
3
(如HS、HI等),B项正确;
2
C.二氧化硫的漂白原理与氯气的漂白原理不一样,二氧化硫漂白的原理是二氧化硫与有色
物质化合成不稳定的无色物质,因此不能根据二氧化硫的漂白是可逆的这一点来判断二者
的氧化性强弱,C项错误;
D. 中硫的化合价为-2价, 中硫的化合价也是-2价,则FeS与稀硫酸发生复分解反
应制备HS,没有元素化合价的变化,因此不是氧化还原反应,D项错误;
2
答案选B。11.B
【解析】由 E的相对分子质量比D的相对分子质量大16 ,说明E中比D中多一个氧原子,
结合图中给出的信息,可推知E为SO ,D为SO ,该元素为硫元素,F为 HSO ,C为
3 2 2 4
S,A是一种酸式盐,则A为NaHS ,B为HS。
2
【详解】A.根据以上分析可知,物质A、B、C、D、E、F中均含有硫元素,故A符合题意;
B.物质D为SO ,溶于水生成亚硫酸,能使石蕊溶液变红,不能使溶液褪色,故B不符合
2
题意;
C.物质C为硫单质,可在纯氧中燃烧 ,火焰呈蓝紫色,故C符合题意;
D.物质F为HSO ,浓硫酸在常温下会和铁发生钝化反应,因此可以用铁制容器盛放,故
2 4
D符合题意;
故选 B。
【点睛】E的相对分子质量比D的相对分子质量大16,E中比D中多一个氧原子,结合图
象和F为一种强酸推出,D、E、F均含有硫元素是解答突破口。
12.D
【详解】A.S 和S 是硫元素的不同单质,化学性质相似,因此它们分别与铜粉反应,所
6 8
得产物相同均为Cu S,故A选项错误。
2
B.NaS 不是复合分子材料,故B选项错误。
2 8
C.不管氧气过量还是少量,S 和S 分子分别与氧气反应可以得到SO ,故C选项错误。
6 8 2
D.等质量的S 和S 分子,其硫原子的物质的量相同,因此它们分别与足量的KOH反应,
6 8
消耗KOH的物质的量相同,故D选项正确。
故答案选D。
【点睛】本题中要注意S 和S 是硫元素的不同单质,互为同素异形体,化学性质相似,可
6 8
以采用对比法研究。
13.(1)Na SO +H SO (浓)= Na SO +SO↑+2H O
2 3 2 4 2 4 2 2
(2)打开弹簧夹,向装置中通入一段时间的N,关闭弹夹
2
(3) 硫酸钡 还原
(4) SO +2Fe3++Ba2++2H O=BaSO↓+2Fe2++4H+ 取少量B中溶液于试管中,加入少量铁
2 2 4
氰化钾[K Fe(CN) ]溶液产生蓝色沉淀
3 6
【分析】(1)亚硫酸钠和浓硫酸反应生成硫酸钠、二氧化硫和水;
答案第4页,共2页(2)为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出;
(3) Fe3+和酸性条件下NO 两种离子都氧化二氧化硫,生成硫酸钡沉淀,根据化合价变化来
判断SO 具有的性质;
2
(4) SO 易被Fe3+氧化,S的化合价升高,Fe的化合价降低,根据化合价升降守恒和原子守
2
恒,可得反应离子方程式,可通过检验是否有Fe2+生成的方法判断;
(1)
装置A中反应的化学方程式是:NaSO +H SO (浓)= Na SO +SO↑+2H O;
2 3 2 4 2 4 2 2
(2)
为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出,操作为打开弹簧
夹,向装置中通入一段时间的N,关闭弹夹;
2
(3)
Fe3+和酸性条件下NO 两种离子都氧化二氧化硫,使二氧化硫变成硫酸根离子,生成的硫
酸根离子和钡离子结合生成硫酸钡白色沉淀,SO 中S的化合价由+4价变为+6价,化合价
2
升高,被氧化,二氧化硫就有还原性;
(4)
SO 易被Fe3+氧化,SO 中S的化合价由+4价变为+6价,Fe的化合价由+3价降低为+2价,
2 2
根据化合价升降守恒和原子守恒,可得反应的离子方程式为:SO +2Fe3++Ba2+
2
+2H O=BaSO↓+2Fe2++4H+,反应中有Fe2+生成,可以检验Fe2+,具体做法为取少量B中溶
2 4
液于试管中,加入少量铁氰化钾[K Fe(CN) ]溶液产生蓝色沉淀;
3 6
14.(1) ②⑩ ③⑦ ⑨ ④⑤ ①⑥
(2) 胶体 ⑪ 丁达⑫尔效应⑬
(3) SO +2NaOH=Na SO +H O NaHS+HCl=NaCl+H S↑ NaHS+NaOH=Na S+HO
3 2 4 2 2 2 2
【详解】(1)①液态氧为非金属单质,②硝酸钾溶液为混合物,③胆矾晶体为正盐,④干
冰属于酸性氧化物,⑤生石灰属于碱性氧化物,⑥金刚石属于非金属单质,⑦纯碱为碳酸
钠属于正盐,⑧甲烷为有机化合物,⑨熟石灰为氢氧化钙,属于碱,⑩食盐水属于混合物,
石灰水属于混合物, KClO 属于正盐, HSO 属于酸, 碱式碳酸铜属于碱式盐,
3 2 4
⑪硫酸氢钠属于酸式盐⑫。故属于混合物的为②⑬⑩ ,属于正盐的⑭是③⑦ ,属于酸的是
⑮,属于碱的是⑨,属于氧化物的是④⑤,属于⑪单质的是①⑥ ⑫
⑬(2)向沸腾的热水中逐滴加入FeCl 饱和溶液,加热煮沸至液体呈红褐色,所得到的分散
3
系为氢氧化铁胶体,要证明胶体的实验方法为丁达尔效应。
(3)三氧化硫和二氧化碳都属于酸性氧化物,则根据二氧化碳与碳酸钙反应的方程式可知
SO 与NaOH反应的化学方程式为SO +2NaOH=Na SO +H O。碳酸氢钠和NaHS都是酸式
3 3 2 4 2
盐,由碳酸氢钠与HCl、NaOH反应的方程式可推断出NaHS与HCl、NaOH反应的方程式
为NaHS+HCl=NaCl+H S↑、NaHS+NaOH=Na S+HO。
2 2 2
15. Cu+2H SO (浓) CuSO +SO↑+2H O B试管中品红溶液褪色
2 4 4 2 2
SO +Cl+2H O=4H++SO2-+2Cl-(或Ba2++SO+Cl+2H O=BaSO↓+4H++2Cl-)
2 2 2 4 2 2 2 4
ABC 分液漏斗 慢 吸收除去Cl 4H++5ClO -=Cl-+4ClO ↑+2H O
2 2 2 2
验证是否有ClO 生成 b
2
【分析】Ⅰ铜与浓硫酸反应生成二氧化硫,二氧化硫与品红反应,溶液褪色,进入氯化钡
溶液中无明显现象,二氧化硫有毒,用NaOH溶液吸收;
II稀盐酸与氯酸钠溶液反应生成二氧化氯、氯气、氯化钠和水,已知装置D为吸收二氧化
氯的装置,则装置C为吸收氯气;根据实验目的释放二氧化氯时,用装置F验证,则F为
洗气装置;
【详解】I.(1)A试管中铜与浓硫酸在加热的条件下生成硫酸铜、二氧化硫和水,方程
式为Cu+2H SO (浓) CuSO +SO↑+2H O;
2 4 4 2 2
(2)二氧化硫与品红溶液反应,品红溶液褪色,若B试管中品红溶液褪色,则证明铜与浓
硫酸反应;
(3)二氧化硫与氯气反应生成硫酸、盐酸,二氧化硫在此反应中表现还原性,生成的白色
沉淀为硫酸钡,离子方程式为SO +Cl+2H O=4H++SO2-+2Cl-;
2 2 2 4
(4)A加热过程中,使铜与浓硫酸充分反应可可上下移动导管E,起搅拌作用,A正确;
B 停止加热,试管内的压强减少,从导管E进入的空气可增大试管A内的压强,防止倒吸,
B正确;
C 二氧化硫有毒,停止反应,撤装置之前往导管E中通入空气,可排出装置内的SO 气体,
2
使NaOH溶液吸收,防止其污染环境,C正确;
答案为ABC;
II.(1)仪器B的名称是分液漏斗;为了使气体充分被溶液吸收,则需生成气体的速率减
慢,通入盐酸的速率宜慢;
答案第6页,共2页(2)关闭B的活塞,ClO 被稳定剂完全吸收,F中溶液颜色不变,则氯气在C中被吸收;
2
(3)已知在酸性条件下NaClO 可发生反应生成NaCl并释放出ClO ,NaClO、NaCl为可
2 2 2
溶性的强电解质,写离子形式,ClO 为气体写化学式,离子方程式为4H++5ClO -=Cl-
2 2
+4ClO ↑+2H O;分析可知,装置F为验证是否有ClO 生成,为洗气装置,导管为长进短出。
2 2 2
16. C BaSO CuSO +Ca(OH) =Cu(OH) ↓+CaSO C H O+6O
4 4 2 2 4 6 12 6 2
6CO+6H O
2 2
【分析】根据各物质均是初中化学常见的物质,A为红色金属单质,所以A是铜,B能参
与植物的光合作用,C、D为黑色粉末,C、D高温会生成铜和B,所以B是二氧化碳,
C、D是氧化铜和碳,C和X生成的E会与氯化钡反应,所以C是氧化铜,D是碳,F为可
用于改良酸性土壤的碱,所以F是氢氧化钙,G为难溶性物质,H为难溶性蓝色物质,所
以E是硫酸铜,硫酸铜和氯化钡反应生成硫酸钡沉淀和氯化铜,所以G是硫酸钡,X是硫
酸,硫酸铜和氢氧化钙反应生成硫酸钙和氢氧化铜沉淀,所以H是氢氧化铜,I是硫酸钙,
然后将推出的物质进行验证即可。
【详解】根据以上分析可知A是铜,B是二氧化碳,C是氧化铜,D是碳,E是硫酸铜,F
是氢氧化钙,G是硫酸钡,X是硫酸,H是氢氧化铜,I是硫酸钙,则
(1)根据以上分析可知D、G的化学式分别是C、BaSO;
4
(2)E与F的反应是氢氧化钙和硫酸铜反应生成硫酸钙和氢氧化铜沉淀,化学方程式为
CuSO +Ca(OH) =Cu(OH) ↓+CaSO ;
4 2 2 4
(3)因为葡萄糖发生缓慢氧化反应生成二氧化碳和水,故化学方程式为C H O+6O
6 12 6 2
6CO+6H O。
2 2
【点睛】在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转
化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。答案第8页,共2页