文档内容
高中化学人教版(2019)选择性必修1 第一章测试卷
一、单选题
1.下列有关说法错误的是( )
A. 一定条件下石墨转化为金刚石反应吸热说明石墨比金刚石稳定
B. 化学反应必然伴随发生能量变化
C. 化学键是一种作用力
D. 不同元素组成的多原子分子中的化学键一定是极性键
21世纪教育网版权所有
2.下列说法不正确的是( )
A. 对于吸热反应,反应物所具有的总能量低于生成物所具有的总能量
B. 任何放热反应在常温条件一定能发生反应
C. 原电池反应一定是氧化还原反应
D. 元素由化合态变成游离态时,它可能被氧化,也可能被还原
21教育网
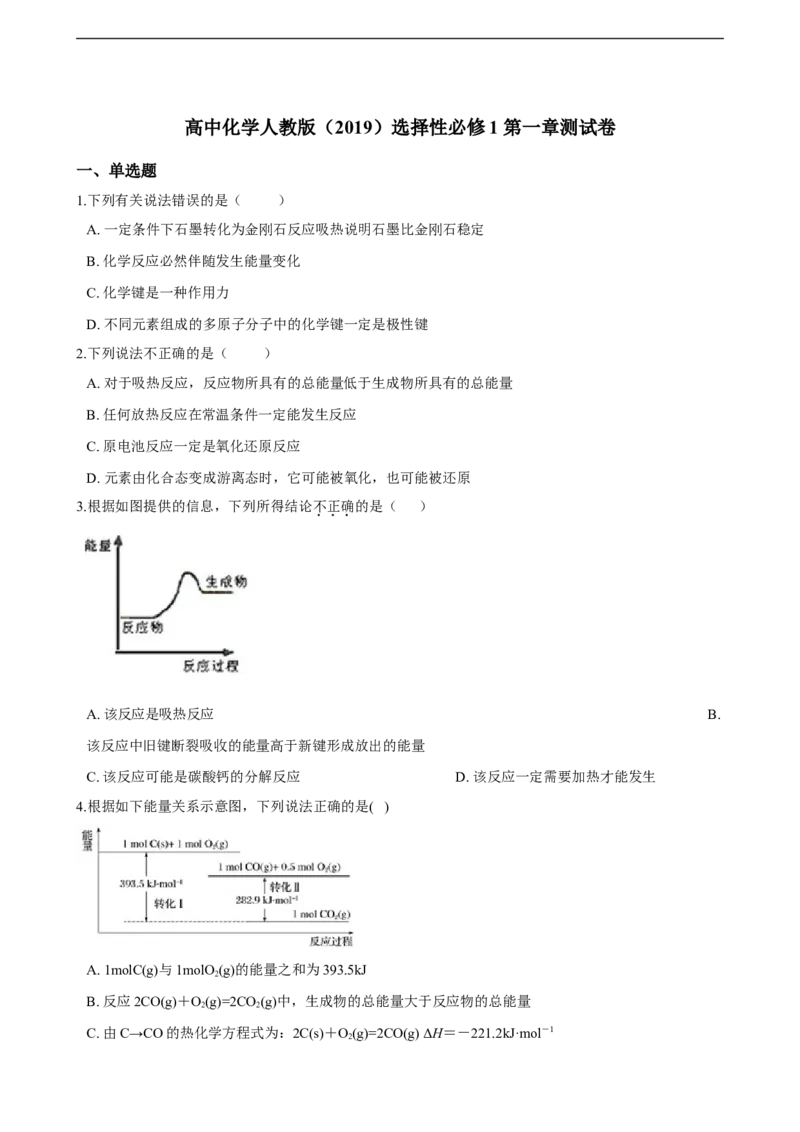
3.根据如图提供的信息,下列所得结论不正确的是( )
A. 该反应是吸热反应 B.
该反应中旧键断裂吸收的能量高于新键形成放出的能量
C. 该反应可能是碳酸钙的分解反应 D. 该反应一定需要加热才能发生
21·世纪*教育网
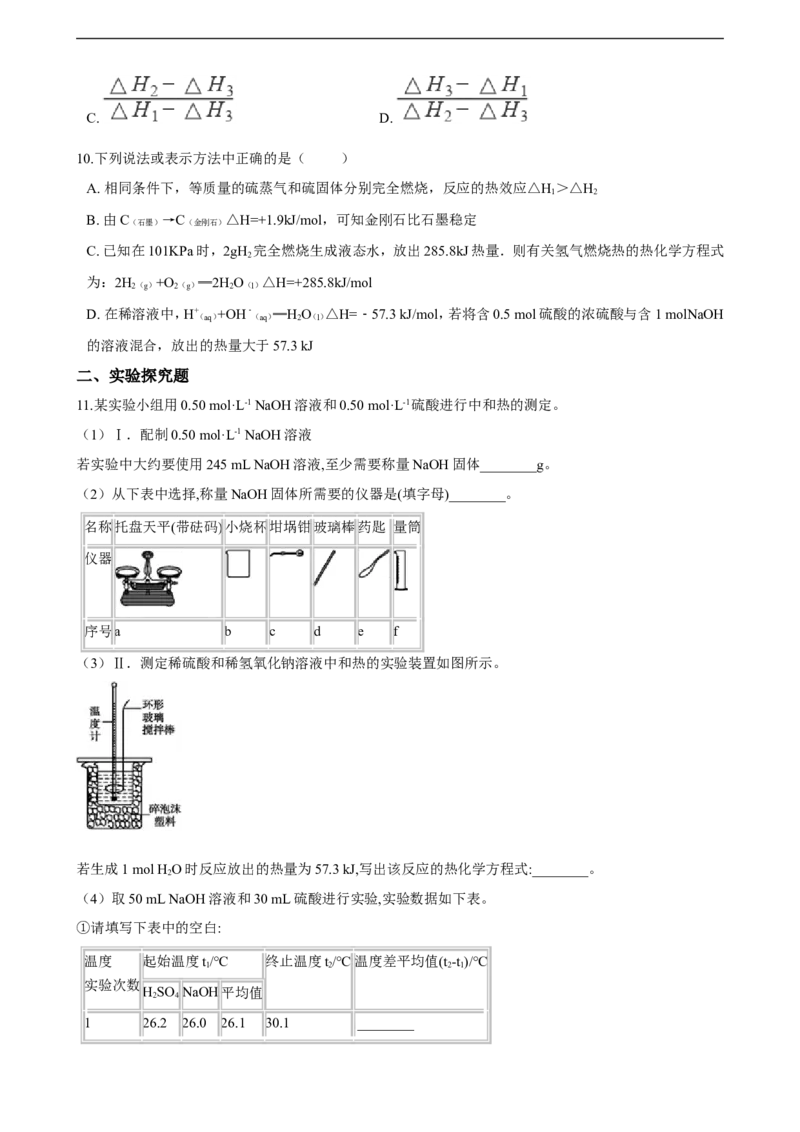
4.根据如下能量关系示意图,下列说法正确的是( )
A. 1molC(g)与1molO (g)的能量之和为393.5kJ
2
B. 反应2CO(g)+O(g)=2CO (g)中,生成物的总能量大于反应物的总能量
2 2
C. 由C→CO的热化学方程式为:2C(s)+O(g)=2CO(g) ΔH=-221.2kJ·mol-1
2D. 热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO热值ΔH=-10.1 kJ·mol-1
5.已知:(1)Zn(s)+1/2O (g)=ZnO(s)ΔH=﹣348.3 kJ·
2
2Ag(s)+1/2O (g)=Ag O(s)ΔH=﹣31.0 kJ·
2 2 www-2-1-cnjy-com
则Zn(s)+Ag O(s)=ZnO(s)+2Ag(s)的ΔH等于( )
2
A. ﹣317.3 kJ· B. ﹣379.3 kJ· C. ﹣332.8 kJ· D. +317.3 kJ·
6.通过以下反应可获得新型能源二甲醚( )。下列说法错误的是( )
①
②
③
④
A. 反应①、②为反应③提供原料气
B. 反应③也是 资源化利用的方法之一
C. 反应 的
D. 反应 的
7.N H 是一种高效清洁的火箭燃料。0.25 mol N H(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则
2 4 2 4
下列热化学方程式中正确的是( )
2-1-c-n-j-y
A. 1/2N H(g)+1/2O (g)=1/2N (g)+HO(g) ΔH=+267 kJ·mol-1
2 4 2 2 2
B. NH(g)+O(g)=N(g)+2HO(g) ΔH=-534 kJ·mol-1
2 4 2 2 2
C. NH(g)+O(g)=N(g)+2HO(g) ΔH=+534 kJ·mol-1
2 4 2 2 2
D. N 2 H 4 (g)+O 2 (g)=N 2 (g)+2H 2 O(l) ΔH=-133.5 kJ·mol-1 【来源:21cnj*y.co*m】
8.已知:H(g)+1/2O(g)=HO(g) ΔH=-241.8 kJ·mol-1 , C(s)+1/2O (g)=CO(g) ΔH =-110.5 kJ·mol-1。由
2 2 2 1 2 2
此可知焦炭与水蒸气反应的热化学方程式为:C(s)+HO(g)=CO(g)+H(g) ΔH , 则ΔH 为( )
2 2 3 3
A. +131.3 kJ·mol-1 B. -131.3 kJ·mol-1 C. +352.3 kJ·mol-1 D. -352.3 kJ·mol-1
9.乙醇的燃烧热为ΔH , 甲醇的燃烧热为ΔH , 且ΔH<ΔH , 若乙醇和甲醇的混合物1 mol完全燃烧,
1 2 1 2
反应热为ΔH , 则乙醇和甲醇的物质的量之比为( )
3 【版权所有:21教育】
A. B.C. D.
21教育名师原创作品
10.下列说法或表示方法中正确的是( )
A. 相同条件下,等质量的硫蒸气和硫固体分别完全燃烧,反应的热效应△H>△H
1 2
B. 由C →C △H=+1.9kJ/mol,可知金刚石比石墨稳定
(石墨) (金刚石)
C. 已知在101KPa时,2gH 完全燃烧生成液态水,放出285.8kJ热量.则有关氢气燃烧热的热化学方程式
2
为:2H +O ═2HO △H=+285.8kJ/mol
2(g) 2(g) 2 (l)
D. 在稀溶液中,H+ +OH﹣ ═HO △H=﹣57.3 kJ/mol,若将含0.5 mol硫酸的浓硫酸与含1 molNaOH
(aq) (aq) 2 (l)
的溶液混合,放出的热量大于57.3 kJ
二、实验探究题
11.某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸进行中和热的测定。
(1)Ⅰ.配制0.50 mol·L-1 NaOH溶液
若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体________g。
(2)从下表中选择,称量NaOH固体所需要的仪器是(填字母)________。
名称托盘天平(带砝码)小烧杯坩埚钳玻璃棒药匙 量筒
仪器
序号a b c d e f
(3)Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如图所示。
若生成1 mol H O时反应放出的热量为57.3 kJ,写出该反应的热化学方程式:________。
2
(4)取50 mL NaOH溶液和30 mL硫酸进行实验,实验数据如下表。
①请填写下表中的空白:
温度 起始温度t/℃ 终止温度t/℃温度差平均值(t -t )/℃
1 2 2 1
实验次数
HSO NaOH平均值
2 4
1 26.2 26.0 26.1 30.1 ________2 27.0 27.4 27.2 33.3
3 25.9 25.9 25.9 29.8
4 26.4 26.2 26.3 30.4
②用上述实验数值计算结果为________kJ•mol-1,与 57.3 kJ•mol-1有偏差,产生偏差的原因可能是
________(填字母)。
2·1·c·n·j·y
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HSO 溶液的温度
2 4
三、综合题
12.在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些
分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用
kJ·mol-1表示。请认真观察下图,然后回答问题。
【出处:21教育名师】
(1)图中所示反应是________(填“吸热”或“放热”)反应。
(2)已知拆开1 mol H—H键、1 mol I—I键、1 mol H—I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ。则
由1 mol氢气和1 mol碘反应生成HI会________(填“放出”或“吸收”)________kJ的热量。在化学反应
过程中,是将________转化为________。
21*cnjy*com
(3)下列反应中,属于放热反应的是________(填序号,下同),属于吸热反应的是________。
①物质燃烧②炸药爆炸③酸碱中和反应④二氧化碳通过炽热的碳⑤食物因氧化而腐败⑥Ba(OH) ·8H O与
2 2
NH Cl反应⑦铁粉与稀盐酸反应
4
13.某化学小组用50ml 0. 50mol/L NaOH溶液和30ml 0.50mol/L硫酸溶液进行中和热的测定实验。
(1)实验中大约要使用230mL NaOH溶液,配制溶液时至少需称量NaOH固体________g.
(2)做中和热的测定实验时:桌上备有大、小两个烧杯、泡沫塑料、硬纸板、胶头滴管、环形玻璃搅拌棒.实验
尚缺少的玻璃仪器(用品)是________、________。
(3)他们记录的实验数据如下:
①请填写表中的空白:
实验起始温度t 终止温度温度差平均值
1次数 t/℃ (t﹣t)/℃
2 2 1
HSO NaOH
2 4
1 25.0℃25.0℃29.1
2 25.0℃25.0℃29.8
Δt=________
3 25.0℃25.0℃28.9
4 25.0℃25.0℃29.0
②已知:溶液的比热容c为4.18 J·℃-1·g-1,溶液的密度均为1 g·cm-3。
测得的中和热∆H =________. (取小数点后一位)
(4)若用氨水代替NaOH做实验,测定结果ΔH会________(填“偏大”、“偏大”、“无影响”)答案解析部分
一、单选题
1. D
解析:A.石墨转化为金刚石为吸热反应,说明石墨具有的能量小于金刚石所具有的能量,因此石墨比金刚石
稳定,选项正确,A不符合题意;
www.21-cn-jy.com
B.任何化学反应的发生都伴随着能量的变化,选项正确,B不符合题意;
C.化学键是以一种强作用力,选项正确,C不符合题意;
D.HO 是由两种元素组成的多原子分子,其中含有极性键和非极性键,选项错误,D符合题意;
2 2
故答案为:D
分析:A.物质所具有的能量越高越不稳定;
B.任何化学反应的发生都伴随着能量的变化;
C.化学键是一种强作用力;
D.HO 中存在非极性共价键;
2 2
2. B
解析:A.对于吸热反应,反应物所具有的能量低于生成物的总量,选项正确,A不符合题意;
B.某些放热反应需要在加热条件下才能发生,选项错误,B符合题意;
C.原电池反应过程中,一定有电子发生转移,因此一定是氧化还原反应,选项正确,C不符合题意;
D.元素由化合态转化为游离态时,其价态变化可能升高,也可能降低,因此可能被氧化,也可能被还原,选项
正确,D不符合题意;
21·cn·jy·com
故答案为:B
分析:A.根据物质能量与反应热效应的关系分析;
B.有些放热反应需要在加热条件下才能发生;
C.原电池反应一定是氧化还原反应;
D.根据元素价态变化分析;
3. D
解析:A.由于反应物的总能量低于生成物的总能量,因此该反应为吸热反应,选项正确,A不符合题意;
B.由于该反应为吸热反应,因此反应过程中,旧化学键断裂吸收的能量要高于新化学键成键释放的能量,选
项正确,B不符合题意;
C.碳酸钙高温分解的反应为吸热反应,因此该反应可能是碳酸钙的分解反应,选项正确,C不符合题意;
D.是否需要加热只是促使反应发生的条件,与反应是否放热或吸热无关,因此该反应不一定需要加热,选项
错误,D符合题意;故答案为:D
分析:由图可知,反应物的总能量低于生成物的总能量,因此该反应为吸热反应;据此结合选项进行分析。
4. C
解析:A.由图可知,1molC(s)与1molO (g)的能量之和比1molCO (g)的能量高393.5kJ,A不符合题意;
2 2
B.由图可知,1molCO(g)和0.5mol的O(g)生成1molCO (g)放出282.9kJ的热量,所以反应 2CO(g)+
2 2
O(g)=2CO (g)中,反应物的总能量大于生成物的总能量,B不符合题意;
2 2
C.由图可知,1molC(s)和0.5molO (g)转化为1mol的CO(g),放出热量为:393.5 kJ-282.9 kJ=110.6 kJ,所以
2
2C(s)+O(g)=2CO(g) ΔH=-221.2 kJ·mol-1 , C符合题意;
2
D.热值指在一定条件下单位质量的物质完全燃烧所放出的热量,燃烧产物在该条件下是一种较为稳定的状
态,则CO的热值为 kJ·g-1≈10.1 kJ·g-1 , 单位不符合题意,D不符合题意;
故答案为:C。
分析:A、根据图示无法得出,一摩尔碳和一摩尔氧气的能量;
B、反应放热,说明生成物的总能量小于反应物的总能量;
C、反应寒冰用生成物的总能量减去反应物的总能量;
D、燃烧热是指在一定条件下生成稳定产物所放出的热量。
5. A
解析:ΔH=ΔH-ΔH=-348.3 kJ·mol-1-(-31.0 kJ·mol-1)=-317.3 kJ·mol-1
1 2
分析:(1)利用盖斯定律进行作答;
(2)盖斯定律:在条件不变的情况下,化学反应的热效应只与起始和终了状态有关,与变化途径无关。
6. C
解析:A.反应③中的反应物为CO、H , 由反应可以知道,反应①、②为反应③提供原料气,所以A选项是
2 2
正确的;
B.反应③中的反应物为CO , 转化为甲醇,则反应③也是 CO 资源化利用的方法之一,所以B选项是正
2 2
确的;
C. 由反应④可以知道,物质的量与热量成正比,且气态水的能量比液态水的能量高,则反应反应
的 ,故C符合题意;
D. 由 盖 斯 定 律 可 以 知 道 ,②×2+③×2+④ 得 到 , 则
,所以D选项是正确的。故答案为:C。
分析:盖斯定律指的是,化学反应中的能量与反应的过程无关,只与反应的始终态有关。
7. B
解析:A、0.25 mol NH(g)完全燃烧生成氮气和气态水时,放出热量133.5 kJ,则0.5 mol NH(g)完全燃烧生
2 4 2 4
成氮气和气态水时,放出热量267 kJ;放热反应其焓变是负值,故A不符合题意;
B、0.25 mol N H(g)完全燃烧生成氮气和气态水时,放出热量133.5 kJ,则0.5 mol NH(g)完全燃烧生成氮气
2 4 2 4
和气态水时,放出热量267 kJ;则1mol NH(g)完全燃烧生成氮气和气态水时,放出267 kJ×2=534 kJ的热量,
2 4
此时水应为气体,故B符合题意;
【来源:21·世纪·教育·网】
C、NH(g)完全燃烧生成氮气和气态水时,放出热量,其焓变是负值,故C不符合题意;
2 4
D、选项中生成液态水,所以放出热量数值大于534 kJ,即ΔH<-534 kJ·mol-1;故D不符合题意;
故答案为:B。
分析:热化学方程式的书写注意物质状态、焓变的符号、数值与单位。
8. A
解析:根据盖斯定律,②-①整理可得C(s)+HO(g)=CO(g)+H (g) ΔH =+131.3 kJ/·mol。因此选项A符合题
2 2 3
意。
故答案为:A
分析:盖斯定律:化学反应不管是一步完成还是分几步完成,其总反应所放出的热或吸收的热总是相同的。
其实质是化学反应的焓变只与始态和终态有关,而与途径无关。
9. B
解析:燃烧热是指1mol纯物质完全燃烧,生成稳定氧化物时放出的热量,因此甲醇燃烧的热化学方程式为:
2CHOH(l)+3O=2CO (g)+4HO(l) 2ΔH , 乙醇燃烧的热化学方程式为:C HOH(g)+3O(g)=2CO (g)+
3 2 2 2 2 2 5 2 2
3HO(l) ΔH ;设甲醇为amol,则乙醇为bmol,则amol甲醇完全燃烧,放出的热量为a×(-ΔH )kJ,bmol乙醇
2 1 2
完全燃烧,放出的热量为b×(-ΔH)kJ,因此可得 , 解得 ,
1
因此可得 , B符合题意;
故答案为:B
分析:根据燃烧热的定义写出甲醇、乙醇燃烧的热化学方程式,设甲醇为amol,乙醇为bmol,结合热化学方程式进行计算。
10. D
解析:A.固体硫燃烧过程中需先转化为气态,过程中吸收热量,因此等质量的固体硫和硫蒸气完全燃烧,固
体硫放出的热量小,则其ΔH,A不符合题意;
B.石墨转化为金刚石的过程为吸热反应,因此石墨所具有的能量低于金刚石所具有的能量,而物质所具有
的能量越高,越不稳定,因此石墨的稳定性高于金刚石,B不符合题意;
C.氢气的燃烧反应为放热反应,其ΔH<0,C不符合题意;
D.浓硫酸稀释过程放出热量,因此反应放出的热量大于57.3kJ/mol,D符合题意;
故答案为:D
分析:A.固体硫燃烧过程中需先转化为气态,过程中吸收热量;
B.物质具有的能量越高越不稳定,由反应的热效应比较物质能量高低,从而得出位置的稳定性;
C.燃烧反应为放热反应,其ΔH<0;
D.浓硫酸稀释过程中放热;
二、实验探究题
11. (1)5.0
(2)abe
(3)1/2H SO (aq)+NaOH(aq)=1/2Na SO (aq)+H O(l) ΔH=-57.3 kJ·mol-1
2 4 2 4 2
(4)4.0;53.5 kJ·mol-1;acd
解析:(1)Ⅰ.没有245mL容量瓶,需要配制250mL溶液,则要称量NaOH固体m=nM=cVM=0.5mol/
L×0.5L×40g/mol=5.0g;(2)氢氧化钠要在称量瓶或者小烧杯中称量,称量固体氢氧化钠所用的仪器有天平、
烧杯和药匙;
(3)Ⅱ.中和热为酸碱中和生成1mol HO时的焓变,所以表示稀硫酸和稀氢氧化钠中和热的热化学方程式
2
为: HSO (aq)+ NaOH(aq)= NaSO (aq)+ HO(l) ΔH=-57.3 kJ·mol-1;
2 4 2 4 2
(4)①第 2 组数据明显有误,所以删掉,其它三组数据求平均值,温度差平均值 =
=4.0°C;
②50mL0.50mol/L 氢氧化 钠与 30mL0.50mol/L 硫酸溶液进行中和反应生成水的物质的量为
0.05L×0.50mol/L=0.025mol,溶液的质量为:80mL×1g/ml=80g,温度变化的值为△T=4℃,则生成0.025mol
水放出的热量为Q=m•c•△T=80g×4.18J/(g•℃)×4.0℃=1337.6J,即1.3376kJ,所以实验测得的中和热△H=-
=-53.5 kJ·mol-1;③a、实验装置保温、隔热效果必须好,否则结果偏低,选项a符合;
b、量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,则大于
57.3kJ/mol,选项b不符合;
c、尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,不允许分多次把NaOH溶液倒入盛有硫酸的小烧
杯中,否则造成热量散失,选项c符合;
d、用温度计测定NaOH溶液起始温度后直接测定HSO 溶液的温度,发生酸碱中和放热,使所测温度偏高,
2 4
结果偏低,选项d符合。
21cnjy.com
分析:(1)配制溶液时,计算数据必须以容量瓶的规格进行相关计算;
(2)氢氧化钠属于腐蚀性物品,需要在小烧杯中称量;
(3)依据中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,标注物质聚集状态和对应焓变
写出热化学方程式;
(4)①先计算出每次试验操作测定的温度差,然后舍弃误差较大的数据,最后计算出温度差平均值;
②根据Q=m•c•△T计算出反应放出的热量,然后计算出生成1mol水放出的热量,就可以得到中和热;
③a.装置保温、隔热效果差,测得的热量偏小;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高;
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失较多;
d.温度计测定NaOH溶液起始温度后直接插入稀HSO 测温度,硫酸的起始温度偏高。
2 4
三、综合题
12. (1)放热
(2)放出;11;化学能;热能
(3)①②③⑤⑦;④⑥
解析:(1)由题图可知反应物的总能量高于生成物的总能量,故该反应为放热反应。(2)H (g)+I(g)=2HI(g),断
2 2
裂1 mol H—H键和1 mol I—I键需要吸收436 kJ+151 kJ=587 kJ热量,生成2 mol HI放出2×299 kJ=598
kJ热量,所以1 mol氢气和1 mol碘反应生成HI放出11 kJ的热量;在化学反应过程中,将化学能转化为热
能。(3)应熟悉常见的吸热反应和放热反应:中和反应、燃料的燃烧、有氧参与的氧化还原反应、多数化合反
应等属于放热反应;多数分解反应(H O 分解除外)、二氧化碳通过炽热的碳、Ba(OH) ·8H O与NH Cl反应等
2 2 2 2 4
属于吸热反应。
分析:(1)根据图像,生成物的总能量低于反应物的总能量属于放热反应;
(2)根据方程式,结合物质结构,进行计算能量变化;
( 3)掌握常见的放热反应与吸热反应,常见的放热反应有酸碱中和反应、金属与酸的反应、饶绍反应,厂家
的吸热反应有氢氧化钡与氯化铵的反应,二氧化碳与碳的反应。13. (1)5.0
(2)量筒;温度计
(3)4.0;﹣53.5kJ/mol
(4)偏大
解析:(1)容量瓶具有一定规格,没有230mL的容量瓶,因此配制230mL溶液,应选用250mL容量瓶,故所
需NaOH固体的质量m=n×M=c×V×M=0.5mol/L×0.25L×40g/mol=5.0g;
( 2)由于实验过程需量取NaOH溶液和稀盐酸的体积,因此需用到量筒;实验过程中,需测量反应前后温度
的变化,故需用到温度计;
(3)①第二次实验终止温度29.8℃与其他数据差距较大, 误差较大, 应舍去,因此温度差的平均值
;
②该反应过程中生成n(H O)=0.025mol,反应过程中放出热量Q=cmΔt=4.18×(50+30)×1×4=1.3376kJ,则当
2
反应生成1molH O时放出的热量为 , 因此中和热ΔH=-53.5kJ/mol;
2
(4)NH ·H O为弱碱,在水中电离需要吸热,会使得反应过程中放出的热量减小,则ΔH偏大;
3 2
分析:(1)配制230mL溶液,应选用250mL容量,根据公式m=n×M=c×V×M计算所需NaOH固体的质量;
(2)根据实验装置,确定所需的仪器;
(3)①多次实验求取平均值时,对于误差较大的数据应舍去;
②根据公式Q=cmΔt计算反应放出的热量,再结合反应生成HO的量,计算中和热;
2
(4)NH ·H O为弱碱,在水中电离需要吸热;
3 2