文档内容
班级 姓名 学号 分数
第一章 化学反应的热效应(A卷·知识通关练)
核心知识1 化学反应中的能量变化
1.下列说法错误的是
A.水能、风能、生物质能是可再生能源,煤、石油、天然气是不可再生能源
B.“冰,水为之,而寒于水”,说明相同质量的水和冰相比较,冰的能量低
4Al(s)+3O (g)=2Al O (s)
C.同温同压下, 2 2 3 在常温和点燃条件下的 ΔH 不同
D.反应物和生成物具有的总能量的高低,决定了该反应是放热还是吸热反应
2.下列反应属于氧化还原反应,且能量变化如图所示的是
A.锌粒和稀硫酸反应
B.灼热的木炭与CO 反应
2
C.甲烷在空气中燃烧的反应
D.Ba(OH)·8HO晶体与NH Cl晶体的反应
2 2 4
3.根据如图提供的信息,下列所得结论不正确的是
A.该反应为吸热反应
B.该反应一定有能量转化成了化学能
C.反应物比反应产物稳定
D.因为反应物的总能量低于反应产物的总能量,所以该反应需要加热才能发生
1 / 10
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司高温
4.炼铁过程中发生的3CO+Fe O 3CO+2Fe为放热反应,下列说法正确的是
2 3 2
A.断开C≡O键放出热量 B.形成C=O键吸收热量
C.放热反应都需要加热 D.有的吸热反应不需要加热
核心知识2 中和反应反应热的测定
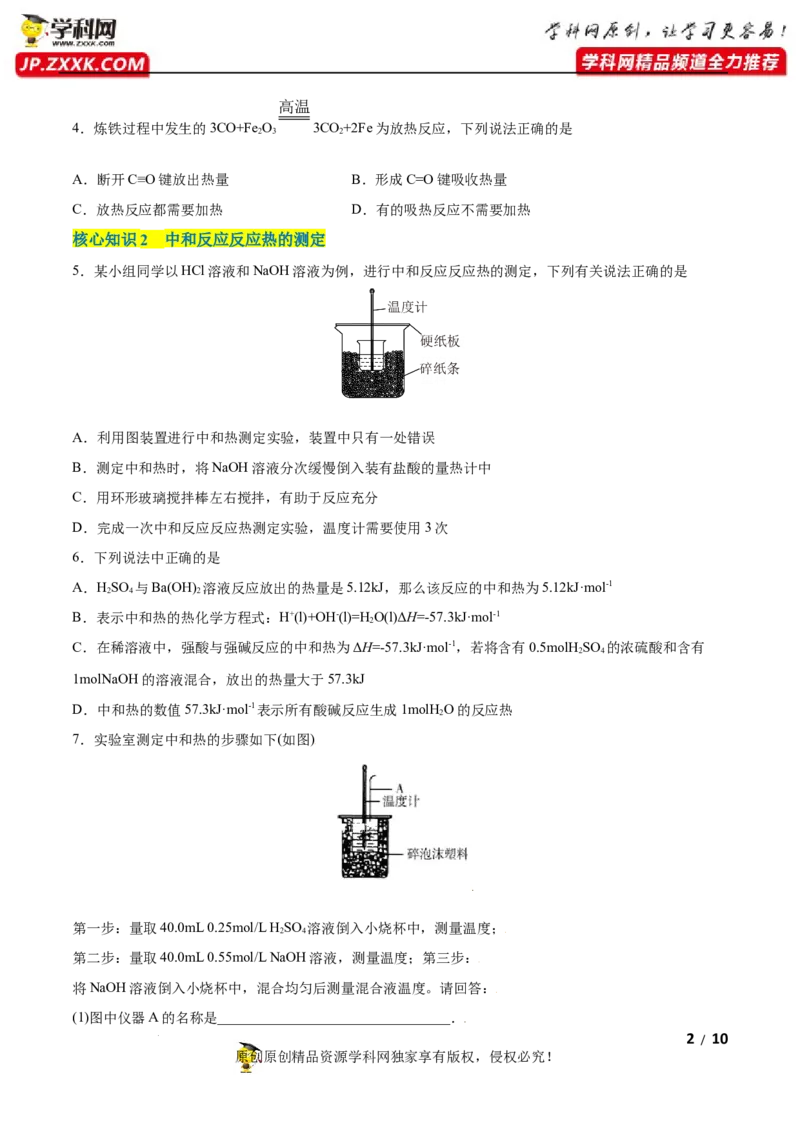
5.某小组同学以HCl溶液和NaOH溶液为例,进行中和反应反应热的测定,下列有关说法正确的是
A.利用图装置进行中和热测定实验,装置中只有一处错误
B.测定中和热时,将NaOH溶液分次缓慢倒入装有盐酸的量热计中
C.用环形玻璃搅拌棒左右搅拌,有助于反应充分
D.完成一次中和反应反应热测定实验,温度计需要使用3次
6.下列说法中正确的是
A.HSO 与Ba(OH) 溶液反应放出的热量是5.12kJ,那么该反应的中和热为5.12kJ·mol-1
2 4 2
B.表示中和热的热化学方程式:H+(l)+OH-(l)=H O(l)ΔH=-57.3kJ·mol-1
2
C.在稀溶液中,强酸与强碱反应的中和热为ΔH=-57.3kJ·mol-1,若将含有0.5molHSO 的浓硫酸和含有
2 4
1molNaOH的溶液混合,放出的热量大于57.3kJ
D.中和热的数值57.3kJ·mol-1表示所有酸碱反应生成1molH O的反应热
2
7.实验室测定中和热的步骤如下(如图)
第一步:量取40.0mL 0.25mol/L H SO 溶液倒入小烧杯中,测量温度;
2 4
第二步:量取40.0mL 0.55mol/L NaOH溶液,测量温度;第三步:
将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。请回答:
(1)图中仪器A的名称是_________________________________.
2 / 10
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司(2)NaOH溶液稍过量的原因________________________________.
(3)加入NaOH溶液的正确操作是______________(填字母).
A.沿玻璃棒缓慢加入 B.分三次均匀加入 C.一次迅速加入 D.用滴定管小心滴加
(4)上述实验测得的结果与理论上的57.3kJ/mol有偏差,其原因可能是_______.
a.NaOH溶液倒入盛有硫酸的小烧杯中后未及时将盖板盖好.
b.实验装置保温、隔热效果不好
c.用温度计测定NaOH溶液起始温度后又直接测定HSO 溶液的温度
2 4
d.使用温度计搅拌混合液体
(5)若实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相
比,所放出的热量______ (填“相等”“不相等”),若实验操作均正确,则所求中和热_______ (填“相等”“不
相等”)。
核心知识3 反应热与焓变
8.下列说法中正确的是
A.化学反应中的能量变化取决于成键放出的能量与断键吸收的能量的相对大小
B.化学反应中的能量变化不一定遵循能量守恒定律
C.在一个确定的化学反应关系中,反应物的总能量与生成物的总能量可能相同
D.在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量
9.氢气在氯气中燃烧生成氯化氢,同时产生苍白色火焰。下列说法正确的是
ΔH>0
A.该反应的
B.参加反应的氢气和氯气的总能量小于生成的氯化氢的总能量
C.断裂HH键放出能量
D.形成HCl键放出能量
10.已知相关共价键的键能数据如下表:
共价键 H-H C-H C-C CC
键能/kJ∙mol-1 436 413 344 614
则C 2 H 6 (g) C 2 H 4 (g)H 2 (g)的 ΔH 为
120kJmol1 46kJmol1 120kJmol1 46kJmol1
A. B. C. D.
11.由NO和NO反应生成N 和NO 的能量变化如图所示。下列说法正确的是
2 2 2
3 / 10
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司A.反应物总能量小于生成物总能量
B.断键吸收能量之和大于成键释放能量之和
C.N(g)+NO (g)=NO(g)+NO(g)∆H=-139kJ·mol-1
2 2 2
D.反应生成1molN 时转移2mol电子
2
12.已知4NH (g)+3O(g)=2N(g)+6HO(g) H=-q kJ·mol-1,相关数据如下表,则下表中z的大小是
3 2 2 2
物质 △ NH (g) O(g) N(g) HO(g)
3 2 2 2
1mol分子中的化学键断裂时需要吸收的能量/kJ a b z d
1 1
A.2 (q+4a+3b-6d) B.2 (q+12a+3b-12d)
1 1
C.2 (q-4a-3b+6d) D.2 (q+12a+6b-12d)
13.中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程
如下图所示。
已知:几种物质中化学键的键能如下表所示。
H 中H—H
化学键 HO中H—O键 O 中O=O 键 2 HO 中O—O键 HO 中O—H键
2 2 键 2 2 2 2
键能kJ/mol 463 496 436 138 463
若反应过程中分解了2 mol水,则下列说法不正确的是
A.总反应为2HO 2H↑+O ↑
2 2 2
B.过程I吸收了926 kJ能量
C.过程II放出了574 kJ能量
4 / 10
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司D.过程Ⅲ属于放热反应
核心知识4 热化学方程式表示的意义及其书写
噲垐�� Δ=-196 1
14.热化学方程式2HO(l) 2HO(l)+O(g) kJ·mol 说法正确的是
2 2 2 2
A.生成11.2LO 时放热98kJ B.反应物总能量小于生成物总能量
2
C.HO为气态时,放出的热量大于196kJ D.正反应的活化能小于逆反应的活化能
2
15.已知Zn(s)+HSO (aq)=ZnSO (aq)+H (g), △H<0,则下列叙述正确的是
2 4 4 2
A.该反应中各物质的化学计量数既可表示物质的量,又可表示分子个数
B.热化学方程式中△H的值与化学方程式中物质的化学计量数无关
C.△H越大反应越易进行
D.该反应中反应物的总能量高于生成物的总能量
16.在同温同压下,下列各组热化学方程式中,ΔH>ΔH 的是
2 1
A.2H(g)+O(g)=2HO(g) ΔH;2H(g)+O(g)=2HO(l) ΔH
2 2 2 1 2 2 2 2
B.S(s)+O(g)=SO(g) ΔH;S(g)+O(g)=SO(g) ΔH
2 2 1 2 2 2
1
C.C(s)+2 O(g)=CO(g) ΔH;C(s)+O(g)=CO (g) ΔH
2 1 2 2 2
1 1
D.H(g)+Cl(g)=2HCl(g) ΔH;2 H(g)+2 Cl(g)=HCl(g) ΔH
2 2 1 2 2 2
17.下列热化学方程式书写正确的是
500℃
A.2SO +O VO 2SO ΔH=-196.6kJ·mol-1
2 2 3
2 5
B.2H(g)+O(g)=2HO(l) ΔH=-571.6kJ·mol-1
2 2 2
C.H(g)+Cl (g)=2HCl(g) ΔH=-183kJ
2 2
D.C(s)+O(g)=CO (g) ΔH=+393.5kJ·mol-1
2 2
1
18.已知2SO (g) + O(g) 2SO (g), H = -197.8kJ·mol-1,则反应: SO (g) =2 O (g) + SO (g) 的
2 2 3 3 2 2
△
H是
△A.+197.8kJ·mol-1 B.+98.9kJ·mol-1 C.-296.7kJ·mol-1 D.-98.9kJ·mol-1
19.1g H 燃烧生成液态水,放出142.9 kJ的热量,下列热化学方程式正确的是
2
5 / 10
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司A.2H(g)+O(g) =2H O(l) ΔH= -571.6 kJ·mol-1
2 2 2
B.2H(g)+O(g) =2H O(l) ΔH= -142.9 kJ·mol-1
2 2 2
C.2H(g)+O(g)=2HO(g) ΔH= -571.6 kJ·mol-1
2 2 2
D.2H(g)+O(g) =2H O(l) ΔH= +571.6 kJ·mol-1
2 2 2
20.有关键能数据如表:
化学键 Si﹣O O=O Si﹣Si
键能kJ·mol
X 500 180
﹣1
晶体硅在氧气中燃烧的热化学方程式:Si(s)+O(g)═SiO (s) H=﹣990kJ·mol﹣1,则表中X的值为
2 2
A.462.5 B.460 C.920 △ D.423.3
21.已知下列热化学方程式:
①2H(g)+O(g)=2HO(l) ΔH=-571.6kJ/mol
2 2 2
②C(s)+O(g)=CO (g) ΔH=-393.5kJ/mol
2 2
③C(s)+HO(g)=CO(g)+H (g) ΔH=+131.5kJ/mol
2 2
请回答:
(1)上述反应中属于放热反应的是_______(填序号,下同),属于吸热反应的是_______。
(2)2g的H 完全燃烧生成液态水,放出的热量为_______。
2
(3)依据事实,写出下列反应的热化学方程式。
①1molN (g)与适量O(g)反应生成NO (g),需吸收68kJ的热量,该反应的热化学方程式为_______。
2 2 2
②1molN (g)与适量H(g)反应生成NH (g),放出92.4kJ的热量,该反应的热化学方程式为_______。
2 2 3
核心知识5 燃烧热
22.下列说法正确的是
A.1molH 完全燃烧生成HO(g)放出的热量叫H 的燃烧热
2 2 2
B.25℃、101kPa时,1molS和2molS的燃烧热相等
3
C.已知S(s)+2 O(g)=SO(g) ∆H=-269.8kJ/mol,则硫生成SO 的反应热为269.8kJ/mol
2 3 3
D.25℃、101kPa时,碳的燃烧热为-393.5kJ/mol
23.101 kPa时,下列热化学方程式中的∆H可用来表示燃烧热的是
4FeS s+11O g=2Fe O s+8SO g
A. 2 2 2 3 2 ∆H
6 / 10
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司25
C H l+ O g=8CO g+9H Ol
B. 8 18 2 2 2 2 ∆H
H g+Cl g=2HClg
C. 2 2 ∆H
1 1 1
Mgs+ O g= MgOs
D.2 4 2 2 ∆H
24.25℃、101kPa 下,碳、氢气、甲烷和葡萄糖的燃烧热依次是
393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol。下列热化学方程式中,正确的是
1
A.C(s)+ O(g)=CO(g);△H=-393.5kJ/mol
2 2
B.2H(g)+O(g)=2HO(l); H=+571.6kJ/mol
2 2 2
C.CH(g)+2O(g)=CO (g)+△2HO(g); H=-890.3kJ/mol
4 2 2 2
D.1/2C H O(s)+3O(g)=3CO (g)+3H△O(l); H=-1400 kJ/mol
6 12 6 2 2 2
25.分析表中的四个热化学方程式,判断氢气和△丙烷的标准燃烧热分别是
①2H(g)+O(g)=2HO(l)ΔH=-571.6kJ∙mol-1
2 2 2
“嫦娥一号”发射火箭燃料 液氢(H )
2
②2H(l)+O (l)=2H O(g) ΔH=-482.6kJ∙mol-1
2 2 2
丙烷(C H) ③C H(l)+5O (g)=3CO (g)+4HO(g) ΔH=-2013.8kJ∙mol-1
3 8 3 8 2 2 2
北京奥运会“祥云”火炬燃料
④C H(g)+5O(g)=3CO (g)+4HO(l) ΔH=-2221.5kJ∙mol-1
3 8 2 2 2
A.-571.6kJ∙mol-1,-2221.5kJ∙mol-1 B.-285.5kJ∙mol-1,-2013.8kJ∙mol-1
C.-285.8kJ∙mol-1,-2221.5kJ∙mol-1 D.-241.3kJ∙mol-1,-2013.8kJ∙mol-1
核心知识6 盖斯定律
26.已知:N(g)+O(g)=2NO(g) ∆H
2 2 1
1
CO(g)+2 O(g)=CO (g) ∆H
2 2 2
则反应2NO(g)+2CO(g)=N (g)+2CO (g)的焓变∆H 为
2 2 3
A.∆H+∆H B.2∆H-∆H C.∆H+2∆H D.∆H-∆H
1 2 2 1 1 2 2 1
27.已知:(I)C(s)+O (g)=CO (g) ΔH
2 2 1
1
(II)H (g)+2 O(g)=HO(g) ΔH
2 2 2 2
7 / 10
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司1
(III)CO(g)+2 O(g)=CO (g) ΔH
2 2 3
(IV)C(s)+H O(g)=CO(g)+H (g) ΔH
2 2 4
下列说法正确的是
A.ΔH<0、ΔH>0
1 3
B.ΔH=ΔH+ΔH-ΔH
4 2 3 1
C.ΔH+ΔH<ΔH
2 3 1
D.ΔH、ΔH、ΔH 分别对应为C、H、CO的标准燃烧热
1 2 3 2
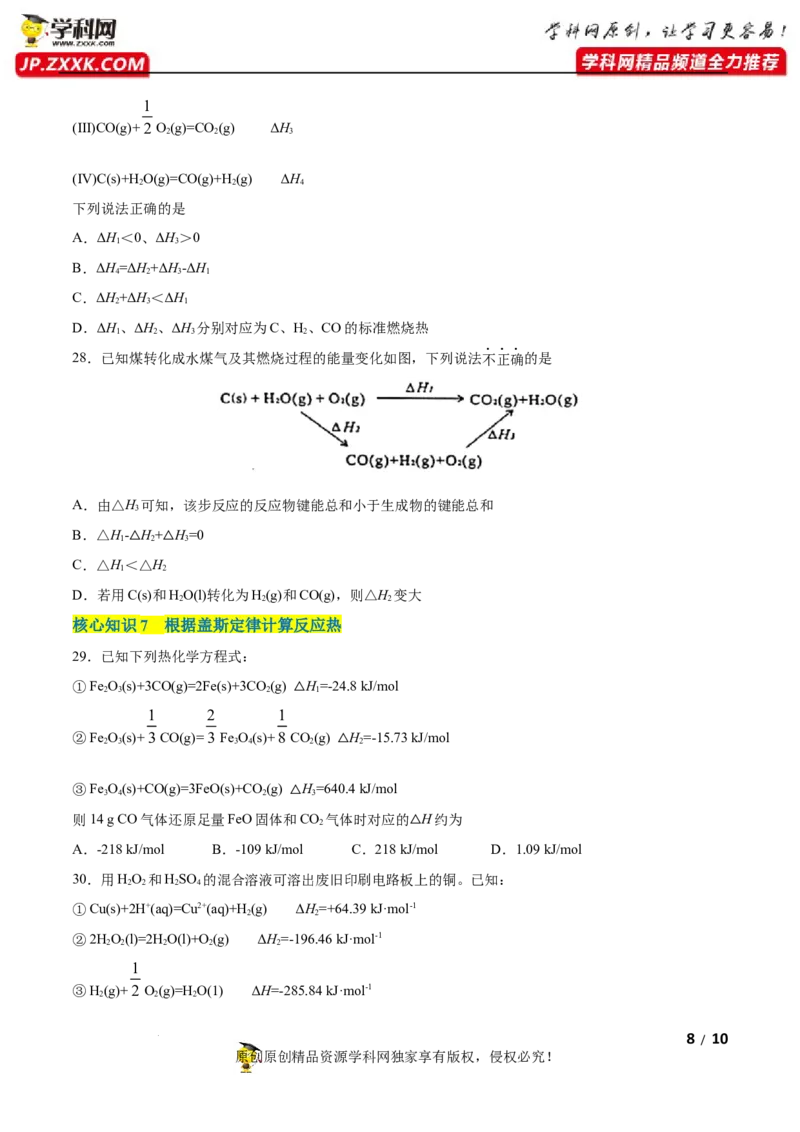
28.已知煤转化成水煤气及其燃烧过程的能量变化如图,下列说法不正确的是
A.由△H 可知,该步反应的反应物键能总和小于生成物的键能总和
3
B.△H- H+ H=0
1 2 3
C.△H<△△H△
1 2
D.若用C(s)和HO(l)转化为H(g)和CO(g),则△H 变大
2 2 2
核心知识7 根据盖斯定律计算反应热
29.已知下列热化学方程式:
①Fe O(s)+3CO(g)=2Fe(s)+3CO (g) H=-24.8 kJ/mol
2 3 2 1
1 2 1 △
②Fe O(s)+3CO(g)=3 Fe O(s)+8 CO(g) H=-15.73 kJ/mol
2 3 3 4 2 2
△
③Fe O(s)+CO(g)=3FeO(s)+CO (g) H=640.4 kJ/mol
3 4 2 3
则14 g CO气体还原足量FeO固体和△CO 气体时对应的 H约为
2
A.-218 kJ/mol B.-109 kJ/mol C.218 kJ△/mol D.1.09 kJ/mol
30.用HO 和HSO 的混合溶液可溶出废旧印刷电路板上的铜。已知:
2 2 2 4
①Cu(s)+2H+(aq)=Cu2+(aq)+H (g) ΔH=+64.39 kJ·mol-1
2 2
②2HO(l)=2H O(l)+O(g) ΔH=-196.46 kJ·mol-1
2 2 2 2 2
1
③H(g)+2 O(g)=HO(1) ΔH=-285.84 kJ·mol-1
2 2 2
8 / 10
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司在HSO 溶液中,1 mol Cu(s)与HO(l)反应生成Cu2+(aq)和HO(l)的反应热ΔH等于
2 4 2 2 2
A.-319.68 kJ·mol-1 B.-417.91 kJ·mol-1
C.-448.46 kJ·mol-1 D.+546.69 kJ·mol-1
31.发射“神五”时用肼(N H)作为火箭发动机的燃料,NO 为氧化剂,反应生成N 和水蒸气。已知:①
2 4 2 2
N(g) + 2O(g)=2NO (g) ΔH = +67.7 kJ/mol;②NH(g) + O(g)=N(g) + 2HO(g) ΔH = -534 kJ/mol。下列关于
2 2 2 2 4 2 2 2
肼和NO 反应的热化学方程式中,正确的是
2
A.2NH(g) + 2NO (g)=3N(g) + 4HO(l) ΔH =-1135.7 kJ/mol
2 4 2 2 2
B.2NH(g) + 2NO (g)=3N(g) + 4HO(g) ΔH=- 1000.3 kJ/mol
2 4 2 2 2
3
C.NH(g) + NO (g)= 2 N(g) + 2HO(l) ΔH=-1135.7 kJ/mol
2 4 2 2 2
D.2NH(g) + 2NO (g)=3N(g) + 4HO(g) ΔH=-1135.7 kJ/mol
2 4 2 2 2
32.(1)由氢气和氧气反应生成1 mol水蒸气放热241.8 kJ,写出该反应的热化学方程式:_______。若1g水
1
蒸气转化成液态水放热2.444kJ,则反应H(g)+ O(g)=HO(l)的ΔH=_______kJ/mol。氢气的燃烧热为
2 2 2 2
_______kJ/mol。
(2)火箭发射时可用肼(N H)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。已知:N(g)
2 4 2
+2O (g)=2NO (g) ΔH=+67.7 kJ/mol;NH(g)+O(g)=N(g)+2HO(g) ΔH=-534 kJ/mol;则NH 和NO 反应
2 2 2 4 2 2 2 2 4 2
的热化学方程式为_______。
9 / 10
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司10 / 10
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司