文档内容
班级 姓名 学号 分数
第一章 化学反应的热效应(B 卷·能力提升练)
(时间:75分钟,满分:100分)
一、选择题(本题共16小题,每小题3分,共48分。)
1.关于化学反应与能量的说法正确的是
A.需要加热的反应都是吸热反应
B.反应物总能量与生成物总能量一定相等
C.断裂化学键要吸收能量
D.燃烧热指的是101kPa时,1mol纯物质完全燃烧生成氧化物时所放出的热量
【答案】C
【解析】A.有的放热反应需要高温条件发生,如铝热反应是放热反应,但需要加热,故A错误;
B.化学反应过程中一定伴随能量的变化,反应物总能量与生成物总能量一定不相等,故B错误;
C.形成化学键放出能量,则断裂化学键需要吸收能量,故C正确;
D.燃烧热指的是101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,故D错误;
答案选C。
2.下列关于反应热的叙述正确的是
A.当ΔH<0时,表示该反应为吸热反应
B.1molH 与0.5molO 反应生成1mol水时放出的热量即是H 的燃烧热
2 2 2
C.热化学方程式中的化学计量数只能是整数,不能是分数
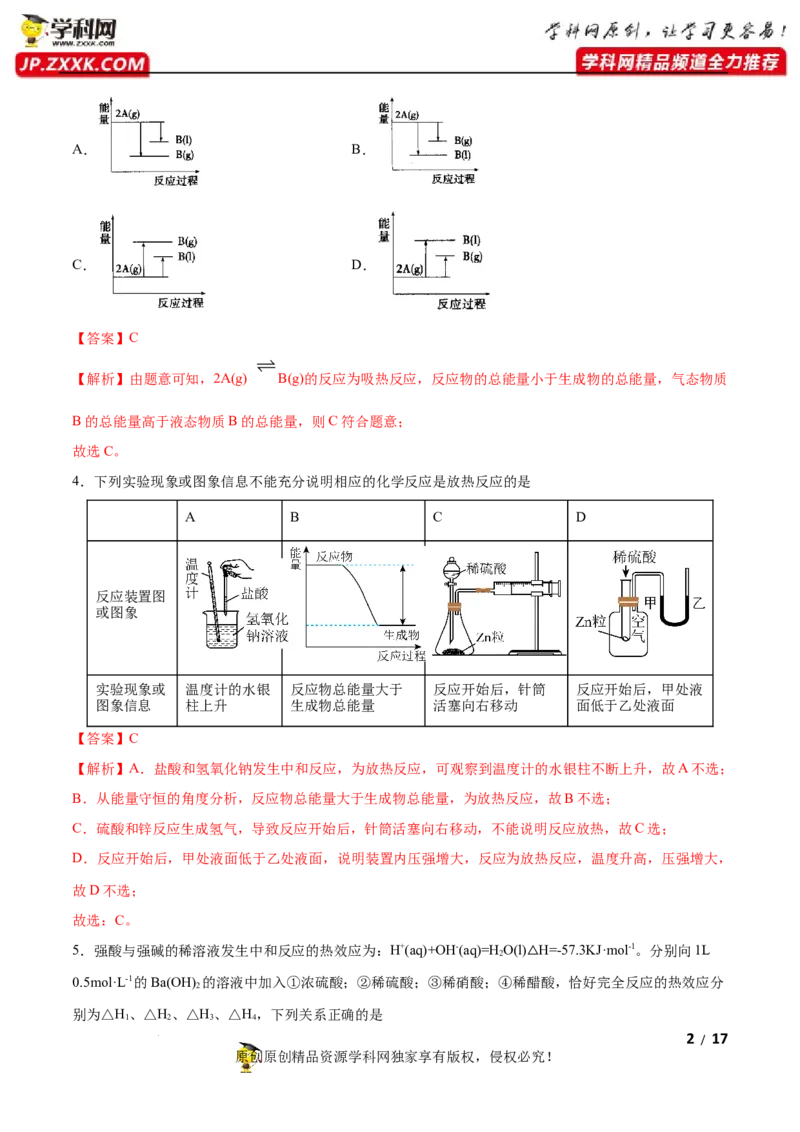
D.1molNaOH分别和1molCH COOH、1molHNO 反应放出的热量:CHCOOH0);2A(g) B(1) ∆H,下列能量变化示意图正确的是
1 1 2
1 / 17
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司A. B.
C. D.
【答案】C
【解析】由题意可知,2A(g) B(g)的反应为吸热反应,反应物的总能量小于生成物的总能量,气态物质
B的总能量高于液态物质B的总能量,则C符合题意;
故选C。
4.下列实验现象或图象信息不能充分说明相应的化学反应是放热反应的是
A B C D
反应装置图
或图象
实验现象或 温度计的水银 反应物总能量大于 反应开始后,针筒 反应开始后,甲处液
图象信息 柱上升 生成物总能量 活塞向右移动 面低于乙处液面
【答案】C
【解析】A.盐酸和氢氧化钠发生中和反应,为放热反应,可观察到温度计的水银柱不断上升,故A不选;
B.从能量守恒的角度分析,反应物总能量大于生成物总能量,为放热反应,故B不选;
C.硫酸和锌反应生成氢气,导致反应开始后,针筒活塞向右移动,不能说明反应放热,故C选;
D.反应开始后,甲处液面低于乙处液面,说明装置内压强增大,反应为放热反应,温度升高,压强增大,
故D不选;
故选:C。
5.强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H O(l) H=-57.3KJ·mol-1。分别向1L
2
0.5mol·L-1的Ba(OH) 的溶液中加入①浓硫酸;②稀硫酸;③稀硝酸;④稀醋△酸,恰好完全反应的热效应分
2
别为△H、△H、△H、△H,下列关系正确的是
1 2 3 4
2 / 17
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司A.△H> H> H > H B.△H<△H<△H <△H
1 2 3 4 1 2 3 4
C.△H>△H=△H >△H D.△H<△H= H<△H
1 2 3 4 4 1 2 3
【答案】B△ △ △ △
【分析】强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)═H O(l) ∆H=-57.3kJ/mol,表示稀溶
2
液氢离子和氢氧根离子之间反应生成1mol水放出的热量为57.3kJ。
【解析】分别向1L0.5mol•L-1的Ba(OH) 的溶液中加入:
2
①浓硫酸,浓硫酸溶于水放热,并且与Ba(OH) 生成硫酸钡沉淀也放热,放热大于57.3kJ;
2
②稀硫酸,稀硫酸与Ba(OH) 生成硫酸钡沉淀放热,放热大于57.3kJ,但小于①放出的热量;
2
③稀硝酸,是强酸和强碱的稀溶液间的中和反应,放热57.3kJ;
④稀醋酸为弱电解质,电离吸收热量,放热小于57.3kJ;
放出的热量为:①>②>③>④,因放热∆H<0,则∆H<∆H<∆H<∆H;
1 2 3 4
答案为B。
6.下列说法或表示方法正确的是
A.吸热反应一定需要加热才能发生
B.氢气与氧气反应生成等量的液态水和水蒸气,后者放出的热量多
1mol 297.3kJ SO SO ΔH=-297.3kJ/mol
C. 硫完全燃烧放热 ,其热化学方程式为: 2 2
H(aq)OH(aq)H O(1) ΔH=-57.3kJ/mol 0.5molH SO
D.在稀溶液中: 2 , ,若将含 2 4的稀硫酸与
含1.1molNaOH的稀溶液混合,放出的热量等于57.3kJ
【答案】D
【解析】A.吸热反应不一定需要加热才能发生,例如吸热反应2NH Cl(s)
4
+Ba(OH) •8H O(s)=BaCl +2NH↑+10H O常温下就能发生,A错误;
2 2 2 3 2
B.液态水到水蒸气为吸热过程,氢气与氧气反应生成等量的液态水和水蒸气,后者多了一个吸热过程,
放出的热量少,B错误;
S(s)+O (g)=SO (g) ΔH=-297.3kJ/mol
C.热化学方程式需要注明物质的状态,应为: 2 2 ,C错误;
0.5molH SO
1.1molNaOH
D.若将含 2 4的稀硫酸与含 的稀溶液混合,发生的反应为1mol氢离子与1mol
氢氧根生成1mol液态水,所以放出的热量等于57.3kJ,D正确;
答案选D。
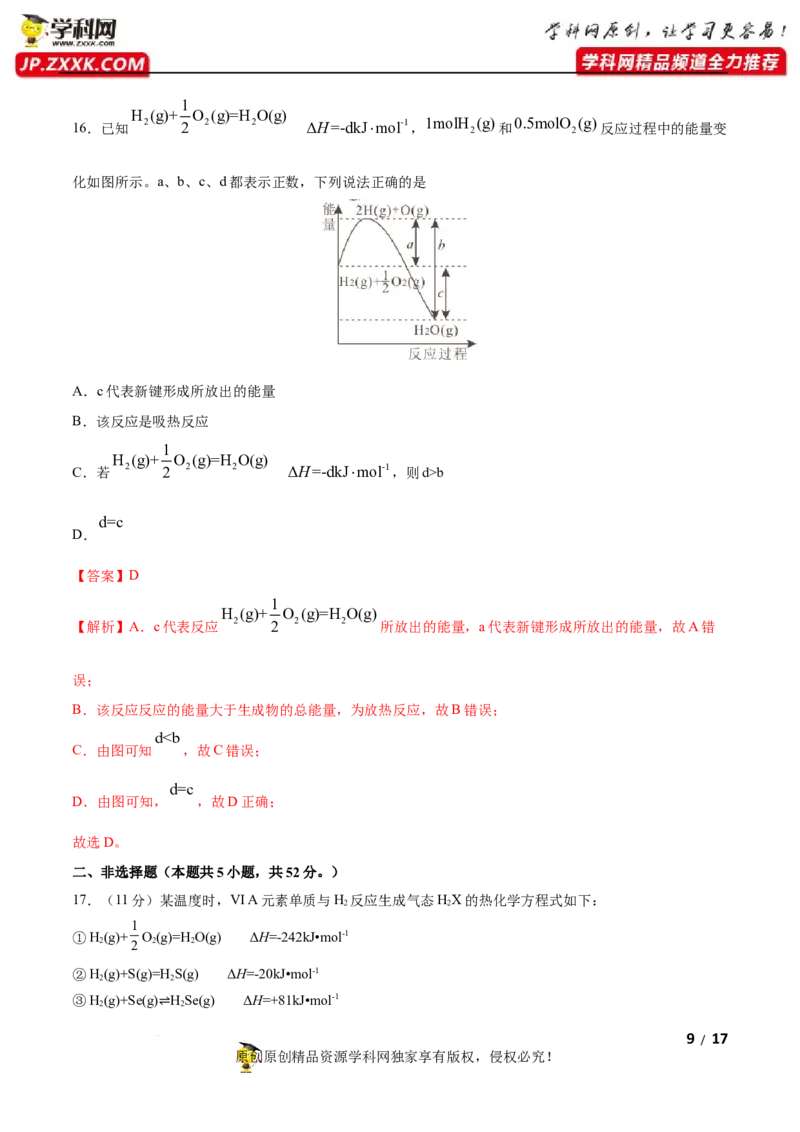
7.下面均是正丁烷与氧气反应的热化学方程式(298K,101kPa)。
3 / 17
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司C H g+O g=4CO g+5H OlΔH=-2878kJ mol-1
① 4 10 2 2 2
C H g+O g=4CO g+5H OgΔH=-2658kJ mol-1
② 4 10 2 2 2
C H g+O g=4COg+5H OlΔH=-1746kJ mol-1
③ 4 10 2 2
C H g+O g=4COg+5H OgΔH=-1526kJ mol-1
④ 4 10 2 2
由此判断,正丁烷的标准燃烧热是
A.ΔH=-2878kJ·mol-1 B.ΔH=-2658kJ·mol-1
C.ΔH=-1746kJ·mol-1 D.ΔH=-1526kJ·mol-1
【答案】A
【解析】燃烧热是指1mol物质完全燃烧生成稳定的氧化物时所放出的热量,本题要求计算正丁烷的燃烧
热,即计算1mol正丁烷完全燃烧生成气态二氧化碳和液态水时放出的热量,只有A符合要求,故选A。
8.下列热化学方程式正确的是
1
A.通常状况下,将1g氢气在氯气中完全燃烧,放出92.4kJ热量:H(g)+Cl(g)= HCl(g);ΔH=
2 2 2
+92.4kJ·mol-1
B.已知充分燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水,并放出bkJ热量:2C H(g)+5O(g)=
2 2 2
4CO(g)+2HO(l);ΔH=-4b kJ·mol-1
2 2
C.1g炭与适量水蒸气反应生成一氧化碳和氢气,需吸收10.94kJ的热量:C+H O=CO+H ΔH=+10.94
2 2
kJ·mol-1
D.已知甲烷燃烧生成二氧化碳和液态水放出的热量为55.625kJ∙g-1:CH(g)+2O(g)=CO(g)+2HO(l);
4 2 2 2
ΔH=-55.625 kJ·mol-1
【答案】B
1 1
【解析】A.放热反应的ΔH<0,正确的热化学方程式为: H(g)+ Cl(g)=HCl(g)
2 2 2 2
ΔH=-92.4kJ·mol-1,A项错误;
B.充分燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水,并放出bkJ热量,则生成4mol CO 和液态
2
水,应放出4bkJ热量,B项正确;
C.1g碳与适量水蒸气反应生成CO和H,需吸收10.94kJ热量,则1mol碳与水蒸气反应,吸收热量为
2
4 / 17
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司10.94kJ12131.28kJ
,且热化学方程式需要标注物质的聚集状态。则此反应的热化学方程式为C(s)
+H O(g)=CO(g)+H(g)ΔH=+131.28 kJ·mol-1,C项错误;
2 2
D.题目中给出的数据意义是:燃烧1g的甲烷放出55.625kJ的热量,换算成燃烧1mol甲烷放出的热量为
890kJ。故正确的热化学方程式为:CH(g)+2O(g)=CO(g)+2HO(l);ΔH=-890 kJ·mol-1,D项错误;
4 2 2 2
答案选B。
9.下图表示HO 分解时能量随反应进程的变化,下列说法正确的是
2 2
A.曲线a表示加入催化剂时能量随反应进程的变化
B.曲线b表示反应的热效应减小了
C.双氧水催化分解不需要加热,由此推测,催化剂存在下的分解都不需要加热
D.该反应的热化学方程式:2HO(l)=2H O(l)+O(g) ΔH= -2(m-n)kJ·mol-1
2 2 2 2
【答案】D
【解析】A.加入催化剂,降低活化能,b为加入催化剂的曲线,故A错误;
B.催化剂只通过改变活化能来改变反应速率,不改变反应的热效应,故B错误;
C.催化剂与反应条件是否需要加热无必然联系,如KClO 分解需要MnO 催化剂,也需要加热,故C错误;
3 2
D.图象分析判断反应是放热反应,热化学方程式要注明状态,同时和计量数有关,所以HO 分解的热化
2 2
学方程式:2HO(l)=2H O(l)+O(g) ΔH= -2(m-n)kJ·mol-1,故D正确;
2 2 2 2
故选:D。
10.在同温同压下,下列各组热化学方程式中, H> H 的是
2 1
A.2H(g)+O(g) =2H O(g) H;2H(g)+O(g) =2△H O(△l) H
2 2 2 1 2 2 2 2
B.S(g)+O(g)=SO(g) H;△ S(s) +O(g)=SO(g) H △
2 2 1 2 2 2
1 △ △
C.C(s)+2 O(g)=CO(g) H;C(s)+O(g)=CO (g) H
2 1 2 2 2
△ △
D.H(g)+Cl (g) =2HC1(g) H;2H(g)+2Cl (g) =4HC1(g), H
2 2 1 2 2 2
【答案】B △ △
5 / 17
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司【解析】A.后者氢气燃烧生成液态水放出的热量多,但放热越多,则 H< H,故A不符合题意;
2 1
B.气态硫的能量要高于固态硫的能量,因此前者放出的能量多,则 H△> H△,故B符合题意;
2 1
△ △
C.前者是不完全燃烧,放热少,后者是完全燃烧,放热多,则 H< H,故C不符合题意;
2 1
D.后者的化学计算数扩大2倍,后者放出的热量多 ,则 H<△H,△故D不符合题意;
2 1
本题答案B。 △ △
11.已知:氧化锂(Li O)晶体形成过程中的能量变化如图所示。
2
下列说法正确的是
A.ΔH>0,ΔH<0
1 2
B.ΔH+ΔH +ΔH +ΔH +ΔH -ΔH =0
1 2 3 4 6 5
C.ΔH<0,ΔH<0
3 4
D.ΔH+ΔH +ΔH +ΔH =ΔH +ΔH
1 2 3 4 5 6
【答案】B
【解析】A.Li晶体转化为Li(g)是吸热过程,Li(g)→Li+(g)是失电子过程吸热,即 H>0、 H>0,故A错
1 2
误; △ △
B.由盖斯定律可知, H + H2 + H+ H + H = H ,即 H + H + H+ H + H - H =0,故
1 3 4 6 5 1 2 3 4 6 5
B正确; △ △ △ △ △ △ △ △ △ △ △ △
C. O(g)到O(g)是键断裂过程吸热,O(g)→O2-(g)是得电子过程放热,即 H>0、 H <0,故C错误;
2 3 4
△ △
D.由盖斯定律可知, H + H + H+ H + H = H ,故D错误;
1 2 3 4 6 5
故答案为B。 △ △ △ △ △ △
12.已知:
N
2
g+3F
2
g=2NF
3
g
的
ΔH=281kJmol1
。其中相关的键能数据如下表所示,则x的
值为
化学键 N N F—F N—F
6 / 17
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司键能/kJ·mol-1 946 x 283
A.471 B.157 C.138 D.756
【答案】B
【解析】化学反应中断裂化学键吸收能量,形成化学键放出能量,反应热等于反应物的总键能减去生成物
N g3F g2NF g ΔH 9463x2836kJmol1 281kJmol1
的总键能,所以反应 2 2 3 ,
x157kJmol1
。故选B。
13.已知HO(g)=HO(1) ΔH=Q kJ•mol-1,
2 2 1
C HOH(g)=C HOH(1) ΔH=Q kJ•mol-1,
2 5 2 5 2
C HOH(g)+3O (g)=2CO(g)+3HO(g) ΔH=Q kJ•mol-1
2 5 2 2 2 3
若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量为 kJ
A.Q+Q +Q B.0.5(Q +Q +Q )
1 2 3 1 2 3
C.0.5Q —1.5Q +0.5Q D.1.5Q —0.5Q +0.5Q
1 2 3 1 2 3
【答案】D
【解析】将已知式子依次编号为①②③,由盖斯定律可知,①×3—②+③可得热化学方程式C HOH(1)
2 5
23g
+3O (g)=2CO (g)+3HO(l) ΔH=(3Q —Q+Q ) kJ•mol-1,23g乙醇的物质的量为46g/mol =0.5mol,由热化学
2 2 2 1 2 3
方程式可知完全燃烧生成液态水放出的热量为0.5mol×(3Q —Q+Q ) kJ•mol-1=(1.5Q —0.5Q +0.5Q ) kJ,故
1 2 3 1 2 3
选D。
14.已知:一些烷烃的燃烧热(101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量)如表:
化合物 甲烷 乙烷 丙烷
燃烧热△H/
-891.0 -1560.8 -2221.5
(kJ·mol-1)
下列说法中正确的是
891.0
A.C—H键的键能为 kJ·mol-1
4
7
B.乙烷燃烧的热化学方程式为C H(g)+ O(g)=2CO (g)+3HO(g) H=-1560.8kJ·mol-1
2 6 2 2 2 2
△
C.等质量的三种烷烃完全燃烧,丙烷放出的热量最多
7 / 17
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司D.由表中数据不能确定C—C键的键能
【答案】D
891.0
【解析】A.燃烧热不是燃料的键能和,故C—H键的键能不是
kJ×mol-1
,选项A项错误;
4
H O
2
B.乙烷燃烧的热化学方程式中 应为液体,B项错误;
C.1g甲烷、乙烷、丙烷完全燃烧放出的热量分别是891.0/16kJ、1560.8/30kJ、2221.5/44kJ,甲烷放出的热
量最多,C项错误;
7
D.由乙烷燃烧的热化学方程式C H g+ O g 2CO g+3H O1 可知,
2 6 2 2 2 2 ΔH=-1560.8kJ×mol-1
ΔH 反应物的键能和生成物的键能和,反应物和生成物中涉及的共价键有C—H键、C—C键、O=O键、
C=O键和H—O键,共五个量,已知三种烷烃的燃烧热,只能列出3个代数方程,故不能计算C—C键的
键能,D项正确。
答案选D。
15. CO 是一种廉价的碳资源,其综合利用具有重要意义,用 CO 与NH 为原料合成尿素
2 2 3
CONH 2 2 是固定和利用CO 2 的成功范例。
已知:①2NH
3
(g)+CO
2
(g)=NH
2
COONH
4
(s) ΔH=-159.5kJ
mol-1
②NH
2
COONH
4
(s)=CONH
2
2
(s)+H
2
O(g) ΔH=+72.5kJ
mol-1
③H
2
O(1)=H
2
O(g) ΔH=+44.0kJ
mol-1
则:反应2NH
3
(g)+CO
2
(g)=CONH
2
2
(s)+H
2
O(1)的ΔH为
A.87.0kJmol1 B.131.0kJmol1
C.131.0kJmol1 D.43.0kJmol1
【答案】B
【解析】已知①2NH
3
(g)+CO
2
(g)=NH
2
COONH
4
(s) ΔH=-159.5kJ
mol-1
②NH
2
COONH
4
(s)=CONH
2
2
(s)+H
2
O(g) ΔH=+72.5kJ
mol-1
③H
2
O(1)=H
2
O(g) ΔH=+44.0kJ
mol-1
2NH (g)+CO (g)=CONH (s)+H O(1)
根据盖斯定律:则:①+②-③可得反应
3 2 2 2 2
的ΔH为72.5kJ/
mol-159.5 kJ/mol-44.0 kJ/mol=-131kJ/mol,答案选B。
8 / 17
原创原创精品资源学科网独家享有版权,侵权必究!
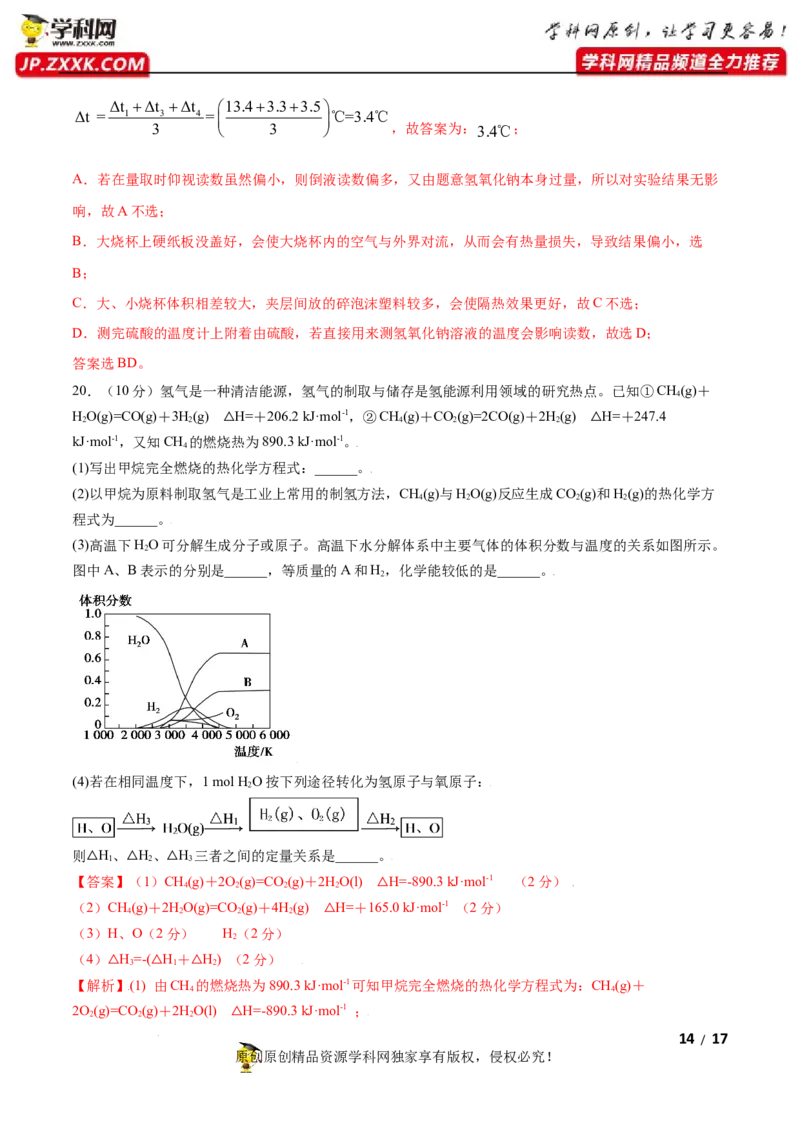
学科网(北京)股份有限公司1
H (g)+ O (g)=H O(g)
16.已知 2 2 2 2 ΔH=-dkJmol-1, 1molH (g) 和 0.5molO (g) 反应过程中的能量变
2 2
化如图所示。a、b、c、d都表示正数,下列说法正确的是
A.c代表新键形成所放出的能量
B.该反应是吸热反应
1
H (g)+ O (g)=H O(g)
C.若 2 2 2 2 ΔH=-dkJmol-1,则d>b
d=c
D.
【答案】D
1
H (g)+ O (g)=H O(g)
【解析】A.c代表反应 2 2 2 2 所放出的能量,a代表新键形成所放出的能量,故A错
误;
B.该反应反应的能量大于生成物的总能量,为放热反应,故B错误;
d”“<”或“=”)。
1
CH OH(l) O (g)CO (g)2H O(g)
(2)已知:CHOH(l)的燃烧热 H=-726.5 k·mol-1; 3 2 2 2 2 H。则
3 1 2
△ △
H______ H(填“>”“<”或“=”)。
1 2
△(3)使 Cl△(g)和HO(g)通过灼热的炭层,生成HCl(g)和 CO(g)。每消耗1mol Cl (g)放出 145 kJ 热量,则
2 2 2 2
该反应的热化学方程式为______。
(4)火箭和导弹表面的涂层是耐高温的物质。将铝粉、二氧化钛粉和石墨粉按一定比例混合在高温下煅
4Al(s)+3TiO (s)+3C(s)=2Al O (s)+3TiC(s)
烧,所得物质可作耐高温材料,反应的热化学方程式为 2 2 3
H =-1176 kJ·mol-1。则反应过程中,每转移 2 mol 电子,放出的热量为______ kJ。
△【答案】(1)<(2分)
(2)> (2分)
2Cl (g)2H O(g)C(s)=4HCl(g)CO (g)
(3) 2 2 2 H=-290 kJ·mol-1(3分)
△
(4)196(2分)
【解析】(1)有机物 M 经过太阳光光照可转化成有机物 N,△H>0,吸收能量,能量越低越稳定,故
两者稳定性大小是:N H;故答案为:>;
1 2
(3)使 Cl(g)和HO(g)通过灼热△的炭△层,生成HCl(g)和 CO(g)。每消耗1mol Cl (g)放出 145 kJ 热量,则
2 2 2 2
2Cl (g)2H O(g)C(s)=4HCl(g)CO (g)
该反应的热化学方程式为: 2 2 2 H=-290 kJ·mol-1;故答案为:
△
2Cl (g)2H O(g)C(s)=4HCl(g)CO (g)
2 2 2 H=-290 kJ·mol-1;
△
4Al(s)+3TiO (s)+3C(s)=2Al O (s)+3TiC(s)
(4) 2 2 3 H =-1176 kJ·mol-1,由反应方程式可知,反应过
△
1176kJ
程中,每转移12mol电子,放出1176kJ的热量,所以每转移 2 mol 电子,放出的热量为: 12
×2=196kJ,故答案为:196。
16 / 17
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司17 / 17
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司