文档内容
第五章 化工生产中的重要非金属元素
第1节 硫及其化合物
(第2课时 硫酸及不同价态含硫物质的转化 )
一、选择题
1.下列变化需要加入氧化剂才能实现的是
A.SO →SO B.HSO →Na SO
3 2 2 4 2 4
C.S→SO D.HSO →SO
2 2 4 2
【答案】C
【解析】
氧化还原反应的特征是有化合价升降,氧化剂得电子发生还原反应,具有氧化性,需要加
入氧化剂的反应为氧化反应,所含元素化合价升高,据此分析判断。
A.由SO 转化为SO ,硫元素化合价降低,不符合题意,故A不选;
3 2
B.由HSO 转化为NaSO ,硫元素化合价不变,不符合题意,故B不选;
2 4 2 4
C.由S转化为SO ,硫元素化合价升高,符合题意,故C选;
2
D.由HSO 转化为SO ,硫元素化合价降低,不符合题意,故D不选;
2 4 2
答案选C。
2.下列有关说法正确的是
A.用饱和Na SO 溶液可除去SO 中含有的HCl杂质
2 3 2
B.浓硫酸具有吸水性,因而能使蔗糖碳化
C.SO 能使品红溶液褪色,是因为SO 具有漂白性
2 2
D.常温下,铁、铝不与浓硫酸发生反应
【答案】C
【详解】
A.SO 与饱和NaSO 溶液反应,因此用饱和NaHSO 溶液可除去SO 中含有的HCl杂质,
2 2 3 3 2
故A错误;
B.浓硫酸具有脱水性,因而能使蔗糖碳化,故B错误
C.SO 具有漂白性,因此SO 能使品红溶液褪色,故C正确;
2 2
D.常温下,铁、铝与浓硫酸发生钝化,故D错误。
综上所述,答案为C。
学科网(北京)股份有限公司3.双碱法脱硫过程如图所示。下列说法不正确的是
A.过程Ⅰ中, 表现出酸性氧化物的性质
B.过程Ⅱ中,1mol 可氧化2mol
C.总反应为
D.双碱法脱硫过程中, 可以循环利用
【答案】D
【详解】
A.过程Ⅰ的化学方程式为:SO +2NaOH=Na SO +H O,即酸性氧化物与碱反应生成盐和
2 2 3 2
水,SO 表现出酸性氧化物的性质,故A正确;
2
B.过程Ⅱ中,O 中氧元素的化合价从0价降低到-2价,则O 做氧化剂,每1molO 可得到
2 2 2
4mol电子,NaSO 中硫元素的化合价从+4价升高到+6价,则每1molNa SO 被氧化时,失
2 3 2 3
去2mol电子,根据得失电子守恒可知,1mol O 可氧化2molNa SO ,故B正确;
2 2 3
C.总反应的反应物为 、SO 和O,生成物为CaSO,O 中氧元素的化合价从0
2 2 4 2
价降低到-2价,SO 中硫元素的化合价从+4价升高到+6价,根据元素化合价升降总数守恒
2
以及原子守恒可知总反应为 ,故C正确;
D.双碱法脱硫过程中,过程Ⅰ消耗NaOH,过程Ⅱ会生成NaOH,NaOH参与了反应,可
循环利用, 不能循环利用,故D错误;
故选D。
4.用下列方案进行某些离子的检验,其中方案设计最严谨的是
学科网(北京)股份有限公司A.检验试液中含Cl-:试液 有白色沉淀 沉淀不溶解
B.检验试液中含SO :试液 无沉淀 白色沉淀
C.检验试液中含I-:试液 黄色溶液 深黄色溶液
D.检验试液中含SO :试液 有白色沉淀 沉淀溶解
【答案】B
【详解】
A.不能用稀盐酸检验白色沉淀是不是氯化银,故A不选;
B.先加入足量稀盐酸,无沉淀,排除其它离子的干扰,再加入氯化钡溶液产生白色沉淀,
说明原溶液中一定含硫酸根离子,故B选;
C.淀粉遇碘变蓝,但加入淀粉溶液后显深黄色,说明没有产生单质碘,因此不能确定原
溶液中是否含有碘离子,故C不选;
D.白色沉淀可能为碳酸钡,不能确定是否含亚硫酸根离子,也可能二者均有,故D不选;
故选B。
5.自然界中不同价态硫元素之间的转化如图所示,下列说法正确的是
A.上图中,酸雨的含硫成分只有 ,由 溶于水生成
B.芒硝在浓硫酸中失水的过程体现了浓硫酸的脱水性
C.黄铁矿燃烧产生的尾气,与空气混合后通入碳酸钙的浆状物,可用来制备石膏
D.凝聚法是将 通入 稀溶液中得到S胶体,该反应中氧化剂:还原剂=2:1
【答案】C
学科网(北京)股份有限公司【详解】
A.酸雨的含硫成分有硫酸和亚硫酸,故A错误;
B.芒硝是 失水后生成 ,体现了浓硫酸的吸水性,浓硫酸的脱水是
指无水去“H”“O”形成水的过程,故B错误;
C.黄铁矿燃烧产生 和氧化铁,其中尾气是 , 与空气混合后通入碳酸钙生成硫
酸钙,可用来制备石膏,故C正确;
D. 与 的反应为: ,该反应中氧化剂是 ,还原剂是 ,
比值为 ,故D错误;
故选C。
6.含S元素的某钠盐a能发生如图转化。下列说法错误的是
A.c为不溶于盐酸的白色沉淀 B.d可漂白纸浆,不可用于杀菌
C.a可能为正盐,也可能为酸式盐 D.反应②中还可能生成淡黄色沉淀
【答案】B
【解析】
由图中转化可知,含S元素的某钠盐a与氯气反应生成溶液b,与稀盐酸反应生成刺激性气
体d,d能被酸性高锰酸钾氧化,可知d为SO ;溶液b与氯化钡反应生成白色沉淀c为
2
BaSO,则溶液a为NaSO 或NaHSO、NaSO 等,以此来解答。
4 2 3 3 2 2 3
A.c为BaSO,既不溶于水,也不溶于盐酸,A正确;
4
B.d为SO ,该气体具有漂白性,可漂白纸浆,也具有一定毒性,可以使细菌的蛋白质发
2
生变性而失去其生理作用,因此也能够用于杀菌消毒,B错误;
C.溶液a为NaSO 或NaHSO 等,则a可能为正盐,也可能为酸式盐,C正确;
2 3 3
D.若a为NaSO,反应②中还可能生成淡黄色沉淀S,D正确;
2 2 3
故合理选项是B。
7.连二亚硫酸钠(Na SO)俗称保险粉,有强还原性,在空气中极易被氧化。用NaHSO 还
2 2 4 3
原法制备保险粉的流程如下:
学科网(北京)股份有限公司下列说法错误的是
A.反应1说明酸性:HSO >H CO
2 3 2 3
B.反应2中消耗的氧化剂和还原剂的物质的量之比为1∶2
C.反应2最好在无氧条件下进行
D.反应1结束后,可用盐酸酸化的BaCl 溶液检验NaHSO 是否被氧化
2 3
【答案】B
【解析】
由题给流程可知,碳酸钠溶液与二氧化硫反应生成亚硫酸氢钠和二氧化碳,亚硫酸氢钠溶
液与锌粉反应生成连二亚硫酸钠和氢氧化锌,连二亚硫酸钠溶液结晶脱水得到连二亚硫酸
钠。
A.由分析可知,反应1为碳酸钠溶液与二氧化硫反应生成亚硫酸氢钠和二氧化碳,由强
酸制弱酸的原理可知,亚硫酸的酸性强于碳酸,故A正确;
B.由分析可知,反应2为亚硫酸氢钠溶液与锌粉反应生成连二亚硫酸钠和氢氧化锌,反
应中亚硫酸氢钠为反应的氧化剂,锌为还原剂,由得失电子数目守恒可知氧化剂和还原剂
的物质的量之比为2∶1,故B错误;
C.由题意可知,连二亚硫酸钠有强还原性,在空气中极易被氧化,则制备连二亚硫酸钠
时,反应2最好在无氧条件下进行,故C正确;
D.亚硫酸氢钠溶液不能与氯化钡溶液反应,若亚硫酸氢钠溶液被氧化,加入酸化氯化钡
溶液会与硫酸根离子反应生成白色硫酸钡沉淀,则反应1结束后,可用盐酸酸化的氯化钡
溶液检验亚硫酸氢钠是否被氧化,故D正确;
故选B。
8.硫在自然界中的循环过程如下图所示,下列说法不正确的是
学科网(北京)股份有限公司A.石油和煤等化石燃料中含有硫元素
B.大气中的二氧化硫只来源于火山喷发产生的气体
C.地壳中的硫元素常以硫化物和硫酸盐的形式存在
D.动植物遗体被微生物分解后,可产生SO 和SO
2
【答案】B
【详解】
A.石油和煤中主要含有C和H,也含有少量的S、N等元素,故A正确;
B.由图可知,大气中的二氧化硫来源于火山爆发、动植物遗体的排泄物或被微生物分解、
煤和石油等化石燃料的燃烧等,另硫酸工业的尾气等也含有SO ,故B错误;
2
C.由图可知,土壤或水体中的硫元素以硫酸根离子形式存在,另外地壳中还含有含硫元
素的矿物,如黄铁矿、黄铜矿等,故C正确;
D.由图可知,动植物遗体被微生物分解后,可产生SO 和SO ,故D正确。
2
故选:B。
9.用如图所示装置进行实验,下列对试管①中的试剂及实验现象的解释不合理的是
选项 试剂 现象 解释
A 品红溶液 溶液褪色 SO 具有漂白性
2
B Ba(NO ) 溶液 生成白色沉淀 SO 与Ba2+生成白色沉淀BaSO
3 2 3
C 紫色石蕊溶液 溶液变红 SO 与水反应生成酸
2
学科网(北京)股份有限公司D 酸性KMnO 溶液 紫色褪去 SO 具有还原性
4 2
A.A B.B C.C D.D
【答案】B
【分析】
Cu和浓HSO 在加热条件下反应生成SO 。
2 4 2
【详解】
A.SO 具有漂白性,能使品红溶液褪色,A项正确;
2
B.SO 通入Ba(NO ) 溶液中,酸性条件下,NO 将SO 氧化为SO ,得到BaSO 沉淀,B
2 3 2 2 4
项错误;
C.SO 与水反应生成HSO ,使紫色石蕊溶液变红,C项正确;
2 2 3
D.SO 具有还原性,能与酸性KMnO 溶液反应而使溶液褪色,D项正确;
2 4
答案选B。
10.下列现象与用途和浓硫酸的脱水性有关的是
A.浓硫酸可作氯气的干燥剂
B.浓硫酸加到蔗糖中,蔗糖变黑
C.浓硫酸加到胆矾上,蓝色晶体变成白色粉末
D.浓硫酸与铜反应制取二氧化硫
【答案】B
【详解】
A.浓硫酸和氯气不反应,浓硫酸作氯气的干燥剂,体现了吸水性,A项错误;
B.浓硫酸将蔗糖中的H、O元素以2∶1的比例脱去而体现脱水性,B项正确;
C.浓硫酸加到胆矾上,蓝色晶体变成白色粉末,体现了吸水性,C项错误;
D.浓硫酸和铜发生氧化还原反应体现其强氧化性和酸性,D项错误;
故选B。
11.在硫酸的工业制法中,下列生产操作与说明生产操作的主要原因二者都正确的是
A.硫铁矿煅烧前要粉碎,因为大块硫铁矿不能燃烧
B.从沸腾炉出来的气体只有SO
2
C.SO 氧化成SO ,SO 能全部转化为SO
2 3 2 3
学科网(北京)股份有限公司D.SO 用98.3%的浓HSO 吸收,目的是防止形成酸雾,以便使SO 吸收更充分
3 2 4 3
【答案】D
【详解】
A.将硫铁矿粉碎是使其增大与空气的接触面积,使燃烧更快、更充分,并不是大块硫铁
矿不能燃烧,故A错误;
B.从沸腾炉出来的气体除SO 外,还有O 等,故B错误;
2 2
C.SO 转化为SO 为可逆反应,正、逆反应同时进行,故SO 不可能全部转化为SO ,故
2 3 2 3
C错误;
D.SO 转化为HSO ,若直接用水吸收,会形成大量酸雾,导致SO 吸收不完全,工业生
3 2 4 3
产中用98.3%的浓硫酸作为吸收剂,则不会出现酸雾,吸收SO 更充分,故D正确;
3
故选D。
12.物质的类别和核心元素的化合价是研究物质化学性质的两个重要角度。某短周期元素
的单质及其部分化合物的价类二维图如图所示。下列推断合理的是
A.a到b、c、d、e、f均可直接转化
B.标准状况下,1molb和c的混合物体积为22.4L
C.可先加盐酸,再加氯化钡溶液检验e的钠盐是否变质
D.f的水溶液在空气中放置,不易被氧化
【答案】C
【详解】
A.由图示知,A为S单质,结合反应:S+O SO 、3S+6NaOH
2 2
2NaS+Na SO +3H O、S+3Na O(熔融) NaSO +2Na O,知a可以直接转化为c、d、e、
2 2 3 2 2 2 2 4 2
f,但S与O 反应不能一步到SO (b),A不合理;
2 3
学科网(北京)股份有限公司B.标准状况下,SO 非气体,故1 mol SO 和SO 混合物体积小于22.4 L,B不合理;
3 2 3
C.e的钠盐为NaSO 或NaHSO,若变质,则会生成NaSO ,可通过先加入盐酸,再加入
2 3 3 2 4
氯化钡溶液检验是否有硫酸根确认其是否变质,C合理;
D.化合物f中硫元素为-2价,容易被空气中氧气氧化成S而变质,D不合理;
故答案选C。
二、非选择题
13.按下图装置进行实验,可证明碳与浓硫酸反应放出的气体是SO 和CO 。
2 2
(1)木炭与浓硫酸反应的化学方程式是___________,该反应的氧化剂为___________(填
化学式)。
(2)洗气瓶①②中溶液褪色,体现的二氧化硫的性质依次为___________(填字母)。
A.氧化性、还原性 B.漂白性、还原性
C.漂白性、氧化性 D.还原性、漂白性
【答案】
(1) C+2H SO (浓) CO↑+2SO↑+2H O 浓HSO
2 4 2 2 2 2 4
(2)B
【解析】
木炭和浓硫酸在加热条件下反应生成CO、SO 、HO,①中品红溶液褪色证明反应生成了
2 2 2
SO ,用②中酸性高锰酸钾溶液除去SO ,用③证明SO 已除尽,用④检验反应生成了
2 2 2
CO。
2
(1)
木炭和浓硫酸在加热条件下反应生成CO、SO 、HO,反应的化学方程式为C+2H SO (浓)
2 2 2 2 4
学科网(北京)股份有限公司CO↑+2SO↑+2H O;S的价态降低,被还原,浓HSO 作氧化剂;
2 2 2 2 4
(2)
①中品红溶液褪色证明SO 具有漂白性,酸性高锰酸钾溶液有强氧化性,②中酸性高锰酸
2
钾溶液褪色证明SO 具有还原性,选B。
2
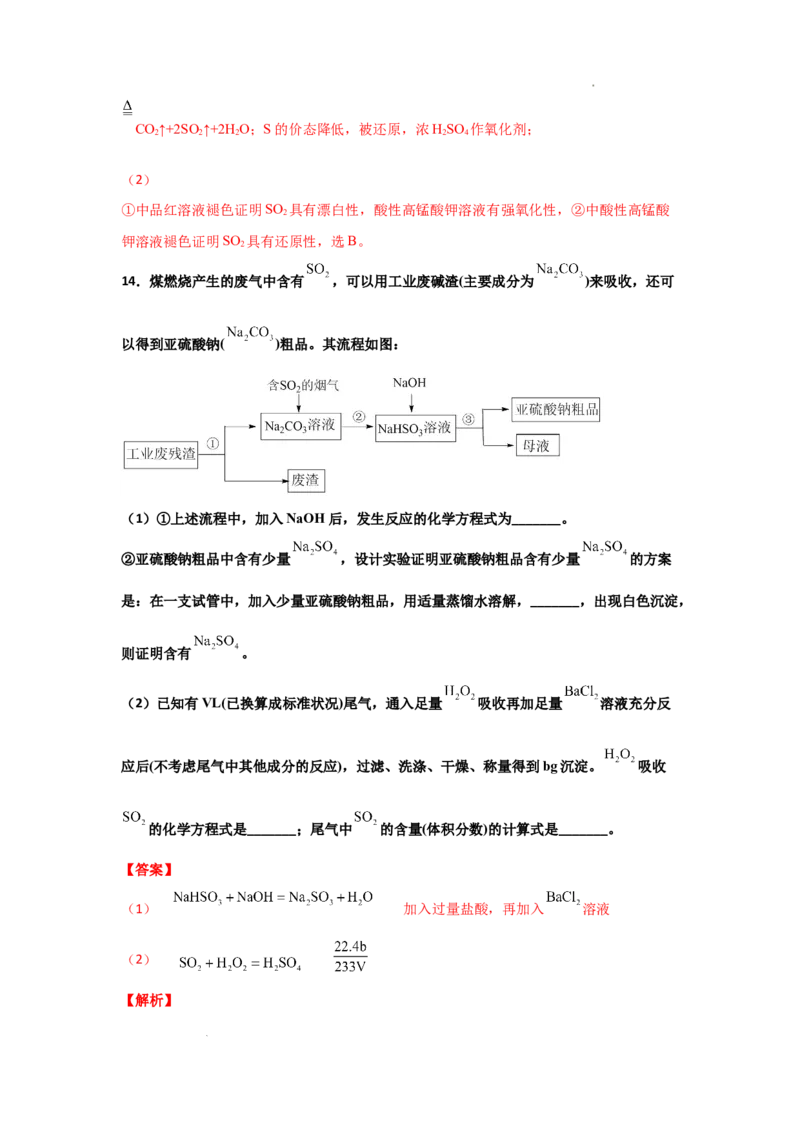
14.煤燃烧产生的废气中含有 ,可以用工业废碱渣(主要成分为 )来吸收,还可
以得到亚硫酸钠( )粗品。其流程如图:
(1)①上述流程中,加入NaOH后,发生反应的化学方程式为_______。
②亚硫酸钠粗品中含有少量 ,设计实验证明亚硫酸钠粗品含有少量 的方案
是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,_______,出现白色沉淀,
则证明含有 。
(2)已知有VL(已换算成标准状况)尾气,通入足量 吸收再加足量 溶液充分反
应后(不考虑尾气中其他成分的反应),过滤、洗涤、干燥、称量得到bg沉淀。 吸收
的化学方程式是_______;尾气中 的含量(体积分数)的计算式是_______。
【答案】
(1) 加入过量盐酸,再加入 溶液
(2)
【解析】
学科网(北京)股份有限公司(1)①上述流程中,加入NaOH后亚硫酸氢钠和氢氧化钠反应后生成亚硫酸钠和水,发生
反应的化学方程式为 。
②亚硫酸钠会干扰 的检验,需要先用盐酸除去亚硫酸钠,则证明亚硫酸钠粗品含有
少量 的方案是:在一支试管中,加入少量亚碗酸钠粗品,用适量蒸馏水溶解,加入
过量盐酸,再加入 溶液,出现白色沉淀,则证明含有 。
(2) 吸收 发生氧化还原反应生成硫酸,反应的化学方程式是
;bg沉淀是硫酸钡,物质的量是 ,根据硫原子守恒可知尾气
中 的含量(体积分数)的计算式是 。
15.某学习小组欲利用如下装置制备SO ,并检验SO 的性质和制取食品抗氧化剂焦亚硫
2 2
酸钠(Na SO)。
2 2 5
(1)检查A装置气密性的方法是___________。
(2)用A装置制备SO ,最适宜的试剂为___________(填序号)。
2
a.10%硫酸、Na SO 固体 b.98%浓硫酸、铜片
2 3
c.70%浓硫酸、Na SO 固体 d.60%浓硝酸、Na SO 固体
2 3 2 3
(3)加好药品,打开K、关闭K。已知:E装置中盛放FeCl 和BaCl 的混合溶液。
1 2 3 2
学科网(北京)股份有限公司①若D装置的作用是检验SO 的漂白性,则D装置中通常盛放的试剂是___________。
2
②用离子方程式表示E装置中发生的反应:___________。
③C装置的作用是___________。F装置中可选用的试剂是___________(填序号)。
a.浓硫酸 b.氢氧化钠溶液 c.酸性高锰酸钾溶液
(4)B装置中盛放的是Na SO 饱和溶液。打开K、关闭K 一段时间后B装置中有
2 3 2 1
Na SO 晶体析出,B装置中发生反应的化学方程式为___________。
2 2 5
【答案】
(1)关闭K 和K 后,向分液漏斗中加水,分液漏斗中形成一段稳定的水柱,则A装置气
1 2
密性良好
(2)c
(3) 品红溶液 Ba2++SO+2Fe3++2H O=BaSO↓+2Fe2++4H+ 吸收SO ,进行尾气
2 2 4 2
处理 bc
(4)SO +Na SO = Na SO↓
2 2 3 2 2 5
【解析】
本实验是采用实验制备SO ,并探究SO 的性质和制取食品抗氧化剂焦亚硫酸钠
2 2
(Na SO),装置A为SO 的发生装置,通常用70%浓硫酸和NaSO 固体,反应原理为:
2 2 5 2 2 3
NaSO +H SO =Na SO +H O+SO ↑,D中装品红溶液可以验证SO 的漂白性,E装置中盛放
2 3 2 4 2 4 2 2 2
FeCl 和BaCl 的混合溶液,反应原理为Ba2++SO+2Fe3++2H O=BaSO↓+2Fe2++4H+,可以验
3 2 2 2 4
证SO 的还原性,B中装有饱和NaSO 溶液,制取焦亚硫酸钠(Na SO),反应原理为:
2 2 3 2 2 5
SO +Na SO = Na SO↓,C和F均为尾气处理装置,据此分析解题。
2 2 3 2 2 5
(1)由实验装置图可知,检查A装置气密性的方法是:关闭K 和K 后,向分液漏斗中加
1 2
水,分液漏斗中形成一段稳定的水柱,则A装置气密性良好,故答案为:关闭K 和K 后,
1 2
向分液漏斗中加水,分液漏斗中形成一段稳定的水柱,则A装置气密性良好;
(2)a.10%硫酸、NaSO 固体:硫酸浓度太小,反应速率慢,且SO 易溶于水,a不合题
2 3 2
意;
b.98%浓硫酸、铜片:铜与浓硫酸反应需要加热装置,图中没有加热装置,b不合题意;
c.70%浓硫酸、NaSO 固体:硫酸浓度适中,反应原理为:
2 3
NaSO +H SO =Na SO +H O+SO ↑,c符合题意;
2 3 2 4 2 4 2 2
d.60%浓硝酸、NaSO 固体:NaSO 与硝酸发生氧化还原反应,将生成NO 等气体,得
2 3 2 3 2
不到SO ,d不合题意;
2
故答案为:c;
学科网(北京)股份有限公司(3)①高中阶段通常用SO 使品红溶液褪色来验证SO 的漂白性,若D装置的作用是检验
2 2
SO 的漂白性,则D装置中通常盛放的试剂是品红溶液,故答案为:品红溶液;
2
②已知:E装置中盛放FeCl 和BaCl 的混合溶液,由于SO 具有还原性,能够还原Fe3+,
3 2 2
自身氧化为 , 与Ba2+结合生成白色沉淀BaSO, E装置中发生的反应的离子方程
4
式为:Ba2++SO+2Fe3++2H O=BaSO↓+2Fe2++4H+,故答案为:Ba2++SO+2Fe3+
2 2 4 2
+2H O=BaSO↓+2Fe2++4H+;
2 4
③由实验装置图可知,C装置的作用是吸收SO ,进行尾气处理,F装置的作用是吸收
2
SO ,进行尾气处理,故F装置中可选用的试剂是氢氧化钠溶液和酸性高锰酸钾溶液,故答
2
案为:吸收SO ,进行尾气处理;bc;
2
(4)B装置中盛放的是NaSO 饱和溶液,打开K、关闭K 一段时间后B装置中有
2 3 2 1
NaSO 晶体析出,即SO 和NaSO 反应生成NaSO,故B装置中发生反应的化学方程式
2 2 5 2 2 3 2 2 5
为:SO +Na SO = Na SO↓,故答案为:SO +Na SO = Na SO↓。
2 2 3 2 2 5 2 2 3 2 2 5
学科网(北京)股份有限公司学科网(北京)股份有限公司