文档内容
专题 01 硫及其化合物
知识梳理
【硫和硫的氧化物】
一.硫
1.硫的存在
(1)游离态:存在于 火山喷口 附近或地壳的岩层里。
(2)化合态:主要以 硫化物 和 硫酸盐 的形式存在。
2.物理性质:硫单质俗称: 硫磺 ,颜色状态: 黄色晶体 ,溶解性: 不 溶于水,
微溶于酒精, 易 溶与二硫化碳。
3.化学性质(硫可以与金属、非金属反应)
化合价角度认识:
(1)与非金属反应
(2)与金属反应 表现氧化性
(3)与热的强碱溶液反应(如NaOH溶液):
3S + 6NaOH ===== 2Na S + Na SO + 3H O,既表现氧化性,又表现还原性。
2 2 3 2
应用:汞洒落在地面,一般会用硫粉来处理,原理是 S + Hg == HgS
二.二氧化硫
1.物理性质
二氧化硫是一种 无 色、有 刺激性气味 的气体,密度比空气 大 ,易液化 易 溶于水。
(1体积水约溶解40 体积SO )
2
2.二氧化硫与水
(1)SO 与水的反应方程式为SO + H O H SO 。
2 2 2 2 3
(2)SO 或亚硫酸的漂白性:
2 ⇌
①二氧化硫或亚硫酸有漂白作用,与有色物质发生化合反应,生成不稳定的无色物质,加热又恢复为原来
的颜色。利用品红溶液可检验二氧化硫气体。
②SO 有 漂白 性,能使 品红 褪色。
2
③SO 的漂白作用与次氯酸的漂白作用相不相同? 不相同 ;
2
SO 的漂白作用稳不稳定? 不稳定 ;
2
④次氯酸的漂白过程是发生了 氧化还原 反应,其漂白作用是永久性的。
【问题】常见的漂白剂有哪些?
SO 、 HClO 、 NaClO 、 H O 、 活性炭
2 2 2
(1)SO 使品红溶液褪色表现的是漂白性,加热后溶液恢复至红色;SO 使酸性高锰酸钾溶液、溴水、氯水、
2 2
碘水褪色表现的是还原性,加热后溶液颜色不复原。
(2)SO 不能漂白酸碱指示剂,只能使紫色石蕊溶液变红,不能使其褪色。
2三.二氧化硫的化学性质
分别从化合价的角度,作为酸性氧化物的角度,二氧化硫有什么化学性质:
1.酸性氧化物的通性
2.氧化性(如与HS溶液反应):SO + 2H S == =3S↓ + 2H O(生成黄色物质)。
2 2 2 2
3.还原性
4.漂白性:SO 可使品红溶液褪色,加热后,溶液由无色变为红色。
2
四.三氧化硫
1.物理性质: 熔点为16.8℃,沸点为44.8℃,标准状况下为 固 态。
2.化学性质:具有酸性氧化物的通性:
(1)与水反应: SO + H O == =H SO
3 2 2 4
(2)与碱性氧化物反应: SO + CaO == = C a SO
3 4
(3)与碱反应: SO + 2NaOH == = Na SO + H O
3 2 4 2
(4)与某些盐溶液反应(如:BaCl ) SO + H O + BaCl == = Ba SO ↓ + 2HCl
2 3 2 2 4
五.硫化氢
1.物理性质: 无色有臭鸡蛋气味的剧毒气体,常温常压下,1体积水约能溶解2.6体积的硫化氢气体。
2.化学性质
(1)酸性 H S H + + HS - , HS - ⇌ H + + S 2 -
2
(2)还原性(易被Cl、O、SO 等氧化)
⇌2 2 2
2H S + SO == =3S↓ + 2H O ; 2H S + O == = 2 S↓ + 2H O ; 2H S + 3O ( 足量 ) ===== 2SO + 2H O
2 2 2 2 2 2 2 2 2 2
【硫酸 硫酸根离子的检验】
一.硫酸的用途和工业制备
1.用途:
(1)重要的化工原料,可用于生产 化肥 、 农药 、炸药、染料、盐类等。
(2)用于精炼石油、金属加工前的酸洗及制取各种挥发性酸、作干燥剂等。
2.工业制备:
\s\up7(金属冶炼)
\s\up7( 硫黄或黄铁矿 ) ――→ SO ――→ SO ――→HSO
2 3 2 4
写出工业制备硫酸有关反应的化学方程式:
(1)制备SO :4FeS + 11O ===== 2Fe O + 8SO
2 2 2 2 3 2
(2)制备SO :2SO + O ===== 2 SO
3 2 2 3
(3)吸收SO :SO + H O = H SO
3 3 2 2 4
二.硫酸的性质
1.稀硫酸
具有酸的通性:2.硫酸的物理性质
硫酸是一种无色、黏稠的油状液体,密度比水的大。浓HSO 与水以任意比互溶,溶解时可放出大量的热,
2 4
浓HSO 稀释的方法是将浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断搅拌。
2 4
3.浓HSO 的特性
2 4
三大特性:吸水性、脱水性、强氧化性
(1)吸水性:浓硫酸能吸收存在于周围环境中的 水分 ,以及混在气体中的水分子,故常用作干燥剂。
(2)脱水性:浓硫酸能将蔗糖、纸张、棉布和木材等有机物中的氢元素和氧元素按 水 的组成比脱去。
(3)强氧化性:能氧化大多数金属单质和部分非金属单质。
a.与金属单质的反应 Cu+2HSO (浓)=====CuSO +SO ↑+2HO
2 4 4 2 2
b.与非金属单质的反应 在加热时,浓硫酸与木炭发生反应:C+2HSO (浓)=====CO↑+2SO ↑+2HO.
2 4 2 2 2
(4)常温下,铁、铝遇浓HSO 发生钝化,可用铝槽车运输浓HSO ;体现了浓硫酸的强氧化性。
2 4 2 4
(5)可利用浓HSO 的高沸点难挥发性制备易挥发性酸(HF、HCl等),
2 4
如2NaCl(固)+HSO (浓)=====NaSO +2HCl↑。
2 4 2 4
三.硫酸根离子的检验
1.实验探究
在三支试管中分别加入少量稀硫酸、NaSO 溶液和NaCO 溶液,然后各滴入几滴BaCl 溶液,观察现象。再
2 4 2 3 2
分别加入少量稀盐酸,振荡,观察现象。
项目 稀硫酸 NaSO 溶液 NaCO 溶液
2 4 2 3
滴入几滴BaCl 溶液 有 白色沉淀 生成 有 白色沉淀 生成 有 白色沉淀 生成
2
加入少量稀盐酸并振荡 白色沉淀不溶解 白色沉淀不溶解 白色沉淀溶解
2.实验结论
在溶液中,SO2-可与Ba2+反应,生成不溶于稀盐酸的白色BaSO 沉淀。
4 4
反应的离子方程式为Ba2++SO2-=== BaSO ↓。
4 4
3.检验SO 2-的正确操作方法:
4
被检液――→取清液――→观察有无白色沉淀产生(判断有无SO 2-)。
4
先加稀盐酸的目的是 排除 CO 2 - 、 SO 2 - 、 Ag + 干扰 ,再滴加BaCl 溶液,有白色沉淀产生。整个过程中可
3 3 2能发生反应的离子方程式:
CO 2 - + 2H + == =CO ↑ + H O 、 SO 2 - + 2H + == =SO ↑ + H O 、 Ag + + Cl - == =AgCl↓ 、 Ba 2 + + SO 2 - == =BaSO ↓。
3 2 2 3 2 2 4 4
【不同价态含硫物质的转化】
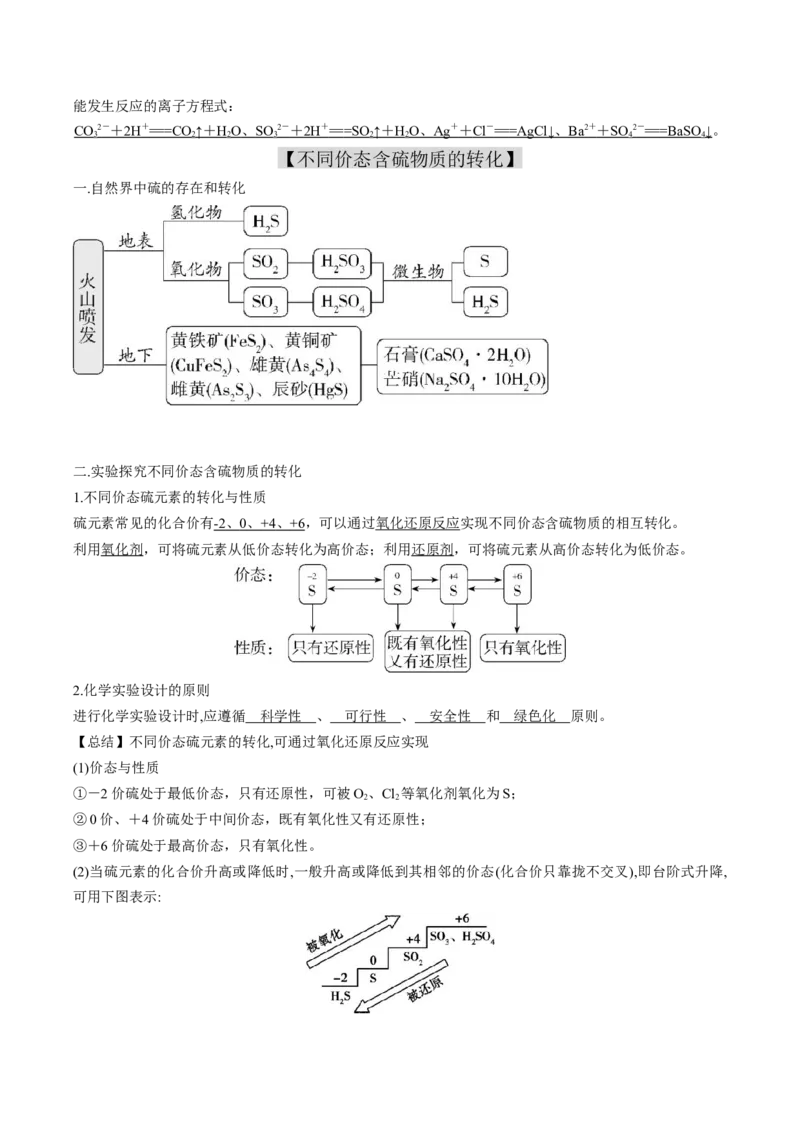
一.自然界中硫的存在和转化
二.实验探究不同价态含硫物质的转化
1.不同价态硫元素的转化与性质
硫元素常见的化合价有 -2 、 0 、 +4 、 +6 ,可以通过氧化还原反应实现不同价态含硫物质的相互转化。
利用氧化剂,可将硫元素从低价态转化为高价态;利用还原剂,可将硫元素从高价态转化为低价态。
2.化学实验设计的原则
进行化学实验设计时,应遵循 科学性 、 可行性 、 安全性 和 绿色化 原则。
【总结】不同价态硫元素的转化,可通过氧化还原反应实现
(1)价态与性质
①-2价硫处于最低价态,只有还原性,可被O、Cl 等氧化剂氧化为S;
2 2
②0价、+4价硫处于中间价态,既有氧化性又有还原性;
③+6价硫处于最高价态,只有氧化性。
(2)当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态(化合价只靠拢不交叉),即台阶式升降,
可用下图表示:相邻价态的同种元素的微粒间不发生氧化还原反应,如S和HS、S和SO 、SO 和浓硫酸之间不发生氧化还
2 2 2
原反应。
(3)不同价态硫元素间的转化,均属于氧化还原反应,需要选择合适的氧化剂或者还原剂。
证明硫单质、SO 具有还原性要选择氧化剂,如 酸性 KMnO 溶液、氯水等;
2 4
证明浓硫酸具有氧化性要选择还原剂,如 金属单质、硫单质、 H S 等;
2
证明SO 具有氧化性要选择还原剂,如H S 、 Na S 等。
2 2 2
(4)含硫物质的连续氧化
HS SO SO H SO
2 2 3 2 4
S SO SO H SO
2 3 2 4