文档内容
3.1.1 铁的单质 铁的氧化物 练习(解析版)
1.下列各物质中,不能由组成它的两种元素的单质直接化合而得到的是( )
A.FeS B.Fe O C.FeCl D.FeCl
3 4 2 3
【答案】C
【详解】
A.铁为变价金属,遇到弱氧化剂被氧化为+2价化合物,Fe+S FeS,故A不选;
B.铁和氧气直接反应生成四氧化三铁,3Fe+2O Fe O,故B不选;
2 3 4
C.氯气是强氧化剂氧化变价金属生成高价化合物,铁和氯气化合反应只能生成氯化铁,2Fe+3Cl
2
2FeCl ,不能直接生成氯化亚铁,故C选;
3
D.铁和氯气化合反应只能生成氯化铁,2Fe+3Cl 2FeCl ,故D不选;
2 3
答案选C。
2.将铁片投入下列溶液,溶液质量增加,但无气体产生的是( )
A.AgNO B.Cu(NO ) C.稀HSO D.FeCl
3 3 2 2 4 3
【答案】D
【详解】
A.Fe置换出Ag,溶液质量减小,故A错误;
B.Fe置换出Cu,溶液质量减小,故B错误;
C.反应生成硫酸亚铁和氢气,溶液质量增加,但生成气体,故C错误;
D.反应生成氯化亚铁,无固体析出,溶液质量增加,且没有气体生成,故D正确;
答案选D。
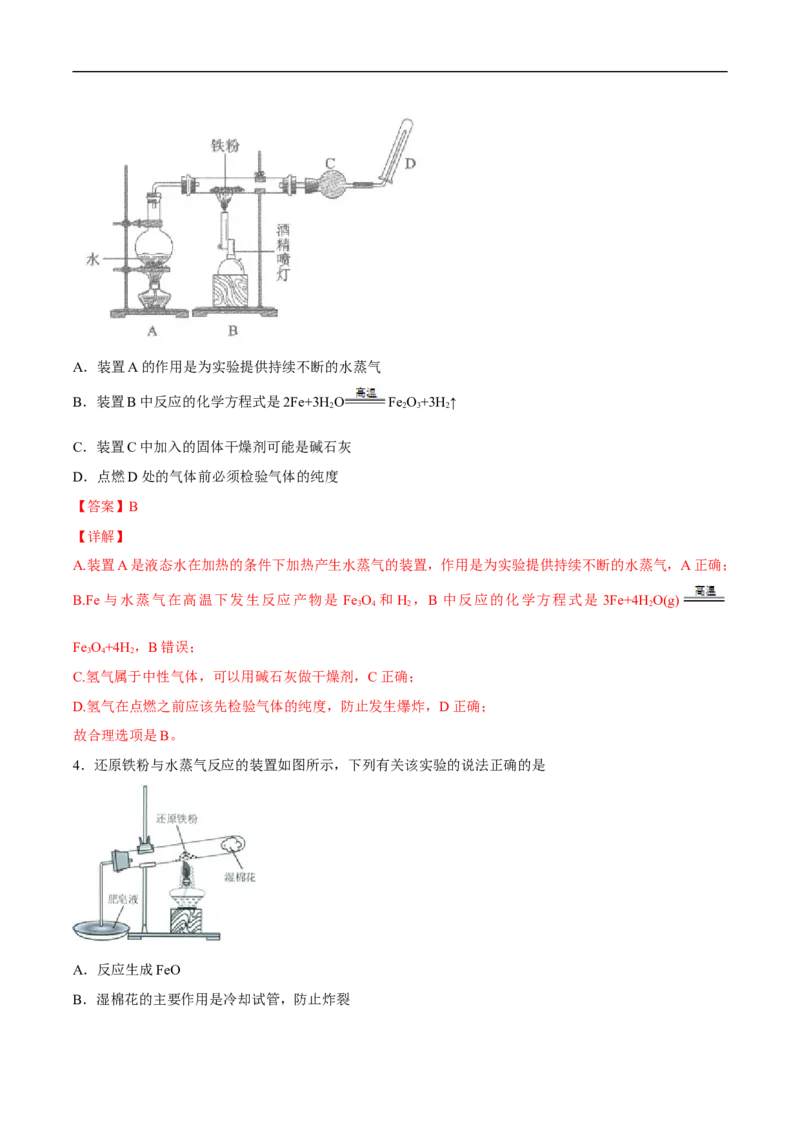
3.用如图所示装置进行Fe与水蒸气反应的实验,下列有关说法不正确的是A.装置A的作用是为实验提供持续不断的水蒸气
B.装置B中反应的化学方程式是2Fe+3H O Fe O+3H ↑
2 2 3 2
C.装置C中加入的固体干燥剂可能是碱石灰
D.点燃D处的气体前必须检验气体的纯度
【答案】B
【详解】
A.装置A是液态水在加热的条件下加热产生水蒸气的装置,作用是为实验提供持续不断的水蒸气,A正确;
B.Fe 与水蒸气在高温下发生反应产物是 Fe O 和 H ,B 中反应的化学方程式是 3Fe+4H O(g)
3 4 2 2
Fe O+4H ,B错误;
3 4 2
C.氢气属于中性气体,可以用碱石灰做干燥剂,C正确;
D.氢气在点燃之前应该先检验气体的纯度,防止发生爆炸,D正确;
故合理选项是B。
4.还原铁粉与水蒸气反应的装置如图所示,下列有关该实验的说法正确的是
A.反应生成FeO
B.湿棉花的主要作用是冷却试管,防止炸裂C.肥皂液的主要作用是检验生成的H
2
D.铁粉与水蒸气反应后,可立即用磁铁将剩余铁粉分离出来
【答案】C
【详解】
A. 铁与水蒸气反应生成Fe O,A错误;
3 4
B. 湿棉花的作用提供水蒸气反应物,B错误;
C. 使用肥皂液的作用是检验反应中生成的 H ,反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥
2
皂泡,当听到爆鸣声时,说明“铁与水蒸气”反应生成了H,C正确;
2
D. 铁粉与水蒸气反应生成的产物四氧化三铁也可以被磁铁吸引,不能分离出铁,D错误;
答案选C。
5.铁不能与冷、热水反应,但能与水蒸气反应。下列说法不正确的是( )
A.组装该实验装置用到的玻璃仪器可仅为1个酒精灯、1支大试管和导气管
B.可通过加热湿棉花产生水蒸气
C.可将产物之一通入肥皂液中用燃烧法检验
D.铁粉与水蒸气反应后,可立即用磁铁将剩余铁粉分离出来
【答案】D
【详解】
先对试管中湿棉花加热,当有水蒸气形成时再把酒精灯移到铁粉位置加热,故一个酒精灯、一支大试管和
导气管也能完成实验,A、B正确;铁和水蒸气反应生成氢气,通入肥皂液中,用燃烧法检验氢气的存在,
C正确;铁粉与水蒸气反应生成的四氧化三铁也可以被磁铁吸引,不能分离出铁,D错误;
综上所述,本题选D。
6.下列关于物质用途的说法错误的是
A.液氨可用作制冷剂 B.二氧化硫可作食物和干果的防腐剂
C.Fe O 可用作红色涂料 D.碳酸氢钠可用作面粉发酵
3 4
【答案】C
【详解】
A. 液氨气化需要吸收大量的热,使环境温度降低,可用作制冷剂,故正确;
B. 二氧化硫有毒,但可以作红酒抗氧化剂和干果的防腐剂,故正确;
C. Fe O 是黑色,氧化铁为红棕色,所以氧化铁可用作红色涂料,四氧化三铁不能用作红色涂料,故错误;
3 4
D. 碳酸氢钠受热分解生成二氧化碳气体,所以碳酸氢钠可用作面粉发酵,故正确。
故选C。7.关于氧化铁、氧化亚铁、四氧化三铁三种氧化物的下列说法中不正确的是( )
A.铁元素化合价不完全相同
B.氧元素的化合价完全相同
C.氧化亚铁俗称铁红,为红棕色固体
D.铁在氧气中燃烧的产物为黑色固体
【答案】C
【详解】
铁的三种氧化物中,氧元素的化合价完全相同,都为-2价;铁元素的化合价不同,氧化铁中铁为+3价,
氧化亚铁中铁为+2价,四氧化三铁中铁为+2价和+3价。氧化铁俗称铁红,是一种红棕色的固体;铁在
氧气中燃烧生成四氧化三铁,是一种黑色固体;故本题选C。
8.下列说法正确的是
A.赤铁矿的主要成分是Fe O
3 4
B.Fe O 为碱性氧化物,可与水反应生成Fe(OH)
2 3 3
C.铁锈的主要成分是Fe O
2 3
D.Fe O 中铁元素有+2价和+3价,Fe O 是混合物
3 4 3 4
【答案】C
【详解】
A.赤铁矿的主要成分是Fe O,故A错误;
2 3
B.Fe O 为碱性氧化物,但不与水反应,故B正确;
2 3
C.铁锈的主要成分是Fe O,故C正确;
2 3
D.Fe O 中铁元素有+2价和+3价,Fe O 是化合物,故D错误。
3 4 3 4
故选C。
9.某校研究性学习小组用一些大部分已经锈蚀(成分为 Fe O)的废铁屑制备绿矾(FeSO ·7H O),实验操作
2 3 4 2
过程如下:
已知:杂质不溶于稀硫酸。
请回答下列问题:
(1)步骤①中,稀硫酸与 Fe O 反应的离子方程式为______,废铁屑用硫酸处理后,还含有不溶性杂质,
2 3
为获取澄清的A溶液,需进行的操作名称是_________。
(2)步骤②中溶液A与铁粉反应的离子方程式为________________。(3)检验溶液 B 中是否还存在杂质金属阳离子的方法是_______。
【答案】Fe O+6H+===2Fe3++3H O 过滤 2Fe3++Fe===3Fe2+ 、2H++Fe===Fe2+ + H ↑ 取少量B
2 3 2 2
溶液于试管中,滴加KSCN溶液,若溶液出现血红色,则溶液中仍存在Fe3+;若溶液不变色,则溶液已不
含Fe3+。(其他合理答案也可)
【解析】
(1)步骤①中,稀硫酸与Fe O 反应的离子方程式为Fe O+6H+=2Fe3++3H O,废铁屑用硫酸处理后,还含
2 3 2 3 2
有不溶性杂质,为获取澄清的A溶液,需进行的操作名称是过滤;
(2)步骤②溶液 A 中有生成的 Fe3+,还有上一步中剩余的 H+,与铁粉反应的离子方程式为
Fe+2Fe3+=3Fe2+、2H++Fe=Fe2+ + H ↑ ;
2
(3)检验溶液B中是否还存在Fe3+的方法是取少量B溶液于试管中,滴加KSCN溶液,若溶液出现血红
色,则溶液中中仍存在Fe3+,反之不含。
10.在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。 应用下列装置,在硬质玻璃
管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实
验”。请回答该实验中的问题。
(1)写出该反应的反应方程式:______________;并指明该氧化还原反应的还原剂是 ______,氧化剂是
______________。
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是 __________ ;烧瓶底部放置了几片碎瓷片,其
作用是___________ 。
(3)酒精灯和酒精喷灯点燃的顺序是 ____________,为什么______________。
(4)试管中收集气体是_________,如果要在 A 处玻璃管处点燃该气体,则必须对该气体进行
_____________ 。
【答案】3Fe+4H O(g) Fe O+4H Fe H O 提供水蒸气 防暴沸 先点燃酒精灯,后点
2 3 4 2 2
燃酒精喷灯 原因是用产生的水蒸气将系统内的空气排尽,否则铁与氧气会发生反应 H 验纯
2
【详解】(1)Fe与水蒸气高温反应生成四氧化三铁和氢气,反应的方程式为3Fe+4H O(g) Fe O+4H ,Fe元素
2 3 4 2
的化合价升高,H元素的化合价降低,则Fe为还原剂,水为氧化剂;
(2)装置受热后,水转化为水蒸气,则其作用为为实验提供水蒸气;烧瓶底部放置了几片碎瓷片,可防
止液体剧烈沸腾,则其作用为防止暴沸;
(3)点燃加热仪器的顺序要考虑实验的安全性和对实验结果的影响,在本实验中为了防止铁与空气中的
氧气在加强热的条件下反应,应该先点燃酒精灯,排掉硬质玻璃管内空气,为Fe与水蒸气的反应实验提供
持续不断的水蒸气,即先点燃酒精灯,后点燃酒精喷灯;
(4)由发生的反应及干燥可知,最后只收集到H ,氢气属于可燃性气体,氢气不纯加热易引起爆炸,因
2
此,点燃之前要检验纯度。