文档内容
7.3.2 乙酸 官能团与有机化合物的分类 练习(解析版)
1.下列说法不正确的是( )
A.乙酸的沸点比乙醇的高
B.乙酸能和碳酸钠反应生成二氧化碳气体,说明乙酸的酸性强于碳酸
C.乙酸和乙醇生成乙酸乙酯的反应属于酸碱中和反应
D.乙酸分子中虽然有4个氢原子,但乙酸是一元酸
【答案】C
【详解】
A.乙酸的沸点为117.9℃,乙醇的沸点为78℃,A正确;
B.乙酸能和碳酸钠反应生成二氧化碳气体,依据强酸制弱酸的原理,乙酸的酸性强于碳酸,B正
确;
C.乙酸和乙醇生成乙酸乙酯的反应属于酯化反应,C不正确;
D.乙酸分子中虽然有4个氢原子,但乙酸只含有1个-COOH,是一元酸,D正确;
故选C。
2.羧酸和醇反应生成酯的相对分子质量为90,该反应的反应物是( )
① 和
② 和
③ 和
④ 和
A.①② B.③④
C.②④ D.②③
【答案】C
【详解】
① 和CHCHOH反应后生成 ,相对分子质量为88, ①不
3 2
合题意;
② 和CHCH-18OH反应后生成 , 相对分子质量为90,②
3 2
符合题意;③ 和CHCH-18OH反应后生成 , 相对分子质量为
3 2
92,③不合题意;
④ 和CHCHOH反应后生成 ,相对分子质量为90,④
3 2
符合题意;
综合以上分析,②④符合题意,故选C。
3.下列有关酯化反应的说法正确的是( )
A.醇与酸的反应都是酯化反应
B.酯化反应和中和反应原理一样
C.酯化反应既属于取代反应,也属于可逆反应
D.酯化反应的机理是羧酸去掉氢原子而醇去掉羟基
【答案】C
【详解】
酯化反应,是一类有机化学反应,是醇和羧酸或含氧无机酸生成酯和水的反应。
A.醇与酸作用生成酯和水的反应是酯化反应,不一定都是酯化反应,如乙醇和HBr反应生成溴乙
烷,不是酯化反应,A错误;
B.中和反应是指酸和碱反应生成盐和水,二者反应原理不同,B错误;
C.酯化反应属于取代反应,也是可逆反应,C正确;
D.酯化反应的机理是羧酸去掉-OH,醇去掉羟基上的H原子,D错误。
答案选C。
4.酯类物质广泛存在于香蕉、梨等水果中。某实验小组先从梨中分离出一种酯,然后将分离出的
酯水解,得到了乙酸和另一种化学式 的物质。下列分析不正确的是( )
A. 分子中含有羟基 B. 可与金属钠发生反应
C.实验小组分离出的酯可表示为 D.这种酯与辛酸互为同分异构体
【答案】C
【详解】
A.酯的水解产物一般为羧酸和醇,因此 为醇,其结构中含有羟基,A项正确;
B. 为醇可与钠反应生成氢气,B项正确;
C.根据CHCOOH+ →酯+H O反应中,原子守恒规律可知,分离出的酯的分子式为
3 2
,C项错误;
D.含有相同碳原子数的饱和一元酯与饱和一元羧酸互为同分异构体,这种酯与辛酸分子式均为
,含有官能团不同,属于同分异构体,D项正确;答案选C。
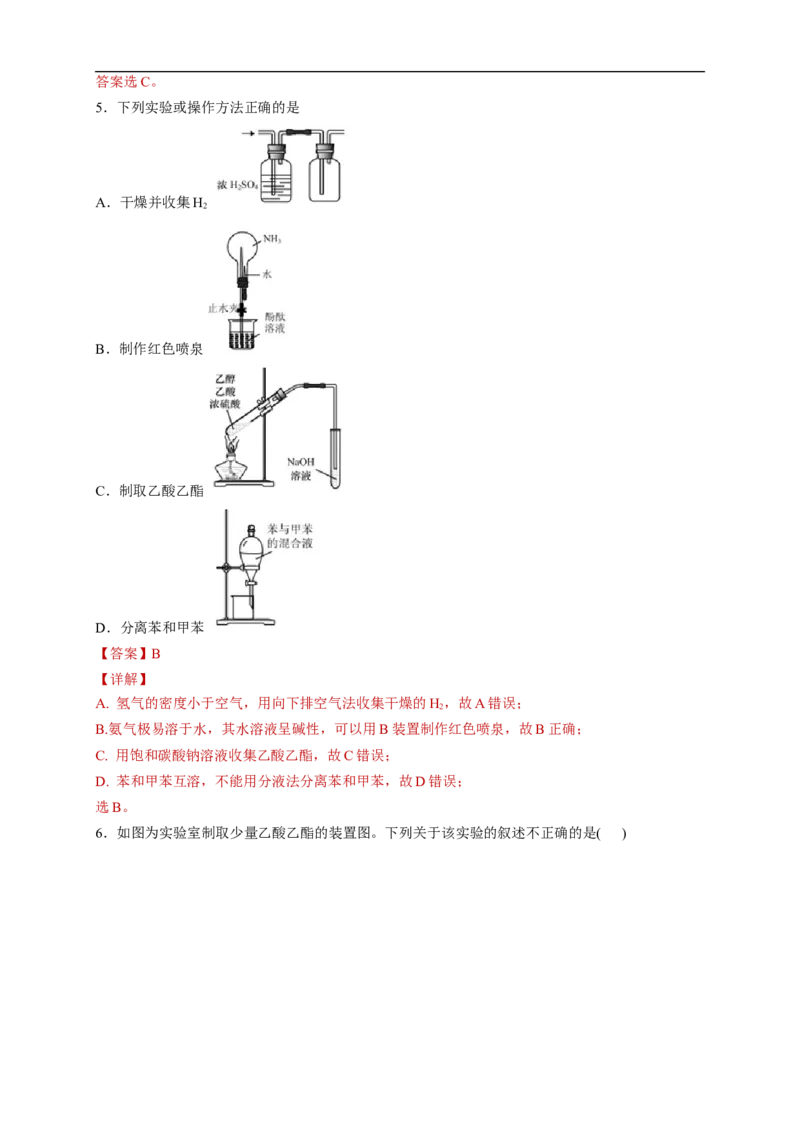
5.下列实验或操作方法正确的是
A.干燥并收集H
2
B.制作红色喷泉
C.制取乙酸乙酯
D.分离苯和甲苯
【答案】B
【详解】
A. 氢气的密度小于空气,用向下排空气法收集干燥的H,故A错误;
2
B.氨气极易溶于水,其水溶液呈碱性,可以用B装置制作红色喷泉,故B正确;
C. 用饱和碳酸钠溶液收集乙酸乙酯,故C错误;
D. 苯和甲苯互溶,不能用分液法分离苯和甲苯,故D错误;
选B。
6.如图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述不正确的是( )A.试管b中导气管下端管口不浸入液面的原因是防止实验过程中产生倒吸现象
B.向试管a中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加入冰醋酸
C. 乙酸与 乙醇充分反应后得到的乙酸乙酯小于
D.试管b中饱和 溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇、降低乙酸乙酯的
溶解度
【答案】B
【详解】
A.乙酸、乙醇易溶于水,易发生倒吸,则试管b中导气管下端管口不能浸入液面,防止倒吸,故
A正确;
B.混合过程中用到浓硫酸,相当于浓硫酸的稀释,需要在试管中先加乙醇,然后边摇动试管边慢
慢加入浓硫酸,最后再加冰醋酸,试剂加入顺序不合理,故B错误;
C.酯化反应为可逆反应,则1mol乙酸与1mol乙醇充分反应达限度时,得到的乙酸乙酯小于
1mol,故C正确;
D.乙醇、乙酸易挥发,则饱和碳酸钠溶液的作用为吸收乙醇、除去乙酸,降低乙酸乙酯的溶解度,
便于分层,分液可分离出乙酸乙酯,故D正确;
故选B。
7.乙酸分子的结构式可|表示为 ,下列叙述正确的是
(1)乙酸的电离,是①键断裂
(2)乙酸与乙醇发生酯化反应,是②键断裂
(3)在红磷存在时, 与 发生反应 是
③键断裂
(4)乙酸生成乙酸酐的反应: ,是①②键断裂
A.仅(1)、(2)、(3) B.(1)、(2)、(3)、(4)
C.仅(2)(3)、(4) D.仅(1)、(3)、(4)
【答案】B【详解】
乙酸电离出 时,断裂①键;在发生酯化反应时酸脱羟基,断裂②键;乙酸与 的反应, 取
代甲基上的氢,断裂③键;乙酸生成乙酸酐的反应,一分子乙酸断裂①键,另一分子乙酸断裂②键。
综上所述,B项正确,故选B。
8.下列物质中,能与醋酸发生反应的是( )
①石蕊试液 ②乙醇 ③乙醛 ④金属铝 ⑤氧化镁 ⑥碳酸钠 ⑦氢氧化铜
A.①③④⑤⑥⑦ B.②③④⑤
C.①②④⑤⑥⑦ D.全部
【答案】C
【详解】
醋酸具有酸的通性,可使石蕊试液变红色,可与Al、MgO、NaCO、Cu(OH) 等发生反应,可与乙
2 3 2
醇发生酯化反应生成乙酸乙酯,但不能与乙醛发生反应,故选C。
9.若乙酸分子中的 都是 ,乙醇分子中的 都是 ,二者发生酯化反应所得生成物中水
的相对分子质量是( )
A.16 B.18
C.20 D.22
【答案】C
【详解】
酸与醇发生反应生成酯和水,反应的过程中酸失羟基,醇失氢,乙酸与乙醇反应方程式如下:
,生成的水为
H18O,故水的相对分子质量为20。
2
答案选C。
10.下列关于乙酸化学反应的离子方程式正确是( )
A.乙酸与氢氧化钠溶液反应:H++OH― HO
2
B.乙酸与生石灰反应:2H++CaO Ca2++H O
2
C.乙酸钠与盐酸反应:CHCOO-+H+ CHCOOH
3 3
D.少量的乙酸与足量的碳酸钠溶液反应2 CH COOH+CO 2- 2 CH COO-+CO ↑+H O
3 3 3 2 2
【答案】C
【详解】
A、乙酸是弱酸,在离子方程式中应该用化学式表示,A、B都是错误的;
C、盐酸是强酸,能和醋酸盐反应生成醋酸,C正确;
D、醋酸少量,碳酸钠生成碳酸氢钠,得不到二氧化碳气体,D不正确;
答案选C。
11.根据乙酸的性质回答下列问题:
(1)将醋酸钠晶体与浓硫酸共热,可观察到的现象为___________;反应的化学方程式为________。
(2)在滴有酚酞的氢氧化钠溶液中,逐滴加乙酸至过量,现象为_______;反应的离子方程式为_______。
(3)在碳酸钠溶液中,加入乙酸后,有________放出,反应的离子方程式为______。
【答案】有刺激性气味的气体放出 2CHCOONa+HSO (浓) 2CHCOOH+NaSO
3 2 4 3 2 4
红色逐渐变浅,最后消失 CHCOOH+OH-→CHCOO-+HO 无色气体 2CHCOOH+
3 3 2 3
CO2-→2CHCOO-+HO+CO↑
3 3 2 2
【详解】
(1)根据强酸制弱酸的原理,将醋酸钠晶体与浓硫酸共热,有乙酸生成,则可观察到的现象为有刺激
性气味的气体放出;反应的化学方程式为2CHCOONa+HSO (浓) 2CHCOOH+NaSO ;
3 2 4 3 2 4
(2)氢氧化钠溶液中滴加酚酞后溶液显红色,逐滴加乙酸发生中和反应生成醋酸钠和水,溶液碱性逐
渐减弱,当乙酸过量后溶液显酸性,可观察到的现象为红色逐渐变浅,最后消失;反应的离子方程
式为CHCOOH+OH-→CHCOO-+HO;
3 3 2
(3)乙酸的酸性比碳酸强,则在碳酸钠溶液中,加入乙酸后,有无色气体放出,反应的离子方程式为
2CHCOOH+CO2-→2CHCOO-+HO+CO↑。
3 3 3 2 2
12.已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香
味的物质E,其合成路线如下图所示。
请回答下列问题:
(1)B、D分子中的官能团名称分别是__________、__________。
(2)写出下列反应的化学方程式,并注明反应类型:
②____________________,___________;④____________________,___________。
(3)在实验室利用B和D制备E的实验中,若用1mol B和1 mol D充分反应,能否生成1mol
E_________,原因是__________。
(4)若184g B和120g D反应能生成106g E,则该反应的产率______________________。
【答案】羟基 羧基 2CHCHOH+O 2CHCHO+2H O 氧化反应
3 2 2 3 2
CHCOOH+CH CHOH CHCOOCH CH+H O 取代反应(酯化反应) 不能 该
3 3 2 3 2 3 2
反应为可逆反应,有一定的限度,不可能完全转化 60.2%
【详解】
(1)B、D分子中的官能团名称分别是羟基、羧基;
(2)②反应的化学方程式是2CHCHOH+O 2CHCHO+2H O,反应类型是氧化反应;④
3 2 2 3 2
反应的化学方程式是CHCOOH+CH CHOH CHCOOCH CH+H O,反应类型是取代反
3 3 2 3 2 3 2
应(也叫酯化反应);
(3)由于酯化反应与酯的水解反应互为可逆反应,所以在实验室利用B和D制备E的实验中,若
用1mol B和1 mol D充分反应,不能生成1mol E;(4)184g乙醇的物质的量是 =4mol; 120g乙酸的物质的量是 =2mol,由于乙醇
过量,所以反应产生的乙酸乙酯应该按照乙酸来计算,理论上应该产生乙酸乙酯的质量是
2mol×88g/mol=196g,实际反应能生成106g E,则该反应的产率 ×100%=60.2%。
13.山西老陈醋是中国四大名醋之一,已有 3000 余年的历史,素有“天下第一醋”的盛誉。
(1)山西人喜欢吃面食,面食为人体提供的营养物质主要是_______________,它对人体所起的作
用是_________________。面食本身偏碱性,吃醋能增加胃液酸度,有助于食物的消化和吸收。
(2)炒菜时,加一点酒和醋能使菜味香可口,原因是(用方程式表示) ___________________,生
成的有香味的物质是__________________(填名称)。
(3)碳酸氢钠是一种治疗胃酸过多的药物,若病人服用此药物的同时吃醋,会使药效大大降低,
有关反应的化学方程式是_______________________。
【答案】糖类 提供能量 乙酸乙
酯 CHCOOH+NaHCO =CH COONa+HO+CO↑
3 3 3 2 2
【详解】
(1)人体的三大营养物质有糖类、脂肪、蛋白质。面食主要提供糖类,其对人体的主要作用是提
供能量;
(2)炒菜时,加一点酒和醋能使菜味香可口,酒和醋可以在加热的条件下,生成具有香味的乙酸
乙酯,故化学方程式为 ;
(3)吃了醋之后,药效降低的原因是药物被醋消耗了一部分,所以该反应的化学方程式为:
CHCOOH+NaHCO =CH COONa+HO+CO↑。
3 3 3 2 2