文档内容
高一化学必修第一册同步单元AB卷(新教材人教版)
高一化学上学期期中模拟卷(二)
说明:本试卷分选择题非选择题,满分100分,考试时间90分钟。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 S 32 Cl 35.5 K 39 Mn 55
一、选择题:本题共20个小题,每小题2分。共40分,在每小题给出的四个选项中,只有一项是符合题目要
求的。
1. 分类是科学研究的重要方法,下列物质分类不正确的是
选项 类别 物质
A 化合物 干冰、冰水混合物、烧碱
B 同素异形体 活性炭、C 、金刚石
60
C 非电解质 乙醇、四氯化碳、氯气
D 混合物 漂白粉、纯净矿泉水、盐酸
【答案】C
【解析】
A. 化合物是不同元素组成的纯净物。干冰是二氧化碳固体是纯净的化合物,冰水混合物成分为水是纯
净的化合物,烧碱是氢氧化钠属于纯净的化合物,故A正确;
B. 同素异形体是同种元素组成的不同单质。活性炭、C 、金刚石是碳元素的不同单质,是碳元素的同素
60
异形体,故B正确;
C,非电解质是水溶液中和熔融状态都不导电的化合物。乙醇、四氯化碳水溶液中和熔融状态下都不导
电,属于非电解质,氯气是单质既不是电解质也不是非电解质,故C错误;
D. 混合物是不同物质组成的物质。漂白粉为氯化钙和次氯酸钙的混合物,纯净矿泉水含有电解质的水
属于混合物,盐酸是氯化氢的水溶液属于混合物,故D正确。
2. 下列关于胶体的说法中,正确的是
①蔗糖溶液、淀粉溶液属于溶液,烟、雾属于胶体
②溶液和胶体的本质区别是后者具有丁达尔效应,而前者无此现象
③制备Fe(OH) 胶体的方法是将饱和FeCl 溶液滴加到沸水中煮沸至溶液呈红褐色
3 3
④利用过滤的方法能将Fe(OH) 胶体从FeCl 溶液中分离出来
3 3
⑤由肾功能衰竭等疾病引起的血液中毒,可利用“血液透析”进行治疗
⑥葡萄糖注射液能产生丁达尔效应,属于胶体⑦溶液是电中性的,胶体是带电的
⑧清晨,在茂密的树林中,常常可以看到从树叶间透过的一道道光柱,与胶体的性质有关
A.①②⑤ B.③⑤⑧
C.③⑤⑦⑧ D.②③⑧
【答案】B
【解析】
①淀粉溶液属于胶体,错误;
②溶液和胶体的本质区别是分散质粒子直径的大小,错误;
③制备Fe(OH) 胶体的方法是将饱和FeCl 溶液滴加到沸水中煮沸至溶液呈红褐色,正确;
3 3
④胶体与溶液都能透过滤纸,不能用过滤的方法分离两者,错误;
⑤“血液透析”的原理是渗析,正确;
⑥葡萄糖是小分子,溶于水形成溶液,错误;
⑦胶体本身不带电,只是胶体中胶粒表面积较大,吸附了溶液中的离子才带电荷,错误;
⑧茂密树林形成的一道道光柱属于丁达尔效应,与胶体性质有关,正确。综上所述,B正确。
3. 下列物质的用途或者制备中所涉及的离子方程式书写正确的是
选项 用途或者制备 离子方程式
A 用稀硫酸清洗铁锈
B 实验室用大理石与稀盐酸反应制备二氧化碳
C 用氢氧化钠溶液吸收氯气
D 用氯化铁溶液刻蚀铜板
【答案】C
【解析】
A. 氧化铁与稀硫酸反应生成硫酸铁和水,正确的离子方程式为:Fe O+6H+=2Fe3++3H O,故A错误;
2 3 2
B. 碳酸钙不能拆开,正确的离子方程式为:CaCO +2H+=Ca2++H O+CO↑,故B错误;
3 2 2
C. 氢氧化钠溶液与氯气反应的离子方程式为:Cl+2OH−=Cl−+ClO−+H O,故C正确;
2 2
D. 用氯化铁溶液刻蚀铜板,反应生成氯化亚铁和氯化铜,正确的离子方程式为:2Fe3+ + Cu=2Fe2+ +
Cu2+,故D错误;故选C。
4. 某溶液中含有较大量的Cl-、CO、OH-等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子
依次检验出来,下列实验操作顺序正确的是
①滴加Mg(NO) 溶液;②过滤;③滴加AgNO 溶液;④滴加Ba(NO ) 溶液。
3 2 3 3 2
A.①②④②③ B.④②①②③C.①②③②④ D.④②③②①
【答案】B
【解析】Cl-用含有AgNO 溶液检验,二者反应生成白色沉淀AgCl;CO用Ba(NO ) 溶液检验,二者反应
3 3 2
生成白色沉淀BaCO ;OH-用Mg(NO) 溶液检验,二者反应生成白色沉淀Mg(OH) ;Cl-、CO、OH-都和
3 3 2 2
AgNO 反应,CO、OH-都和Mg(NO) 溶液反应生成白色沉淀;只有CO和Ba(NO ) 溶液反应生成白色沉淀,
3 3 2 3 2
为了防止干扰,应该先检验CO、再检验OH-。
5. 某溶液遇石蕊溶液显红色,下列各组离子能在该溶液中大量共存的是
A. 、 、 、 B. 、 、 、
C. 、 、 、 D. 、 、 、
【答案】A
【解析】溶液遇石蕊试液显红色,溶液中含大量的H+,结合离子之间不能结合生成沉淀、气体、水等,不能
发生氧化还原反应等,则离子大量共存,以此来解答。
A. 酸溶液中该组离子之间不反应,可大量共存,故A选;
B. 酸溶液中不能大量存在 ,故B不选;
C. 、H+均与OH−反应, 、 结合生成沉淀,不能大量共存,故C不选;
D. 酸性溶液中不能大量存在 ,故D不选;故选A。
6. 有一包白色粉末,由BaCl 、KSO 、CaCO 、NaOH、CuSO 中的一种或几种组成,为了探究它的成分,
2 2 4 3 4
进行了如下实验。下列判断正确的是
A.BaCl 、CaCO 一定存在,NaOH可能存在
2 3
B.KSO 、CaSO 一定不存在
2 4 4
C.KSO 、NaOH、CaCO 、BaCl 一定存在,CuSO 可能存在
2 4 3 2 4
D.C为单一溶质溶液【答案】B
【解析】白色粉末溶于水得到白色滤渣和无色滤液,说明不含CuSO ,滤渣中加入盐酸得到气体B,且滤
4
渣全部溶解,推出滤渣A为CaCO ,气体B为CO,滤液C中通入CO,有白色沉淀产生,说明含有BaCl 、
3 2 2 2
NaOH,一定不含KSO ,故B正确,A、C、D错误。
2 4
7. 下列氧化还原反应中,水作为还原剂的是
A.3Fe+4HO=====Fe O+4H B.3NO +HO ===2HNO+ NO
2 3 4 2 2 2 3
C.2NaO+2HO===4NaOH+O↑ D.2F+2HO === 4HF+O
2 2 2 2 2 2 2
【答案】D
【解析】
A.水中H元素的化合价降低,水为氧化剂,故A不选;
B.水中H、O元素的化合价变化,只有N元素的化合价变化,故B不选;
C.只有过氧化钠中O元素的化合价变化,故C不选;
D.水中O元素的化合价升高,水为还原剂,故D选;
8. 实验室常用NaNO 和NH Cl反应制取N。下列有关说法正确的是
2 4 2
A.NaNO 是还原剂
2
B.NH Cl中N元素被还原
4
C.生成1 mol N 时转移6 mol电子
2
D.氧化剂和还原剂的物质的量之比是1∶1
【答案】D
【解析】实验室常用NaNO 和NH Cl反应制取N,根据氧化还原反应中电子守恒、原子守恒可得化学方
2 4 2
程式:NaNO +NH Cl===N ↑+NaCl+2HO。
2 4 2 2
在该反应中NaNO 中的N元素化合价是+3价,反应后变为N 中的0价,化合价降低,得到电子,
2 2
NaNO 作氧化剂,A错误;
2
在NH Cl中N元素化合价是-3价,反应后变为N 中的0价,化合价升高,失去电子,NH Cl中的N元素
4 2 4
被氧化,B错误;
根据化学方程式NaNO +NH Cl===N ↑+NaCl+2HO可知,每产生1 mol N 转移3 mol电子,C错误;
2 4 2 2 2
根据化学方程式可知,在该反应中氧化剂NaNO 和还原剂NH Cl的物质的量之比是1∶1,D正确。
2 4
9. 已知反应:
①Cl+2KBr===2KCl+Br ,
2 2
②KClO+6HCl===3Cl↑+KCl+3HO,
3 2 2
③2KBrO +Cl===Br +2KClO。
3 2 2 3
下列说法正确的是
A.氧化性由强到弱的顺序为KBrO >KClO>Cl>Br
3 3 2 2
B.①中KCl是氧化产物,KBr发生还原反应
C.③中1 mol氧化剂参加反应得到电子的物质的量为2 mol
D.反应②中氧化剂与还原剂的物质的量之比为1∶6【答案】A
【解析】
由①知氧化性Cl>Br ,由②知氧化性KClO>Cl,由③知氧化性KBrO >KClO,故氧化性KBrO >
2 2 3 2 3 3 3
KClO>Cl>Br ,A项正确;
3 2 2
①中Cl元素化合价降低,被还原为还原产物KCl,Br元素化合价升高,被氧化为氧化产物Br ,B项不正
2
确;
反应③中氧化剂为KBrO ,化合价变化:Br―→Br,故1 mol KBrO 参加反应得到电子5 mol,C项不正确;
3 3
反应②中,氧化剂为KClO,还原剂为HCl,但6HCl中有HCl→KCl,故氧化剂与还原剂的物质的量之比
3
为1∶5。
10. 下列叙述正确的是
A.切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O===NaO
2 2 2
B.一定条件下,2.3 g的Na完全与O 反应生成3.6 g产物,失去的电子数为0.2N
2 A
C.钠在空气中受热时,熔化为银白色的小球,产生黄色的火焰,生成白色粉末
D.钠在空气中长期放置,最终主要生成物为碳酸钠
【答案】D
【解析】
钠在通常条件下反应生成氧化钠,点燃条件生成过氧化钠,故A错误;
2.3 g钠的物质的量为0.1 mol,而钠无论反应后产物是什么,钠元素反应后一定变为+1价,故0.1 mol钠
失去0.1N 电子,故B错误;
A
钠在空气中加热,生成了淡黄色的过氧化钠,故C错误;
钠在空气中长期放置,开始生成氧化钠,最终变成了碳酸钠,故D正确。
11. 纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体。下列区分这两种物质的方法正确的是
A.分别用砂锅加热两种样品,全部分解挥发,没有残留物的是小苏打
B.放入水中,能溶于水的为小苏打
C.等质量的碳酸钠和碳酸氢钠分别与足量的盐酸反应, 前者产生二氧化碳少
D.先将两样品配成溶液,再分别加入石灰水,无白色沉淀生成的是小苏打
【答案】C
【解析】
A项, 纯碱受热不分解,小苏打受热变成纯碱:2NaHCO =====NaCO+CO↑+HO;
3 2 3 2 2
B项,NaCO、NaHCO 均易溶于水;
2 3 3
C项,等质量的NaCO 和NaHCO ,n(NaHCO )>n(Na CO),故与足量的盐酸反应时,NaCO 产生CO 的
2 3 3 3 2 3 2 3 2
量少;
D项,二者均出现白色沉淀。
12. 两份体积相同、浓度未知的NaCO 和HCl溶液,将它们互相滴加,产生的气体在相同的温度和压强下
2 3
的体积之比为1∶3,则NaCO 和HCl溶液的浓度之比为
2 3
A. 5∶6 B. 2∶5 C. 3∶4 D. 5∶3
【答案】A【解析】
碳酸钠滴加到盐酸中,发生反应NaCO+2HCl===2NaCl+CO ↑+H O,盐酸滴加到碳酸钠中,发生反应
2 3 2 2
NaCO+HCl===NaHCO +NaCl,NaHCO +HCl===NaCl+CO ↑+H O。因为生成气体的体积不同,说明盐酸不足,
2 3 3 3 2 2
设NaCO 的浓度为c mol·L-1,盐酸的浓度为c mol·L-1,溶液的体积为1 L,碳酸钠滴入盐酸中产生的CO 的
2 3 1 2 2
体积大于盐酸滴加到碳酸钠中产生的CO 的体积,碳酸钠滴入盐酸中产生CO 的量可根据盐酸计算,即
2 2
n(CO)= mol,盐酸滴入碳酸钠溶液中产生CO 的物质的量为(c-c )×1 mol, =1∶3,即c∶c=5∶6。
2 2 2 1 1 2
13. 有关Cl 的性质,下列说法不正确的是
2
A.Cl 有毒但可用于自来水消毒
2
B.能与Ca(OH) 溶液反应生成两种正盐
2
C.能与Fe反应生成FeCl
2
D.H 在Cl 中燃烧产生苍白色火焰,且集气瓶口有白雾
2 2
【答案】C
【解析】
A.氯气与水反应生成盐酸和次氯酸,次氯酸具有强的氧化性,能够杀菌消毒,故A正确;
B.氯气能够与氢氧化钙反应生成的氯化钙和次氯酸钙,都是正盐,故B正确;
C.氯气与铁反应生成氯化铁,故C错误;
D.氢气在氯气中燃烧生成氯化氢,产生苍白色火焰,氯化氢极易溶于水,从瓶口逸出的氯化氢溶于空
气中的水蒸气形成白雾,故D正确。
14. 在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl
2
B.向氯水中滴加硝酸酸化的AgNO 溶液,产生白色沉淀,说明氯水中含有Cl-
3
C.向氯水中加入NaHCO 粉末,有气泡产生,说明氯水中含有H+
3
D.向FeCl 溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
2
【答案】D
【解析】
A项,Cl 是黄绿色气体,因此氯水的颜色呈浅绿色,说明氯水中含有Cl,正确;
2 2
B项,向氯水中滴加硝酸酸化的AgNO 溶液,产生白色沉淀,白色沉淀是AgCl,这说明氯水中含有Cl-,
3
正确;
C项,向氯水中加入NaHCO 粉末,有气泡产生,气体是CO,这说明氯水中含有H+,正确;
3 2
D项,向FeCl 溶液中滴加氯水,溶液颜色变成棕黄色,说明反应中有FeCl 生成。由于Cl 也能把FeCl
2 3 2 2
氧化生成FeCl ,因此不能说明氯水中含有HClO,错误。
315. 下列关于实验室制取氯气的说法正确的是
A.盛浓盐酸的分液漏斗可用长颈漏斗代替
B.为了便于学生观察氯气的制备实验,可在讲台上直接做氯气的制备实验
C.可用饱和食盐水吸收尾气
D.可在集气瓶口放一张湿润的淀粉碘化钾试纸,观察氯气是否收集满
【答案】D
【解析】
盛浓盐酸的分液漏斗若用长颈漏斗代替无法控制盐酸的用量,A错误;
在讲台上直接做氯气的制备实验,没有在通风橱中进行,容易造成中毒事件,B错误;
饱和食盐水不能与氯气反应,不能用于吸收尾气,C错误;
可在集气瓶口放一张湿润的淀粉碘化钾试纸,若试纸变蓝,则氯气集满,D正确。
16. 下列说法不正确的是
A.温度相同、体积相同的O(g)和N(g)所含的分子数一定相同
2 2
B.等温等压下,SO 气体与CO 气体的密度之比等于16∶11
2 2
C.温度和容积相同的两容器中分别盛有5 mol O 和2 mol N ,则压强之比为5∶2
2 2
D.等温等压条件下,5 mol O (g)和2 mol H (g)的体积之比等于5∶2
2 2
【答案】A
【解析】
温度相同、压强相同、体积相同的O(g)和N(g)所含的分子数相同,故A错误;
2 2
等温等压下,气体的密度之比等于摩尔质量之比,故B正确;
同温同体积的气体的物质的量之比等于压强之比,故C正确;
等温等压条件下气体的物质的量之比等于体积之比,故D正确。
17. 高温下用CO还原m g R O 得n g R,已知氧的相对原子质量为16,则R的相对原子质量为
2 3
A. B.
C. D.
【答案】B
【解析】
R O 中“O”的质量(g)为:m-n;“O”的物质的量(mol)为:(m-n)/16;R O 的物质的量:[(m-n)/16]/3=
2 3 2 3
(m-n)/48;
R的物质的量:[(m-n)/48]×2=(m-n)/24;
R的相对原子质量:n/[(m-n)/24]=24n/(m-n)。
18. 将15 mL 2 mol·L−1 Na CO 溶液逐滴加入到40 mL 0.5 mol·L−1 MCl 盐溶液中,恰好将溶液中的Mn+完
2 3 n
全沉淀为碳酸盐,则MCl 中n值是
n
A.4 B.3 C.2 D.1
【答案】B【解析】根据NaCO 溶液与MCl 盐溶液反应时,恰好将溶液中的Mn+离子完全沉淀为碳酸盐,利用化合
2 3 n
价得出Mn+离子与nCO2-离子的关系,然后利用物质的量来计算解答.
3
NaCO 溶液中nCO2-离子的物质的量为15mL×10-3×2mol•L-1=0.03mol,
2 3 3
MCln盐溶液中Mn+离子的物质的量为40mL×10-3×0.5mol•L-1=0.02mol,
由反应中恰好将溶液中的Mn+离子完全沉淀为碳酸盐,及M的化合价为+n,
则NaCO 与MCln反应对应的关系式为:
2 3
2Mn+~nCO2-
3
2 n
0.02mol 0.03mol
,解得n=3,故选B。
19. 用N 表示阿伏加德罗常数的值,下列叙述不正确的是
A
A.常温常压下,1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1N
A
B.0.1 mol HO中含有电子的数目为N
2 A
C.0.5 mol·L-1 CaCl 溶液中的Cl-的数目为N
2 A
D.标准状况下,11.2 L甲烷中含有分子的数目为0.5N
A
【答案】C
【解析】
A.氧气和臭氧都是由氧原子构成,1.6 g氧气和臭氧的混合物中含有1.6 g氧原子,含有0.1 mol氧原子,
含有氧原子的数目为0.1 N ,故A正确;
A
B.1个水分子中含有10个电子,0.1 mol HO中含有电子的数目为N ,故B正确;
2 A
C.依据n=cV可知,题干中没指明溶液的体积无法计算Cl-的物质的量及数目,故C错误;
D.标准状况下,11.2 L甲烷的物质的量为=0.5 mol,含有分子的数目为0.5 N ,故D正确。
A
20. V mL Al (SO ) 溶液中含Al3+a g,取 mL溶液稀释到4V mL,则稀释后溶 的物质的量浓度是
2 4 3
A. mol·L−1 B. mol·L−1 C. mol·L−1 D. mol·L−1
【答案】C【解析】根据 ,计算Al3+的物质的量,再利用n(Al3+):n( )=2:3计算V mL溶液中n(
),进而计算 mL溶液中 的物质的量,再根据 ,计算稀释为4VmL溶液中 物质的量浓度.
ag Al3+的物质的量=
溶液中n(Al3+):n( )=2:3,VmL溶液中n( )=
mL溶液中 的物质的量:
溶液稀释到4VmL,溶液中c( )=
二、非选择题:本题共5个题,共60分。
21.(10分)
现有一定量含有NaO杂质的NaO 试样,用如图所示实验装置测定NaO 试样的纯度。(可供选用的反
2 2 2 2 2
应物只有CaCO 固体、6mol·L-1盐酸、6mol·L-1硫酸和蒸馏水)
3
回答下列问题:
(1)装置A中液体试剂选用_____________________。
(2)装置B的作用是_________________________,装置E中碱石灰的作用是___________________
__________________________________________________________________。
(3)装置D中发生反应的化学方程式为_________________________________________。
]
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则NaO 试样的纯
2 2
度为_________。
]【答案】
(1)6 mol·L-1盐酸
(2)除去气体中的HCl 吸收装置D中反应剩余的CO,防止水蒸气进入D中
2
(3)2Na O + 2CO===2Na CO + O 、 NaO +
2 2 2 2 3 2 2
CO===Na CO
2 2 3
(4)78%
【解析】
(1)A是用来制取二氧化碳的装置,碳酸钙和硫酸反应时,生成的硫酸钙微溶于水,会覆盖在碳酸钙的表
面,使反应不能继续进行,所以用盐酸而不用硫酸来反应,故装置A中液体试剂选用6 mol·L-1盐酸。
(2)碳酸钙和盐酸反应生成的二氧化碳中含有氯化氢气体,可用饱和碳酸氢钠溶液来除去;装置E中碱石
灰的作用是吸收二氧化碳,防止二氧化碳对氧气的体积测量造成干扰。防止水蒸气进入D中,防止对O 的体
2
积测量造成干扰。
(3)装置D中含有氧化钠和过氧化钠,CO 分别与它们发生反应。
2
(4)根据反应2NaO+2CO===2Na CO+O,反应结束后测得气体体积为224 mL(标准状况),即生成的
2 2 2 2 3 2
氧气的物质的量为=0.01 mol,则过氧化钠的物质的量为0.02 mol,故试样中过氧化钠的纯度为×100%=
78%。
22. (10分)
Ⅰ. 某反应为:4CuI + Hg === Cu HgI + 2Cu (反应前后的I均为-1价),试回答:
2 4
(1)上述反应产物Cu HgI 中,Hg元素显 价;
2 4
(2)CuI发生 反应(填氧化或还原)。
Ⅱ. 某反应为:3HO+Cr (SO ) +10KOH===2KCrO + 3K SO + 8H O,用单线桥表示出该反应中电子
2 2 2 4 3 2 4 2 4 2
转移的方向和数目: 。
Ⅲ. 有下列三个反应:
a. 2FeCl + 2KI===2FeCl + 2KCl + I
3 2 2
b. 2FeCl + Cl ===2FeCl
2 2 3
c. 2KMnO + 16HCl(浓)===2KCl + 2MnCl + 5Cl ↑+ 8H O
4 2 2 2
(1)上述三个反应中氧化剂氧化性强弱关系为 ;
(2) 在 反 应 c 中 , 若 被 氧 化 的 HCl 为 1.5mol, 则 转 移 的 电 子 数
是 个。
【答案】
Ⅰ. ①+2; ②还原;
Ⅱ.6e-
3H O + Cr (SO ) + 10KOH 2K CrO + 3K SO + 8H O
2 2 2 4 3 2 4 2 4 2
(全对给分,有错无分)
Ⅲ. ① KMnO 〉Cl〉FeCl ② 1.5N (或9.03x1023)
4 2 3 A
【解析】
Ⅰ、①Cu HgI 中,反应前后的I均为−1价,则依据化合价代数和为0,Cu元素的化合价为+1价,计算
2 4
Hg元素的化合价为+2价,故答案为:+2;
②分析反应可知,4CuI+Hg═Cu HgI +2Cu中CuI中的铜元素化合价+1价变化为0价,化合价降低做氧化
2 4
剂被还原,故答案为:还原;
Ⅱ、①元素化合价降低的反应物做氧化剂被还原,元素化合价升高的反应物做还原剂被氧化,反应
3HO+Cr (SO ) +10KOH===2KCrO + 3K SO + 8H O,反应中Cr元素化合价+3价变化为+6价,元素化合
2 2 2 4 3 2 4 2 4 2
价升高失电子做还原剂被氧化,发生氧化反应,过氧化氢中氧元素化合价−1价变化为−2价,化合价降低得
到电子做氧化剂被还原,发生还原反应,故答案为:HO;Cr;
2 2
②单线桥是指从失去电子的一方指向得到电子的一方,上面标注电子转移总数,此反应中铬元素化合价
+3价变化为+4价,被氧化电子转移6e−,用单线桥表示出该反应中电子转移的方向和数目的化学方程式为:
6e-
3H O + Cr (SO ) + 10KOH 2K CrO + 3K SO + 8H O
2 2 2 4 3 2 4 2 4 2 ;
Ⅲ、①氧化剂的氧化性大于氧化产物,则
a. 2FeCl +2KI═2FeCl +2KCl+I ,氧化剂FeCl ,氧化产物I,氧化性FeCl >I ,
3 2 2 3 2 3 2
b. 2FeCl +Cl═2FeCl ,氧化剂Cl,氧化产物FeCl ,氧化性Cl>FeCl ,
2 2 3 2 3 2 3
c. 2KMnO +16HCl(浓)═2KCl+2MnCl +5Cl↑+8H O,氧化剂KMnO ,氧化产物Cl,氧化性KMnO >Cl,氧
4 2 2 2 4 2 4 2
化剂氧化性强弱关系为KMnO >Cl>FeCl ;
4 2 3
②2KMnO+16HCl(浓)═2KCl+2MnCl +5Cl↑+8H O,反应中被氧化10molHCl电子转移10mol,若被氧化
4 2 2 2
的HCl为1.5mol,则转移的电子数是1.5N .
A
23. (14分)
实验室需要0.1 mol·L-1 NaOH溶液450 mL和 0.5 mol·L-1硫酸溶液450 mL。根据这两种溶液的配制情
况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是________(填字母)。仪器C的名称是________,本实验所需玻璃仪器E的规格和名称是________。
(2)下列操作中,容量瓶所不具备的功能有__________(填字母)。
A.配制一定体积准确浓度的标准溶液
B.长期贮存溶液
C.用来加热溶解固体溶质
D.量取220 mL体积的液体
(3)在配制NaOH溶液的实验中,其他操作均正确,若定容时仰视刻度线,则所配制溶液浓度________(填
“大于”“等于”或“小于”,下同)0.1 mol·L-1。若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液
浓度________0.1 mol·L-1。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保
留一位小数)。如果实验室有10 mL、25 mL、50 mL量筒,应选用________mL规格的量筒最好。
(5)如果定容时不小心超过刻度线,应如何操作:______________________________。
【答案】
(1)AC 分液漏斗 500 mL容量瓶
(2)BCD
(3)小于 大于
(4)13.6 25
(5)重新配制
【解析】
(1)配制一定物质的量浓度溶液的一般步骤:计算、称量(量取)、溶解、冷却、移液、洗涤、定容、摇匀,用到
的仪器:托盘天平、药匙、量筒、烧杯、玻璃棒、容量瓶、胶头滴管,用不到的仪器:圆底烧瓶和分液漏斗;仪器
C的名称为分液漏斗;需要配制0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液450 mL,实验室没有
450 mL容量瓶,所以应选择500 mL容量瓶。
(2)容量瓶只能用来配制一定体积准确浓度的溶液,不能配制或测量容量瓶规格以下的任意体积的液体,
不能稀释或溶解药品,不能长期贮存溶液,不能用来加热溶解固体溶质,故选BCD。
(3)若定容时仰视刻度线,导致溶液体积偏大,溶液浓度偏小;若NaOH溶液未冷却即转移至容量瓶定容,
冷却后,溶液体积偏小,溶液浓度偏大。
(4)质量分数为98%、密度为1.84 g·cm-3的浓硫酸的物质的量浓度c= mol·L-1=18.4 mol·L-1,设配制
0.5 mol·L-1硫酸溶液500 mL需要浓硫酸的体积为V,则依据溶液稀释前后溶质的物质的量保持不变得:
V×18.4 mol·L-1=0.5 mol·L-1×500 mL,解得V≈13.6 mL,宜选用25 mL量筒。(5)如果定容时不小心超过刻度
线,实验失败,且不能补救,必须重新配制。
24. (16分)
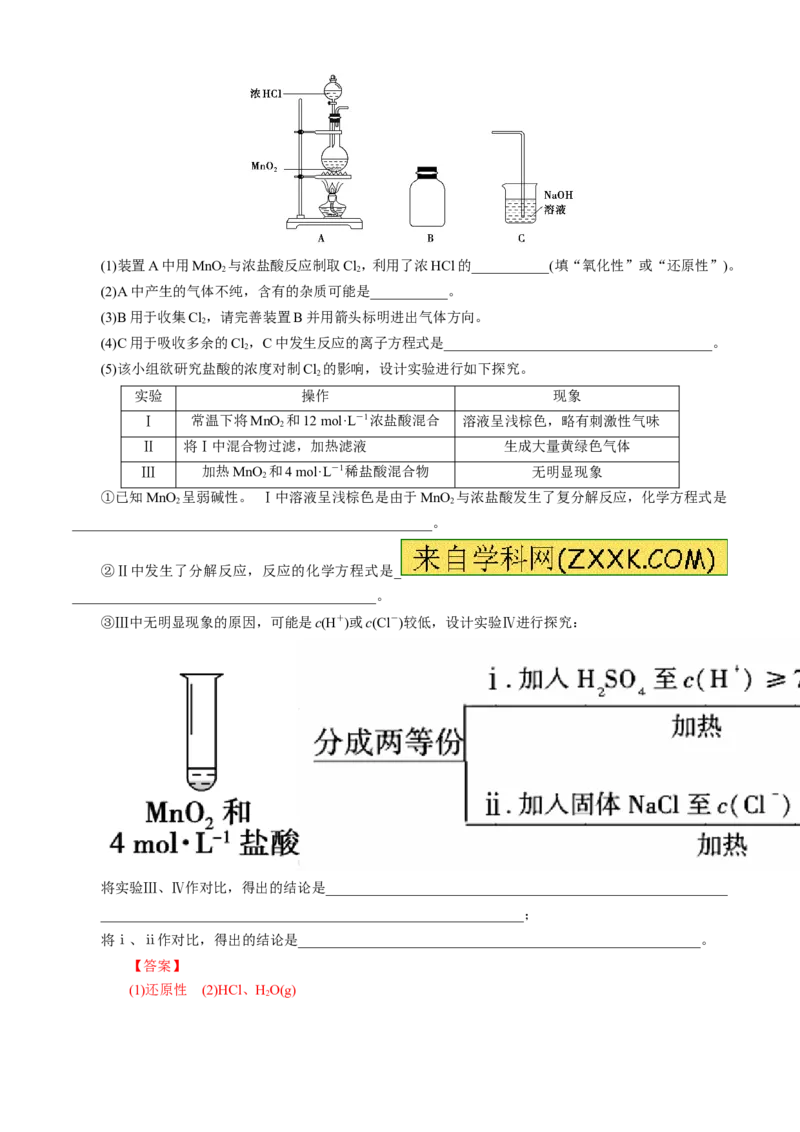
某研究小组制备氯气并对产生氯气的条件进行探究。(1)装置A中用MnO 与浓盐酸反应制取Cl,利用了浓HCl的___________(填“氧化性”或“还原性”)。
2 2
(2)A中产生的气体不纯,含有的杂质可能是___________。
(3)B用于收集Cl,请完善装置B并用箭头标明进出气体方向。
2
(4)C用于吸收多余的Cl,C中发生反应的离子方程式是______________________________________。
2
(5)该小组欲研究盐酸的浓度对制Cl 的影响,设计实验进行如下探究。
2
实验 操作 现象
Ⅰ 常温下将MnO 和12 mol·L-1浓盐酸混合 溶液呈浅棕色,略有刺激性气味
2
Ⅱ 将Ⅰ中混合物过滤,加热滤液 生成大量黄绿色气体
Ⅲ 加热MnO 和4 mol·L-1稀盐酸混合物 无明显现象
2
①已知MnO 呈弱碱性。 Ⅰ中溶液呈浅棕色是由于MnO 与浓盐酸发生了复分解反应,化学方程式是
2 2
___________________________________________________。
②Ⅱ中发生了分解反应,反应的化学方程式是_
___________________________________________。
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:
将实验Ⅲ、Ⅳ作对比,得出的结论是_________________________________________________________
____________________________________________________________;
将ⅰ、ⅱ作对比,得出的结论是_________________________________________________________。
【答案】
(1)还原性 (2)HCl、HO(g)
2(3)
(4)Cl +2OH-===Cl-+ClO-+HO
2 2
(5)①MnO + 4 HCl===MnCl + 2HO
2 4 2
②MnCl ===Cl↑+MnCl ③Ⅲ中没有明显现象的原因是c(H+)、c(Cl-) 较低,需要增大到一定浓度才能被
4 2 2
MnO 氧化;MnO 氧化盐酸的反应中c(H+)变化的影响大于c(Cl-)
2 2
【解析】
(1)二氧化锰和浓盐酸加热反应生成氯气,氯元素化合价升高失电子发生氧化反应,锰元素化合价降低得
到电子发生还原反应,氯化氢做还原剂具有还原性;
(2)浓盐酸具有挥发性,氯气中含杂质为氯化氢和水蒸气,化学式为:HCl、HO(g);
2
(3)氯气比空气重,用向上排空气法收集,导气管长进短出,装置图为: ;
(4)C用于吸收多余的Cl,是氢氧化钠和氯气反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl
2 2
+2OH-===Cl-+ClO-+HO;
2
(5)①Ⅰ中溶液呈浅棕色是由于MnO 与浓盐酸发生了复分解反应,化学方程式是:MnO +4HCl===MnCl
2 2 4
+2HO;
2
②Ⅱ中发生了分解反应,将Ⅰ中混合物过滤,加热滤液分解生成氯气和氯化锰,反应的化学方程式是:
MnCl ===Cl↑+MnCl ;
4 2 2
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,将实验Ⅲ、Ⅳ作对比,得出的结论是Ⅲ中没有明
显现象的原因是c(H+)、c(Cl-) 较低,需要增大到一定浓度才能被MnO 氧化,将ⅰ、ⅱ作对比,加热MnO 和
2 2
4 mol·L - 1 稀 盐 酸 混 合 物 , 加 入 硫 酸 和 加 入 氯 化 钠 都 生 成 黄 绿 色 气 体
,其中氢离子浓度小于氯离子,得出的结论是MnO 氧
2
化盐酸的反应中c(H+)变化的影响大于c(Cl-)。
25. (10分)
常温下,将20.0 g质量分数为14.0%的KNO 溶液与30.0 g质量分数为24.0%的KNO 溶液混合,得到
3 3
的密度为1.15 g/cm3的混合溶液。计算(写出计算步骤):
(1)混合后溶液的质量分数。
(2)混合后溶液的物质的量浓度(计算结果保留两位小数,下同)。
(3)在1 000 g水中需溶解多少摩尔KNO 才能使其浓度恰好与上述混合后溶液的浓度相等?
3
【答案】
(1)混合后溶液的质量分数为20%;(2)混合后溶液的物质的量浓度为2.28mol/L;
(3)在1000g水中需溶解2.48molKNO 才能使其浓度恰好与上述混合后溶液的浓度相等。
3
【解析】
(1)混合后溶液中的质量为:20.0g+30.0g=50.0g,溶质硝酸钾的质量为:20.0g×14%+30.0g×24%=10.0g,
混合后溶液的质量分数: ×100%=20%,
(2)混合溶液的体积为: =43.48mL=0.04348L,溶液中溶质的物质的量为:
=0.099mol,混合后溶液的物质的量浓度为: =2.28mol/L,
(3)设需要硝酸钾的物质的量为xmol,硝酸钾的质量为101x,根据(1)可知,硝酸钾的质量分数为20%,则
ω=20%= ,解得:x≈2.48mol,