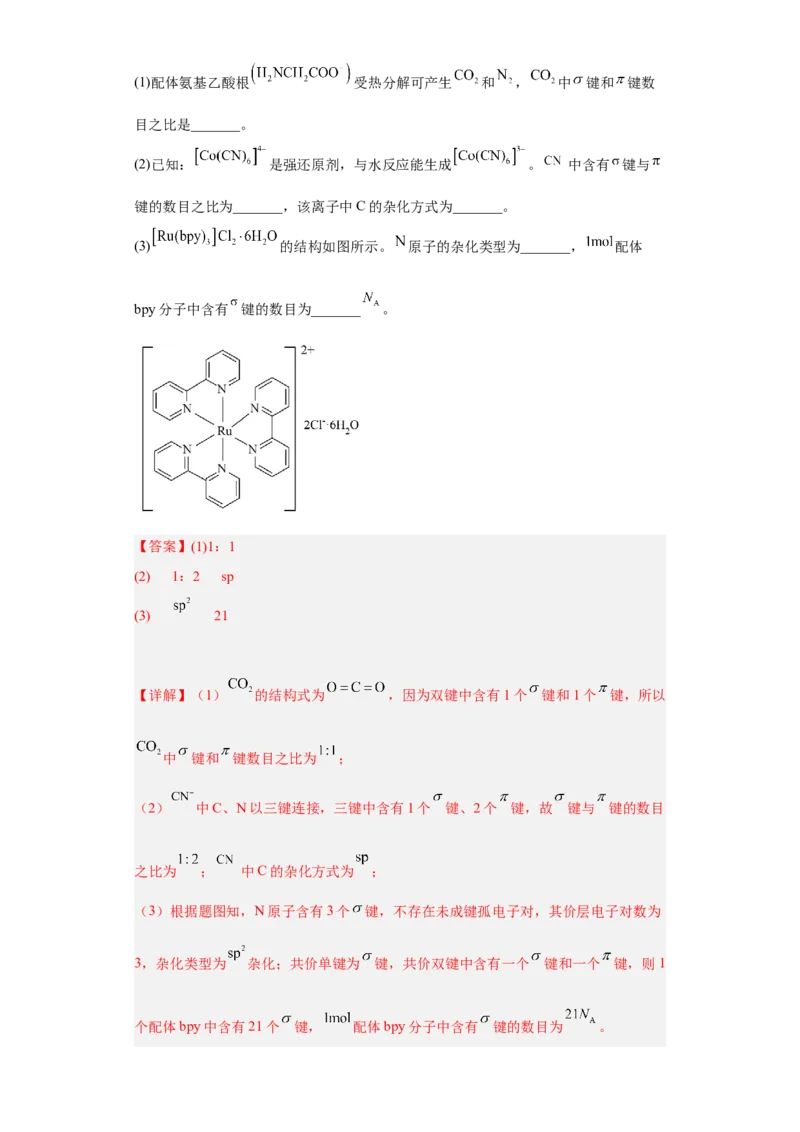
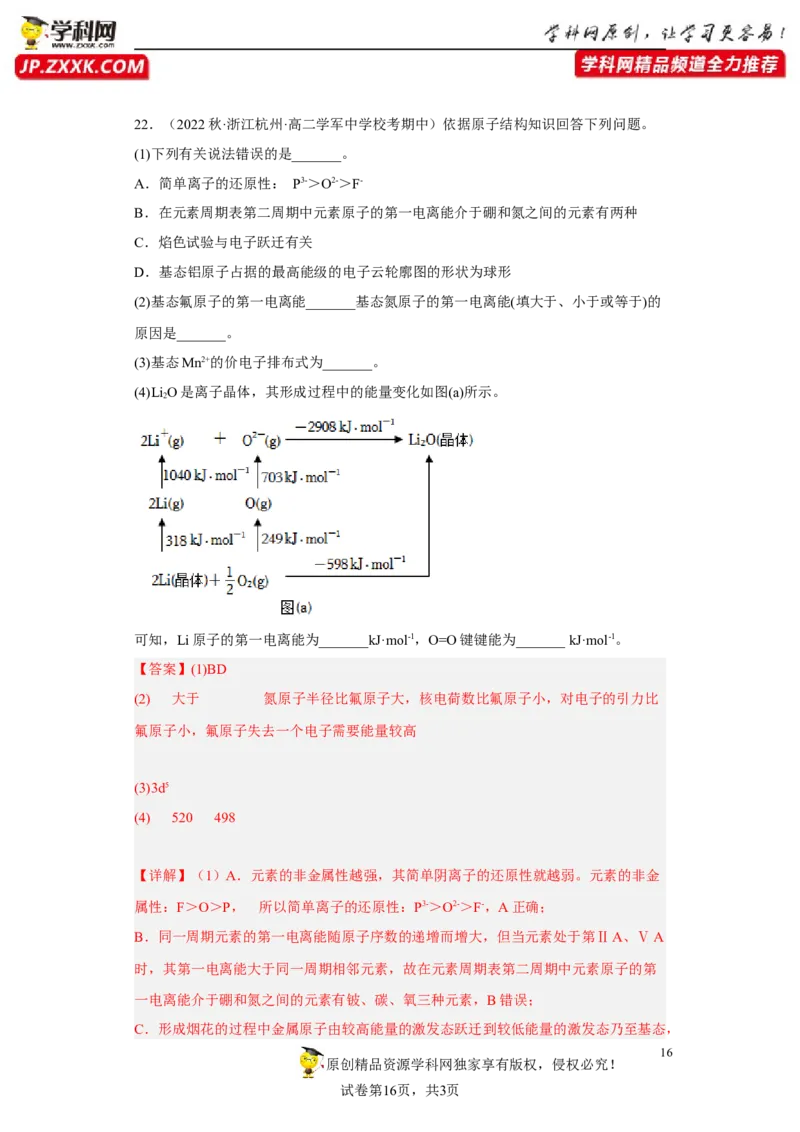
文档内容
期末复习检测卷一
一、单选题
1.(广西桂林市2022-2023学年高一上学期期末考试化学试题)硒( )元素位于元
素周期表第四周期,与硫同族。以下对于硒( )的相关说法不正确的是
A.Se的原子序数是34 B.Se的原子半径大于S
C.Se的最高化合价为+6价 D. 的还原性比 弱
【答案】D
【详解】A.硒( )元素位于元素周期表第四周期,与硫同族,Se的原子序数是
16+18=34,故A正确;
B.同主族元素,原子序数越大,半径越大,则Se的原子半径大于S,故B正确;
C.硒( )元素位于元素周期表第四周期,与硫同族,位于第VIA族,最高化合价为
+6价,故C正确;
D.硒( )元素位于元素周期表第四周期,与硫同族,同主族元素核电荷数越大,单
质氧化性减弱,对应离子还原性增强, 的还原性比 强,故D错误;
故选D。
2.(2023秋·辽宁葫芦岛·高二统考期末)下列化学用语正确的是
A.乙醇的结构式:
B.水的电子式:
C.基态铬原子( )的价层电子排布式:
D.基态氧原子的轨道表示式:
【答案】C【详解】A.乙醇的结构式: ,故A错误;
B.水是共价化合物,水的电子式: ,故B错误;
C.基态铬原子( Cr)的价电子排布式:3d54s1,故C正确;
24
D.根据洪特规则,原子核外电子在能量相同的各个轨道上排布时,电子尽可能分占
不同的原子轨道,且自旋状态相同,则基态氧原子的轨道表示式为:
,故D错误;
故选C。
3.(天津市南开区2022-2023学年高二上学期阶段性质量监测化学试题)嫦娥5号月
球探测器带回的月壤样品的元素分析结果如图,下列有关含量前六位元素的说法正确
的是
A.原子半径:Al<Si B.第一电离能:Mg<Ca
C.Fe位于元素周期表的p区 D.这六种元素中,电负性最大的是O
【答案】D
【详解】A.Al、Si同周期,Al的核电荷数小于Si,原子半径:Al>Si,故A错误;
B.Mg、Ca同主族,同主族从上到下第一电离能减小,故B错误;
C.Fe位于元素周期表的d区,故C错误;
D.同周期元素从左到右电负性增大,同主族元素从上到下电负性减弱,则由此可知
2
原创精品资源学科网独家享有版权,侵权必究!
试卷第2页,共3页六种元素中电负性最大的为O,故D正确;
故选:D。
4.(山东省菏泽市2023届高三一模考试化学试题)居里夫妇用α粒子( )轰击某金
属原子 得到 ,基态Y原子3p能级半充满。 具有放射性,很快衰变为 :
, 。下列说法正确的是
A.第一电离能:XQ,故D错误;
故答案选A。
5.(2023秋·四川绵阳·高二统考期末)下列物质中,由极性键构成的非极性分子是
A. B. C. D.
【答案】A
【分析】同种原子构成的共价键是非极性键,不同原子构成的共价键是极性键;分子
中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样
的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子
分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子,据此分析
解答。【详解】A. 含有C-H极性键,正负电荷的重心重合,属于非极性分子,故A正
确;
B. 正负电荷的重心不重合,属于极性分子,故B错误;
C. 由阴阳离子构成,不存在分子,故C错误;
D. 正负电荷的重心不重合,属于极性分子,故D错误;
故选:A。
6.(四川省雅安市2022-2023学年高二上学期期末考试化学试题)下列分子中只存在
σ键的是
A.CO B.C H C.CHOH D.C H
2 2 4 3 2 2
【答案】C
【分析】单键全是σ键,双键中有1个σ键和1个π键,叁键中有1个σ键和2个π
键,。
【详解】A.CO 中含有2个碳氧双键,所以CO 中有2个σ键和2个π键,故不选
2 2
A;
B.C H 分子中含有1个碳碳双键和4个C-H键,C H 分子中5个σ键和1个π键,故
2 4 2 4
不选B;
C.CHOH分子中含有3个C-H键、1个C-O键、1个O-H键,CHOH分子中只存在
3 3
σ键,故选C;
D. C H 分子中含有1个碳碳叁键和2个C-H键,C H 分子中3个σ键和2个π键,
2 2 2 2
故不选D;
选C。
7.(2022·福建·统考高考真题)某非线性光学晶体由钾元素(K)和原子序数依次增大的
X、Y、Z、W四种短周期元素组成。X与Y、Z与W均为同周期相邻元素,X的核外
电子总数为最外层电子数的2倍,Z为地壳中含量最多的元素。下列说法正确的是
A.简单氢化物沸点: B. 分子的空间构型为三角锥形
C.原子半径: D.最高价氧化物对应水化物的碱性:
4
原创精品资源学科网独家享有版权,侵权必究!
试卷第4页,共3页【答案】A
【分析】X的核外电子总数为最外层电子数的2倍,X为Be;Z为地壳中含量最多的
元素,Z为O,X与Y、Z与W均为同周期相邻元素,Y为B,W为F,据此解答。
【详解】A. 常温下为液态,HF常温下为气体,沸点 ,故A正确;
B. 为BF,中心B原子有3对价电子且没有孤电子对,空间构型为平面三角形,
3
故B错误;
C.四种元素为同周期元素,随核电荷数增大原子半径减小,原子半径:Be>B>O>F,
故C错误;
D.Be最高价氧化物水化物为Be(OH) ,溶液显两性,B最高价氧化物的水化物为
2
HBO,溶液显酸性,故D错误;
3 3
故选:A。
8.(2022·福建·高三统考专题练习)工业上制备高纯硅涉及的反应
。 为阿伏加德罗常数的值。下列说法正确的是
A.2gH 完全反应时转移的电子数为 B. 单晶硅中 键的数目为
2
C. 的 溶液中 的数目为 D.标准状况下, 的分子数
为
【答案】A
【详解】A.反应中氢气中氢元素化合价由0变为+1,根据化学方程式和电子守恒可
知,2gH(为1mol)完全反应时转移的电子数为 ,A正确;
2
B.单晶硅中平均1个硅原子形成2个硅硅键, 单晶硅中 键的数目为 ,
B错误;
C.不确定溶液体积,不能计算氢离子的物质的量,C错误;
D.标准状况下, 不是气体,不能计算其物质的量,D错误;
答案选A。
9.(2022·福建·高三统考专题练习)某种净水剂由原子序数依次增大的R、W、X、Y、Z五种主族元素组成。五种元素分处三个短周期,且包含地壳中含量前三的三种元
素。五种元素原子的最外层电子数之和为20。下列说法正确的是
A.简单离子半径:
B.最简单氢化物的稳定性:
C.R分别与W、Z形成的三原子分子均为V形分子
D.常见单质的熔点:
【答案】C
【分析】R、W、X、Y、Z为原子序数依次增大的五种主族元素,且分处三个短周期,
则R一定位于第一周期,Z一定位于第三周期。五种元素包含地壳中含量前三的元素
O、Si、Al,五种元素原子的最外层电子数之和为20,则剩余的最后一种元素最外层
电子数为 ,为S,结合原子序数关系,可知R为H,W为O,X为
Al,Y为Si,Z为S。
【详解】A.电子层结构相同的离子,原子序数越大,半径越小,故离子半径
,A错误;
B.非金属性 ,故最简单氢化物的稳定性 ,B错误;
C. 和 的空间构型均为V形,C正确;
D.硅单质为共价晶体(原子晶体),其熔点比铝单质的高,D错误;
故选C。
10.(四川省乐山市2022-2023学年高二下学期开学考试化学试题)下图为“点击化
学”的一种反应,下列关于物质Ⅰ~Ⅲ的说法正确的是
A.Ⅰ的组成元素中电负性最大的元素为O
B.一个Ⅱ分子中有9个 键
C.Ⅱ分子中C原子的杂化方式均为sp杂化
6
原创精品资源学科网独家享有版权,侵权必究!
试卷第6页,共3页D.Ⅲ中碳氧键的键能均相等
【答案】A
【详解】A.Ⅰ由C、H、O和N元素组成,电负性最大的元素为O,故A正确;
B.单键均为 键,双键中含有1个 键1个π键,叁键含有1个 键2个π键;I个II
分子中含有14个 键,故B错误;
C.Ⅱ分子中苯环上的C原子的杂化形式属于sp2杂化,故C错误;
D.Ⅲ中含有C-O和C=O,碳氧键的键能不相等,故D错误;
故答案选A。
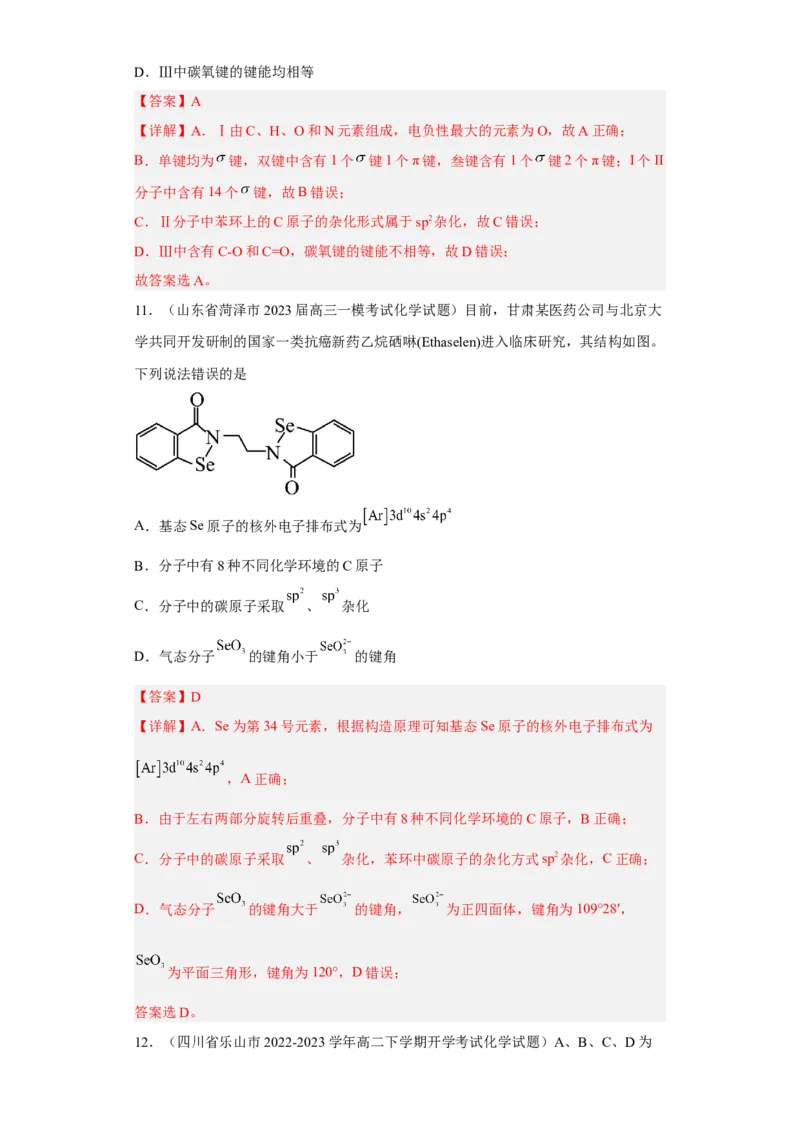
11.(山东省菏泽市2023届高三一模考试化学试题)目前,甘肃某医药公司与北京大
学共同开发研制的国家一类抗癌新药乙烷硒啉(Ethaselen)进入临床研究,其结构如图。
下列说法错误的是
A.基态Se原子的核外电子排布式为
B.分子中有8种不同化学环境的C原子
C.分子中的碳原子采取 、 杂化
D.气态分子 的键角小于 的键角
【答案】D
【详解】A.Se为第34号元素,根据构造原理可知基态Se原子的核外电子排布式为
,A正确;
B.由于左右两部分旋转后重叠,分子中有8种不同化学环境的C原子,B正确;
C.分子中的碳原子采取 、 杂化,苯环中碳原子的杂化方式sp2杂化,C正确;
D.气态分子 的键角大于 的键角, 为正四面体,键角为109°28′,
为平面三角形,键角为120°,D错误;
答案选D。
12.(四川省乐山市2022-2023学年高二下学期开学考试化学试题)A、B、C、D为四种短周期主族元素,在周期表中的相对位置如图所示,D的最高价氧化物对应水化
物在周期表中酸性最强,下列说法正确的是
A B
C D
A.原子半径:A>B>C
B.非金属性:D>C>B
C.C与D形成的化合物为分子晶体
D.离子 中中心原子的价电子对数为3
【答案】C
【分析】D的最高价氧化物对应水化物在周期表中酸性最强,该化合物是HClO,推
4
出D为Cl,B为O,A为N,C为Si,据此分析;
【详解】A.同一周期,从左向右,原子半径逐渐减小,同一主族,从上到下,原子
半径逐渐增大,因此原子半径大小顺序是Si>N>O,故A错误;
B.O的非金属性强于Cl,故B错误;
C.Si与Cl形成化合物是SiCl ,属于分子晶体,故C正确;
4
D.ClO 中心原子Cl,有3个σ键,孤电子对数为 =1,价电子对数为4,故
D错误;
答案为C。
13.(2022秋·吉林长春·高三校考阶段练习)下列物质中属于分子晶体,而且既含σ
键又含π键的是
A.KSCN B.CO C.HO D.Al(OH)
2 2 2 3
【答案】B
【详解】A.KSCN属于离子晶体,故A不符合题意;
B.CO 属于分子晶体,结构式为O=C=O,含有σ键和π键,故B符合题意;
2
C.HO 属于分子晶体,结构式为H-O-O-H,只含有σ键,故C不符合题意;
2 2
D.氢氧化铝的结构式为 ,只含有σ键,故D不符合题意;
8
原创精品资源学科网独家享有版权,侵权必究!
试卷第8页,共3页答案为B。
14.(2022秋·重庆北碚·高二西南大学附中校考开学考试)下列说法正确的是
A.SiO 晶体中最小环是十二元环
2
B.石墨和金刚石中碳原子的杂化类型相同,属于同种晶体类型
C.金刚石比石墨更稳定
D.12g金刚石中含有的C—C数目为1.5N
A
【答案】A
【详解】A. SiO 晶体中每个Si原子连接4个O原子,每个O原子连接2个Si原子,
2
最小环上有12个原子,其中包括6个Si原子,6个O原子,故A正确;
B. 石墨和金刚石中碳原子的杂化类型不相同,分别采用sp2、sp3杂化,分别属于混
合晶体、共价晶体,故B错误;
C. 金刚石没有石墨稳定,故C错误;
D.金刚石中每个碳原子与4个其它碳原子相连,两个碳原子共用一条键,1mol金刚
石实际拥有2mol碳碳键,则12g金刚石中含有的共价键数目为2N ,故D错误;
A
故选A。
15.(2023·湖南常德·高三常德市鼎城区第一中学校考阶段练习)X、Y、Z、W是元
素周期表中原子序数依次增大的前四周期元素,某科研团队研究发现,X、Y、W形成
的晶体有超导性,该新型超导晶体的一个晶胞如图所示,晶胞参数为apm。已知X是
形成化合物种类最多的元素,Y和W的最外层电子数相同,但不同族,W的次外层电
子数是最外层的8倍,Z是主族元素,其最高价氧化物的水化物可以用于净水,下列
说法正确的是
A.Y的第一电离能小于Z的第一电离能
B.Z的最高价氧化物的水化物可以与X最高价氧化物的水化物反应
C.晶胞中与Y最近的W原子有6个
D.晶体密度为 g/cm3
【答案】D
【分析】X、Y、Z、W是元素周期表中原子序数依次增大的前四周期元素,X是形成
化合物种类最多的元素,则X为C元素;Z是主族元素,其最高价氧化物的水化物可以用于净水,则Z为Al元素;Y和W的最外层电子数相同,但不同族,W的次外层
电子数是最外层的8倍,则Y为Mg元素、W为Ni元素。
【详解】A.同周期元素,从左到右第一电离能呈增大趋势,镁原子的3s轨道为稳定
的全充满结构,元素的第一电离能大于同周期相邻元素,则镁元素的第一电离能大于
铝元素,故A错误;
B.氢氧化铝是溶于强酸、强碱的两性氢氧化物,但氢氧化铝不能溶于弱酸碳酸,故B
错误;
C.由晶胞结构可知,晶胞中位于顶点的镁原子与位于面心的镍原子的距离最近,则晶
胞中与镁原子最近的镍原子个数为12,故C错误;
D.由晶胞结构可知,晶胞中位于顶点的镁原子个数为8× =1,位于面心的镍原子个
数为6× =3,位于体内的碳原子个数为1,则晶胞的化学式为MgNiC,设晶体的密度
3
为dg/cm3,由晶胞的质量公式可得: =(10-10a)3d,解得d= ,故D正确;
故选D。
16.(2023秋·湖北武汉·高三统考期末)O和S为ⅥA族元素,下列说法正确的是
A.O元素、S元素可形成多种同分异构体 B. 和 均可和 形成配位键
C. 与 均是强酸 D. 与 中S原子的杂化方式相同
【答案】B
【详解】A.O元素、S元素可形成多种同素异形体,A错误;
B.含有孤对电子和含有空轨道的原子间易形成配位键,HO和HS均有孤对电子,
2 2
H+有一个空轨道,可以和HO和HS的中心原子形成1个配位键,B正确;
2 2
C.HSO 是弱酸,HSO 是强酸,C错误;
2 3 2 4
D.SCl 中心S价层电子对数=2+ =4,S为sp3杂化,SF 中S原子最外层有6个电
2 6
子,每个F再提供一个电子,共提供6个电子形成6对成键电子,是sp3d2杂化,杂化
方式不同,D错误;
故答案为:B。
10
原创精品资源学科网独家享有版权,侵权必究!
试卷第10页,共3页17.(2023秋·上海徐汇·高三上海市西南位育中学校考期末)下列固体熔化时破坏共
价键的是
A.冰 B.铝 C.二氧化硅 D.烧碱
【答案】C
【详解】A.冰是固态水,熔化时破坏的是分子间作用力,故A不选;
B.铝属于金属,熔化时破坏的是金属键,故B不选;
C.二氧化硅中硅原子和氧原子之间存在极性共价键,二氧化硅熔化时破坏极性共价键,
故C选;
D.烧碱是NaOH,属于离子化合物,熔化时破坏的是离子键,故D不选;
故选C。
18.(2023春·河北邯郸·高三校联考开学考试)工业上利用黄铜矿炼铜的反应方程式
是 。产物中某种晶体的立方晶胞结构如图所示。下列说法
错误的是
A.该立方晶胞结构图表示的是FeS B.每生成 ,有 原子被
氧化
C. 中S原子的杂化类型为 D.晶胞中黑球所代表粒子的配位数为4
【答案】C
【详解】A.根据晶胞结构,黑球个数为4,白球个数为4,晶胞中两种微粒个数比为
1∶1,故为 ,A正确;
B.从方程式中可以看出,每生成1molFeS,被氧化的S元素生成了 ,物质的量为
,B正确;
C. 中S原子价层电子数为 ,故S为 杂化,C错误;
D.根据晶胞结构, 的配位数为4,则S的配位数也为4,D正确;
故选C。二、填空题
19.(天津市武清区2022-2023学年高一上学期期末考试化学试题)回答下列问题:
(1)原子X,它的质量数等于137,中子数是81,则X核外电子数为_______。
(2)某离子化合物化学式为 ,X、Y均为周期表前20号元素。其阳离子和阴离子的
电子结构相同,且 含有54mol电子。
①读离子化合物的化学式是_______。
②该物质中化学键类型是_______,电子式是_______。
(3)已知铷 (Rb)是37号元素,与钠同主族。
①铷位于第_______周期,其形成的氢氧化物的碱性比氢氧化钠的碱性_______(填
“强”或“弱”)。
②铷单质与水反应的离子方程式为_______,实验表明。Rb与水反应比Na与水反应
_______(填“剧烈”或“强慢”)。
【答案】(1)56
(2) 离子键
(3) 五 强 剧烈
【详解】(1)X的质量数为137,中子数为81,所以质子数=质量数-中子数=137-
81=56,又因为原子呈电中性,所以核外电子数=质子数=56。
(2)某种化合物的化学式为XY ,X、Y均为周期表前20号元素,其阳离子和阴离子
2
的电子层结构相同,且lmolXY 含有54mol电子,则阴、阳离子核外电子数为
2
=18,则为Ca2+、 Cl-,即X为Ca、Y为Cl,XY 为CaCl ,钙离子与氯离子之间存在
2 2
离子键。
①该物质的化学式为:CaCl ;
2
12
原创精品资源学科网独家享有版权,侵权必究!
试卷第12页,共3页②其含有的化学键类型为:离子键;其电子式为: 。
(3)①铷位于第五周期,Na和Rb同主族,金属性:Na