文档内容
2022-2023 学年高一化学上学期期中测试卷 05
(考试时间:90分钟 试卷满分:100分)
考试内容:新教材人教必修1第一、二章 难度:★★★★☆
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 Si-28 S-32
Fe-56 Cu-64
一、选择题(本题共25个小题,每小题2分,共50分。在每小题给出的四个选项中,只有
一项是符合题目要求的。)
1.下列物质属于酸性氧化物的是( )
A.NaO B.CO C.CaO D.SO
2 2
2.由一种元素组成的物质( )
A.一定是一种单质 B.一定是纯净物 C.一定不是化合物 D.不可能是混合物
3.下列物质中,属于电解质的是( )
A.Cu B.HCl C.NaCl溶液 D.CO
2
4.下列分散系能产生丁达尔效应的是
A.稀硫酸 B.氢氧化铁胶体 C.饱和食盐水 D.氯化钾溶液
5.下列物质在水溶液中的电离方程式书写正确的是( )
A.NaHCO ===Na++HCO B.Al O===2Al3++3O2-
3 2 3
C.MgCl ===Mg2++Cl D.NaHSO===Na++HSO
2 4
6.下列叙述中,不正确的是( )
A.摩尔是物质的量的单位 B.N 的摩尔质量为28g/mol
2
C.阿伏加德罗常数为6.02×1023 D.标准状况下,气体摩尔体积约为22.4L/mol
7.下列物质中,所含分子数最多的( )
A.0.8molHe B.标准状况下4.48LSO
2
C.N 个CH(N 为阿伏加德罗常数) D.16gO(O 的摩尔质量是32g•mol-1)
A 4 A 2 2
8.下列反应中,划线的物质发生氧化反应的是( )
A.Cu+2FeCl ===2FeCl +CuCl B.CO+C=====2CO
3 2 2 2
C.Fe O+2Al=====Al O+2Fe D.CO+NaOH===NaHCO
2 3 2 3 2 3
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司9.下列电离方程式书写正确的是( )
A.把CaO放入水中:CaO=Ca2++O2-
B.加热NaHSO 至熔融状态:NaHSO=Na++HSO -
4 4 4
C.把Al (SO ) 放入水中:Al (SO )=Al3++SO2-
2 4 3 2 4 3 4
D.把NH Cl放入水中:NH Cl=N3-+4H++Cl-
4 4
10.近年来我国大力弘扬中华优秀传统文化体现了中华民族的文化自信。下列有关说法不
正确的是( )
A.成语“百炼成钢”水滴石穿”中均涉及了氧化还原反应
B.“忽如一夜春风来,千树万树梨花开”的场景描述主要是物理变化
C.《梦溪笔谈》中“又石穴中水,所滴者皆为钟乳……”不涉及氧化还原反应
D.《荷塘月色》中“薄薄的青雾浮起在荷塘里”中的“青雾”属于胶体
11.新冠肺炎疫情“此起彼伏”,新型冠状病毒的主要传播途径有直接传播(飞沫传播)和接
触传播,目前没有直接证据证明病毒通过气溶胶传播。下列说法不正确的是( )
A.云、烟、雾均属于气溶胶
B.胶体的分散质粒子大小在1nm到l00nm之间,能通过滤纸不能透过半透膜
C.胶体是混合物,可用丁达尔效应来鉴别胶体和溶液
D.PM2.5是对空气中直径小于或等于2.5μm(2.5×10-6m)的固体颗粒或液滴的总称,其分散
在空气中一定形成气溶胶
12.X、Y、Z、W各代表一种物质,若X+Y===Z+W,则X和Y之间不可能是( )
A.盐和盐的反应 B.碱性氧化物和水的反应
C.酸与碱的反应 D.酸性氧化物和碱的反应
13.把钠放入滴有酚酞溶液的水中,下列现象不会出现的是( )
A.钠浮在水面上 B.钠熔化成小球
C.溶液中产生较多的气泡 D.水溶液变成红色
14.下列不是NaO和NaO 的共同之处是( )
2 2 2
A.均是碱性氧化物 B.均能与水反应生成碱
C.阴阳离子的个数比均为1:2 D.均能与CO 反应生成NaCO
2 2 3
15.下列化学反应的离子方程式,书写正确的是( )
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司A.稀硫酸滴在铜片上:Cu+2H+=Cu2++H ↑
2
B.金属钠投入硫酸铜溶液中:2Na+Cu2+=Cu+2Na+
C.NaHSO 溶液与NaOH溶液混合:HSO -+OH-=SO2-+H O
4 4 4 2
D.碳酸钙溶于足量的盐酸中:CaCO +2H+=Ca2++H O+CO↑
3 2 2
16.下列表示氧化还原反应中电子转移的方向和数目正确的是( )
A. B.
C. D.
17.下列各组中的离子,能在溶液中大量共存的是( )
A.K+、H+、SO 2-、OH- B.Na+、Ca2+、CO2-、NO -
4 3 3
C.K+、Na+、OH-、Cl- D.Cu2+、Ba2+、Cl-、SO 2-
4
18.将氯气持续通入紫色石蕊试液中,溶液颜色呈如图变化:
关于溶液中导致变色的微粒I、II、III的判断正确的是( )
A.H+、HClO、Cl B.H+、Cl-、ClO-
2
C.HCl、ClO-、Cl- D.HClO、HCl、Cl
2
19.设N 为阿伏加德罗常数的值。下列说法正确的是( )
A
A.42gNaHCO 含有的阳离子总数为0.5N
3 A
B.标准状况下2.24LNH 含有的中子数为N
3 A
C.35.5g氯气与过量铁粉充分反应转移的电子数为1.5N
A
D.含0.2mol的FeCl 饱和溶液滴入沸水中,形成的Fe(OH) 胶粒数为0.2N
3 3 A
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司20.已知NCl 中N元素为 价,关于反应NCl +6 NaClO+3H O=3NaOH+3ClO ↑+NH↑+
3 3 2 2 2 3
3NaCl,下列说法正确的是( )
A.NH 是氧化产物
3
B.NaClO 发生了还原反应
2
C.当反应中转移0.6mol电子时,有0.1molNCl 被还原
3
D.氧化剂与还原剂的物质的量之比为6:1
21.已知酸性:HCO>HClO>HCO -,氧化性:HClO>Cl>Br >Fe3+>I。下列有关离子
2 3 3 2 2 2
反应或离子方程式的叙述中,正确的是( )
A.向溴水中加入足量氯化亚铁溶液能使溴水褪色
B.能使 试纸显蓝色的溶液中,Fe3+、 、 、 能大量共存
C.向 溶液中通入少量二氧化碳的离子方程式2ClO-+CO +H O=2HClO+CO2-
2 2 3
D.向FeI 溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl=2Cl-+2Fe3+
2 2
22.氯酸是一种强酸,氯酸的浓度超过 就会迅速分解,反应的化学方程式为:
8HClO=3O ↑+2Cl↑+4HClO +2H O。下列说法正确的是( )
3 2 2 4 2
A.所得混合气体的平均相对分子质量为
B.O、Cl 是氧化产物
2 2
C.生成标准状况下1.344LO ,转移电子数0.4N
2 A
D.被氧化和被还原的氯元素之比为2:1
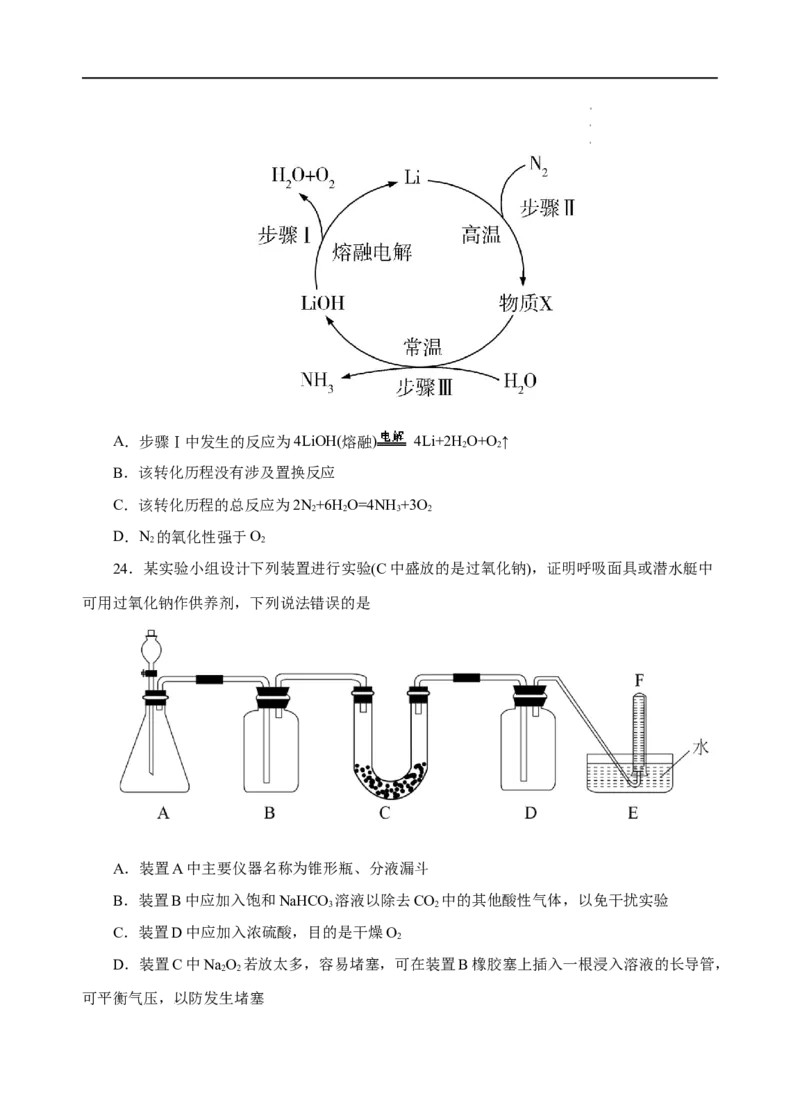
23.氮肥是保证粮食安全的重要物资,某种制备NH 的转化历程如图所示。下列说法错误
3
的是( )
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司A.步骤Ⅰ中发生的反应为4LiOH(熔融) 4Li+2H O+O↑
2 2
B.该转化历程没有涉及置换反应
C.该转化历程的总反应为2N+6H O=4NH +3O
2 2 3 2
D.N 的氧化性强于O
2 2
24.某实验小组设计下列装置进行实验(C中盛放的是过氧化钠),证明呼吸面具或潜水艇中
可用过氧化钠作供养剂,下列说法错误的是
A.装置A中主要仪器名称为锥形瓶、分液漏斗
B.装置B中应加入饱和NaHCO 溶液以除去CO 中的其他酸性气体,以免干扰实验
3 2
C.装置D中应加入浓硫酸,目的是干燥O
2
D.装置C中NaO 若放太多,容易堵塞,可在装置B橡胶塞上插入一根浸入溶液的长导管,
2 2
可平衡气压,以防发生堵塞
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司25.下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
选项 陈述Ⅰ 陈述Ⅱ 判断
A 纯碱可用于治疗胃溃疡 纯碱可与盐酸反应 Ⅰ对,Ⅱ对,有
CO 中的少量HCl杂质可将气
B 2 NaCO 可与HCl反应 Ⅰ对,Ⅱ错,无
体通入饱和NaCO 溶液除去 2 3
2 3
NaCO 溶液中混有少量
2 3 NaHCO 可与NaOH反
C NaHCO 杂质,可加入适量 3 Ⅰ对,Ⅱ对,有
3 应生成NaCO
NaOH除去 2 3
向饱和NaCO 溶液中通入CO
D 2 3 2 NaHCO 难溶于水 Ⅰ对,Ⅱ对,有
气体,有白色晶体析出 3
二、非选择题(包括第26题~第31题6个大题,共50分)
26.(7分)钠、铁及它们的化合物在生产、生活中有着重要的用途。
(1)某汽车安全气囊的产气药剂主要含有NaN 、Fe O、KClO、NaHCO 等物质。当汽车发
3 2 3 4 3
生碰撞时,NaN 迅速分解产生N 和Na,同时放出大量的热,N 使气囊迅速膨胀,从而起到保
3 2 2
护作用。
①KClO 是助氧化剂,可处理产生的Na,其中氯元素的化合价是_______。
4
②Fe O 是主氧化剂,也可处理产生的Na,反应为6Na+Fe O 3NaO+2Fe,反应
2 3 2 3 2
中NaO是_______(填“还原产物”或“氧化产物”)。
2
③NaHCO 是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式为_______。
3
(2)电子工业常用30%的FeCl 溶液腐蚀覆在绝缘板上的铜箔,制造印刷电路板。
3
①FeCl 溶液与金属铜发生反应的离子方程式为_______。
3
②除去FeCl 溶液中混有的FeCl 可加入_______,反应的离子方程式为_______。
3 2
③将FeCl 饱和溶液滴入沸水中,并继续加热至液体呈红褐色,制得分散系为_______(填
3
“溶液”“胶体”或“浊液”)。
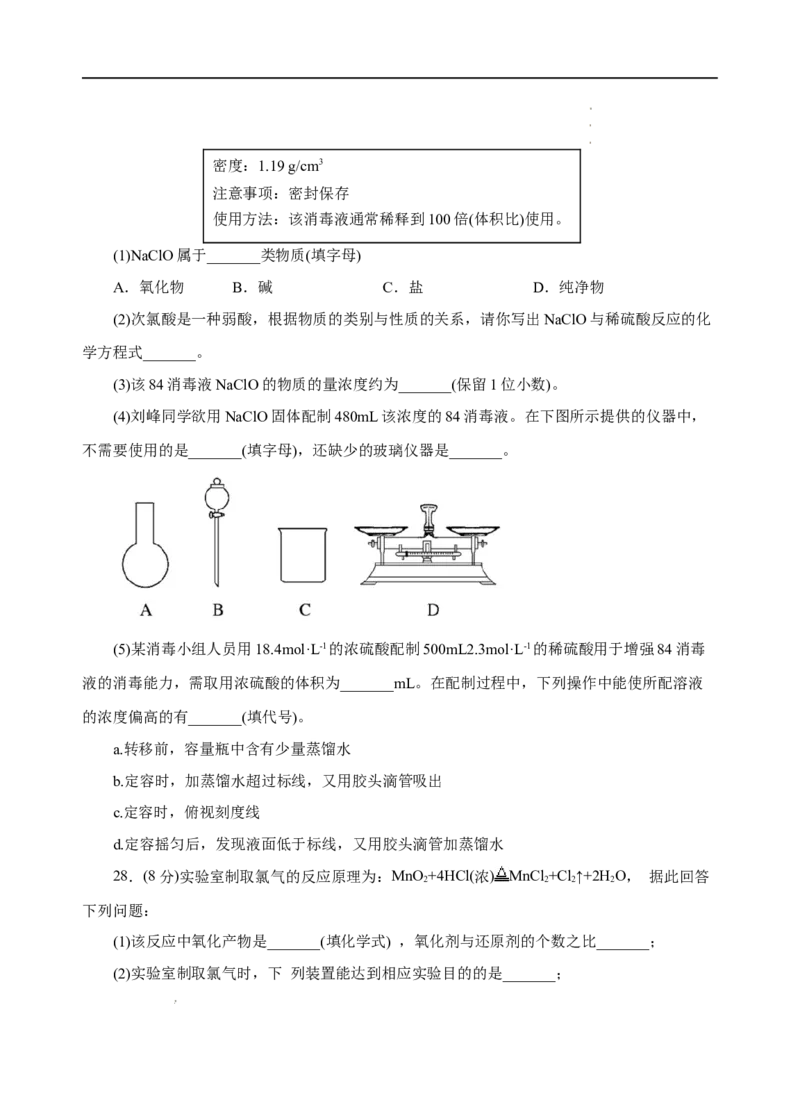
27.(11分)最近,单县二中在校园内喷洒了“84消毒液”,它能有效杀灭新冠病毒。刘峰
同学购买了一瓶“84消毒液”,用于自己家院落的消毒,该消毒液包装说明如下:
主要成分:25%NaClO 500 mL
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司密度:1.19 g/cm3
注意事项:密封保存
使用方法:该消毒液通常稀释到100倍(体积比)使用。
(1)NaClO属于_______类物质(填字母)
A.氧化物 B.碱 C.盐 D.纯净物
(2)次氯酸是一种弱酸,根据物质的类别与性质的关系,请你写出NaClO与稀硫酸反应的化
学方程式_______。
(3)该84消毒液NaClO的物质的量浓度约为_______(保留1位小数)。
(4)刘峰同学欲用NaClO固体配制480mL该浓度的84消毒液。在下图所示提供的仪器中,
不需要使用的是_______(填字母),还缺少的玻璃仪器是_______。
(5)某消毒小组人员用18.4mol·L-1的浓硫酸配制500mL2.3mol·L-1的稀硫酸用于增强84消毒
液的消毒能力,需取用浓硫酸的体积为_______mL。在配制过程中,下列操作中能使所配溶液
的浓度偏高的有_______(填代号)。
a.转移前,容量瓶中含有少量蒸馏水
b.定容时,加蒸馏水超过标线,又用胶头滴管吸出
c.定容时,俯视刻度线
d.定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水
28.(8分)实验室制取氯气的反应原理为:MnO +4HCl(浓) MnCl +Cl↑+2H O, 据此回答
2 2 2 2
下列问题:
(1)该反应中氧化产物是_______(填化学式) ,氧化剂与还原剂的个数之比_______;
(2)实验室制取氯气时,下 列装置能达到相应实验目的的是_______;
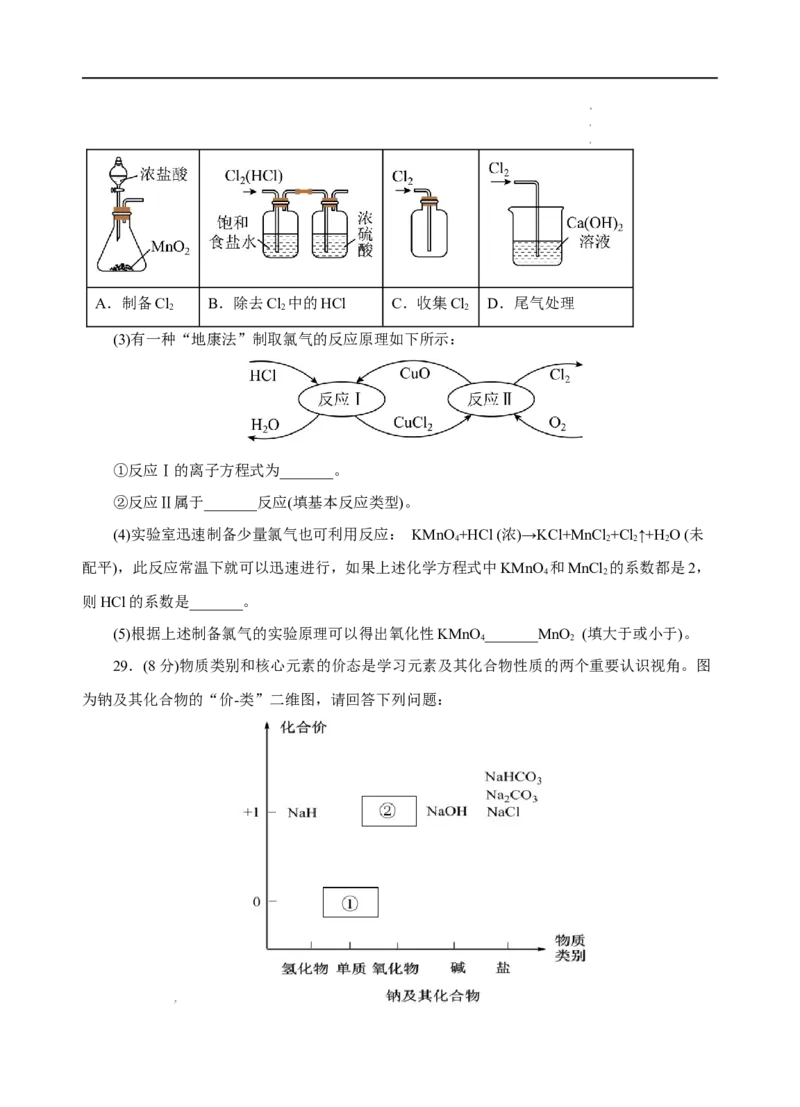
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司A.制备Cl B.除去Cl 中的HCl C.收集Cl D.尾气处理
2 2 2
(3)有一种“地康法”制取氯气的反应原理如下所示:
①反应Ⅰ的离子方程式为_______。
②反应Ⅱ属于_______反应(填基本反应类型)。
(4)实验室迅速制备少量氯气也可利用反应: KMnO +HCl (浓)→KCl+MnCl +Cl↑+H O (未
4 2 2 2
配平),此反应常温下就可以迅速进行,如果上述化学方程式中KMnO 和MnCl 的系数都是2,
4 2
则HCl的系数是_______。
(5)根据上述制备氯气的实验原理可以得出氧化性KMnO _______MnO (填大于或小于)。
4 2
29.(8分)物质类别和核心元素的价态是学习元素及其化合物性质的两个重要认识视角。图
为钠及其化合物的“价-类”二维图,请回答下列问题:
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司(1)物质①与水反应的离子方程式为_______,所以通常将其保存在_______中。
(2)写出淡黄色固体②与二氧化碳反应的化学方程式:_______。
(3)从核心元素价态的视角看,NaH中H元素的化合价为_______,从H元素的价态分析,
NaH常用作_______(填“氧化剂”或“还原剂”)。
(4)纯碱和小苏打都是重要的化工原料,在生产和生活中有着广泛的应用。
①只根据图Ⅰ、Ⅱ所示实验,能够达到鉴别目的的是_______(填装置序号)。
②图Ⅲ、Ⅳ中_______能更好说明二者的稳定性(填装置序号)。Ⅳ中受热处发生反应的化学
方程式:_______。
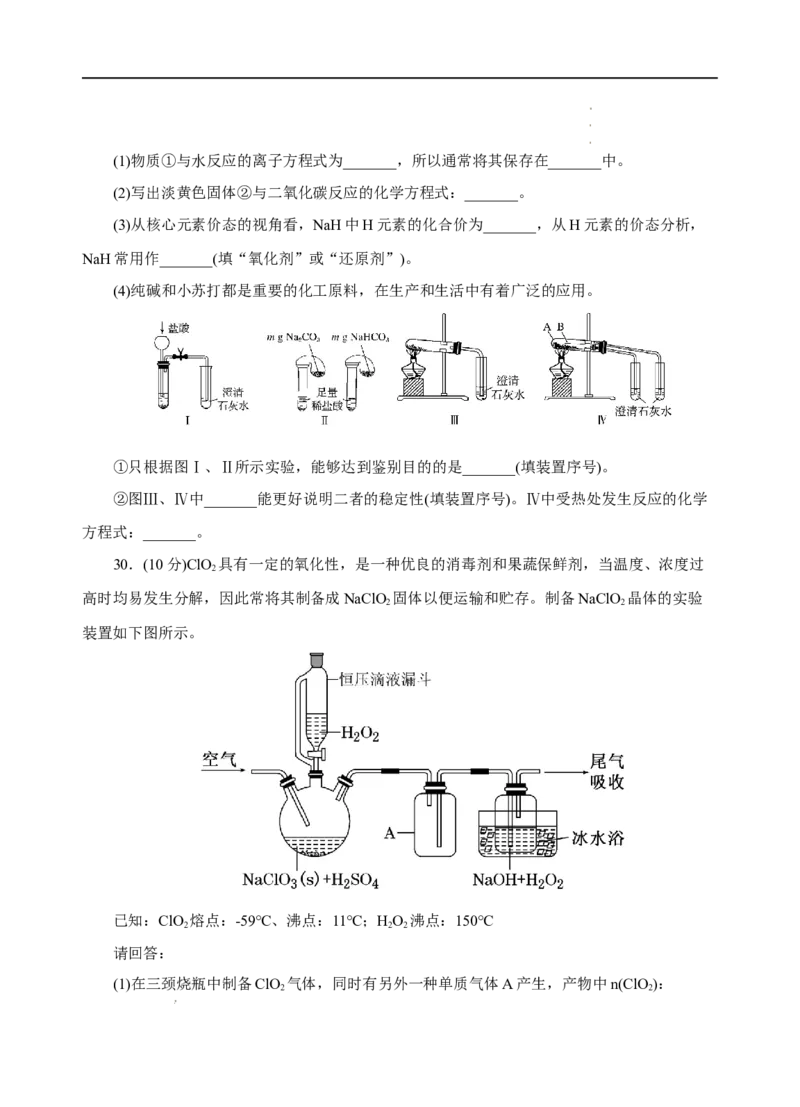
30.(10分)ClO 具有一定的氧化性,是一种优良的消毒剂和果蔬保鲜剂,当温度、浓度过
2
高时均易发生分解,因此常将其制备成NaClO 固体以便运输和贮存。制备NaClO 晶体的实验
2 2
装置如下图所示。
已知:ClO 熔点:-59℃、沸点:11℃;HO 沸点:150℃
2 2 2
请回答:
(1)在三颈烧瓶中制备ClO 气体,同时有另外一种单质气体A产生,产物中n(ClO ):
2 2
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司n(A)=_______;相比于普通的分液漏斗,恒压滴液漏斗其优点是:_______。
(2)反应开始时,打开恒压滴液漏斗,滴加双氧水,一段时间后,以适当的流速通入空气将
ClO 吹入的HO 与NaOH溶液混合洗气瓶中,并用冰水浴降温,制备NaClO 晶体。
2 2 2 2
①当空气流速过慢时,产率会降低,请解释其原因:_______。
②仪器A的作用是_______;
③制备NaClO 晶体的化学方程式为:_______。
2
④冰水浴的作用是:_______、_______。
(3)将NaClO 在一定条件下可重新释放ClO 气体,其浓度随时间的变化如图所示,若用于
2 2
水果保鲜,适宜的条件是_______。推测下列物质可以起到与ClO 气体相同保鲜作用的是
2
_______。
a.KMnO 溶液 B.NaCl溶液 C.KHSO 溶液
4 3
31.(6分)取4.9g KClO 和0.87g MnO 的固体混和物,加热一段时间后剩余固体为4.81g。
3 2
该剩余固体与足量的浓盐酸在加热条件下充分反应,生成单质气体A。提示:2KClO
3
2KCl+3O ↑。请计算:
2
(1) KClO 的分解率___________。
3
(2)气体A的物质的量___________。
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司