文档内容
参考答案:
一、单项选择题:共 13 题,每题 3 分,共 39 分。每题只有一个选项最符合题意。
1.C
【详解】A.NO2 会形成光化学烟雾,A 正确;
B. 铝合金是金属材料,B 正确;
C.光导纤维主要成分为 SiO2,C 错误;
D.铵态氮肥与碱性物质草木灰混用,会释放出氨气降低肥效,故不可混用,D 正确。
2.B
【详解】A.原子半径:碳大于氢,甲烷分子的球棍模型为
,故 A 错误;
B.甲烷分子去掉一个氢原子得到甲基,甲基的电子式为
,故 B 正确;
C.碳原子的质子数为 6,中子数为 8 时质量数等于 14,原子符号为 14C,故 C 错误;
D.乙烯分子的结构式为
,书写结构简式时碳碳双键不能省略,结构简式为 CH2=CH2,故 D 错
误。
3.【答案】D
【详解】A 项,NaHCO3 能与 HCl 反应,故 NaHCO3 用于制胃酸中和剂,NaHCO3 用于制胃酸中和剂与
NaHCO3 受热易分解没有对应关系;
B 项,SO2 的漂白性与还原性无关;
C 项,Al2O3 的熔点很高,故用作耐高温材料,Al2O3 用作耐高温材料与 Al2O3 是两性氧化物没有对应关系;
D 项,CaO 能与水反应,故用于食品干燥剂,CaO 用于食品干燥剂与 CaO 与水反应有对应关系;答案选 D。
4.【答案】B
【详解】A.S2-、K+具有相同的核外电子排布,且 K 的核电荷数比 S 的大,故半径大小:r(S2−) > r(K+),
A 错误;
B.同一周期元素,从左往右元素的非金属性增强,B 正确;
C.2H2S + O2 = 2S + 2H
2O,氧化剂的氧化性大于氧化产物的氧化性,氧化性 O2 > S,C 错
误;
D.已知 O 的非金属性强于 S,元素非金属性越强,简单氢化物越稳定,故气态氢化物稳定性:H2O > H2S,
D 错误。
5.【答案】C
【详解】A.锌电极为负极,发生氧化反应,A 错误;
B.锌电极为负极,Pt 电极为正极,电池中的 Cl-向锌电极方向移动,B 错误;
C.铂电极为正极,发生还原反应,反应式为 H2O2+2e-=2OH-,C 正确;
D.电子从 Zn 电极沿导线流向 Pt 电极,不进入溶液,溶液中为离子的转移,D 错误;
6.【答案】C
【详解】A.同位素是质子数相同,中子数不同的两种或多种核素之间的互称,金刚石和石墨是碳元素形
成的不同种单质,互为同素异形体,A 错误;
B.物质的能量越低越稳定,由图可知,石墨能量低,故石墨比金刚石更稳定,B 错误;
C.能量由高到低是放热反应,铝热反应也是放热反应,能量变化趋势与图一致,C 正确;
D.等质量的金刚石和石墨的起始能量不同,完全燃烧金刚石释放的热量多,D 错误;
7.【答案】D
【详解】A.用装置甲制备氨气时,为防止水滴倒流,试管口应该略向下倾斜,A 错误;
B.氨气可以和硫酸反应,不能用浓硫酸干燥氨气,B 错误;
C.氨气的密度比空气小,要使用向下排空气方法收集,导气管应伸入到烧瓶底部,同时烧瓶口不能密闭,
应该放一团棉花,C 错误;
D.氨气是大气污染物,最后尾气可根据氨气易溶于水的性质,用水进行吸收,为防止倒吸现象的发生,
可以在导气管的末端安装一个干燥管或倒扣的漏斗,这样既可以使氨气被充分吸收,同时也防止倒吸现象
的发生,D 正确;
8.【答案】A
【详解】A.向 Ba(OH)2 溶液中逐滴加入 NH4HSO4 溶液至 Ba2+刚好沉淀完全,二者的物质的量相等,反
应的离子方程式为:Ba2++2OH-+H++
+
=BaSO4↓+NH3•H2O+H2O,故 A 错误;
B.Fe3O4 中铁元素化合价有+2、+3,硝酸具有强氧化性,能氧化 Fe2+,将 Fe3O4 粉末溶于足量的稀硝酸,
离子方程式:3Fe3O4+28H++
= 9Fe
3++NO↑+14H2O,故 B 正确;
C.ClO−具有强氧化性,SO2 具有还原性,SO2 能够还原 ClO−,离子方程式为:
SO2+ ClO- + H2O═
+Cl-+2H+,故 C 正确;
D.在强碱性溶液中,ClO−将 Mn2+氧化成 MnO2,离子方程式:ClO-+Mn2++2OH-=MnO2↓+Cl-+H2O,故 D
正确。
9.B
【详解】A.次氯酸分解为氧气和盐酸,故不能实现转化,故 A 不选;
B.Al 与氧气加热反应生成氧化铝,氧化铝与 NaOH 溶液反应生成
,转化可以实现,故 B
选;
C.Na 与氧气加热生成 Na2O2,故不能实现转化,故 C 不选;
D.Fe 与水蒸气在高温条件下生成 Fe3O4,故不能实现转化,故 D 不选。
10. 【答案】A
【详解】A.向
溶液中加入几滴氯水,CCl4 无明显现象,说明无 Br2 生成,即
还原性强于
,
A 符合题意;
B.将稀盐酸滴入硅酸钠溶液中,振荡,生成白色胶状物 H2SiO3,说明盐酸的酸性大于硅酸的酸性,但由
于 HCl 不是 Cl 元素的最高价含氧酸,所以不能说明
的非金属性强于
,B 不符合题意;
C.Fe3+过量,反应后一定会检验到 Fe3+,不能判断该反应是否为可逆反应,正确的探究方法是取少量含
Fe3+溶液和过量含 I-的溶液, C 不符合题意;
D.向溶有
的
溶液中通入气体
,出现白色沉淀, 可能是强氧化性物质,也可能是氨气等碱性
物质,D 不符合题意;
11.【答案】C
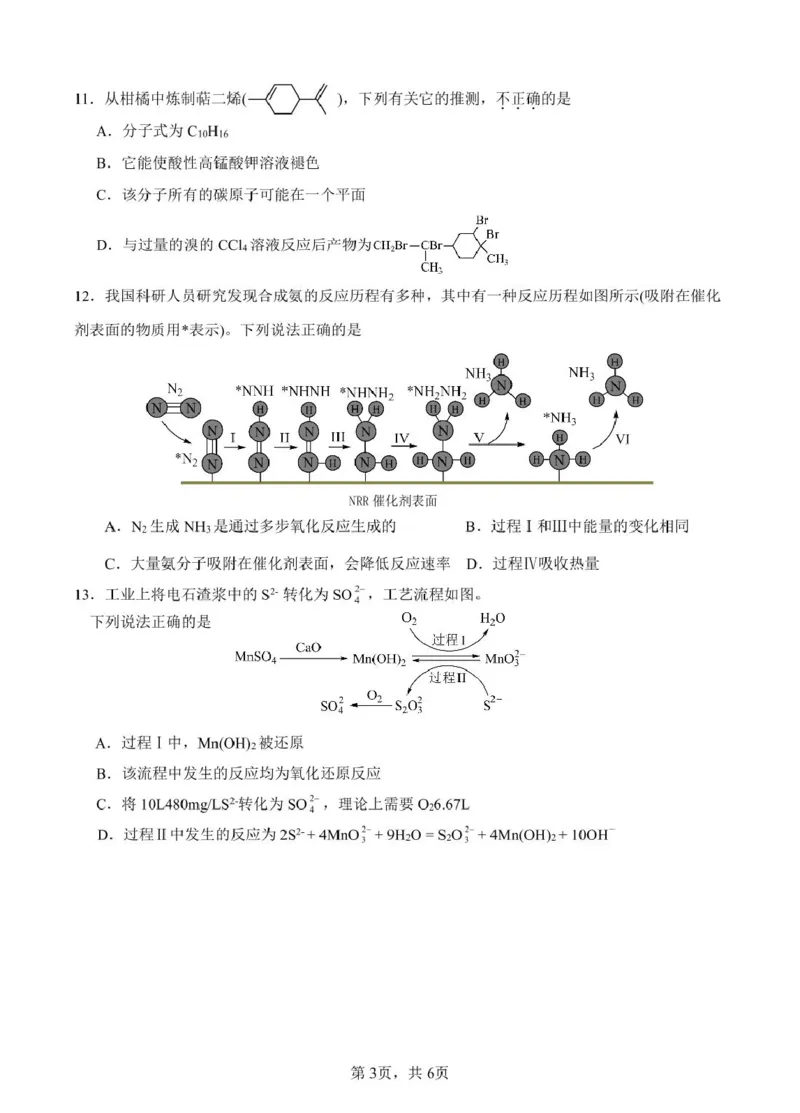
【详解】A.该有机物含有 10 个 C、16 个 H,则分子式为 C10H16,故 A 正确;
B.该有机物中含有 C=C,能被酸性高锰酸钾氧化,使酸性高锰酸钾溶液褪色,故 B 正确;
C.该分子(
)中*标记的碳原子,连有 3 个碳原子和 1 个氢原子,它们构成类似甲烷的
四面体结构,这 4 个碳原子构成三角锥形,所以该分子所有的碳原子不可能在一个平面上,故 C 错误;
D.该有机物中含有两个碳碳双键,与过量溴的 CCl4 溶液可完全发生加成反应生成
,故 D 正确。
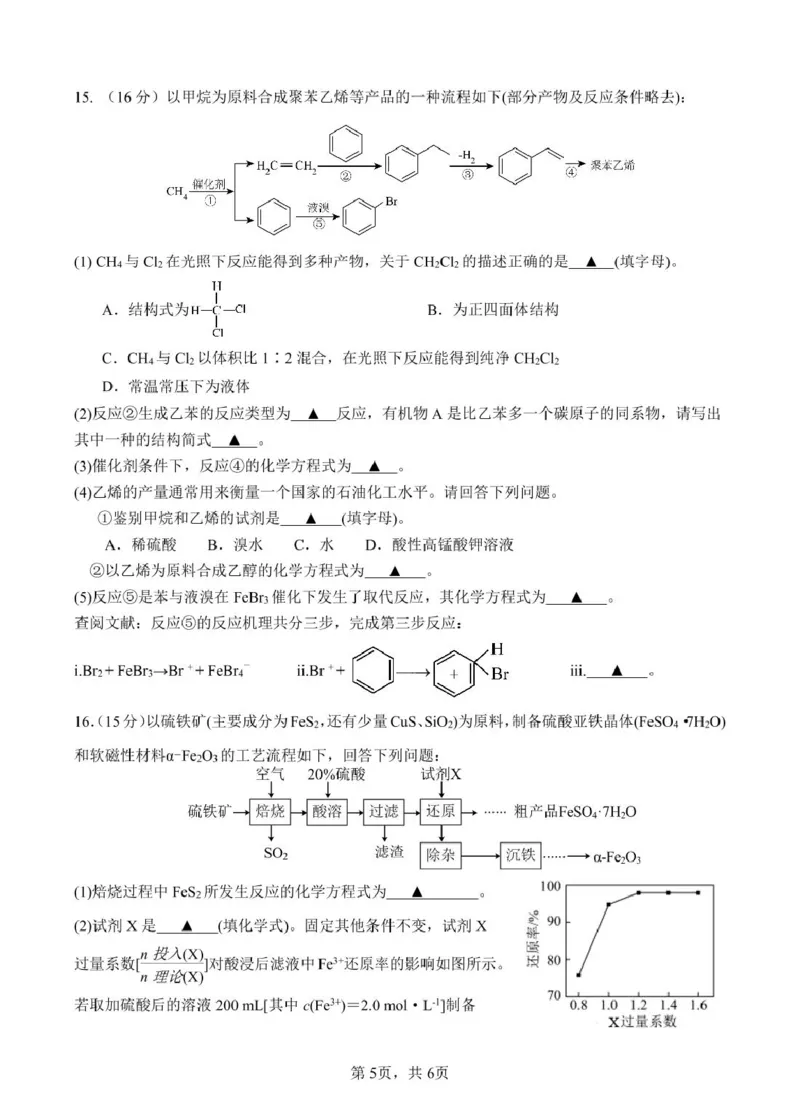
12.【答案】C
【详解】A.由图可知,N2 生成 NH3 的过程为 N2→N=N-H→H-N=N-H→H-N-NH2→H2N-NH2→NH3,氮元
素化合价逐渐降低,是发生多步还原反应生成的,故 A 错误;
B.过程 1 是断裂氮氮三键中的一个键,而过程 3 与过程 1 断键不同,所以所需能量不同,过程Ⅰ和Ⅲ中
能量的变化不相同,故 B 错误;
C.NH3 的及时脱附可留下继续反应的空间(增加催化剂的活性位点),如果大量氨分子吸附在催化剂表面,
就将减缓反应速率,故 C 正确;
D.过程Ⅳ的变化是形成氮氢键,成键释放热量,故 D 错误。
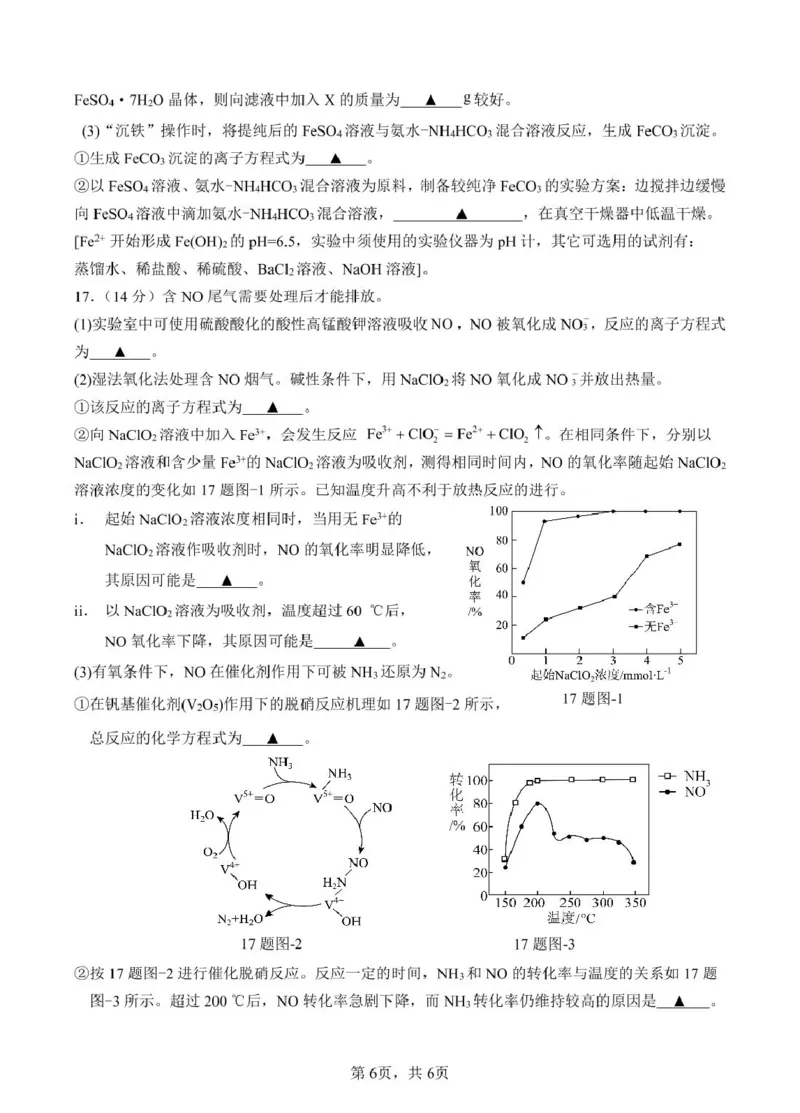
13. 【答案】D
【分析】由流程可知,CaO 与硫酸锰反应生成
,通入氧气生成
,涉及反应为
,
与 S2−反应生成
,进而与氧气反应生成硫酸根离子,可
用于制备 CaSO4•2H2O;
【详解】A.过程Ⅰ中,Mn(OH)2 通入氧气生成
,锰元素化合价升高,
被氧化,A 错误;
B.该流程中,CaO 与硫酸锰反应生成
不涉及化合价的变化,不属于氧化还原反应,B 错误;
C.没有标况,不能计算生成氧气的体积,C 错误;
D.过程Ⅱ中反应为在碱性条件下,
与 S2−反应生成
和
,锰化合价由+4 变为+2、硫
化合价由-2 变为+2,根据电子守恒可知,发生的反应为
2S2-+4MnO +9H2O=S2O +4Mn(OH)2+10OH-,D 正确;
二、非选择题:共 4 题,共 61 分。
14. 共 16 分,每空 2 分
【答案】Ⅰ.(1)
0.375
=
AE
(2)CE
Ⅱ.
(1)
(2) 1.5
III.(1)
(2)低于
Ⅰ.【详解】(1)①0~4 min 时,氢气的平均反应速率为:
,
v(H2)=3v(H2O)=0.375 mol·L-1·min-1,15 min 时反应达到平衡,故 v(正)=v(逆);
②能增大该反应的反应速率有升高温度,增大压强,选择合适的催化剂,增大
的浓度等,故答案
为 AE;
(2)A.反应达到平衡时,
、
、
、
四种物质的浓度分别为 0.25mol·L-1,2.25 mol·
L-1,0.75 mol·L-1,0.75 mol·L-1,A 项错误;
B.反应前后气体总质量不变,容器的体积不变,混合气体的密度始终为定值,因此密度不变,不能判定
反应达到平衡,B 项错误;
C.不同物质 v 正∶v 逆 等于化学计量系数之比,说明反应达到平衡,C 项正确;
D.单位时间内消耗 3 mol H2 的同时生成 1 mol CH3OH,反应始终按此比例进行,不能说明反应达到平衡,
D 项错误。
E.平衡转化率是该条件下的最大转化率,E 项正确。
Ⅱ.
①在
电池中,a 电极 Li 失电子转化为 Li+,作负极,b 电极 CO2 得电子生成 C 和 Li2CO3,
作正极;正极电极反应式为
;
②原电池中,由正极反应式可得关系式为
,该电池中每转移 2 mol 电子,能够吸收
CO2;
III.①由图像中的数据分析可知:200℃左右失去水分子,400~600℃失去的是 CO,所以方程式为:
;
②800℃之后发生的是碳酸钙分解的反应,所以 CaO 捕捉 CO2 的反应温度应低于 800℃。
15. 共 16 分,每空 2 分
【答案】(1)AD
(2)加成反应
催化剂
(3) n
(写成“一定条件”也可以)
合理答案写一种即可
催化剂
(4) ①BD
② CH2=CH2 + H2O
CH3CH2OH (写成“一定条件”也可以)
(5)
+Br2FeBr3
+HBr
FeBr4- +
FeBr3 +
+ HBr
(5)
+Br2FeBr3
+HBr
FeBr
- +
FeBr3+
+HBr
4
16. 共 16 分,除特别标注外,其余每空 2 分
【答案】(1)
(2) Fe(1 分)
13.44g(3 分)
(3)
①Fe2++HCO +NH3·H2O=FeCO3↓+NH +H2O 或 Fe2++HCO +NH3=FeCO3↓+NH
(3 分)
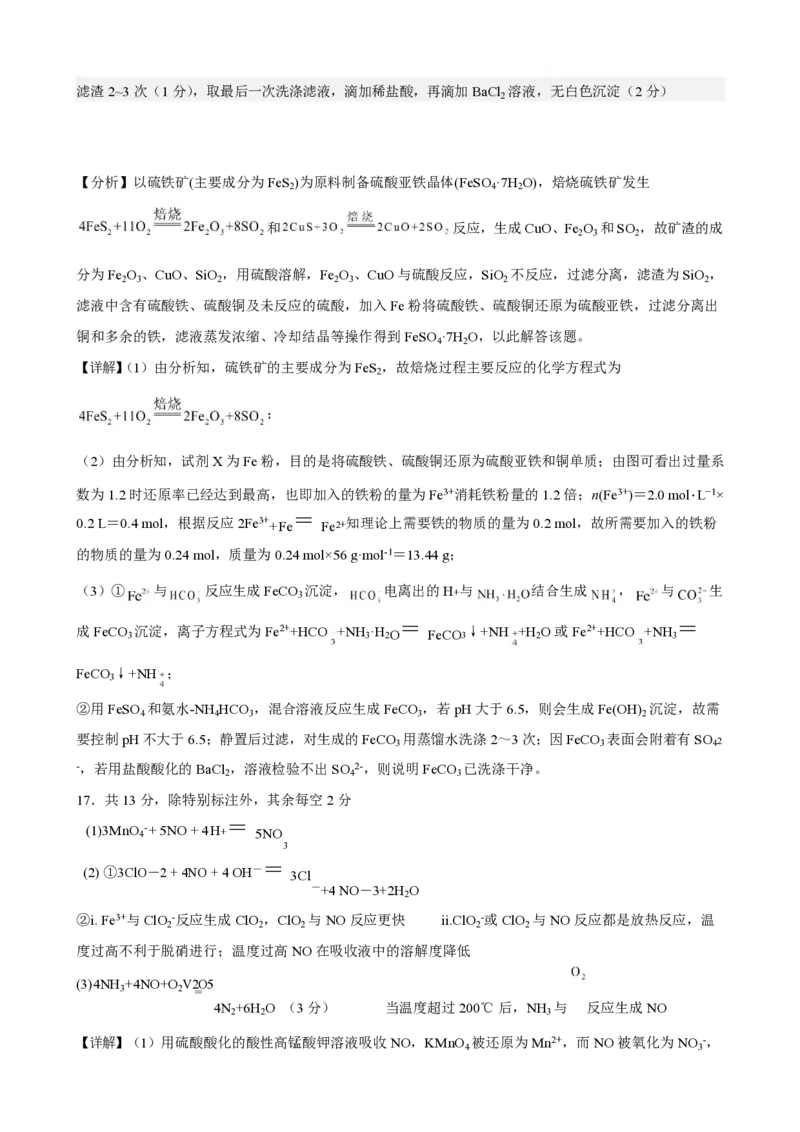
②用 PH 计测量 pH,控制 pH 不大于 6.5,(1 分)直至不再产生沉淀,静置后过滤,(1 分)用蒸馏水洗涤
滤渣 2~3 次(1 分),取最后一次洗涤滤液,滴加稀盐酸,再滴加 BaCl2 溶液,无白色沉淀(2 分)
【分析】以硫铁矿(主要成分为 FeS2)为原料制备硫酸亚铁晶体(FeSO4·7H2O),焙烧硫铁矿发生
和
反应,生成 CuO、Fe2O3 和 SO2,故矿渣的成
分为 Fe2O3、CuO、SiO2,用硫酸溶解,Fe2O3、CuO 与硫酸反应,SiO2 不反应,过滤分离,滤渣为 SiO2,
滤液中含有硫酸铁、硫酸铜及未反应的硫酸,加入 Fe 粉将硫酸铁、硫酸铜还原为硫酸亚铁,过滤分离出
铜和多余的铁,滤液蒸发浓缩、冷却结晶等操作得到 FeSO4·7H2O,以此解答该题。
【详解】(1)由分析知,硫铁矿的主要成分为 FeS2,故焙烧过程主要反应的化学方程式为
;
(2)由分析知,试剂 X 为 Fe 粉,目的是将硫酸铁、硫酸铜还原为硫酸亚铁和铜单质;由图可看出过量系
数为 1.2 时还原率已经达到最高,也即加入的铁粉的量为 Fe3+消耗铁粉量的 1.2 倍;n(Fe3+)=2.0 mol⋅L−1×
0.2 L=0.4 mol,根据反应 2Fe3++ Fe= Fe2+知理论上需要铁的物质的量为 0.2 mol,故所需要加入的铁粉
的物质的量为 0.24 mol,质量为 0.24 mol×56 g·mol-1=13.44 g;
(3)①
与
反应生成 FeCO3 沉淀,
电离出的 H+与
结合生成
,
与
生
成 FeCO3 沉淀,离子方程式为 Fe2++HCO +NH3·H2O= FeCO3↓+NH +H2O 或 Fe2++HCO +NH3=
FeCO3↓+NH ;
②用 FeSO4 和氨水-NH4HCO3,混合溶液反应生成 FeCO3,若 pH 大于 6.5,则会生成 Fe(OH)2 沉淀,故需
要控制 pH 不大于 6.5;静置后过滤,对生成的 FeCO3 用蒸馏水洗涤 2~3 次;因 FeCO3 表面会附着有 SO42
-,若用盐酸酸化的 BaCl2,溶液检验不出 SO42-,则说明 FeCO3 已洗涤干净。
17.共 13 分,除特别标注外,其余每空 2 分
(1)3MnO4- + 5NO + 4 H+= 5NO
3
(2) ①3ClO-2 + 4NO + 4 OH-= 3Cl
-+4 NO-3+2H2O
②i. Fe3+与 ClO2-反应生成 ClO2,ClO2 与 NO 反应更快
ii.ClO2-或 ClO2 与 NO 反应都是放热反应,温
度过高不利于脱硝进行;温度过高 NO 在吸收液中的溶解度降低
(3)4NH3+4NO+O2V2O5
=
4N2+6H2O (3 分)
当温度超过 200℃ 后,NH3 与
反应生成 NO
【详解】(1)用硫酸酸化的酸性高锰酸钾溶液吸收 NO,KMnO4 被还原为 Mn2+,而 NO 被氧化为 NO3-,
则反应的离子方程式为 3MnO4- +5NO+4 H+= 5NO
3
(2)①在碱性条件下,NaClO2 能将 NO 氧化成 NO3-,则反应的离子方程式为
3ClO-2 + 4NO + 4 OH-= 3Cl
-+4 NO-3+2H2O
②i.根据题目信息,Fe3+会将 ClO2-转化为 ClO2:
,ClO2 具有强氧化性,能与
NO 发生更快的反应,使单位时间内 NO 的氧化率升高,所以无 Fe3+时,NO 的氧化率明显降低;
ii.以 NaClO2 溶液为吸收剂,NO 的氧化率随温度的变化情况如图,当温度超过 60℃后,NO 氧化率下降,
根据题目中的已知信息:温度升高不利于正向放热反应的进行,可以得到 NO 氧化率随温度升高而下降的
原因可能是:ClO2-或 ClO2 与 NO 反应都是放热反应,温度过高不利于脱硝平衡正向进行,NO 的转化率降
低,且温度过高,NO 在吸收液中的溶解度也会降低,导致 NO 的转化率也降低。
(3)①根据 NO 在钒基催化剂(V2O5)作用下可被 NH3 还原为 N2 以及脱硝反应机理图可知,参与反应的物
质为 NO、O2 和 NH3,且根据中间产物判断 NO 和 NH3 的物质的量之比为 1∶1,生成物为 N2 和 H2O,则
转化的总反应化学方程式为 4NH3+4NO+O2V2O5
4N2+6H2O;
=
②根据反应一定的时间后,NH3 和 NO 的转化率与温度的关系图,可以看出当温度超过 200℃ 后,NO 转
化率急剧下降,而 NH3 转化率仍维持较高,产生这种变化的原因可能是:当温度超过 200℃ 后,NH3 会与
O2 反应生成 NO,导致 NO 的量增多,使其转化率下降,而 NH3 继续被消耗,所以转化率仍维持较高。