文档内容
班级 姓名 学号 分数
第二章 分子结构与性质(B 卷·能力提升练)
(时间:75分钟,满分:100分)
一、选择题(本题共18小题,每小题3分,共52分。)
1.氰气的化学式为 ,结构式为 ,其性质与卤素气体单质相似,氰气可用于有机合成、
制农药,也可用作消毒、杀虫的熏蒸剂等。下列叙述正确的是
A.在所有气体单质分子中,一定有 键,可能有 键
B.氰气分子中 键的键长大于 键的键长
C.1个氰气分子中含有3个 键和4个 键
D. 不能与氢氧化钠溶液发生反应
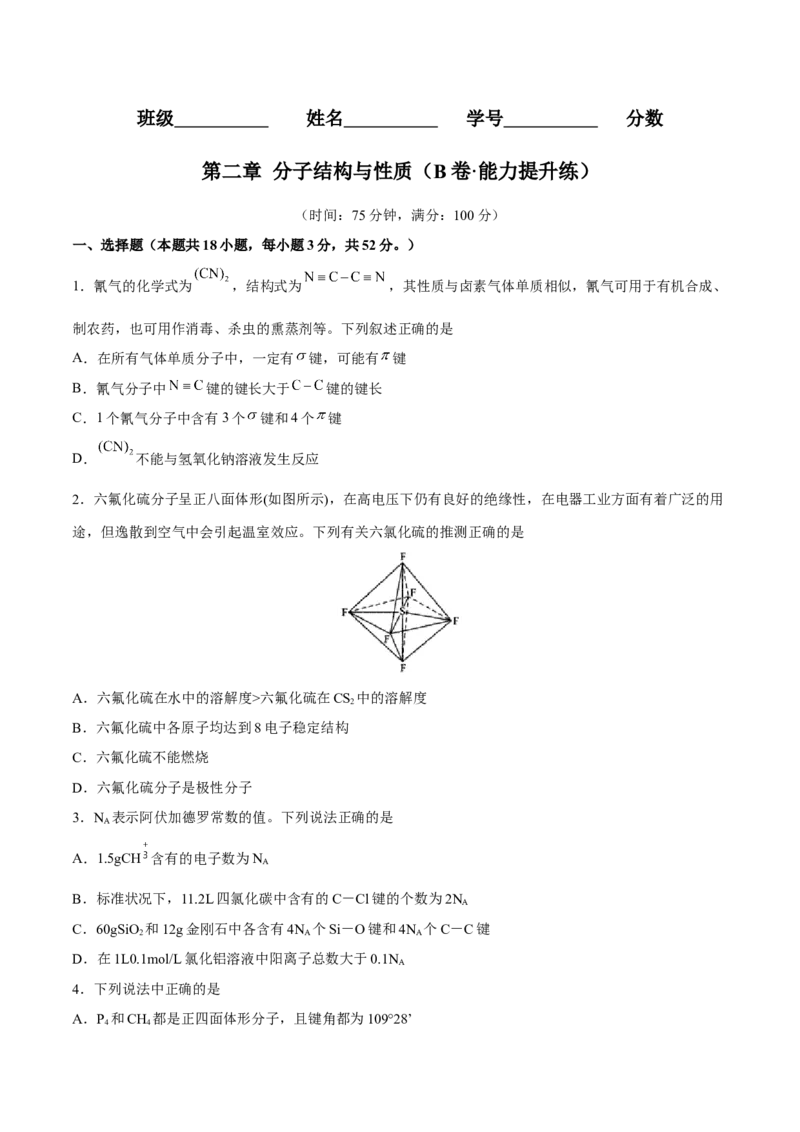
2.六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用
途,但逸散到空气中会引起温室效应。下列有关六氯化硫的推测正确的是
A.六氟化硫在水中的溶解度>六氟化硫在CS 中的溶解度
2
B.六氟化硫中各原子均达到8电子稳定结构
C.六氟化硫不能燃烧
D.六氟化硫分子是极性分子
3.N 表示阿伏加德罗常数的值。下列说法正确的是
A
A.1.5gCH 含有的电子数为N
A
B.标准状况下,11.2L四氯化碳中含有的C-Cl键的个数为2N
A
C.60gSiO 和12g金刚石中各含有4N 个Si-O键和4N 个C-C键
2 A A
D.在1L0.1mol/L氯化铝溶液中阳离子总数大于0.1N
A
4.下列说法中正确的是
A.P 和CH 都是正四面体形分子,且键角都为109°28’
4 4B.乙烯分子中,碳原子的sp2杂化轨道形成σ键,未杂化的2p轨道形成π键
C.键长H-F < H-Cl < H-Br < H-I,因此稳定性HF < HCl < HBr < HI
D.PH 分子中孤电子对与成键电子对的排斥作用比成键电子对之间的排斥作用弱
3
5.由短周期前10号元素组成的物质 和 有如图所示的转化。 不稳定,易分解。下列有关说法正确的
是( )
A.为使该转化成功进行, 可以是酸性 溶液
B.等物质的量的 、 分子中含有 键的数目均为
C. 分子中含有的 键个数是 分子中含有的 键个数的2倍
D. 分子中只含有极性键, 分子中既含有极性键又含有非极性键
6.下列有关化学键的比较错误的是( )
A.键能:
B.键长:
C.键角:
D.乙烯分子中碳碳键的键能: 键> 键
7.通过在隧道的路面涂上一种光催化剂涂料,可将汽车尾气中的NO和CO转化成N 和CO,发生的反应
2 2
为2NO(g)+2CO(g) N(g)+2CO (g) △H=x(x<0)kJ·mol-1,向某恒温恒容密闭容器中通入1molNO(g)和
2 2
1molCO(g)发生上述反应,下列说法正确的是
A.上述反应中4种物质含有的共价键均为极性共价键
B.使用光催化剂能增大该反应的活化能
C.当混合气体的密度不再变化时,说明该反应达到平衡状态
D.反应达到平衡后,升高温度,再次达到平衡时NO的平衡体积分数增大
8.南京理工大学化工学院胡炳成教授团队成功合成世界首个全氮阴离子盐,其局部结构如图所示。下列
说法错误的是A.1mol该物质中有15molσ键
B.全氮阴离子盐两种阳离子中心原子的杂化轨道类型相同
C. 中所有的氮原子在同一平面内
D. 的键角比全氮阴离子盐的两种阳离子键角都大
9.下列说法错误的是
A.基态B原子核外电子的运动状态有5种
B.二氯乙酸的酸性强于氯乙酸
C. 的价电子对分布的几何构型与分子的空间结构不一致
D.可以通过红外光谱仪来测定分子的相对分子质量
10.硼酸(H BO)的电离方程式为:HBO+H O [B(OH) ]-+H+,电离时HBO 结合溶液中的OH-,使B
3 3 3 3 2 4 3 3
原子最外层电子达到饱和结构,下列有关硼酸的说法正确的是
A.是一种三元弱酸
B.硼酸能抑制水的电离
C.与NaOH溶液反应的离子方程式:HBO+OH-=[B(OH) ]-
3 3 4
D.HBO 与[B(OH) ]-中B原子的杂化方式相同
3 3 4
11.有机反应过程中,随反应条件不同,成键的碳原子可以形成碳正离子( )、碳负离子( )、甲基(
)等微粒。下列说法不正确的是
A. 的电子式是 B. 的空间构型为平面三角形C.键角: D. 中所有的原子不都在一个平面内
12.二氧化氯( )是国际上公认的安全、无毒的绿色消毒剂,对酸性污水中的 有明显的去除效果,
其反应原理为: (部分反应物和产物省略、未配平),工业上可用 制取
,化学方程式如下: 。实验室用如下方法制备饮用水消毒
剂 :
已知: 为强氧化剂,其中N元素为+3价。下列说法不正确的是
A. 的空间构型为三角锥形
B.电解池中总反应的化学方程式为
C.X溶液中主要存在的离子有: 、 、
D.饮用水制备过程中残留的 可用适量 溶液去除
13.下列分子或离子的中心原子为sp3杂化,且杂化轨道容纳1对孤电子对的是( )
A.CH、NH 、HO B.CO、BF、SO
4 3 2 2 3
C.C H、SO 、BeCl D.NH 、PCl 、NH
2 4 2 2 3 3 2 4
14.短周期主族元素X、Y、Z、W原子序数依次增大,Y、Z处于同一周期,四种元素形成的一种化合物
结构如图所示。下列说法错误的是A.简单氢化物的沸点:Z>Y
B.YF 的空间构型为三角锥形
3
C.X与W形成的二元化合物具有强还原性
D.Z的同周期元素中第一电离能比Z大的有3种
15.气相离子催化剂( 等)具有优良的催化效果。其中在 催化下乙烷氧化反应的机理如图
所示(图中-----为副反应),下列说法不正确的是
A.主反应的总反应方程式为:
B.每生成 消耗 的物质的量等于
C. 中碳原子的杂化方式有 和 两种
D.X与Y能互溶因为它们的分子结构具有相似性
16.下列说法正确的是
A.沸点:正戊烷>异戊烷>异丁烷、对羟基苯甲酸( )>邻羟基苯甲酸( )、氯化氢
>氟化氢
B.已知:B元素和Cl元素的电负性差值大于N元素和Cl元素的电负性差值,故:BCl 分子的极性大于
3
NCl
3
C.键角大小比较:NH >HO、NH >PH 、[Cu(NH )]2+的配体NH >NH 分子
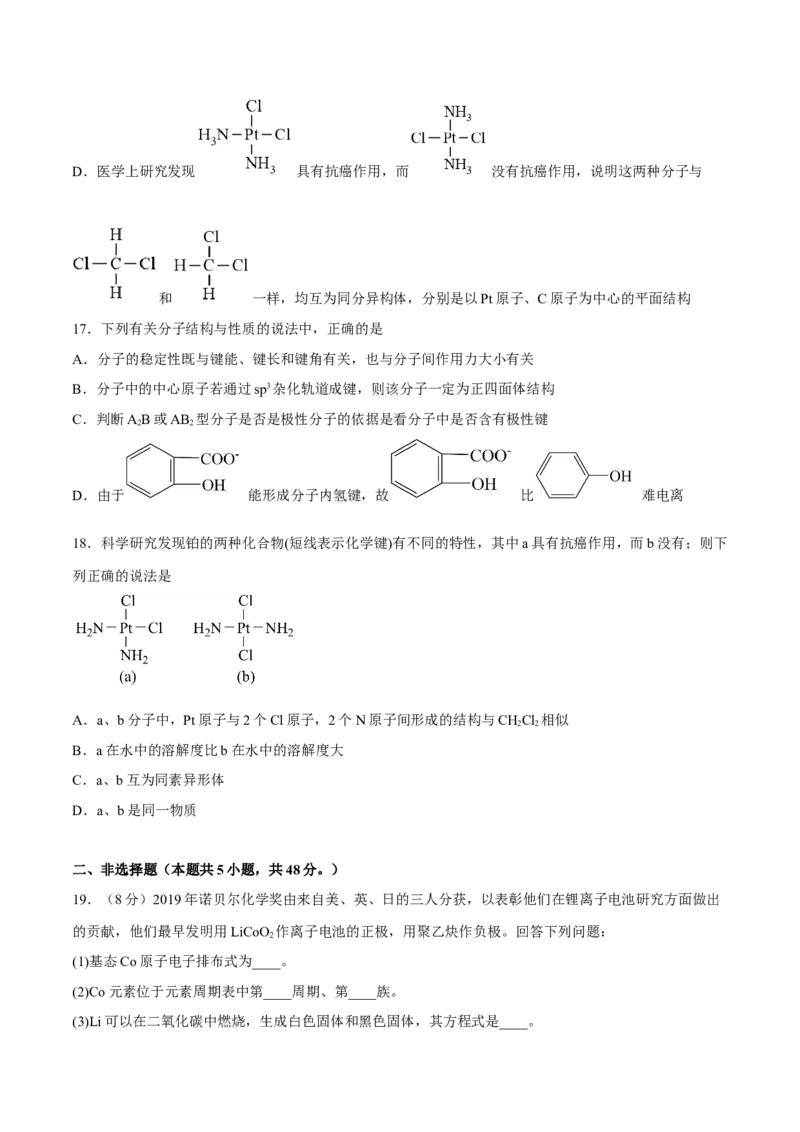
3 2 3 3 3 4 3 3D.医学上研究发现 具有抗癌作用,而 没有抗癌作用,说明这两种分子与
和 一样,均互为同分异构体,分别是以Pt原子、C原子为中心的平面结构
17.下列有关分子结构与性质的说法中,正确的是
A.分子的稳定性既与键能、键长和键角有关,也与分子间作用力大小有关
B.分子中的中心原子若通过sp3杂化轨道成键,则该分子一定为正四面体结构
C.判断AB或AB 型分子是否是极性分子的依据是看分子中是否含有极性键
2 2
D.由于 能形成分子内氢键,故 比 难电离
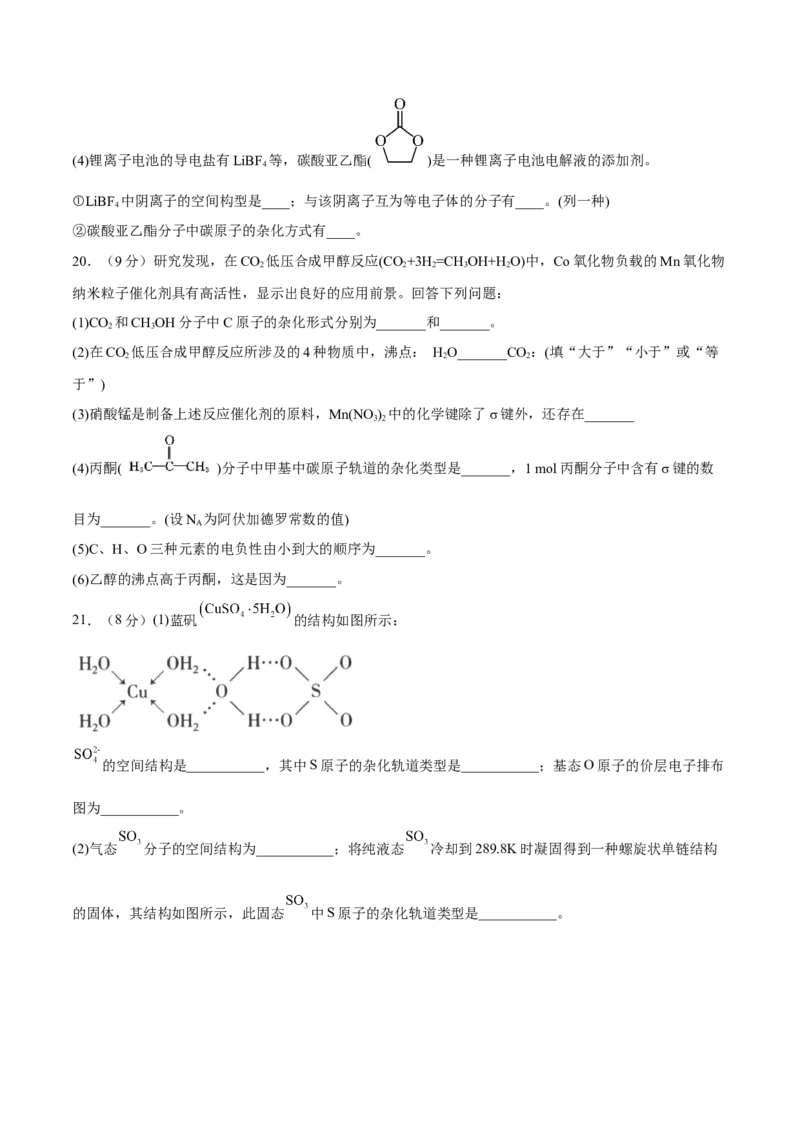
18.科学研究发现铂的两种化合物(短线表示化学键)有不同的特性,其中a具有抗癌作用,而b没有;则下
列正确的说法是
A.a、b分子中,Pt原子与2个Cl原子,2个N原子间形成的结构与CHCl 相似
2 2
B.a在水中的溶解度比b在水中的溶解度大
C.a、b互为同素异形体
D.a、b是同一物质
二、非选择题(本题共5小题,共48分。)
19.(8分)2019年诺贝尔化学奖由来自美、英、日的三人分获,以表彰他们在锂离子电池研究方面做出
的贡献,他们最早发明用LiCoO 作离子电池的正极,用聚乙炔作负极。回答下列问题:
2
(1)基态Co原子电子排布式为____。
(2)Co元素位于元素周期表中第____周期、第____族。
(3)Li可以在二氧化碳中燃烧,生成白色固体和黑色固体,其方程式是____。(4)锂离子电池的导电盐有LiBF 等,碳酸亚乙酯( )是一种锂离子电池电解液的添加剂。
4
①LiBF 中阴离子的空间构型是____;与该阴离子互为等电子体的分子有____。(列一种)
4
②碳酸亚乙酯分子中碳原子的杂化方式有____。
20.(9分)研究发现,在CO 低压合成甲醇反应(CO+3H =CH OH+H O)中,Co氧化物负载的Mn氧化物
2 2 2 3 2
纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)CO 和CHOH分子中C原子的杂化形式分别为_______和_______。
2 3
(2)在CO 低压合成甲醇反应所涉及的4种物质中,沸点: HO_______CO :(填“大于”“小于”或“等
2 2 2
于”)
(3)硝酸锰是制备上述反应催化剂的原料,Mn(NO) 中的化学键除了σ键外,还存在_______
3 2
(4)丙酮( )分子中甲基中碳原子轨道的杂化类型是_______,1 mol丙酮分子中含有σ键的数
目为_______。(设N 为阿伏加德罗常数的值)
A
(5)C、H、O三种元素的电负性由小到大的顺序为_______。
(6)乙醇的沸点高于丙酮,这是因为_______。
21.(8分)(1)蓝矾 的结构如图所示:
的空间结构是___________,其中S原子的杂化轨道类型是___________;基态O原子的价层电子排布
图为___________。
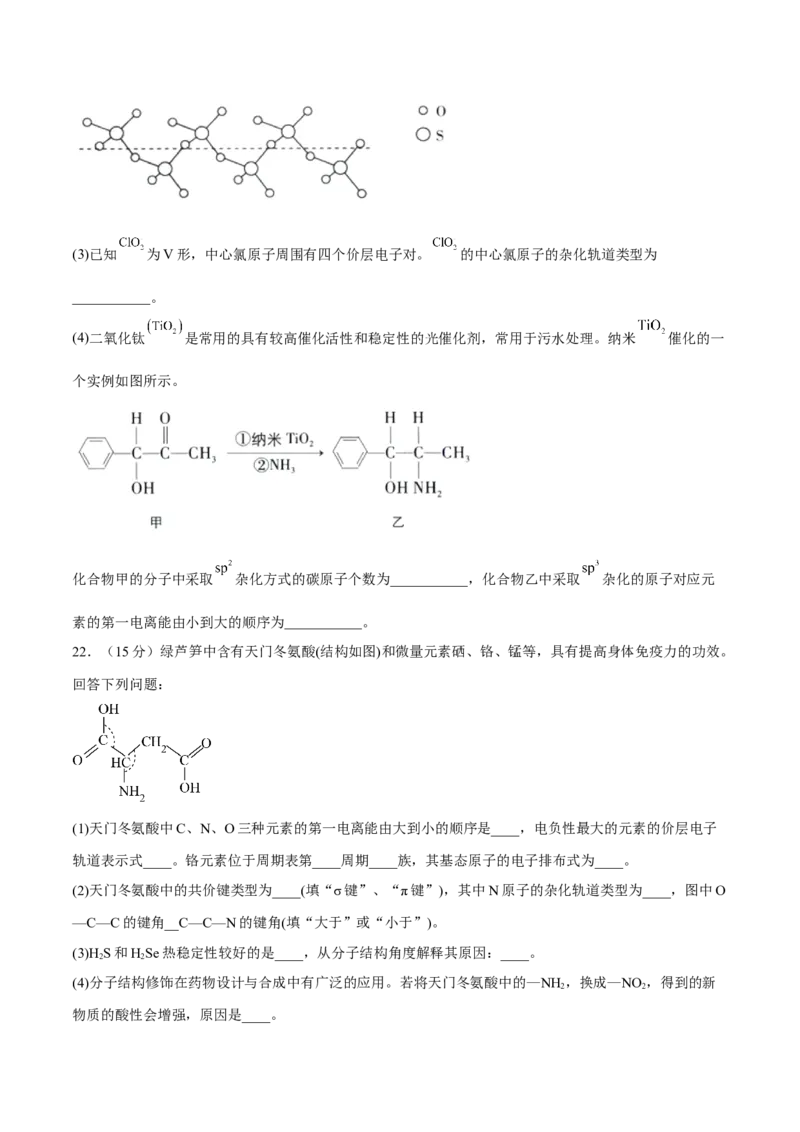
(2)气态 分子的空间结构为___________;将纯液态 冷却到289.8K时凝固得到一种螺旋状单链结构
的固体,其结构如图所示,此固态 中S原子的杂化轨道类型是___________。(3)已知 为V形,中心氯原子周围有四个价层电子对。 的中心氯原子的杂化轨道类型为
___________。
(4)二氧化钛 是常用的具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米 催化的一
个实例如图所示。
化合物甲的分子中采取 杂化方式的碳原子个数为___________,化合物乙中采取 杂化的原子对应元
素的第一电离能由小到大的顺序为___________。
22.(15分)绿芦笋中含有天门冬氨酸(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。
回答下列问题:
(1)天门冬氨酸中C、N、O三种元素的第一电离能由大到小的顺序是____,电负性最大的元素的价层电子
轨道表示式____。铬元素位于周期表第____周期____族,其基态原子的电子排布式为____。
(2)天门冬氨酸中的共价键类型为____(填“σ键”、“π键”),其中N原子的杂化轨道类型为____,图中O
—C—C的键角__C—C—N的键角(填“大于”或“小于”)。
(3)H S和HSe热稳定性较好的是____,从分子结构角度解释其原因:____。
2 2
(4)分子结构修饰在药物设计与合成中有广泛的应用。若将天门冬氨酸中的—NH ,换成—NO ,得到的新
2 2
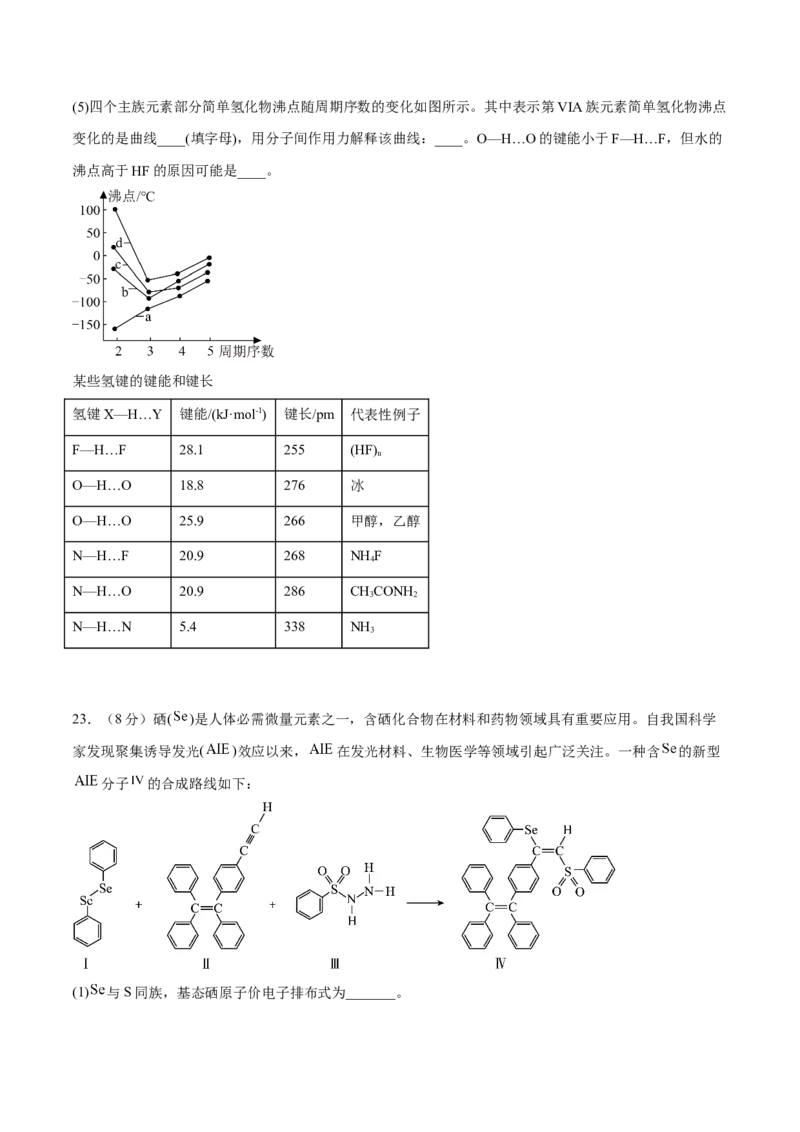
物质的酸性会增强,原因是____。(5)四个主族元素部分简单氢化物沸点随周期序数的变化如图所示。其中表示第VIA族元素简单氢化物沸点
变化的是曲线____(填字母),用分子间作用力解释该曲线:____。O—H…O的键能小于F—H…F,但水的
沸点高于HF的原因可能是____。
某些氢键的键能和键长
氢键X—H…Y 键能/(kJ·mol-1) 键长/pm 代表性例子
F—H…F 28.1 255 (HF)
n
O—H…O 18.8 276 冰
O—H…O 25.9 266 甲醇,乙醇
N—H…F 20.9 268 NH F
4
N—H…O 20.9 286 CHCONH
3 2
N—H…N 5.4 338 NH
3
23.(8分)硒( )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学
家发现聚集诱导发光( )效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含 的新型
分子 的合成路线如下:
(1) 与S同族,基态硒原子价电子排布式为_______。(2) 的沸点低于 ,其原因是_______。
(3)关于I~III三种反应物,下列说法正确的有_______。
A.I中仅有 键
B.I中的 键为非极性共价键
C.II易溶于水
D.II中原子的杂化轨道类型只有 与
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有_______。
(5)硒的两种含氧酸的酸性强弱为 _______ (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸
钠( )可减轻重金属铊引起的中毒。 的立体构型为_______。