文档内容
化学参考答案、评分标准和解析
序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 A C B B A D C B C C B D A D C
16.(共14分,每空2分)
(1)4s24p4(2分)
(2)CuS PbS(答对1个1分,答错0分)
(3)TeO 为两性氧化物,会与过量的硫酸反应进入中和液中导致碲元素损失。
2
(2分)
(4)6.75×10-7(2分)(6.8×10-7得分,其余不得分)
(5)H SeO +4HONH Cl=Se↓+2N ↑+7H O+4HCl(2分,无“↓”“↑”扣1
2 3 3 2 2
分)
(6)①滴入半滴Na S O 标准溶液,溶液蓝色消失,且半分钟内不变色(溶液
2 2 3
蓝色消失,且半分钟内不变色2分,其余不得分)
②98.75%(2分,98.8%得分,其余不得分)
17.(共13分)
(1)丙烯腈(1分,错别字0分)
(2)碳碳三键,羟基 (2分,答对1个得1分,答错0分,错别字0分 )
消去反应(1分,无“反应”0分)
(3)9(1分) 6(1分)
(4) (2分,无反应条件或不完整,
其余都正确得1分)
(5)10(2分)
(6)
(3分,一步1分,分步得分,无反应条件该步不得分)
试卷第1页,共2页18.(共14分)
(1) 五氧化二磷或硅胶或无水氯化钙(2分,答对一种得1分,填化学式不得分)d (1
分)
(2)增大接触面积(1分),提高吸收效率(或吸收速率) (1分);
(3) (2分,无反应条件其余都正确得1分)
(4)防止倒吸
(5)①氧气将NO转化为NO ,可以提高原料利用率。②过量的氧气将C中生成的尾气NO
2
氧化,促进尾气吸收。③将装置中的气体赶入后面的装置充分吸收。(2分,1点1分,
答对其中两点得2分)
(6)DMSO与水分子之间可形成氢键(2分)
(7)80.00(2分,80或80.00不得分)
19.(共14分,每空2分)
(1)-90
2
(2)①CO ② D ③ (或者66.7%) 0.8
3
(3)1.8 <
试卷第2页,共2页化学解析
1.【解析】
A选项,虽然SO 虽有毒,但食品中添加适量的SO 能起到漂白、防腐和抗氧化作用,故
2 2
A错误;
B选项,工业上可以以纤维素为原料生产燃料乙醇,故B正确;
C选项,松花蛋在制备过程中蛋白质发生了变性,故C正确;
D选项,工业上制取NaOH一般采用电解饱和食盐水,用NaO与HO反应,成本太高,
2 2
故D正确。
综上,答案为A。
2.【解析】
A选项,NaCO 与稀盐酸反应,分步进行,依次为:CO2- + H+ = HCO-, HCO-+ H+ =
2 3 3 3 3
CO↑+H O,遵循“量变引起质变”的哲学思想;
2 2
B选项,AgNO 溶液与氨水反应,分步进行,遵循“量变引起质变”的哲学思想;
3
C选项,氯水中的H+使试纸变红,氯水中的HClO的漂白性使红色褪去,不遵循“量变引
起质变”的哲学思想;
D选项,铁丝与稀硫酸、浓硫酸反应实验现象不同,是因为硫酸浓度不同导致反应原理不
同,遵循“量变引起质变”的哲学思想。
综上,答案为C。
3.【解析】
A选项,正确;
B选项,水为共价化合物,用电子式表示水分子的形成过程应:
,故B错确;
C选项,正确;
D选项,正确。
综上,答案为B。
4.【解析】
A选项,实验室制氨气不能用氢氧化钠代替熟石灰,因为氢氧化钠易吸水结块,且易腐蚀
试管,故A错误;
试卷第3页,共2页B选项,根据质量守恒定律可推出物质A为尿素,是一种高效氮肥,故B正确;
C选项,反应的化学方程式为:2NH + NaClO = NH + NaCl + H O,氧化剂与还原剂
3 2 4 2
的物质的量之比为1:2,故C错误;
D选项,离子方程式为:Na++NH +CO +H O = NH + + NaHCO ↓,故D错误。
3 2 2 4 3
综上,答案为B。
5.【解析】
A选项,由图可知,一个泽布替尼分子中有1个手性碳原子,故A错误;
B选项,双键、苯环均可发生加成反应,故B正确;
C选项,碳碳双键可以使酸性高锰酸钾溶液褪色,故C正确;
D选项,氨基可以与盐酸反应,酰胺基可以与氢氧化钠溶液反应,故D正确。
综上,答案为A。
6.【解析】根据题意可推出X、Y、Z、W、R分别为:H、C、N、F、P。
A选项,电负性F>N>C,故A正确;
B选项,最简单氢化物的沸点NH >PH ,因为氨气分子间存在氢键,故B正确;
3 3
C选项,PF -有6个成键电子对,无孤电子对,空间结构为正八面体形,故C正确;
6
D选项,Z原子均为SP2杂化,故D错误。
综上,答案为D。
7.【解析】
A选项,-CH 的碳原子为SP3杂化无孤电子对,-NH 的氮原子为SP2杂化有1对孤电子对,
3 2
孤电子与成键电子对之间的排斥力>成键电子对之间的排斥力,-CH 的键角∠HCH大于-
3
NH 的键角∠HNH,故A错误;
2
B选项,该分子中无配位键,氢键是较强的分子间作用力,不是化学键,故B错误;
C选项,超分子具有自组装的特征,故C正确;
D选项,该超分子不能发生水解反应,故D错误。
综上,答案为C。
8.【解析】
A选项,实验中利用环己烷-水的共沸体系(沸点69℃)带出水分,体系中沸点最低的有机物
是环己烷(沸点81℃),反应时水浴温度应高于69℃,低于81℃,故A错误;
B选项,根据环己烷带出水的体积,结合反应方程式,可估算出反应进度,故B正确;
C选项,蒸出的是共沸体系,环己烷与水不混溶,锥形瓶中冷却为液体后会出现分层现象,
故C错误;
D选项,以共沸体系带出水促使反应正向进行,会减小反应速率,故D错误。
综上,答案为B。
9. 【解析】
A选项,Ga原子占据As原子形成的四面体空隙,故A正确;
√2
B选项,两个As原子间最短距离为面对角线的一半,为 d pm,故B正确;
2
试卷第4页,共2页C选项,该晶胞的密度为4×145 ×1030g/cm3,故C错误;
N ×d3
A
1 3 3
D选项,c点原子的坐标分数为( , , ),故D正确。
4 4 4
综上,答案为C。
10.【解析】a电极(阴极)的电极反应式:2HO +2e- = H↑+ 2OH-,b电极(阳极)的电
2 2
极反应式为:2NH +6OH- - 6e- = N ↑+ 6H O,n为正极,m为负极。
3 2 2
A选项,正极电势高于负极,n极电势高于m极电势,故A错误;
B选项,OH- 由a经过离子交换膜到b,离子交换膜应选择阴离子交换膜,故B错误;
C选项,b电极的电极反应式为:2NH +6OH- - 6e- = N ↑+ 6H O,故C正确;
3 2 2
D选项,电解产生2.24 L H(标况)时导线中通过0.2 mol 电子,故D错误。
2
综上,答案为C。
11. 【解析】
A选项,中硝酸具有挥发性和强氧化性,进入b中干扰了NO 与I-的反应,故A错误;
2
B选项,纯银为阳极,铝件为阴极,符合电镀条件,故B正确;
C选项,Na的燃烧实验不能在玻璃表面皿中进行,应在坩埚中进行,故C错误;
D选项,蒸发结晶应该在蒸发皿中进行,且需蒸发浓缩、冷却结晶才能得到FeSO .7H O晶
4 2
体,故D错误。
综上,答案为B。
12.【解析】
A选项,HF形成分子间氢键,沸点相对较高,HF在标准状况下为液态,故A正确;
B选项,O 是极性分子,O 是非极性分子,HO为极性分子,根据相似相容原理,O 在水中
3 2 2 3
的溶解度大于O,故B正确;
2
C选项,石墨晶体中相邻碳原子平面之间相隔较远,石墨的导电性只能沿石墨平面的方向,故
C正确;
D选项,分子空间结构不同,物质的稳定性不同,椅式的空间位阻小,椅式环己烷(CH )比船
6 12
式环己烷稳定,故D错误。
综上,答案为D。
13.【解析】
A选项,由图可知,转化历程有四个基元反应;活化能越大,反应越慢,为决速步,决速步为
,故A正确;
B选项,催化剂能改变反应的速率,不能决定反应是否自发进行,无Cu/ZnO/ZrO催化剂,
二氧化碳加氢制甲醇依然能自发进行,故B错误;
C选项,反应过程中断裂与形成的共价键类型不相同,故C错误;
D选项,反应产物还有水生成,原子利用率不可能达到100%,故D错误。
综上,答案为A。
14.【解析】
ΔH<0,升高温度,平衡逆向移动,氨气的平衡产率降低,K减小,故T >T ;Δn(g)<0,增
1 2
大压强,平衡正向移动。
A选项,平衡常数只与温度有关,K(A)>K(B)=K(C),故A错误;
B选项,平衡时,正逆反应速率相等,相同压强,温度高反应速率大,v(B)>v(A),相同温
度时,压强大反应速率快,v(B)>v(C),所以v(B)>v(A)>v(C),故B错误;
试卷第5页,共2页C选项,ΔH<0,升高温度,平衡逆向移动,氨气的平衡产率降低,K减小,故T >T ,故C
1 2
错误;
D选项,平均摩尔质量=质量/物质的量,质量守恒,物质的量越大,平均摩尔质量越小,
n(A)M(B)>M(C),故D正确。
综上,答案为D。
15.【解析】
图中,a、b、c、d分别表示HRO、HRO−、HRO2−、RO3−分布分数随pH变化曲线。
3 3 2 3 3 3
A选项,HRO 的k =10-9.22,故A错误;
3 3 a
1
B选项,当pH调至11~12时,所发生的离子方程式为:HR +OH-=HR +H O,故B错误;
2 O− O2− 2
3 3
C 选 项 , pH=12.8 时 , 溶 液 中 电 荷 守 恒 c(HRO− )+2c(HRO2− )+3c(RO3− )+c(OH-)=c(H+)
2 3 3 3
+c(Na+),,而c(HRO− )=c(RO3− ),所以2c(HRO2− )+4c(RO3− )+c(OH-)=c(H+)+c(Na+),故C正
2 3 3 3 3
确;
D选项,pH=14时,c(OH-)=1mol/L,溶液中c(OH-)>c(R )>c(HR )>c(HR ),故D错误。
O3− O2− 2 O−
3 3 3
综上,答案为C。
16.
(1)略(2)略
(3)由信息可知TeO 为两性氧化物,若硫酸过量,TeO 会与过量硫酸反应进
2 2
入溶液。
(4)由电离平衡常数的关系可知:c2 (H+ )×c(SeO2−
)= ,
3 K ×K
a a
c(H SeO ) 1 2
2 3
所以 c(SeO 3 2− ) = K a 1 ×K a 2= 2.7×10−3×2.5×10−8 =6.75×10−7
c(H SeO ) c2 (H+ ) 10−4
2 3
(5)“沉硒”时生成了一种无污染的气体,说明生成了N ,故反应方程式为:
2
H SeO +4HONH Cl=Se↓+2N ↑+7H O+4HCl
2 3 3 2 2
(6)由题目可知:Se与硫酸和硝酸反应生成H SeO ;H SeO 与KI反应生成I ,反
2 3 2 3 2
应方程式为:4H+ + H SeO + 4I- = 2I +Se↓+3H O;再用Na S O 滴定I :
2 3 2 2 2 2 3 2
2Na S O + I =2NaI+ Na S O
2 2 3 2 2 4 6
可以建立相关物质的关系Se ~HSeO ~2 I ~4Na S O
2 3 2 2 2 3
1 4
n(Se) 12.50×0.1000×10-3
12.50×0.1000×10−3
n(Se)= =0.00125mol
4
0.00125×79
Se的纯度为: ×100%=98.75%
0.1000
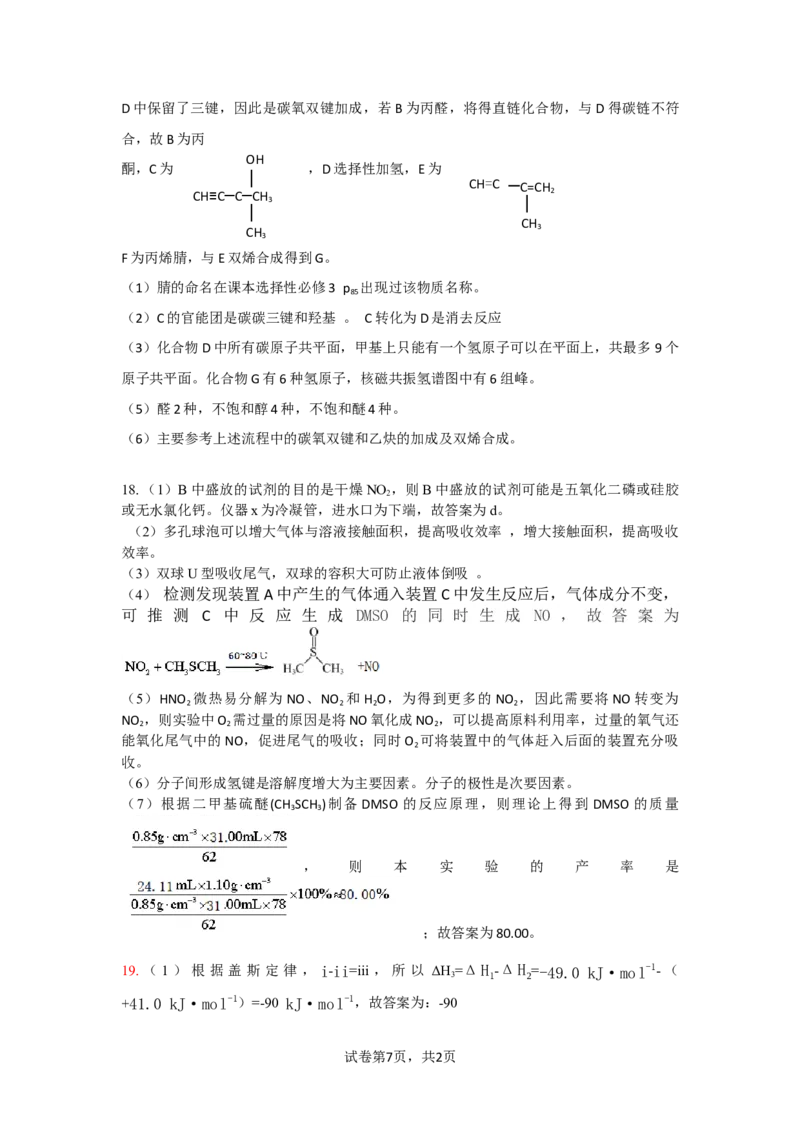
17.【解析】
丙烯到A增加了2个H 1个O,故为与H O加成,A为正丙醇或异丙醇,B比A少2个H,
2
发生了催化氧化,B为丙醛或丙酮。B与乙炔反应生成C,由C的分子式可知为加成反应,
试卷第6页,共2页D中保留了三键,因此是碳氧双键加成,若B为丙醛,将得直链化合物,与D得碳链不符
合,故B为丙
OH
酮,C为 ,D选择性加氢,E为
│ CH=C ─C=CH
CH≡C─C─CH 2
3 │
│
CH
CH 3
3
F为丙烯腈,与E双烯合成得到G。
(1)腈的命名在课本选择性必修3 p 出现过该物质名称。
85
(2)C的官能团是碳碳三键和羟基 。 C转化为D是消去反应
(3)化合物D中所有碳原子共平面,甲基上只能有一个氢原子可以在平面上,共最多 9个
原子共平面。化合物G有6种氢原子,核磁共振氢谱图中有6组峰。
(5)醛2种,不饱和醇4种,不饱和醚4种。
(6)主要参考上述流程中的碳氧双键和乙炔的加成及双烯合成。
18.(1)B中盛放的试剂的目的是干燥NO ,则B中盛放的试剂可能是五氧化二磷或硅胶
2
或无水氯化钙。仪器x为冷凝管,进水口为下端,故答案为d。
(2)多孔球泡可以增大气体与溶液接触面积,提高吸收效率 ,增大接触面积,提高吸收
效率。
(3)双球U型吸收尾气,双球的容积大可防止液体倒吸 。
(4) 检测发现装置A中产生的气体通入装置C中发生反应后,气体成分不变,
可 推 测 C 中 反 应 生 成 DMSO 的 同 时 生 成 NO , 故 答 案 为
(5)HNO 微热易分解为 NO、NO 和H O,为得到更多的NO ,因此需要将NO转变为
2 2 2 2
NO ,则实验中O 需过量的原因是将NO氧化成NO ,可以提高原料利用率,过量的氧气还
2 2 2
能氧化尾气中的NO,促进尾气的吸收;同时O 可将装置中的气体赶入后面的装置充分吸
2
收。
(6)分子间形成氢键是溶解度增大为主要因素。分子的极性是次要因素。
(7)根据二甲基硫醚(CH SCH )制备 DMSO 的反应原理,则理论上得到 DMSO 的质量
3 3
, 则 本 实 验 的 产 率 是
;故答案为80.00。
19. ( 1 ) 根 据 盖 斯 定 律 , i-ii=iii , 所 以 ΔH=ΔH -ΔH =-49.0 kJ·mol-1- (
3 1 2
+41.0 kJ·mol-1)=-90 kJ·mol-1,故答案为:-90
试卷第7页,共2页(2)①反应ii为吸热反应,升高温度平衡正向移动,CO的选择性提高,反应中CO 的转
2
化率升高,CO 的选择性为a曲线;反应i为放热反应,升高温度平衡逆向移动,CHOH
3
的选择性降低,反应中CO 的转化率降低,CHOH的选择性为c曲线;两反应综合效应,
2 3
CO 的转化率为b曲线。故答案为:CO
2
②A.升高温度,所有反应的正逆反应速率均升高,所以A错误;
B. 在恒容容器中充入N ,反应体系中各物质的浓度不会发生改变,反应速率不变,平衡
2
不移动,所以CO 转化率不变,B错误;
2
C. 移去部分 HO(g),反应i、ii均正向移动,导致CHOH和CO增加,浓度熵可能发生
2 3
变化,所以反应 iii 平衡平衡可能发生移动。C错误;
D. 催化剂具有专一性,所以选择合适的催化剂能提高CHOH的选择性。D正确。
3
所以答案为:D
③投料n(CO):n(H ):n(N )=1 :3 :1,假设物质的量分别为1mol、3mol、1mol。因为
2 2 2
发生反应i和ii,达到平衡时CO 的转化率为80%,CO的选择性为25%,所以共反应掉
2
CO 0.8mol,生成CO:0.8×25%=0.2mol,生成CH OH 0.6mol。所以根据三段式有
2 3
反应i:CO (g)+ 3H (g)
⇌
CH OH(g)+H O(g)
2 2 3 2
反应ii:CO (g)+H (g)⇌ CO(g)+H O(g)
2 2 2
∆n/mol 0.6 1.8 0.6 0.6 0.2 0.2 0.2 0.2
n /mol 1-0.6-0.2 3-1.8-0.2 0.6 0.6+0.2 0.2 1 0.2 0.8
平
=0.2 =1 0.6 = 0.8
所以,H 的转化率为(1.8+0.2)/3,即2/3。平衡时气体(包括 N )的总物质的量为
2 2
0.2+1+0.6+0.8+0.2+1=3.8mol,根据PV=nRT可得平衡时总压强P =3.8p kPa,CO 、H 、
平 2 2
CO、HO 的分压分别为 0.2p kPa、1p kPa、0.2p kPa、0.8p kPa,反应ii的 Kp=
2
0.8p kPa×0.2p kPa 2
=0.8。故答案为: ,0.8
0.2p kPa×1p kPa 3
(3)反应CO
2
(g)+H
2
(g)⇌HCOOH(g)的化学平衡常数表达式K= c(HCOOH) 。而v
正
=k
正
c(CO
2
)×c(H
2
)
c(CO)c(H),v =k c(HCOOH),k 、k 为速率常数,平衡时 v =v ,即 k
2 2 逆 逆 正 逆 正 逆 正
c(CO)c(H)=k c(HCOOH),所以 K= c(HCOOH) = K ,所以 k =1.8k 。温度为 T℃
2 2 逆 正 正 逆 2
c(CO
2
)×c(H
2
) K
逆
试卷第8页,共2页时,k =1.9k ,则K= K =1.9,即平衡常数K增大,反应正向移动。反应为放热反应,
正 逆 正
K
逆
降低温度才正向移动,所以T T 所以答案为:1.8 <
2< 1。
试卷第9页,共2页