文档内容
姓 名
准考证号
岳阳市 2024 年高二教学质量监测
化 学
本试卷共8页,共18道题,满分100分,考试用时75分钟。
注意事项:
1.答卷前,考生务必将自己的学校、班级、考号、姓名填写在答题卡上。
2.作答选择题时,选出每小题答案后,用2B铅笔在答题卡上对应题目选项的答案信
息点涂黑;如需改动,用橡皮擦干净后,再选涂其它答案。答案不能答在试卷上。
3.非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卡各题目指定
区域内相应位置上;如需改动,先划掉原来的答案,然后再写上新答案;不准使用铅笔和
涂改液。不按以上要求作答无效。
4.考生必须保证答题卡的整洁。考试结束后,只交答题卡。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cu-64
一、选择题(本大题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只
有一项是符合题目要求的。)
1.2024年4月25日,神舟十八号载人飞船成功发射,4月30日,神舟十七号返回并成
功取回我国“首批舱外暴露实验材料样品”。下列关于这些材料和研究的叙述,错误的是
A. 聚月球土壤加固材料经过空间实验,有望提高其在极端环境下的稳定性和耐久性
B. 固体润滑材料在±100℃温差的环境中仍能保持稳定润滑,减少空间机构磨损
C. 凝胶复合润滑材料通过空间实验,验证了其在高能粒子辐射下的润滑性能
D. 聚酰亚胺纤维材料是一种高性能的天然纤维材料,由聚酰亚胺树脂制成
2.冰晶石—Al O 熔体电解法仍然是目前工业生产金属铝的唯一方法。实验室利用以下装
2 3
置能达到实验目的的是
A.制取CO B.制取Al(OH) C.分离Al(OH) D.制取Al O
2 3 3 2 3
高二化学试卷 第1页 (共8页)
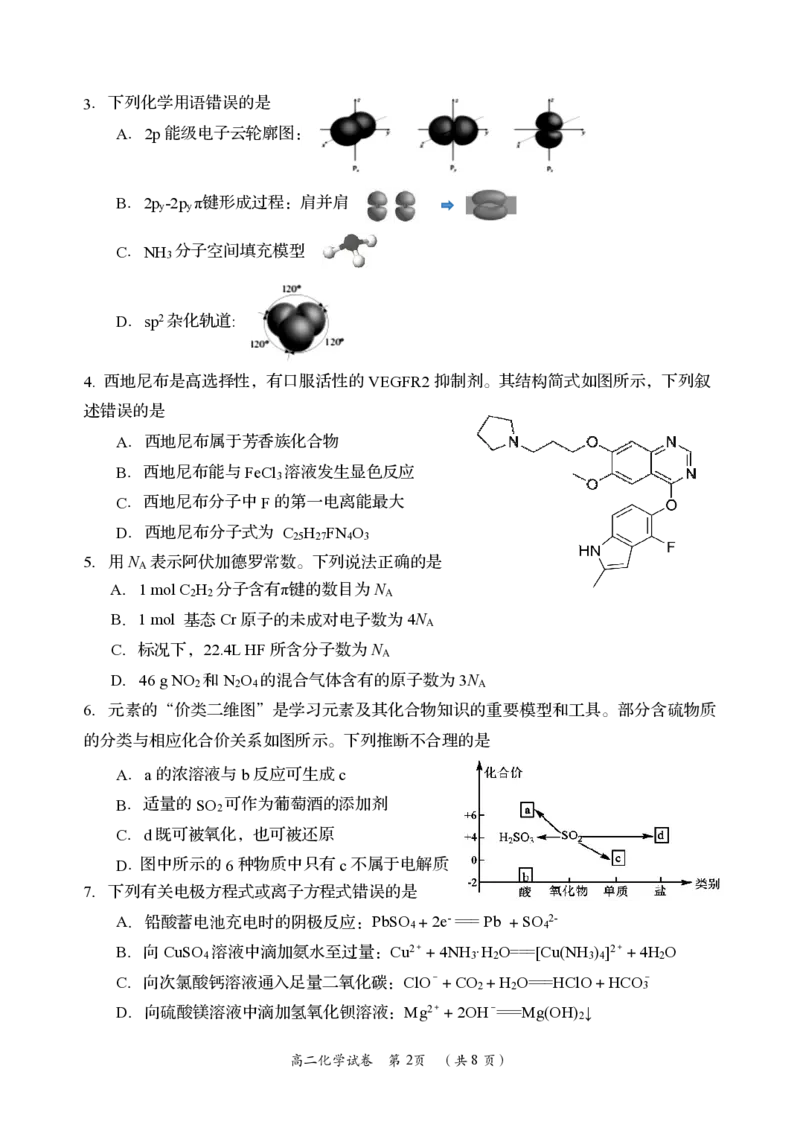
{#{QQABCYAEogCAAJAAAAhCAQnICEEQkAGAASgGwAAEMAIAgBFABAA=}#}3.下列化学用语错误的是
A.2p能级电子云轮廓图:
B.2p -2p π键形成过程:肩并肩
y y
C.NH 分子空间填充模型
3
D.sp2杂化轨道:
4. 西地尼布是高选择性,有口服活性的VEGFR2抑制剂。其结构简式如图所示,下列叙
述错误的是
A.西地尼布属于芳香族化合物
B.西地尼布能与FeCl 溶液发生显色反应
3
C.西地尼布分子中F的第一电离能最大
D.西地尼布分子式为 C H FN O
25 27 4 3
5.用N 表示阿伏加德罗常数。下列说法正确的是
A
A.1molC H 分子含有π键的数目为N
2 2 A
B.1mol 基态Cr原子的未成对电子数为4N
A
C.标况下,22.4LHF所含分子数为N
A
D.46gNO 和N O 的混合气体含有的原子数为3N
2 2 4 A
6.元素的“价类二维图”是学习元素及其化合物知识的重要模型和工具。部分含硫物质
的分类与相应化合价关系如图所示。下列推断不合理的是
A.a的浓溶液与b反应可生成c
B.适量的SO 可作为葡萄酒的添加剂
2
C.d既可被氧化,也可被还原
D.图中所示的6种物质中只有c不属于电解质
7.下列有关电极方程式或离子方程式错误的是
A.铅酸蓄电池充电时的阴极反应:PbSO +2e-===Pb +SO 2-
4 4
B.向CuSO 溶液中滴加氨水至过量:Cu2++4NH ·H O===[Cu(NH ) ]2++4H O
4 3 2 3 4 2
C.向次氯酸钙溶液通入足量二氧化碳:ClO-+CO
2
+H
2
O===HClO+HCO-
3
D.向硫酸镁溶液中滴加氢氧化钡溶液:Mg2++2OH-===Mg(OH) ↓
2
高二化学试卷 第2页 (共8页)
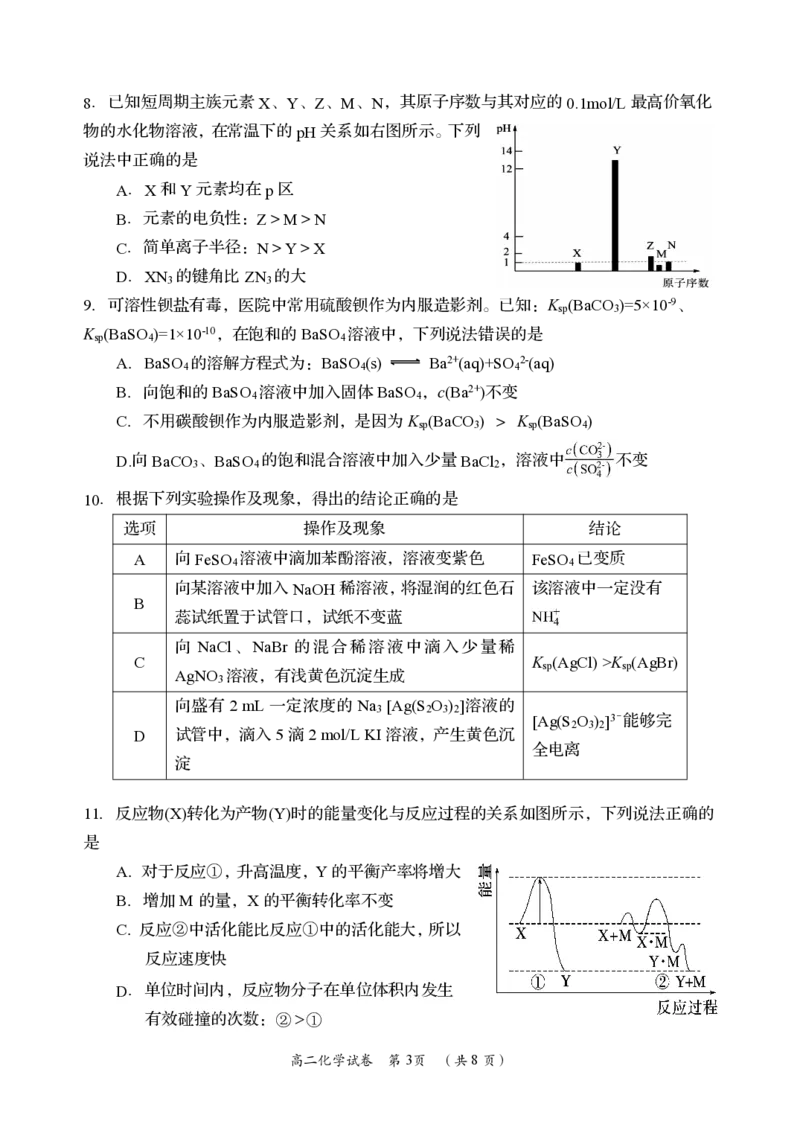
{#{QQABCYAEogCAAJAAAAhCAQnICEEQkAGAASgGwAAEMAIAgBFABAA=}#}8.已知短周期主族元素X、Y、Z、M、N,其原子序数与其对应的0.1mol/L最高价氧化
物的水化物溶液,在常温下的pH关系如右图所示。下列
说法中正确的是
A.X和Y元素均在p区
B.元素的电负性:Z>M>N
C.简单离子半径:N>Y>X
D.XN 的键角比ZN 的大
3 3
9.可溶性钡盐有毒,医院中常用硫酸钡作为内服造影剂。已知:K (BaCO )=5×10-9、
sp 3
K (BaSO )=1×10-10,在饱和的BaSO 溶液中,下列说法错误的是
sp 4 4
A.BaSO 的溶解方程式为:BaSO (s) Ba2+(aq)+SO 2-(aq)
4 4 4
B.向饱和的BaSO 溶液中加入固体BaSO ,c(Ba2+)不变
4 4
C.不用碳酸钡作为内服造影剂,是因为K (BaCO ) > K (BaSO )
sp 3 sp 4
D.向BaCO 、BaSO 的饱和混合溶液中加入少量BaCl ,溶液中 不变
3 4 2
10.根据下列实验操作及现象,得出的结论正确的是
选项 操作及现象 结论
A 向FeSO 溶液中滴加苯酚溶液,溶液变紫色 FeSO 已变质
4 4
向某溶液中加入NaOH稀溶液,将湿润的红色石 该溶液中一定没有
B
蕊试纸置于试管口,试纸不变蓝
向 NaCl、NaBr 的混合稀溶液中滴入少量稀
C K (AgCl)>K (AgBr)
sp sp
AgNO 溶液,有浅黄色沉淀生成
3
向盛有2 mL 一定浓度的Na [Ag(S O ) ]溶液的
3 2 3 2
[Ag(S O ) ]3-能够完
2 3 2
D 试管中,滴入5滴2mol/LKI溶液,产生黄色沉
全电离
淀
11.反应物(X)转化为产物(Y)时的能量变化与反应过程的关系如图所示,下列说法正确的
是
A.对于反应①,升高温度,Y的平衡产率将增大
B.增加M的量,X的平衡转化率不变
C.反应②中活化能比反应①中的活化能大,所以
反应速度快
D.单位时间内,反应物分子在单位体积内发生
有效碰撞的次数:②①
高二化学试卷 第3页 (共8页)
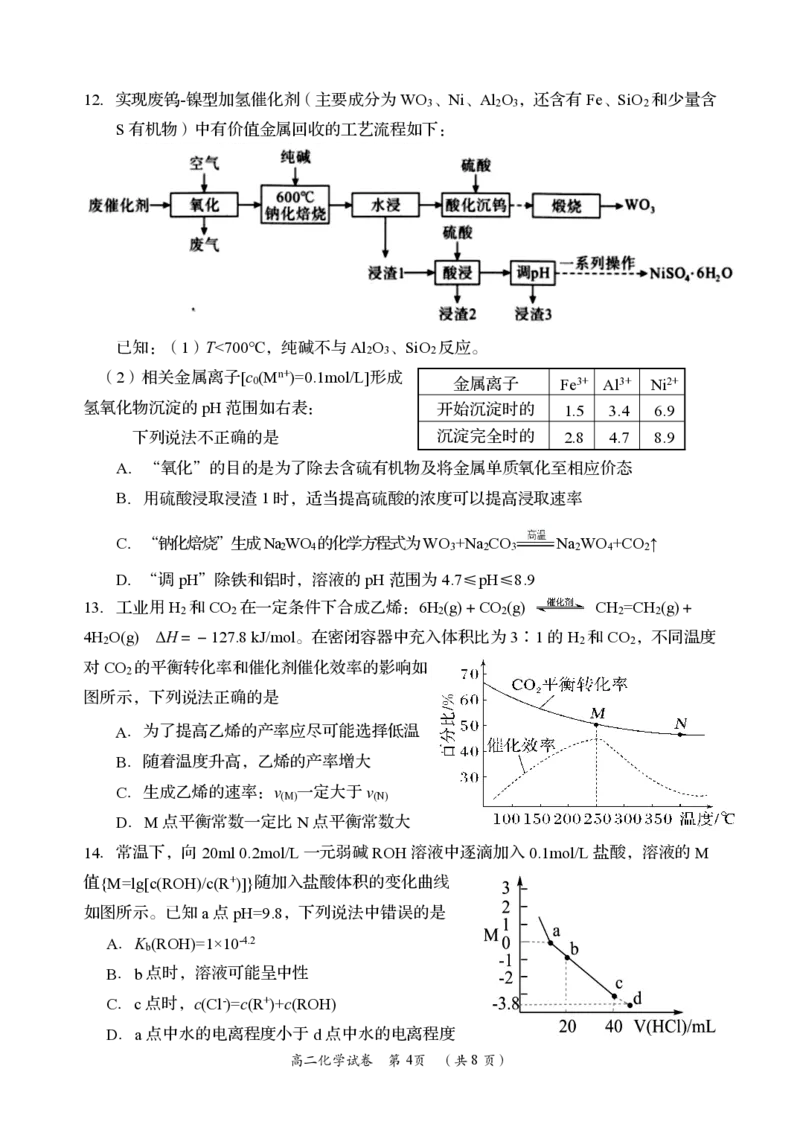
{#{QQABCYAEogCAAJAAAAhCAQnICEEQkAGAASgGwAAEMAIAgBFABAA=}#}12.实现废钨-镍型加氢催化剂(主要成分为WO 、Ni、Al O ,还含有Fe、SiO 和少量含
3 2 3 2
S有机物)中有价值金属回收的工艺流程如下:
已知:(1)T<700℃,纯碱不与Al O 、SiO 反应。
2 3 2
(2)相关金属离子[c (Mn+)=0.1mol/L]形成
0 金属离子 Fe3+ Al3+ Ni2+
氢氧化物沉淀的pH范围如右表: 开始沉淀时的 1.5 3.4 6.9
下列说法不正确的是 沉淀完全时的 2.8 4.7 8.9
A.“氧化”的目的是为了除去含硫有机物及将金属单质氧化至相应价态
B.用硫酸浸取浸渣1时,适当提高硫酸的浓度可以提高浸取速率
C.“钠化焙烧”生成NaWO 的化学方程式为WO +Na CO Na WO +CO ↑
2 4 3 2 3 2 4 2
D.“调pH”除铁和铝时,溶液的pH范围为4.7≤pH≤8.9
13.工业用H 和CO 在一定条件下合成乙烯:6H (g)+CO (g) CH =CH (g)+
2 2 2 2 2 2
4H O(g) ΔH=-127.8kJ/mol。在密闭容器中充入体积比为3∶1的H 和CO ,不同温度
2 2 2
对CO 的平衡转化率和催化剂催化效率的影响如
2
图所示,下列说法正确的是
A.为了提高乙烯的产率应尽可能选择低温
B.随着温度升高,乙烯的产率增大
C.生成乙烯的速率:v 一定大于v
(M) (N)
D.M点平衡常数一定比N点平衡常数大
14.常温下,向20ml0.2mol/L一元弱碱ROH溶液中逐滴加入0.1mol/L盐酸,溶液的M
值{M=lg[c(ROH)/c(R+)]}随加入盐酸体积的变化曲线
如图所示。已知a点pH=9.8,下列说法中错误的是
A.K (ROH)=1×10-4.2
b
B.b点时,溶液可能呈中性
C.c点时,c(Cl-)=c(R+)+c(ROH)
D.a点中水的电离程度小于d点中水的电离程度
高二化学试卷 第4页 (共8页)
{#{QQABCYAEogCAAJAAAAhCAQnICEEQkAGAASgGwAAEMAIAgBFABAA=}#}二、非选择题:(共58分)
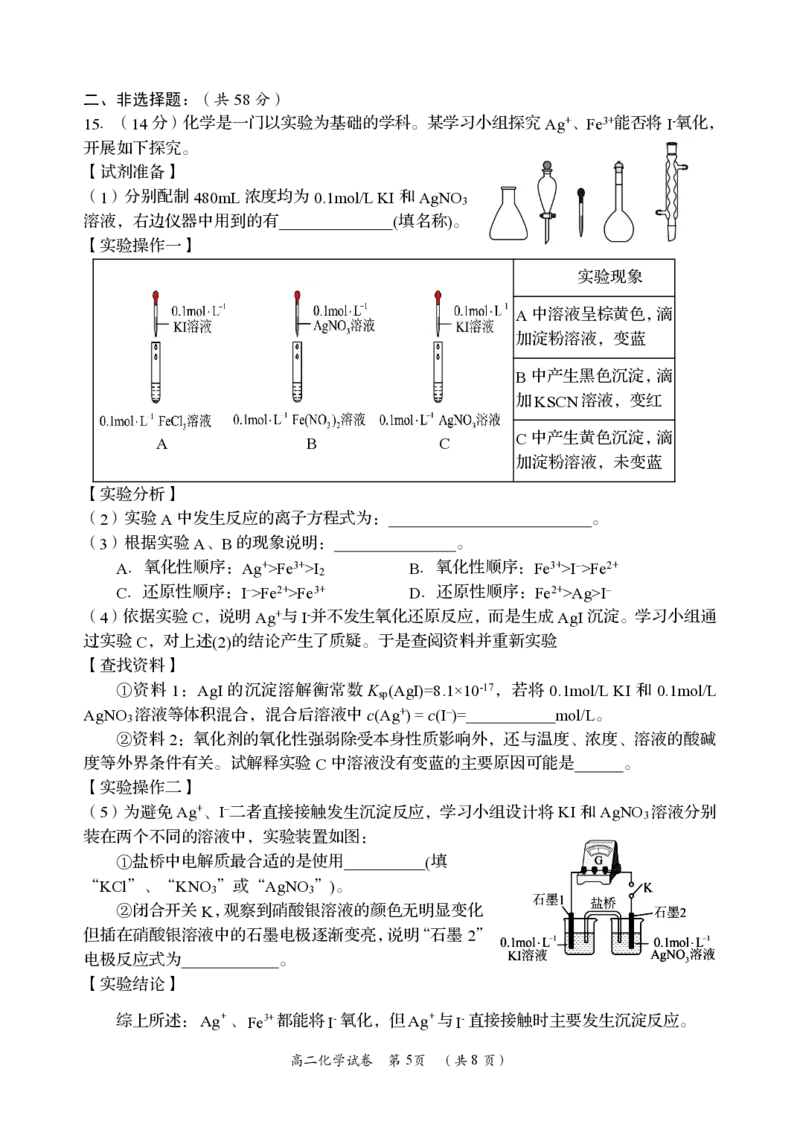
15.(14分)化学是一门以实验为基础的学科。某学习小组探究Ag+、Fe3+能否将I-氧化,
开展如下探究。
【试剂准备】
(1)分别配制480mL浓度均为0.1mol/LKI和AgNO
3
溶液,右边仪器中用到的有 (填名称)。
【实验操作一】
实验现象
A中溶液呈棕黄色,滴
加淀粉溶液,变蓝
B中产生黑色沉淀,滴
加KSCN溶液,变红
A B C C中产生黄色沉淀,滴
加淀粉溶液,未变蓝
【实验分析】
(2)实验A中发生反应的离子方程式为: 。
(3)根据实验A、B的现象说明: 。
A.氧化性顺序:Ag+>Fe3+>I B.氧化性顺序:Fe3+>I–>Fe2+
2
C.还原性顺序:I–>Fe2+>Fe3+ D.还原性顺序:Fe2+>Ag>I–
(4)依据实验C,说明Ag+与I-并不发生氧化还原反应,而是生成AgI沉淀。学习小组通
过实验C,对上述(2)的结论产生了质疑。于是查阅资料并重新实验
【查找资料】
①资料 1:AgI 的沉淀溶解衡常数 K (AgI)=8.1×10-17,若将 0.1mol/LKI 和 0.1mol/L
sp
AgNO 溶液等体积混合,混合后溶液中c(Ag+)=c(I–)= mol/L。
3
②资料2:氧化剂的氧化性强弱除受本身性质影响外,还与温度、浓度、溶液的酸碱
度等外界条件有关。试解释实验C中溶液没有变蓝的主要原因可能是 。
【实验操作二】
(5)为避免Ag+、I–二者直接接触发生沉淀反应,学习小组设计将KI和AgNO 溶液分别
3
装在两个不同的溶液中,实验装置如图:
①盐桥中电解质最合适的是使用 (填
“KCl”、“KNO ”或“AgNO ”)。
3 3
②闭合开关K,观察到硝酸银溶液的颜色无明显变化
但插在硝酸银溶液中的石墨电极逐渐变亮,说明“石墨2”
电极反应式为 。
【实验结论】
综上所述:Ag+、Fe3+都能将I-氧化,但Ag+与I-直接接触时主要发生沉淀反应。
高二化学试卷 第5页 (共8页)
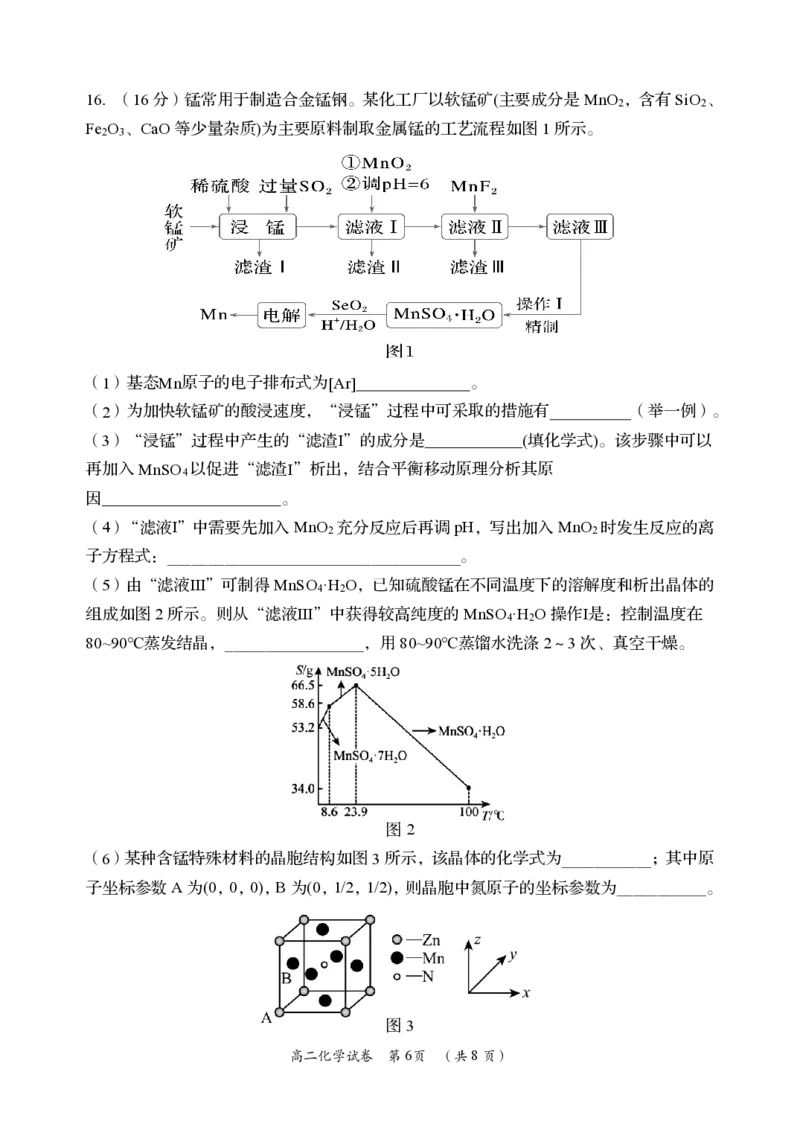
{#{QQABCYAEogCAAJAAAAhCAQnICEEQkAGAASgGwAAEMAIAgBFABAA=}#}16.(16分)锰常用于制造合金锰钢。某化工厂以软锰矿(主要成分是MnO ,含有SiO 、
2 2
Fe O 、CaO等少量杂质)为主要原料制取金属锰的工艺流程如图1所示。
2 3
(1)基态Mn原子的电子排布式为[Ar] 。
(2)为加快软锰矿的酸浸速度,“浸锰”过程中可采取的措施有 (举一例)。
(3)“浸锰”过程中产生的“滤渣Ⅰ”的成分是 (填化学式)。该步骤中可以
再加入MnSO 以促进“滤渣Ⅰ”析出,结合平衡移动原理分析其原
4
因 。
(4)“滤液Ⅰ”中需要先加入MnO 充分反应后再调pH,写出加入MnO 时发生反应的离
2 2
子方程式:____________________________________。
(5)由“滤液Ⅲ”可制得MnSO ·H O,已知硫酸锰在不同温度下的溶解度和析出晶体的
4 2
组成如图2所示。则从“滤液Ⅲ”中获得较高纯度的MnSO ·H O操作Ⅰ是:控制温度在
4 2
80~90℃蒸发结晶,_________________,用80~90℃蒸馏水洗涤2~3次、真空干燥。
图2
(6)某种含锰特殊材料的晶胞结构如图3所示,该晶体的化学式为___________;其中原
子坐标参数A为(0,0,0),B为(0,1/2,1/2),则晶胞中氮原子的坐标参数为___________。
图3
高二化学试卷 第6页 (共8页)
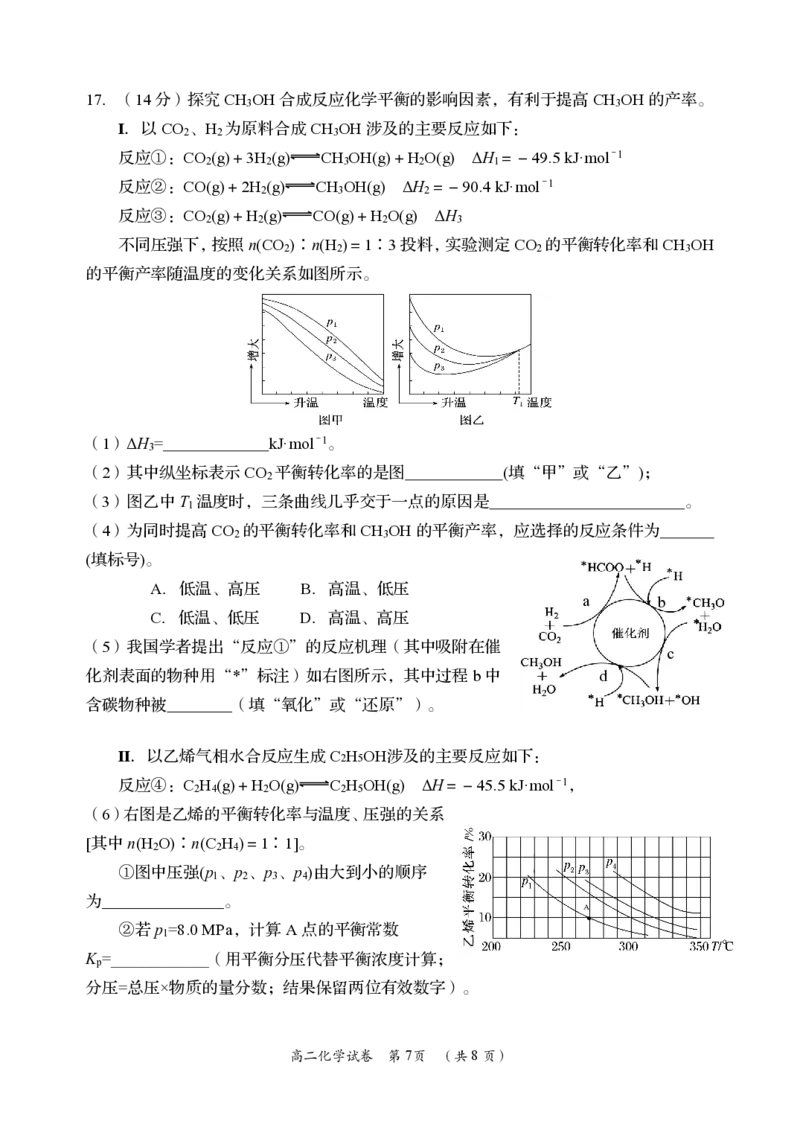
{#{QQABCYAEogCAAJAAAAhCAQnICEEQkAGAASgGwAAEMAIAgBFABAA=}#}17.(14分)探究CH OH合成反应化学平衡的影响因素,有利于提高CH OH的产率。
3 3
Ⅰ.以CO 、H 为原料合成CH OH涉及的主要反应如下:
2 2 3
反应①:CO (g)+3H (g) CH OH(g)+H O(g) ΔH =-49.5kJ·mol-1
2 2 3 2 1
反应②:CO(g)+2H (g) CH OH(g) ΔH =-90.4kJ·mol-1
2 3 2
反应③:CO (g)+H (g) CO(g)+H O(g) ΔH
2 2 2 3
不同压强下,按照n(CO )∶n(H )=1∶3投料,实验测定CO 的平衡转化率和CH OH
2 2 2 3
的平衡产率随温度的变化关系如图所示。
(1)ΔH = kJ·mol-1。
3
(2)其中纵坐标表示CO 平衡转化率的是图 (填“甲”或“乙”);
2
(3)图乙中T 温度时,三条曲线几乎交于一点的原因是 。
1
(4)为同时提高CO 的平衡转化率和CH OH的平衡产率,应选择的反应条件为
2 3
(填标号)。
A.低温、高压 B.高温、低压
a b
C.低温、低压 D.高温、高压
(5)我国学者提出“反应①”的反应机理(其中吸附在催
c
化剂表面的物种用“*”标注)如右图所示,其中过程b中 d
含碳物种被 (填“氧化”或“还原”)。
Ⅱ.以乙烯气相水合反应生成C2H5OH涉及的主要反应如下:
反应④:C H (g)+H O(g) C H OH(g) ΔH=-45.5kJ·mol-1,
2 4 2 2 5
(6)右图是乙烯的平衡转化率与温度、压强的关系
[其中n(H O)∶n(C H )=1∶1]。
2 2 4
①图中压强(p 、p 、p 、p )由大到小的顺序
1 2 3 4
为 。
A
·
②若p =8.0MPa,计算A点的平衡常数
1
K =____________(用平衡分压代替平衡浓度计算;
p
分压=总压×物质的量分数;结果保留两位有效数字)。
高二化学试卷 第7页 (共8页)
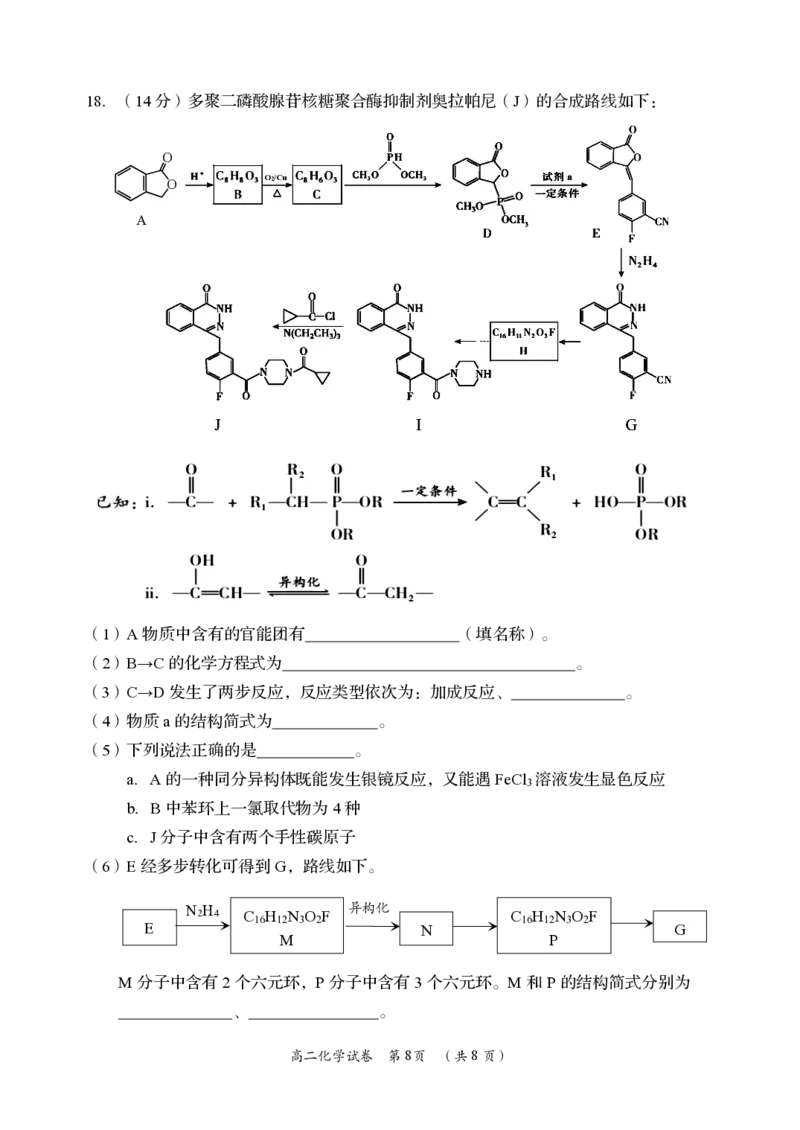
{#{QQABCYAEogCAAJAAAAhCAQnICEEQkAGAASgGwAAEMAIAgBFABAA=}#}18.(14分)多聚二磷酸腺苷核糖聚合酶抑制剂奥拉帕尼(J)的合成路线如下:
O
O O2/Cu
A
(1)A物质中含有的官能团有 (填名称)。
(2)B→C的化学方程式为 。
(3)C→D发生了两步反应,反应类型依次为:加成反应、 。
(4)物质a的结构简式为 。
(5)下列说法正确的是 。
a.A的一种同分异构体既能发生银镜反应,又能遇FeCl 溶液发生显色反应
3
b.B中苯环上一氯取代物为4种
c.J分子中含有两个手性碳原子
(6)E经多步转化可得到G,路线如下。
N H 异构化
2 4 C H N O F C H N O F
16 12 3 2 16 12 3 2
E N G
M P
M分子中含有2个六元环,P分子中含有3个六元环。M和P的结构简式分别为
、 。
高二化学试卷 第8页 (共8页)
{#{QQABCYAEogCAAJAAAAhCAQnICEEQkAGAASgGwAAEMAIAgBFABAA=}#}