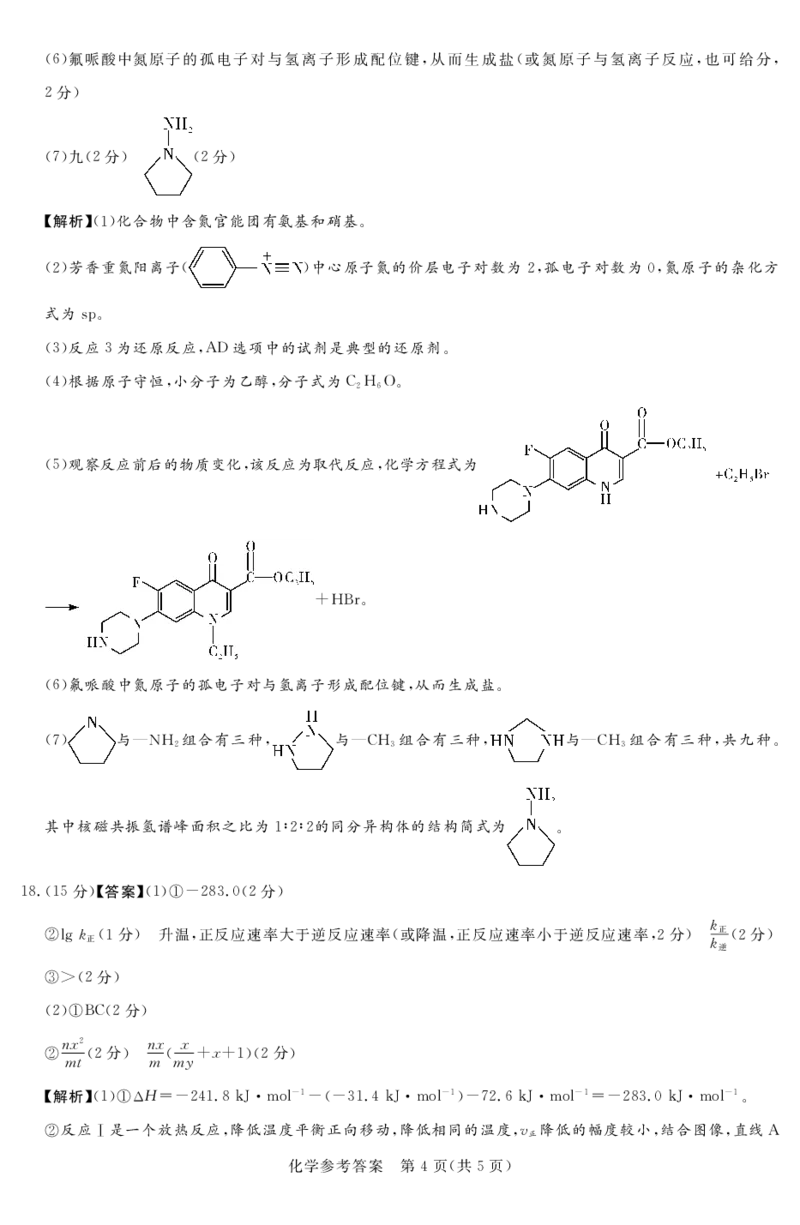
文档内容
湘 豫 名 校 联 考
#$#% #$#"学年高三一轮复习质量检测
化学参考答案
题号 ! # & % " ’ ( ) * !$ !! !# !& !%
答案 + , + - . , . - . , , - + -
一!选择题"本题共!%小题#每小题&分#共%#分$在每小题给出的四个选项中#只
有一项是符合题目要求的$
!/+!%解析&有机合成农药是一类以天然有机物和合成有机物为主要原料制成的农药!由于有机合成农药化
学结构简单"易于降解"对环境友好"安全性高"不会导致耐药性等特点!有机合成农药的研制使农药向着高
效"低毒和低残留的方向发展!.项正确#纳米晶体的比表面积较大!相对于通常的晶体!在声"光"电"磁"热
等性能上常会呈现新的特性!,项正确#聚乳酸是一种生物降解高分子!具有良好的生物相容性和生物可吸
收性!可用于手术缝合线"骨科固定材料"药物缓释材料!-项正确#高纯硅具有半导体性能!广泛应用于信息
技术和新能源技术等领域!+项错误$故选+$
#/,!%解析&反应!为&0
#
1-2 #"""-0
&
2010
#
2!原子利用率小于!$$3!,项错误$故选,$
&/+!%解析&0-4易溶于水是因为0-4和水分子都是极性分子!.项错误#苯能使溴水褪色的原因是苯能萃取
溴水中的溴!,项错误#%-5&02’(#1容易转化为%-5&60 ’(#1是因为6的电负性小于2!更容易提供孤
# % & %
电子对!-项错误#邻二甲苯的极性大于对二甲苯极性!分子间作用力越大!沸点越高!+项正确$故选+$
%/-!%解析&由题中左图可知!有机化合物 7的摩尔质量为(%8)9:4;!!.项错误#设该有机物的分子式为
-
!
0
"
2
#
!!#!1"1!’#<(%!当!<%!"
#
2
"
是酸性干燥剂!能干燥-4
#
!.项正确#6?
#
-2
&
受热难分解!不能制取-2
#
!,项错误#62易
与空气中的氧气反应!不能用向上排空气法收集62!-项错误#铁件作负极!容易失电子被腐蚀!+项错误$
故选.$
’/,!%解析&碘离子有还原性!能将铁离子还原成亚铁离子!.项错误#酰胺在酸存在并加热的条件下可以发生
水解反应生成羧酸和铵盐!,项正确#常温下!铝遇浓硝酸钝化!-项错误#铜作阳极!铜失去电子生成铜离
子!+项错误$故选,$
(/.!%解析&配合物中6@的化合价为1#!.项错误#氮原子A轨道半充满!第一电离能最大!,项正确#阳离子
中含有 " "B三种配体!-项正确#该配合物中存在阴"阳离子!是离子晶体!+项正确$故选.$
)/-!%解析&气体中含有的杂质吸附或沉积在催化剂表面!使其活性降低或丧失!6
#
和 0
#
必须净化!.项正
确#氨的催化氧化生成62!,项正确#硝酸具有强氧化性!腐蚀橡胶!应该使用玻璃塞!-项错误#氮氧化物在
化学参考答案!第!!!!!页!共"页"
书书书碱性溶液中通过发生氧化还原反应除去!+项正确$故选-$
*/.!%解析&该二元化合物是离子化合物!化学式为组成离子的最简整数比!即6?2
#
!.项错误#棱上的2
#
;有
相同的空间取向!面上的2;有相同的空间取向!,项正确#2;位于’个6?1形成的八面体空隙中!-项正
# #
确#2;中含有单电子!反应活性高!有强氧化性!+项正确$故选.$
#
!$/,!%解析&电极7产生氧气!7为阳极!与电源的正极相连!.项正确#电极6上生成0
#
2
#
的电极反应式
为2
#
1#011#C;"""0
#
2
#
!,项错误#增大2
#
在电极间的流通速率!提高阴极2
#
的浓度!有利于0
#
2
#
的生成!-项正确#六价铬还原释放的化学能转化为电能来增强过氧化氢的原位生成!+项正确$故选,$
!!/,!%解析&苯甲醛制备苯甲酸和苯甲醇的反应是歧化反应!发生电子的转移!.项错误#温度过高!苯甲醛易
被氧化为苯甲酸!歧化生成苯甲醇的量减少!,项正确#分离苯甲醇和苯甲酸的常用方法是蒸馏!-项错误#
利用6?20溶液滴定苯甲酸测定纯度时!滴定终点A0#(!应选用酚酞做指示剂!+项错误$故选,$
!#/-!%解析&由题图甲可知!物质>& ’和6& ’互为顺反异构体!.项错
误#焓变*"$
!
;"$
#
1"$
&
<$!,项错误#据图乙可知!反应速率*反应#小于反应!!活化能*反应##反
应!!-项正确#物质D& ’中最多有!$个原子共平面!+项错误$故选-$
!&/+!%解析&该反应为放热反应!适当升温!可降低甲醇的平衡产率!.项错误#E的活化能高!反应速率慢!
FGH#!!,项错误#氘代甲烷-0
&
+与721反应!生成#种氘代甲醇!-项错误#步骤$中氧氢键形成!步骤
%中碳氧键形成!+项正确$故选+$
!%/-!%解析&碳酸氢钠溶液呈碱性!曲线#表示A&01’的变化曲线!.项正确#质子守恒式%&01’1%&0
#
-2
&
’
<%&-2#;’1%&20;’!交点7处!%&-2#;’<%&20;’!因此%&01’1%&0-2’<#%&-2#;’!,项正确#据
& & # & &
图可知!碳酸氢钠溶液物质的量浓度较小时!可能出现%&01’<%&0
#
-2
&
’#%&-2#
&
;’!-项错误#碳酸氢钠
溶液中! %&0 # -2 & ’)%&-2# & ;’ < & ?#$!!+项正确$故选-$
%#&0-2;’ &
& ?!
二!非选择题"本题共%小题#共")分$
!"/!!%分"%答案&!!"三颈烧瓶!#分"
!#"将二氧化硫气体吹入装置,中充分反应!或防倒吸#答案合理即可给分##分"
!&"6?
#
I2
&
1I2 #"""6?
#
I
#
2
"
!#分"
!%"没有吸收二氧化硫尾气装置!答案合理即可给分##分"
!""氢离子的自催化作用#加快反应速率!#分"
!’"过量的G2
&
;与反应#生成的G;发生反应!#不断消耗氢离子!#分"
!("亚硫酸钠在溶液中易被氧气氧化为硫酸钠#使G2
&
;实际上略微过量#仍能发生反应!#不断消耗氢离子#
生成少量G!#分"
#
%解析&&!’仪器?的名称为三颈烧瓶$
&#’二氧化硫易溶于水!直接通入会导致倒吸!实验过程中持续通入氮气!能将二氧化硫吹入装置,中充分
反应!并防止倒吸$
化学参考答案!第!!!!#页!共"页"&&’装置,中合成焦亚硫酸钠!化学方程式为6?
#
I2
&
1I2 #"""6?
#
I
#
2
"
$
&%’二氧化硫有毒!会污染环境!需要进行尾气处理$
&"’反应#不断生成氢离子!达到一定浓度后!氢离子的自催化作用!加快反应速率$
&’’曲线E对应的G2
&
;过量!过量的G2
&
;与反应#生成的G;发生反应!!不断消耗氢离子!生成G
#
!A0逐渐
增大$
&(’理论上!曲线J对应的G2
&
;量少!不会继续发生反应!!但亚硫酸钠在溶液中易被氧气氧化为硫酸钠!使
G2
&
; 实际上略微过量!仍能发生反应!!不断消耗氢离子!生成少量G
#
$
!’/!!%分"%答案&!!"A!!分"
!#"提高钒元素和砷元素沉淀率!答案合理即可给分##分"
!&"-?
&
!K2
%
"
#
1)011&I2#
%
;"""&-?I2
%
1#K2
#
11%0
#
2!#分"
!%"小于!!分"!两种离子中.L的杂化方式均为LA&#但.L2&
&
;中存在孤电子对与成键电子对的相斥作用#
使2$.L$2键角减小!#分"
!""氧化.L2&;和MC#1#促进MC.L2 沉淀生成!#分"
& %
!’"胶状MC.L2 能吸附K2&;!#分"
% %
!("!!/)!#分"
%解析&&!’砷元素位于第四周期&.族!A区$
&#’增大钙离子的浓度!促使沉钒"沉砷的沉淀溶解平衡正向移动!提高钒砷的沉淀率$
&&’在强酸性条件下!1"价钒元素主要以K21形式存在!-?I2 是微溶物!离子方程式为-?&K2 ’1
# % & % #
)011&I2#
%
;"""&-?I2
%
1#K2
#
11%0
#
2$
&%’亚砷酸根离子&.L2&
&
;’和砷酸根离子&.L2&
%
;’中!.L的杂化方式均为LA&!.L2&
&
;中存在有孤电子对与
成键电子对的相斥作用!2+.L+2键角减小$
&"’02 将.L2&;氧化为.L2&;!将MC#1氧化为MC&1!MC&1和.L2&;生成MC.L2 沉淀$
# # & % % %
&’’胶状MC.L2 能吸附K2&;!造成钒损失率增大$
% %
&(’%&-?#1’<槡 & & LA
%
%
#
-
&
?
K
&
2
&K
& % ;
2
’
% ’ # ( <槡 &
&!
!
$
$
;
;
"
!"
’#
?
- -
平衡压强,O>?!!!!-!!! !
! !
- -
)
! ! ( (!#
!!!!! < !!-<
- ) )
- (!#
则反应G的速率为 < O>?)9@Q;!$
* )*
设平衡时0 的压强为.$
#
!!!!!!!!-2
#
10 #&’0-220!&<)O>?;!
(!#
平衡压强,O>?!!"! !.!!!
)
(!#
) (!#
!!!!!!!! <)!!.<
". ")#
(!# (!# (! (! !
则0 的初始压强为 1 1 < & 1!1!’$
# ")# ) ) ) )"
化学参考答案!第!!!!"页!共"页"2024.12 湘豫联考化学评分细则补充
说明:如无补充的题目按参考答案给分
第15题
(1)三口烧瓶,也给2分
(2)排尽装置内的空气,防止亚硫酸钠氧化,得0分
(4)无尾气处理装置,也给2分
(5)反应生成的氢离子对反应①有催化作用,也给2分
(6)出现“发生反应②,生成I 同时消耗H+”,也给2分
2
第16题
(2)学生表述出使砷、钒滤渣生成更彻底,沉淀率更高的意思,都给2分。
只答钒元素,给1分,答“营造碱性环境”“使反应更快”等,均得0分
(3)写成化学反应方程式,得0分,写沉淀符号,不扣分
(4)第一问按答案给分,第一问答错第二问不给分
第二问答出来杂化类型相同,且孤电子对与成键电子对斥力大导致键角小,给2分,只答孤
对电子与成键电子对斥力大,给1分
(5)学生答“氧化剂”或者只答“氧化二价铁离子”/“氧化亚砷酸离子”,给1分
(6)答案更改加上“胶状物无法分离完全”用来解释砷沉淀率较小,两个得分点
第17题
(1)两个名称只答对一个得1分,答对一个答错一个不得分。全对得2分,全错不得分。
(3)AD两个只选一个得1分,答对一个答错一个不得分。全对得2分,全错不得分。
(4)分子式只能写成C H O,答成C H OH或CH CH OH不得分。
2 6 2 5 3 2
(5)按答案给分,写错物质、写漏HBr均不得分,连接符号用等号,标注气体符号不扣分。
(6)答案只要能够表述出氟哌酸分子与H+反应就可以得分,如:氨基消耗H+、N与H+反
应(结合)、N与H+形成配位键、氟哌酸(产物)与H+反应生成盐、氨基(N)显碱性能消
耗H+等得2分。如答成:氨基被破坏、生成副产物、产率降低等得1分。
第18题
(1)②第二个空
反应Ⅰ的ΔH<0,降温时平衡常数K增大(或答反应正向移动),因此k 减小幅度小于k 减
正 逆
小幅度
【或者升温时平衡常数K减小(或答反应逆向移动),因此k 增大幅度小于k 增大幅度】
正 逆
(2)①BC两个只选一个得1分;
答对一个答错一个为0分(有错误答案者均为0分)
②书写形式可不同,只要结果对即满分